Лекарственные формы с замедленным высвобождением зипразидона
Иллюстрации
Показать всеНастоящее изобретение относится к области лекарственных средств, в частности к пероральным лекарственным формам с замедленным высвобождением, содержащим по меньшей мере 20 мгА зипразидона и средство, обеспечивающее замедленное высвобождение. Кроме того, изобретение относится к способам лечения пациента введением указанных лекарственных форм. Технический результат заключается в обеспечении эффективных уровней зипразидона в крови в течение продолжительного периода времени. 4 н. и 40 з.п. ф-лы, 2 ил., 15 табл.
Реферат
Уровень техники
Изобретение относится к лекарственным формам замедленного высвобождения, содержащим зипразидон.
Зипразидон является атипичным антипсихотическим лекарственным средством, продаваемым в настоящее время в Соединенных Штатах как GEODON® как в виде капсулированного состава с немедленным высвобождением (IR) для перорального введения для неотложного и продолжительного лечения шизофрении, так и в виде IR состава для внутримышечного (IM) введения для срочного ограничения возбуждения пациентов с шизофренией. IR капсулу для перорального введения обычно принимают дважды в день. IR капсула для перорального введения доступна в виде капсул по 20, 40, 60 и 80 мгА. (Под "мгА" подразумевается количество активного зипразидона, то есть свободного основания зипразидона в мг.) Начальная доза обычно равна 20 мгА дважды в день, принимаемым вместе с пищей. Дозу затем подбирают на основе ответной реакции пациента.
Желательно предоставить лекарственную форму для перорального введения с замедленным высвобождением зипразидона. Такая лекарственная форма должна обеспечивать эффективные уровни содержания зипразидона в крови в течение более продолжительного периода времени, чем IR капсула для перорального введения, но в идеале не должна обеспечивать максимальные уровни содержания в крови, которые выше уровней, обеспечиваемых IR капсулой для перорального введения, содержащей то же количество зипразидона. Такая лекарственная форма может улучшить соблюдение пациентом режима и схем лечения и максимизировать одобрение со стороны пациента и лечащего врача, например, благодаря уменьшению побочных эффектов. Такая лекарственная форма может также обеспечивать такой же хороший или даже лучше профиль безопасности и переносимости, чем схема приема IR капсул для перорального введения, благодаря относительно более низким уровням содержания зипразидона в крови по сравнению с IR капсулой для перорального введения при той же дозе.
Для достижения эффективных уровней содержания в крови в течение продолжительных периодов времени лекарственная форма с замедленным высвобождением должна высвобождать зипразидон в желудочно-кишечный тракт таким образом, чтобы дать возможность зипразидону быть абсорбируемым в течение длительного периода времени. Однако введение зипразидона в состав лекарственной формы с замедленным высвобождением представляет некоторые трудности. Хотя зипразидон имеет относительно хорошую растворимость при желудочном рН, он имеет относительно слабую растворимость при кишечном рН. Форма свободного основания зипразидона имеет растворимость около 0,2 мкг/мл при рН около 6,5. Столь низкая растворимость при кишечном рН ингибирует абсорбцию зипразидона в кишечнике. К тому же, если водный раствор зипразидона становится перенасыщенным (то есть если зипразидон растворен в концентрации, которая больше равновесной концентрации лекарства при кишечном рН так, как это случается при перемещении из желудочной среды с низким рН в кишечную среду с более высоким рН), зипразидон имеет тенденцию к быстрому осаждению в его кристаллической форме свободного основания, соответственно к быстрому снижению концентрации растворенного зипразидона до растворимости кристаллического свободного основания (форма с самой низкой энергией) зипразидона.
Curatolo и др. в патенте США № 6548555 В1 раскрывают смеси лекарств основного характера и ингибирующих осаждение полимеров, таких как гидроксипропилметилцеллюлозы ацетат сукцинат (HPMCAS). Curatolo и др. указывают, что лекарство будет растворяться в желудке и ингибирующий осаждение полимер будет поддерживать высокую концентрацию растворенного лекарства, когда растворенное лекарство поступает в кишечник.
Curatolo и др., публикация США № 2002/0006443 А1, и Curatolo и др., публикация США № 2003/0072801 А1, раскрывают физические смеси форм с улучшенной растворимостью лекарств малой растворимости, объединенных с полимерами, чтобы обеспечить улучшение концентрации в воде растворенного лекарства. В частности, раскрыты различные формы с улучшенной растворимостью зипразидона, смешанные с полимерами, такими как гидроксипропилметилцеллюлозы ацетат сукцинат.
WO 01/47500 раскрывает лекарственную форму с осмотически регулируемым высвобождением. Заявка раскрывает в примере 10 осмотическую лекарственную форму, содержащую 20 мгА зипразидона в виде твердой аморфной дисперсии лекарства в полимере гидроксипропилметилцеллюлозы ацетат сукцинат.
Желательно предоставить лекарственную форму для перорального введения, чтобы сделать возможным замедленное высвобождение зипразидона, что доставляет фармацевтически эффективное количество зипразидона пациенту при необходимости этого.
Сущность изобретения
Данное изобретение относится к пероральной твердой лекарственной форме замедленного высвобождения (SR) для лечения психотического расстройства, например шизофрении, у млекопитающего, эта лекарственная форма для перорального введения содержит зипразидон в количестве, эффективном для лечения указанного психотического расстройства, и фармацевтически приемлемый носитель.
Соответственно, данное изобретение относится к твердой лекарственной форме для перорального введения для лечения психотического расстройства, например шизофрении, у млекопитающего, эта лекарственная форма для перорального введения содержит зипразидон в количестве, эффективном для лечения указанного психотического расстройства и фармацевтически приемлемый носитель, где эффективное количество зипразидона высвобождается в течение продолжительного периода времени.
В одном воплощении лекарственная форма для перорального введения является таблеткой. В другом воплощении лекарственная форма для перорального введения является капсулой.
В другом воплощении поддерживаемый период времени равен приблизительно по меньшей мере 24 часам. В других воплощениях поддерживаемый период времени находится в пределах от около 4 часов до около 24 часов. Поддерживаемый период времени может быть по меньшей мере около 4 часов, по меньшей мере около 6 часов, по меньшей мере около 8 часов, по меньшей мере около 10 часов, по меньшей мере около 12 часов или по меньшей мере около 16 часов. В другом воплощении поддерживаемый период времени равен приблизительно по меньшей мере 24 часам. На примере выражения "по меньшей мере около 6 часов" выражение "по меньшей мере около", используемое в данном контексте, означает в одном воплощении, что по существу весь зипразидон (например, около 80% или более) в лекарственной форме высвобождается из лекарственной формы после введения в течение периода времени около 6 часов с не более чем около 20%, высвобождаемыми после 6 часов. В другом воплощении это означает, что по существу весь зипразидон (например, около 80% или более) высвобождается из лекарственной формы после введения в течение периода времени более чем около 6 часов.
В другом воплощении лекарственная форма для перорального введения содержит более чем один слой, например 2 или 3 слоя. В предпочтительном воплощении лекарственная форма для перорального введения содержит двухслойное ядро, содержащее активный слой и разбухающий слой. Ядро может быть покрытым. Лекарственная форма для перорального введения, содержащая несколько слоев, может в одном воплощении содержать одно или несколько отверстий на поверхности покрытия на стороне активного слоя.
В одном аспекте лекарственная форма для перорального введения с замедленным высвобождением содержит фармацевтически эффективное количество зипразидона и средства замедленного высвобождения для высвобождения по меньшей мере части зипразидона, где после введения, чтобы достичь устойчивого состояния, лекарственная форма обеспечивает минимальную концентрацию зипразидона в крови при устойчивом состоянии (Сmin) по меньшей мере 20 нг/мл и максимальную концентрацию зипразидона в крови при устойчивом состоянии (Сmax) менее чем 330 нг/мл.
Под концентрацией зипразидона в крови подразумевается концентрация зипразидона в крови, в сыворотке или в плазме.
В одном предпочтительном воплощении отношение при устойчивом состоянии Сmax к Сmin менее чем около 2,6, когда лекарство дают дважды в день. В другом предпочтительном воплощении отношение Сmax к Сmin менее чем около 12, когда лекарство дают один раз в день.
Во втором аспекте фармацевтическая лекарственная форма содержит фармацевтически эффективное количество зипразидона, лекарственная форма высвобождает не более чем около 90% суммарного количества зипразидона из лекарственной формы во время первых двух часов после введения в среду применения. Лекарственная форма содержит по меньшей мере 30 мгА зипразидона.
Используемая здесь "среда применения" может быть либо средой in vivo, такой как GI тракт животного, особенно человека, либо средой in vitro в виде испытуемого раствора, такого как забуференный фосфатным буфером физиологический раствор (PBS), эталонный дуоденальный раствор натощак (MFD) или искусственный кишечный буферный раствор.
В третьем воплощении лекарственная форма для перорального введения с замедленным высвобождением содержит фармацевтически эффективное количество зипразидона и средства замедленного высвобождения для высвобождения по меньшей мере части зипразидона. Зипразидон, содержащийся в части замедленного высвобождения, является по меньшей мере одним из (i) кристаллического лекарства и (ii) лекарства, объединенного с циклодекстрином.
В другом аспекте изобретение относится к способу введения зипразидона. Способ содержит введение лекарственной формы с замедленным высвобождением, которая, когда лекарство дают человеку в сытом состоянии один или два раза в день, обеспечивает минимальную концентрацию зипразидона в крови при устойчивом состоянии (Сmin) по меньшей мере 20 нг/мл и максимальную концентрацию зипразидона в крови при устойчивом состоянии (Сmax) менее чем 330 нг/мл.
В одном предпочтительном воплощении способа отношение при устойчивом состоянии Сmax к Сmin не более чем около 2,6, когда лекарство дают дважды в день. В другом предпочтительном воплощении отношение Сmax к Сmin не более чем около 12, когда лекарство дают один раз в день.
"Замедленное высвобождение" означает, что лекарственная форма высвобождает не более чем около 90 мас.% зипразидона в лекарственной форме во время первых двух часов после введения в среду применения. Таким образом, лекарственная форма может высвобождать зипразидон постепенно и непрерывно в течение периода высвобождения, может высвобождать зипразидон в пульсирующем или замедленном режиме или может высвобождать зипразидон при сочетании профилей высвобождения, таком как немедленный выброс с последующим либо задержанным выбросом, либо с постепенным и непрерывным высвобождением.
"Введение" в среду применения, когда средой применения in vivo является GI тракт, означает доставку поглощением или проглатыванием или другими такими способами, чтобы доставить лекарственную форму. Когда среда применения является средой in vitro, "введение" относится к помещению или доставке лекарственной формы в среду испытания in vitro.
Лекарственная форма с замедленным высвобождением может обеспечить некоторые преимущества. Без желания быть связанными теорией представляется, что эффективность зипразидона имеет отношение к занятости рецептора D2. Занятость, в свою очередь, является функцией концентрации зипразидона в мозге, которая связана с концентрацией зипразидона в крови, причем занятость возрастает, когда увеличивается концентрация зипразидона в крови. Занятость D2 составляет приблизительно 50%, когда концентрация зипразидона в крови равна 16 нг/мл, приблизительно 65%, когда концентрация зипразидона в крови равна 30 нг/мл, и приблизительно 75%, когда концентрация зипразидона в крови равна 50 нг/мл. Соответственно, предпочтительно, что лекарственная форма обеспечивает минимальную концентрацию зипразидона в крови при устойчивом состоянии по меньшей мере около 20 нг/мл для эффективности, более предпочтительно по меньшей мере около 30 нг/мл и еще более предпочтительно по меньшей мере около 50 нг/мл. Лекарственная форма с замедленным высвобождением может улучшать эффективность, поддерживая уровень содержания зипразидона в крови при достаточно высоких концентрациях, чтобы обеспечить более значительную занятость D2 на более продолжительный период времени, чем IR капсула для перорального введения. Это может быть достигнуто, потому что лекарственная форма с замедленным высвобождением может давать возможность приема увеличенных количеств зипразидона по отношению к IR капсуле для перорального введения, или благодаря абсорбции зипразидона в течение более продолжительного периода времени по сравнению с IR капсулой для перорального введения, или за счет того и другого. Лекарственная форма с замедленным высвобождением может также сводить к минимуму колебания уровней содержания в крови зипразидона, тем самым вызывая более однородную ответную реакцию.
Лекарственная форма с замедленным высвобождением может также обеспечивать более низкие максимальные уровни содержания в крови зипразидона по отношению к IR капсуле для перорального введения для данной дозы, таким образом потенциально уменьшая или смягчая вредные события или побочные эффекты. Альтернативно, лекарственная форма с замедленным высвобождением может быть введена в более высокой дозе, которая будет иметь результатом более высокую эффективность по сравнению с IR капсулой для перорального введения более низкой дозы и меньше вредных событий или побочных эффектов по сравнению с IR капсулой для перорального введения более высокой дозы.
Что касается таких составов с замедленным высвобождением, которые обеспечивают введение один раз в день, лекарственные формы с замедленным высвобождением могут обеспечивать большее удобство и одобрение, возникающие из-за разового приема в день. Это особенно важно, потому что абсорбция зипразидона увеличивается вплоть до 2-кратной в присутствии пищи и, как это рекомендуется, зипразидон вводят с пищей. Удобство "приема с пищей" может быть реализовано лучше, когда частота приема лекарства один или два раза в день по сравнению с приемом несколько раз в день.
Предшествующие и другие особенности, характерные признаки и преимущества изобретения станут более легко понятными при рассмотрении следующего подробного описания изобретения.
Краткое описание чертежей
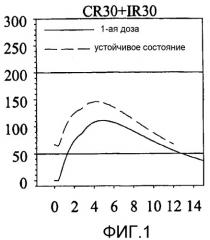
Фиг. 1 показывает концентрацию зипразидона в крови (плазме) против времени для модельной лекарственной формы на основе результатов моделирования из примера 4.
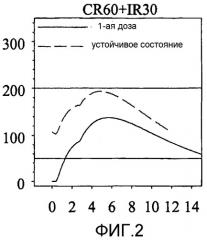
Фиг. 2 показывает концентрацию зипразидона в крови (плазме) против времени для другой модельной лекарственной формы на основе результатов моделирования из примера 4.
Подробное описание изобретения
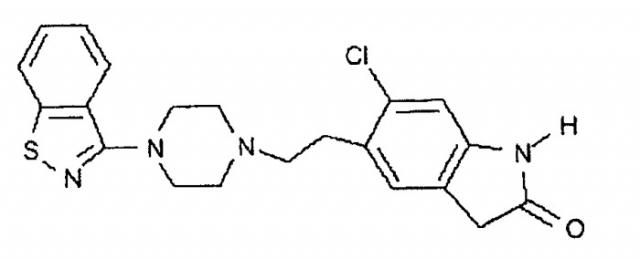
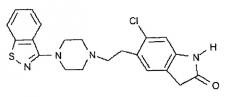
Зипразидон - это 5-[2-[4-(1,2-бензизотиазол-3-ил)-1-пиперазинил]этил]-6-хлор-1,2-дигидро-2Н-индол-2-он, известное соединение, имеющее структуру:
Зипразидон раскрыт в патентах США № 4831031 и 5312925, которые включены в описание в качестве ссылок во всей их полноте. Зипразидон применяется в качестве нейролептика и, следовательно, применим, наряду с прочим, в качестве антипсихотического средства. Зипразидон обычно вводят в суточной дозе от около 40 мгА до около 160 мгА в зависимости от потребности пациента. Под "суточной дозой" подразумевается суммарное количество зипразидона, введенного пациенту в одни сутки.
Термин "зипразидон" следует понимать как охватывающий любые фармацевтически приемлемые формы соединения. Под "фармацевтически приемлемой формой" подразумевается любое фармацевтически приемлемое производное или изменение, включая стереоизомеры, смеси стереоизомеров, энантиомеры, сольваты, гидраты, изоморфы, полиморфы, псевдоморфы, нейтральные формы, кислотные аддитивные солевые формы и пролекарства. Фармацевтически приемлемые кислотные аддитивные соли зипразидона получают обычным образом обработкой раствора или суспензии свободного основания приблизительно одним химическим эквивалентом фармацевтически приемлемой кислоты. Традиционные технологии концентрирования и перекристаллизации используют для изоляции солей. Примерами подходящих кислот являются уксусная, молочная, янтарная, малеиновая, винная, лимонная, глюконовая, аскорбиновая, мезиловая, тозиловая, бензойная, коричная, фумаровая, серная, фосфорная, хлористоводородная, бромистоводородная, иодистоводородная, сульфаминовая, сульфоновая, такая как метансульфоновая, бензолсульфоновая, и подобные кислоты. Предпочтительные формы зипразидона включают свободное основание, моногидрат гидрохлорда зипразидона, тригидрат мезилата зипразидона и тозилат зипразидона.
Лекарственные формы с замедленным высвобождением для перорального введения по данному изобретению содержат достаточное количество зипразидона, такое, чтобы быть фармацевтически эффективным. Типичная суточная доза зипразидона находится в пределах от 40 мгА до 240 мгА зипразидона. Одна или несколько лекарственных форм с замедленным высвобождением могут быть введены одновременно для достижения желательной дозы. В предпочтительных воплощениях лекарственная форма с замедленным высвобождением содержит по меньшей мере около 40 мгА до около 160 мгА зипразидона.
Так как лекарственные формы могут содержать относительно большое количество зипразидона, желательно согласовывать высокую лекарственную нагрузку, так что зипразидон составляет значительную часть лекарственной формы. Это позволяет сохранять размер лекарственной формы, который удобен для перорального введения (например, предпочтительно менее чем 1000 мг и более предпочтительно менее чем 800 мг). Предпочтительно зипразидон составляет по меньшей мере около 5% лекарственной формы. Зипразидон может входить в состав лекарственной формы даже в более высоких относительных количествах, таких как по меньшей мере около 10 мас.% или даже по меньшей мере около 15 мас.% от лекарственной формы.
Зипразидон может присутствовать в кристаллической или аморфной форме. Так как зипразидон имеет тенденцию быстро кристаллизоваться, кристаллическая форма является предпочтительной с точки зрения стабильности лекарства в лекарственной форме. Когда присутствует как аморфное лекарство, зипразидон предпочтительно присутствует в стабильной форме. Предпочтительной аморфной формой является со-лиофил зипразидона и циклодекстрина.
Зипразидон в лекарственной форме с замедленным высвобождением может быть необязательно в форме с улучшенной растворимостью. Под "формой с улучшенной растворимостью" подразумевается форма зипразидона, которая способна обеспечивать повышение концентрации, как описано более подробно ниже. Как обсуждалось здесь, форма с улучшенной растворимостью предпочтительна для тех воплощений, в которых желательно достичь абсорбции зипразидона в дистальном отделе тонкой кишки или в толстой кишке, и для тех воплощений, в которых желательно обеспечить введение один раз в сутки.
В одном воплощении форма с улучшенной растворимостью зипразидона является высоко растворимой солевой формой. Известно, что некоторые слабо растворимые лекарства могут быть введены в состав в высоко растворимых солевых формах, которые обеспечивают временные улучшения концентрации лекарства в среде применения по сравнению с другой солевой формой лекарства. Примером такой солевой формы зипразидона является соль мезилат, которая имеет растворимость в воде около 900 мкг/мл при рН 2,5. Растворимость некоторых высоко растворимых солевых форм зипразидона дана в следующей таблице:
| Солевая форма | Растворимость в воде (мкг/мл) | рН насыщенного раствора |
| Свободное основание | 0,2 | 9,8 |
| Гидрохлорид | 12 | 4,3 |
| Мезилат | 900 | 2,5 |
| Цитрат | 86 | 4,1 |
| Фосфат | 37 | 2,3 |
| Тозилат | 64 | 6,0 |
| Малеат | 118 | 4,3 |
| Сукцинат | 187 | 3,4 |
| Салицилат | 58 | 5,5 |
| Фумарат | 2000 | 2,5 |
Предпочтительные высоко растворимые солевые формы зипразидона включают гидрохлорид, мезилат, тозилат, фосфат и салицилат.
В другом воплощении форма с улучшенной растворимостью содержит зипразидон, имеющий объемно-массовый средний размер частиц менее чем около 10 мкм и предпочтительно менее чем около 5 мкм. Стандартный кристаллический зипразидон.HCl обычно находится в виде массы однородных частиц или в виде игольчатых кристаллов. Размеры таких кристаллов обычно 30 мкм в длину и 4 мкм в ширину, но наблюдается широкий диапазон. Когда указанные кристаллы анализируют с помощью Malvern Mastersizer и изучают как влажную суспензию, объемно-массовый средний диаметр равен около 10 мкм. Уменьшение размеров частиц зипразидона может улучшить скорость его растворения, обеспечивая тем самым по меньшей мере временно улучшенные концентрации растворенного зипразидона в водной среде применения по сравнению в концентрацией, достигаемой с более крупными кристаллами. Такие малые частицы могут быть получены по обычным технологиям измельчения и размалывания. В одном предпочтительном процессе зипразидон размалывают в струйной мельнице. Измельченный в струйной мельнице зипразидон может иметь объемно-массовый средний диаметр менее чем около 5 микрометров и предпочтительно менее чем около 3 микрометров.
В другом воплощении зипразидон может быть в форме наночастиц. Термин "наночастица" относится к зипразидону в форме частиц, имеющих в большинстве случаев эффективный средний размер кристалла менее чем около 500 нм, более предпочтительно менее чем около 250 нм и еще более предпочтительно менее чем около 100 нм. Примерами таких частиц являются дополнительно описанные в патенте США № 5145684, приобщенном к сему ссылкой. Наночастицы лекарства могут быть приготовлены с использованием известного способа получения наночастиц. Один способ содержит суспендирование зипразидона в жидкой дисперсионной среде и применение механических средств в присутствии измельчающей среды, чтобы уменьшить размер частиц лекарственного вещества до эффективного среднего размера частиц. Частицы могут быть уменьшены в размере в присутствии модификатора поверхности. В качестве варианта частицы могут быть приведены в контакт с модификатором поверхности после истирания. Другие альтернативные способы формирования наночастиц описаны в патенте США № 5560932 и в патенте США № 5874029, оба приобщены к сему ссылкой во всей их полноте.
Другая форма зипразидона с улучшенной растворимостью содержит зипразидон, объединенный с циклодекстрином (как комплекс включения или как физическая смесь). Используемый здесь термин "циклодекстрин" относится ко всем формам и производным циклодекстрина. Конкретные примеры циклодекстрина включают α-циклодекстрин, β-циклодекстрин и γ-циклодекстрин. Примеры производных циклодекстрина включают моно- или полиалкилированный β-циклодекстрин, моно- или полиоксиалкилированный β-циклодекстрин, такой как гидроксипропил-β-циклодекстрин (гидроксипропилциклодекстрин), моно-, тетра- или гепта-замещенный β-циклодекстрин, и циклодекстрины с группами сульфоалкиловых простых эфиров (SAE-CD), такие как сульфобутиловый простой эфир-циклодекстрин (SBECD).
Указанные формы с улучшенной растворимостью, известные также как производные циклодекстрина, упоминаемые здесь далее как "формы циклодекстрин/лекарство", могут быть простыми физическими смесями. Пример этого находится в патенте США № 5134127, приобщенном к сему ссылкой. В качестве варианта лекарство и циклоцектрин могут быть связаны друг с другом в комплекс. Например, активное лекарство и сульфоалкиловый простой эфир-циклоцекстрин (SAE-CD) могут быть предварительно преобразованы в комплекс до приготовления конечного состава. В качестве варианта лекарство может быть введено в состав с использованием пленочного покрытия, окружающего твердое ядро, содержащее модификатор скорости высвобождения и смесь SAE-CD/лекарство, как раскрыто в патенте США № 6046177, приобщенном к сему ссылкой. В качестве варианта составы с замедленным высвобождением, содержащие SAE-CD, могут состоять из ядра, содержащего физическую смесь одного или нескольких производных SAE-CD, необязательный модификатор скорости высвобождения, терапевтический агент, большая часть которого не связана в комплекс с SAE-CD, и необязательного модифицирующего скорость высвобождения покрытия, окружающего ядро. Другие формы циклодекстрин/лекарство, предусматриваемые изобретением, находятся в патентах США № 5134127, 5874418 и 5376645, все они приобщены к сему ссылкой.
Другой формой зипразидона с улучшенной растворимостью является сочетание зипразидона и солюбилизирующего агента. Такие солюбилизирующие агенты способствуют растворимости в воде зипразидона. Когда зипразидон вводят в водную среду применения в присутствии солюбилизирующего агента, концентрация растворенного зипразидона может превышать равновесную концентрацию растворенного зипразидона по меньшей мере временно. Примеры солюбилизирующих агентов включают поверхностно-активные вещества; регулирующие рН агенты, такие как буферы, органические кислоты; глицериды; неполные глицериды; производные глицеридов; простые эфиры полиоксиэтилена и полиоксипропилена и их сополимеры; сложные эфиры ангидросорбита; сложные эфиры полиоксиэтилен-ангидросорбита; алкилсульфонаты и фосфолипиды. В этом аспекте лекарство и солюбилизирующий агент предпочтительно оба твердые.
Примеры поверхностно-активных веществ включают жирную кислоту и алкилсульфонаты; коммерческие поверхностно-активные вещества, такие как хлорид бензалкония (HYAMINE® 1622, доступный от Lonza, Inc., Fairlawn, New Jersey); сульфосукцинат диоктил-натрия (DOCUSATE SODIUM, доступный от Mallinckrodt Spec. Chem., St. Louis, Missuri); сложные эфиры жирных кислот и полиоксиэтилен-ангидросорбита (TWEEN®, доступный от ICI Americas Inc., Wilmington, Delaware; LIPOSORB® 0-20, доступный от Lipochem Inc., Petterson, New Jersey; CAPMUL® POE-0, доступный от Abitec Corp., Janesville, Winsconsin) и натуральные поверхностно-активные вещества, такие как натриевая соль таурохолевой кислоты, 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин, лецитин и другие фосфолипиды и моно- и диглицериды.
Один предпочтительный класс солюбилизирующих агентов состоит их органических кислот. Примеры органических кислот включают уксусную, аконитиновую, адипиновую, аскорбиновую, аспарагиновую, бензолсульфоновую, бензойную, камфарсульфоновую, холевую, лимонную, декановую, эриторбовую, 1,2-этандисульфоновую, этансульфоновую, муравьиную, фумаровую, глюконовую, глюкуроновую, глутаминовую, глутаровую, глиоксиловую, гептановую, гиппуровую, гидроксиэтансульфоновую, молочную, лактобионовую, левулиновую, лизин, малеиновую, яблочную, малоновую, миндальную, метансульфоновую, слизевую, 1- и 2-нафталинсульфоновую, никотиновую, памовую, пантотеновую, фенилаланин, 3-фенилпропионовую, фталевую, салициловую, сахарную, янтарную, дубильную, винную, п-толуолсульфоновую, триптофан и мочевую кислоту.
Другой класс солюбилизирующих агентов состоит из материалов формирующих липофильную микрофазу, описанных в опубликованной патентной заявке США 2003/0228358А1, опубликованной 11 декабря 2003, приобщенной к сему ссылкой. Материал, формирующий липофильную микрофазу, может содержать поверхностно-активное вещество и/или липофильный материал. Так, используемый здесь термин "материал, формирующий липофильную микрофазу" предназначается для охвата смесей материалов в дополнение к единственному материалу. Примеры амфифильных материалов, подходящих для применения в качестве материала, формирующего липофильную микрофазу, включают сульфированные углеводороды и их соли, такие как 1,4-бис(2-этилгексил)сульфосукцинат натрия, известный также как докузат натрия (CROPOL), и лаурилсульфат натрия (SLS); полоксамеры, упоминаемые также как блок-сополимеры полиоксиэтилен-полиоксипропилен (PLURONICs, LUTROLs); алкиловые простые эфиры полиоксиэтилена (CREMOPHOR A, BRIJ); сложные эфиры жирных кислот и полиоксиэтилен-ангидросорбита (полисорбаты, TWEEN); глицерил-моноалкилаты с короткой цепью (HODAG, IMWITTOR, MYRJ); полигликозилированные глицериды (GELUCIREs); моно- и ди-алкилатные сложные эфиры полиолов, таких как глицерин; неионогенные поверхностно-активные вещества, такие как моноолеат полиоксиэтилен 20 ангидросорбита (полисорбат 80, продаваемый под торговой маркой TWEEN 80, коммерчески доступный от ICI); монолаурат полиоксиэтилен-ангидросорбита 20 (полисорбат 20, TWEEN 20); полиэтилен (40 или 60) гидрогенизированное касторовое масло (доступное под товарными знаками CREMOPHOR® RH40 и RH60 от BASF); полиоксиэтилен (35) касторовое масло (CREMOPHOR® EL); полиоксиэтилен (60) гидрогенизированное касторовое масло (Nikkol HCO-60); альфа-токоферил полиэтиленгликоль 1000 сукцинат (витамин Е TPGS); глицерил PEG 8 каприлат/капрат (коммерчески доступный под зарегистрированным товарным знаком LABRASOL® от Gattefosse); PEG 32 глицерил лаурат (продаваемый коммерчески под зарегистрированным товарным знаком GELUCIRE 44/14 от Gattefosse), сложные эфиры жирных кислот и полиоксиэтилена (коммерчески доступные под зарегистрированным товарным знаком MYRJ от ICI), простые эфиры жирных кислот и полиоксиэтилена (коммерчески доступные под зарегистрированным товарным знаком BRIJ от ICI). Сложные эфиры алкилаты полиолов могут считаться амфифильными или гидрофобными в зависимости от числа алкилатов на молекулу и числа атомов углерода в алкилате. Когда полиолом является глицерин, моно- и диалкилаты часто считаются амфифильными, тогда как триалкилаты глицерина, в большинстве случаев, считаются гидрофобными. Однако некоторые ученые классифицируют моно- и диглицериды даже со средней длиной цепи как гидрофобные. Смотри, например, Patel и др. патент США № 6294192 (В1), который приобщен к сему ссылкой во всей его полноте. Невзирая на классификацию, составы, содержащие моно- и диглицериды, являются предпочтительными составами по данному изобретению. Другие подходящие амфифильные материалы могут быть найдены в патенте США № 6294192, Patel, и каталогизированы как "гидрофобные неионогенные поверхностно-активные вещества и гидрофильные ионогенные поверхностно-активные вещества".
Следует отметить, что некоторые амфифильные материалы могут быть не смешивающимися с водой сами по себе, но вместо этого являются по меньшей мере до некоторой степени растворимыми в воде. Такие амфифильные материалы, тем не менее, могут быть использованы в смесях для формирования липофильной микрофазы, особенно, когда использованы как смеси с гидрофобными материалами.
Примеры гидрофобных материалов, подходящих для применения в качестве формирующего липофильную микрофазу материала, включают глицерил моно-, ди- и триалкилаты со средней длиной цепи (CAPMUL MCM, MIGLYOL 810, MYVEROL 18-92, ARLACEL 186, фракционированное кокосовое масло, легкие растительные масла); сложные эфиры ангидросорбита (ARLACEL 20, ARLACEL 40); жирные спирты с длинной цепью (стеариловый спирт, цетиловый спирт, цетостеариловый спирт); жирные кислоты с длинной цепью (стеариновая кислота) и фосфолипиды (яичный лецитин, соевый лецитин, растительный лецитин, натриевая соль таурохолевой кислоты и 1,2-диацил-sn-глицеро-3-фосфохолин, такой как 1-пальмитоил-2-олеил-sn-глицеро-3-фосфохолин, 1,2-дипальмитоил-sn-глицеро-3-фосфохолин, 1,2-дистеароил-sn-глицеро-3-фосфохолин, 1-пальмитоил-2-стеароил-sn-глицеро-3-фосфохолин, и другие натуральные или синтетические фосфатидилхолины); моно- и диглицериды каприновой и каприловой кислоты под следующими зарегистрированными товарными знаками: CAPMUL® MCM, MCM 8 и MCM 10, коммерчески доступные от Abitec, и Imwitor® 988, 742 или 308, коммерчески доступные от Condea Vista; полиоксиэтилен 6 абрикосовое ядровое масло, доступное под зарегистрированным товарным знаком Labrafil® M 1944 CS от Gattefosse; полиоксиэтилен кукурузное масло, коммерчески доступное как Labrafil® M 2125; монолуарат пропиленгликоля, коммерчески доступный как Lauroglycol от Gattefosse; дикаприлат/капрат пропиленгликоля, коммерчески доступный как Captex® 200 от Abitec или Miglyol® 840 от Condea Vista, полиглицерил-олеат, коммерчески доступный как Plurol oleique от Gattefosse, сложные эфиры ангидросорбита с жирными кислотами (например, Span® 20, Crill® 1, Crill® 4, коммерчески доступные от ICI и Croda) и глицерил-моноолеат (Maisine, Peceol); триглицериды со средней длиной цепи (МСТ, С6-С12) и триглицериды с длинной цепью (LCT, C14-C20) и смеси моно-, ди- и триглицеридов или липофильные производные жирных кислот, такие как сложные эфиры с алкиловыми спиртами; фракционированные кокосовые масла, такие как Miglyol® 812, который представляет собой 56% каприлового (С8) и 36% капринового (С10) триглицерида, как Miglyol® 810 (68% С8 и 28% С10), Neobee® M5, Captex® 300, Captex® 355 и Crodamol® GTCC; (Miglyols поставляются Condea Vista Inc. (Huls), Neobee® - Stepan Europe, Voreppe, France, Captex - Abitec Corp. и Crodamol - Croda Corp.); растительные масла, такие как соевое, саффлоровое, кукурузное, оливковое, хлопковое, арахисовое, подсолнечное, пальмовое или рапсовое; сложные эфиры жирных кислот с алкиловыми спиртами, такие как этил-олеат и глицерил-моноолеат. Другие гидрофобные материалы, подходящие для применения в качестве формирующего липофильную микрофазу материала, включают те, что перечислены в патенте США № 6294192, Patel, как "гидрофобные поверхностно-активные вещества". Примерные классы гидрофобных материалов включают жирные спирты, простые алкиловые эфиры полиоксиэтилена, жирные кислоты, сложные моноэфиры жирных кислот и глицерина, сложные диэфиры жирных кислот и глицерина, ацетилированные сложные моноэфиры жирных кислот и глицерина, ацетилированные сложные диэфиры жирных кислот и глицерина, сложные эфиры жирных кислот и низших спиртов, сложные эфиры жирных кислот и полиэтиленгликоля, сложные эфиры жирных кислот с полиэтиленгликолем и глицерином, сложные эфиры жирных кислот и полипропилена, полиоксиэтилен глицериды, производные молочной кислоты моноглицеридов, производные молочной кислоты диглицеридов, диглицериды пропиленгликоля, сложные эфиры жирных кислот и ангидросорбита, сложные эфиры жирных кислот и полиоксиэтилен-ангидросорбита, блок-сополимеры полиоксиэтилен-полиоксипропилен, переэтерифицированные растительные масла, стерины, производные стерина, сложные эфиры сахара, простые эфиры сахара, сакроглицериды, полиоксиэтилен-растительные масла, полиоксиэтилен-гидрогенизированные растительные масла, продукты реакции полиолов и по меньшей мере одного члена группы, состоящей из жирных кислот, глицеридов, растительных масел, гидрогенизированных растительных масел и стеринов, и их смеси. Смеси относительно гидрофильных материалов, такие как те, которые названы здесь как "амфифильные" или по Patel как "гидрофобные поверхностно-активные вещества", и указанные выше гидрофобные материалы являются особенно подходящими. Конкретно, смеси гидрофобных поверхностно-активных веществ и гидрофильных поверхностно-активных веществ, раскрытые Patel, являются подходящими и для многих составов предпочтительными. Однако в отличие от Patel смеси, которые содержат триглицериды в качестве гидрофобного компонента, также являются подходящими.
В одном воплощении формирующий липофильную микрофазу материал выбран из группы, состоящей из таких членов, как полигликолизированные глицериды (GELUCIREs), полиэтилен (40 или 60) - гидрогенизированное касторовое масло (доступное под товарными знаками CREMOPHOR® RH40 и RH60 от BASF); полиоксиэтилен (35) - касторовое масло (CREMOPHOR® EL); полиоксиэтилен (60) - гидрогенизированное касторовое масло (Nikkol HCO-60); сукцинат альфа-токоферил-полиэтиленгликоля 1000 (витамин Е TPGS); глицерил PEG 8 каприлат/капрат (коммерчески доступный под зарегистрированным товарным знаком LABRASOL® от Gattefosse); PEG 32 глицерил лаурат (продаваемый коммерчески под зарегистрированным товарным знаком GELUCIRE 44/14 от Gattefosse), сложные эфиры жирных кислот и полиоксиэтилена (коммерчески доступные под зарегистрированным товарным знаком MYRJ от ICI), простые эфиры жирных кислот и полиоксиэтилена (коммерчески доступные под зарегистрированным товарным знаком BRIJ от ICI), блок-сополимеры полиоксиэтилен-полиоксипропилен (PLURONICs, LUTROLs), алкиловые простые эфиры полиоксиэтилена (CREMOPHOR A, BRIJ), жирные спирты с длинной цепью (стеариловый спирт, цетиловый спирт, цетостеариловый спирт); жирные кислоты с длинной цепью (стеариновая кислота), полиоксиэтилен 6 абрикосовое ядровое масло, до