Диазаспиропиперидиновые производные в качестве ингибиторов глицинового переносчика 1 и глицинового переносчика 2
Иллюстрации
Показать всеИзобретение относится к новым соединениям общей формулы
где А-В означает CH2-CH2, -CH2-O-, -O-СН2-, -CH2-S-, -S-CHz-, N(R4)-CH2- или -СН2-N(R4)-; R1 означает (низш.)алкил, (низш.)алкенил, циклоалкил или означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, циано, (низш.)алкила, CF3, OCF3 или (низш.)алкокси, или означает гетероарил, который представляет собой циклический ароматический углеводородный радикал, содержащий один или два гетероатома, выбранных из группы, состоящей из серы ли азота, например тиазолил или тиенил, необязательно замещенный одним или двумя заместителями, выбранными из (низш.)алкила; R2 означает (низш.)алкил, циклоалкил или означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, CF3, (низш.)алкокси, или означает гетероарил, который представляет собой циклический ароматический углеводородный радикал, содержащий один гетероатом серы, например, тиенил; R3 означает водород; R4 означает водород или бензил; n означает 0, 1 или 2; и к их фармацевтически приемлемьм солям. Изобретение также относится к лекарственному средству. Технический результат - получение новых биологически активных соединений, обладающих ингибирующим действием в отношении глицинового переносчика 1 (GlyT-1). 2 н. и 17 з.п. формулы, 1 табл.
Реферат
Настоящее изобретение относится к соединениям формулы
где А-В означает СН2-СН2, -СН2-О-, -O-СН2-, -CH2-S-, -S-CH2-, -СН2-С(O)-, -С(O)-СН2-, -N(R4)-CH2- или -CH2-N(R4)-;
R1 означает (низш.)алкил, (низш.)алкенил, циклоалкил или означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, циано, (низш.)алкила, CF3, OCF3 или (низш.)алкокси, или означает гетероарил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, CF3 или (низш.)алкокси;
R2 означает (низш.)алкил, циклоалкил или означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, CF3, (низш.)алкокси, или означает гетероарил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, CF3 или (низш.)алкокси;
R3 означает водород, (низш.)алкил или бензил;
R4 означает водород или бензил;
n означает 0, 1 или 2,
и к их фармацевтически приемлемым солям.
Настоящее изобретение относится к соединениям общей формулы I, к содержащим их фармацевтическим композициям и к их применению в лечении неврологических и нейропсихиатрических нарушений.
Неожиданно было найдено, что соединения общей формулы I являются эффективными ингибиторами глицинового переносчика 1 (GlyT-1) и что они обладают высокой селективностью к ингибиторам глицинового переносчика 2 (GlyT-2).
Шизофрения является прогрессирующим и изнуряющим неврологическим заболеванием, характеризующимся эпизодическими позитивными симптомами, такими, как иллюзии, галюцинации, нарушения мышления и психоз, и постоянными негативными симптомами, такими, как вялая эмоциональная реакция, нарушенное внимание и социальная самоизоляция и нарушения познавательной способности (D.A.Lewis и J.A.Liberman, Neuron, 2000, 28: 325-333). В течение десятилетий исследование было сосредоточено на «допаминэргической гиперреактивности», на гипотезе, которая привела к терапевтическим вмешательствам, включающим блокаду допаминэргической системы (R.J.Vandenberg и R.R.Aubrey, Exp. Opin. Ther. Targets, 2001, 5(4): 507-518; A.Nakazato и S.Okuyama и др., 2000, Exp. Opin. Ther. Patents, 10(1): 75-98). Данный фармакологический подход недостаточно рассматривает негативные и когнитивные симптомы, которые являются лучшими прогностическими факторами функционального последствия (Т.Sharma, Br.J.Psychiatry, 1999, 174 (доп. 28): 44-51).
Комплементарная модель шизофрении была предложена в середине шестидесятых годов, основанная на психотомиметическом действии, вызванном блокадой глутаматной системы с помощью таких соединений, как фенциклидин (РСР), и родственных агентов (кетамин), которые являются неконкурентными антагонистами рецептора N-метил-D-аспартата (NMDA). Что интересно, у здоровых добровольцев индуцированное РСР психотомиметическое действие включает позитивные и негативные симптомы, а также когнитивную дисфункцию, таким образом близко напоминая шизофрению у пациентов (D.C.Javitt и др., 1999, Biol. Psychiatry, 45: 668-679 и ссылки здесь). Кроме того, трансгенные мыши, экспрессирующие сниженные уровни субъединицы рецептора NMDAR1, проявляют поведенческие аномалии, подобные тем, которые наблюдались на фармакологически индуцированных моделях шизофрении, поддерживая тем самым модель, на которой сниженная рецепторная активность NMDA приводит к поведению, подобному шизофрении (A.R.Mohn и др., 1999, Cell, 98: 427-236).
Нейротрансмиссия глутамата, особенно рецепторная активность NMDA, играет существенную роль в синаптической пластичности, обучении и запоминании, такие рецепторы, как NMDA, по-видимому, служат в качестве дифференцированного переключателя для синхронизации порога синаптической пластичности и формирования памяти (D.O.Hebb, 1949, The organization of behavior, Wiley, NY; T.V.Bliss и G.L.Collingridge, 1993, Nature, 361: 31-39). Трансгенные мыши, сверхэкспрессирующие субъединицу NMDA NR2B, обладают повышенной синаптической пластичностью и превосходной способностью обучения и запоминания (J.P.Tang и др., 1999, Nature: 401-63-69).
Таким образом, если дефицит глутамата вовлечен в патофизиологию шизофрении, усиление глутаматной трансмиссии, в особенности через рецепторную активацию NMDA, можно было ожидать получение как антипсихотических, так и когнитивных усиливающих эффектов.
Известно, что аминокислота глицин имеет по меньшей мере две важные функции в ЦНС. Он действует в качестве ингибиторной аминокислоты, связываясь с чувствительными к стрихнину глициновыми рецепторами, а также влияет на возбуждающую активность, действуя как незаменимый совместный агонист с глутаматом для рецепторной функции N-метил-D-аспартата (NMDA). Тогда как глутамат высвобождается из синаптических окончаний зависимым от активности способом, глицин, очевидно, присутствует на более постоянном уровне и, по-видимому, модулирует/контролирует рецептор в его ответе на глутамат.
Одним из наиболее эффективных способов контроля синаптических концентраций нейромедиатора является влияние на их повторное поглощение в синапсах. Переносчики нейромедиаторов путем удаления нейромедиаторов из внеклеточного пространства могут контролировать их внеклеточное время жизни и тем самым модулировать интенсивность синаптической трансмиссии (R.R.Gainetdinov и др., 2002, Trends in Pharm. Sci., 23(8): 367-373).
Переносчики глицина, которые образуют часть семейства натриевых и хлоридных нейромедиаторных переносчиков, играют важную роль в прекращении глицинэргических действий и поддержании концентрации внеклеточного глицина путем повторного поглощения в пресипаптических нервных окончаниях и проходящих снаружи тонких глиальных процессах.
Два различных гена глицинового переносчика были клонированы (GlyT-1 и GlyT-2) от мозга млекопитающего, которые дают начало двум переносчикам примерно с 50% гомологией аминокислотных последовательностей. GlyT-1 представляет собой четыре изоформы (1a, 1b, 1с и 1d), являющиеся результатом альтернативного сплайсинга и альтернативного использования промоторов. Только две из этих изоформ были найдены в мозге грызунов (GlyT-1а и GlyT-1b). GlyT-2 также в некоторой степени гетерогенен. В мозге грызунов были идентифицированы две изоформы GlyT-2 (2а и 2b). Известно, что GlyT-1 локализован в ЦНС и в периферических тканях, тогда как GlyT-2 специфичен для ЦНС. GlyT-1 преимущественно распространен в глиальных клетках и найден не только в областях, соответствующих чувствительным к стрихнину глициновым рецепторам, но также и за пределами этих областей, где, как было предположено, включен в модуляцию рецепторной функции NMDA (В.Lopez-Corcuera и др., 2001, Mol. Mem. Biol., 18: 13-20). Таким образом, одна стратегия для усиления рецепторной активности NMDA состоит в увеличении концентрации глицина в локальном микроокружении синаптических рецепторов NMDA путем ингибирования переносчика GlyT-1 (R.Bergereon и др., 1998, Proc. Natl. Acad. Sci. USA, 95: 15730-15734; L.Chen и др., 2003, J.Neurophysiol., 89 (2): 691-703).
Ингибиторы переносчиков глицина пригодны для лечения неврологических и психоневрологических нарушений. Большинство подразумеваемых болезненных состояний составляют психозы, шизофрения (R.E.Armer и D.J.Miller, 2001, Exp. Opin. Ther. Patents. 11 (4): 563-572), психотические расстройства настроения, такие, как острая большая депрессия, расстройства настроения, ассоциированные с психотическими расстройствами, такими как острая мания, или депрессия, ассоциированная с биполярными расстройствами, и расстройства настроения, ассоциированные с шизофренией (Е.Т.Pralong и др., 2002, Prog. Neurobiol., 67: 173-202), аутистические расстройства (M.L.Carlsson, 1998, J.Neural Transm. 105: 525-535), расстройства познавательной способности, такие, как деменции, включая возрастную деменцию и сенильную деменцию типа болезни Альцгеймера, расстройства памяти у млекопитающих, включая человека, синдром дефицита внимания и боли (R.E.Armer и D.J.Miller, 2001, Exp. Opin. Ther. Patents. 11 (4): 563-572).
Таким образом, усиление активации рецепторов NMDA посредством ингибирования GlyT-1 может привести к созданию препаратов, которые лечат психоз, шизофрению, деменцию и другие заболевания, при которых процессы познавательной способности нарушены, такие, как синдром дефицита внимания или болезнь Альцгеймера.
Объектами по настоящему изобретению являются соединения формулы I как таковые, применение соединений формулы I и их фармацевтически приемлемых солей для приготовления лекарственных средств для лечения заболеваний, связанных с активацией рецепторов NMDA посредством ингибирования GlyT-1, их приготовление, лекарственные средства, основанные на соединении по изобретению и их получение, а также применение соединений формулы I при контроле и предупреждении болезней, таких, как психозы, дисфункция запоминания и обучения, шизофрения, деменция и другие болезни, при которых процессы познавательной способности нарушены, такие, как синдром дефицита внимания или болезнь Альцгеймера.
Предпочтительными показаниями для применения соединений по настоящему изобретению являются шизофрения, нарушение познавательной способности и болезнь Альцгеймера.
Более того, изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры.
Термин «(низш.)алкил», как он использован в контексте, означает группу с насыщенной линейной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например, метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
Термин «алкенил, как он использован в контексте, означает ненасыщенную линейную или разветвленную группу, содержащую от 2 до 7 атомов углерода и по меньшей мере одну двойную связь.
Термин «циклоалкил» означает насыщенное или частично насыщенное кольцо, содержащее от 3 до 7 атомов углерода, например, циклопропил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил или циклогептенил.
Термин «галоид» означает хлор, йод, фтор или бром.
Термин «арил» означает одновалентный циклический ароматический углеводородный радикал, состоящий из одного или нескольких конденсированных колец, из которых по меньшей мере одно кольцо имеет ароматическую природу, например, фенил или нафтил.
Термин «гетероарил» означает циклический ароматический углеводородный радикал, содержащий один, два или три гетероатома, выбранных из группы, состоящей из кислорода, серы или азота, например, пиридил, пиразинил, пиримидинил, пиридазинил, триазинил, тиазолил, тиенил, фурил, пирролил, имидазолил, пиразолил, оксазолил, изотиазолил или изоксазолил.
Термин «фармацевтически приемлемые кислотно-аддитивные соли» охватывает соли с неорганическими и органическими кислотами, такими, как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, n-толуолсульфоновая кислота и тому подобное.
Особенно предпочтительными являются соединения формулы I,
где
А-В означает -СН2-СН2-, -СН2-O-, -O-СН2-, -S-CH2- или -N(R4)-CH2-;
R1 означает (низш.)алкил, (низш.)алкенил, циклоалкил или означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, циано, (низш.)алкила, CF3, OCF3 или (низш.)алкокси, или означает гетероарил, необязательно замещенный (низш.)алкилом;
R2 означает (низш.)алкил или означает фенил, необязательно замещенный одним заместителем, выбранным из группы, состоящей из галоида, (низш.)алкила, CF3, (низш.)алкокси, или означает гетероарил;
R3 означает водород;
R4 означает бензил;
N означает 1 или 2,
и их фармацевтически приемлемые соли.
Кроме того, предпочтительными являются соединения, в которых -А-В- означает -СН2-СН2- и n означает 1.
Особенно предпочтительными в этой группе являются соединения, в которых R1 и R2 означают фенил, необязательно замещенный галоидом или (низш.)алкилом, например, следующие соединения:
рац-4-фенил-8-(1-фенилциклогексил)-2,8-диазаспиро[4.5]декан-1-он, рац-4-(4-фторфенил)-8-[1-(4-фторфенил)пиклогексил]-2,8-диазаспиро[4.5]декан-1-он или рац-8-[1-(4-фторфенил)пиклогексил]-4-n-толил-2,8-диазаспиро[4.5]декан-1-он;
или где R1 означает тиофенил и R2 означает фенил, замещенный галоидом, например, следующие соединения:
рац-4-(4-фторфенил)-8-(1-тиофен-2-илциклогексил)-2,8-диазаспиро[4.5]декан-1-он или рац-4-(4-фторфенил)-8-(1-тиофен-3-илциклогексил)-2,8-диазаспиро[4.5]декан-1-он;
или где R1 означает фенил, необязательно замещенный галоидом, и R2 означает (низш.)алкил, например, следующие соединения:
рац-8-(1-фенилциклогексил)-4-пропил-2,8-диазаспиро[4.5]декан-1-он или
рац-8-[1-(4-фторфенил)циклогексил]-4-пропил-2,8-диазаспиро[4.5]декан-1-он.
Кроме того, предпочтительными являются соединения, где -А-В- означает -О-СН2-, -СН2О-, -S-CH2- или -N(бензил)-СН2-, а n означает 1.
Дополнительным объектом по настоящему изобретению являются соединения формулы I, где n означает 2. Примером из этой группы является соединение
рац-4-(4-фторфенил)-8-[1-(4-фторфенил)циклогептил1]-2,8-диазаспиро[4.5]декан-1-он. Данные соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например, способом, описанным ниже, который включает:
а) взаимодействие соединение формулы
с соединением формулы
в присутствии уксусной кислоты и триметилтиоцианата (TMSCN) и затем с соответствующим реактивом Гриньяра формулы
с образованием соединения формулы
где заместители такие, как описано выше, и hal означает хлор, бром или йод, и
б) при необходимости разделение полученных рацемических форм на соответствующие энантиомеры и
при необходимости превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
Кислотно-аддитивные соли основных соединений формулы I могут быть превращены в соответствующие свободные основания обработкой по меньшей мере стехиометрическим эквивалентом подходящего основания, такого, как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
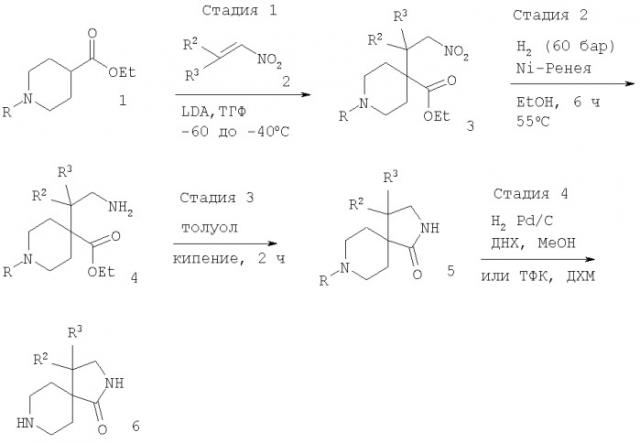
Соединения формулы I могут быть получены в соответствии с вариантами а) и б) способа и следующими схемами 1 и 2.
Исходный материал является коммерчески доступным или может быть получен в соответствии с известными способами.
Следующие аббревиатуры были использованы:
LDA - диизопропиламид лития
TMSCN - триметилтиоцианат
ДХМ - дихлорметан
ТФК - трифторуксусная кислота
ТГФ - тетрагидрофуран
Исходя из соответствующим образом 1-(защищенного)-4-этилкарбоксилата 1, обработка с соответствующим основанием, обычно диизопропиламидом лития, с последующей обработкой надлежащим образом защищенным нитроалкеном 2 приводит к образованию нитроалкана 3. Восстановление в аминогруппу, облегчаемое с помощью Ni-Ренея и водорода, обычно при давлении 60 бар и температуре 60°С в этаноле в качестве растворителя, приводит к образованию соединения 4. Последующая циклизация нагреванием в толуоле при кипении дает амид 5. Удаление защитной группы в стандартных условиях (обработка ТФК в ДХМ в случае R = трет-бутилоксикарбонил (Boc); или гидрогенолиз с Pd/C в ДХМ, метаноле в случае R = бензил (Bn)) дает диазаспиропиперидины 6 (схема 1).
Схема 1
где R означает N-защитную группу, такую, как Boc или бензил, а другие заместители имеют значения, описанные выше.
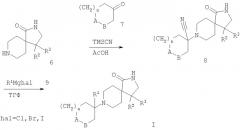
Соединения формулы 6 обрабатывают в условиях реакции Штреккера соединением формулы 7 в присутствии уксусной кислоты и источника цианида (предпочтительно триметилтиоцианата), получая соединение формулы 8, которое затем обрабатывают в условиях реакции Брюлана с соответствующим реагентом Гриньяра 9, получая соединения формулы I (схема 2). Синтез Штреккера может быть также осуществлен при использовании подходящих цианирующих реагентов (цианистого калия, ацетонциангидрина) согласно известным способам в диапазоне температур от 0°С до 100°С с продолжительностью реакции между 30 мин и 7 сутками. Реакции Брюлана могут осуществляться с использованием реагентов Гриньяра, полученных из магния (Mg(0)) или из изопропилмагнийхлорида или других известных реагентов в соответствующем растворителе, таком, как тетрагидрофуран (ТГФ). Соответствующие реагенты Гриньяра представлены формулой .
Схема 2
Все соединения формул 1, 3, 4, 5, 6 и 8 могут быть получены в рацемической форме, следуя методикам, описанным ниже, и разделены на хиральные нерацемические энантиомеры препаративной ВЭЖХ, используя колонку или Chiralpak OD, или AD (5×50 см) при комнатной температуре, применяя в качестве мобильной фазы смесь этанол-гептан и УФ-детектирование при 220 нм.
Соединения формулы I и их фармацевтически применимые соли обладают ценными фармакологическими свойствами. Конкретно было найдено, что соединения по настоящему изобретению являются эффективными ингибиторами глицинового переносчика 1 (GlyT-1).
Соединения исследовали согласно методике, приведенной далее.
Растворы и материалы
Полная среда DMEM: питательная смесь F-12 (Gibco Life Technologies), 5% эмбриональная бычья сыворотка (FBS) (Gibco Life Technologies), 1% пенициллин/стрептомицин (Gibco Life Technologies), 0,6 мг/мл гигромицина (Gibco Life Technologies), 1 мМ глутамин (Gibco Life Technologies).
Буфер поглощения (UB): 150 мМ NaCl, 10 мМ Hepes-трис, рН 7,4, 1 мМ CaCl2, 2,5 мМ KCl, 2,5 мМ MgSO4, 10 мМ (+)-D-глюкоза.
Клетки Flp-in™-CHO (по каталогу Invitrogen № R758-07), устойчиво трансфицированные кДНК mGlyT-1b.
Анализ ингибирования поглощения глицина (mGlvT-1b)
В день 1 клетки млекопитающего (Flp-in™-CHO), трансфицированные кДНК mGlyT-1b, помещали при плотности 40000 клеток/лунку в полную среду F-12 без гигромицина в 96-луночные культуральные планшеты. В день 2 среду аспирировали и клетки промывали дважды буфером поглощения (UB). Затем клетки инкубировали в течение 20 мин при 22°С с каждым из следующих вариантов: (i) без потенциального конкурента, (ii) 10 мМ нерадиоактивный глицин, (iii) одна концентрация потенциального ингибитора. Использовали диапазон концентраций потенциального ингибитора, чтобы получить данные для расчета концентрации ингибитора, приводящей к 50% эффекту (например, IC50-концентрации конкурента, ингибирующего поглощение глицина на 50%). Затем незамедлительно прибавляли раствор, содержащий 60 нМ [3Н]-глицин (11-16 Ки/ммоль) и 25 мкМ нерадиоактивный глицин. Планшеты инкубировали при осторожном встряхивании, реакцию останавливали аспирацией смеси и промыванием (три раза) охлажденным льдом буфером UB. Клетки лизировали со сцинтилляционной жидкостью, встряхивали 1 ч и радиоактивность в клетках считали, используя сцинтилляционный счетчик.
Следующая активность была показана для мыши и человека.
| № примера | GlyT-1 рацемат мышь/человек (нмоль) | GlyT-1 энантиомер мышь/человек (нмоль) |
| 1 | 115/118 | 115, 160/77, 107 |
| 25 | 103/95 | 56, 73/н.о., 97 |
| 36 | 67/- | 75, н.о./281, 381 |
| 38 | 99/- | 99, 213/- |
| 50 | -/132 | 81, 153/- |
| 52 | -/73 | |
| 56 | -/161 | -/62, 82 |
| 57 | -/93 |
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут применяться в качестве лекарственных средств, например, в форме фармацевтических композиций. Фармацевтические композиции могут быть введены перорально, например, в форме таблеток, таблеток с нанесенным покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение может быть также осуществлено ректально, например, в форме суппозиториев, парентерально, например, в форме инъекционных растворов.
Соединения формулы I могут быть переработаны с фармацевтически инертными неорганическими или органическими носителями для приготовления фармацевтических композиций. Например, лактоза, кукурузный крахмал или их производные, тальк, стеариновые кислоты или их соли и т.д. могут использоваться в качестве таких носителей для таблеток, таблеток с нанесенным покрытием, драже и твердых желатиновых капсул. Соответствующими носителями для мягких желатиновых капсул являются, например, растительные масла, воск, жиры, полутвердые и жидкие полиолы и тому подобное. В зависимости от природы активного вещества никакие носители, однако, не требуются в случае мягких желатиновых капсул. Соответствующими носителями для приготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и тому подобное. Соответствующими носителями для суппозиториев являются, например, природные и затвердевшие масла, воск, жиры, полужидкие или жидкие полиолы и тому подобное.
Более того, фармацевтические композиции могут содержать консерванты, солюбилизаторы, стабилизаторы, скользящие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать и другие терапевтически ценные вещества.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом по настоящему изобретению, как и способ для их получения, который включает приведение одного или нескольких соединений формулы I и/или фармацевтически приемлемых их кислотно-аддитивных солей и, если требуется, одного или нескольких терапевтически ценных веществ в галенову форму введения вместе с одним или несколькими терапевтически инертными носителями.
Наиболее предпочтительными показаниями по настоящему изобретению являются те, которые включают нарушения центральной нервной системы, например, лечение или предупреждение шизофрении, повреждение познавательной способности и болезнь Альцгеймера.
Доза может изменяться в широких пределах и, безусловно, должна будет приведена к индивидуальным требованиям в каждом конкретном случае. В случае перорального введения доза для взрослых может меняться от примерно 0,01 мг до 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Ежедневная доза может вводиться в виде однократной дозы или в разделенных дозах, и, кроме того, верхний предел может быть также превышен, когда это необходимо по показаниям.
Следующие примеры иллюстрируют настоящее изобретение без его ограничения. Все температуры даны в градусах Цельсия.
Получение структурных элементов 6
рац-4-Фенил-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир рац-1-бензил-4-(2-нитро-1-фенилэтил)пиперидин-4-карбоновой кислоты
а) Раствор LDA (14 ммолей) получали обработкой диизопропиламина (1,37 г, 14 ммолей) бутиллитием (1,6 М, 8,5 мл, 14 ммолей) при -78°С в безводном ТГФ (10 мл) в атмосфере аргона и давали нагреться до -20°С. Затем данный раствор, охлажденный до -60°С, прибавляли к раствору 1-бензилпиперидин-4-этилкарбоксилата (3,05 г, 12 ммолей) при -60°С и давали нагреться до -40°С в течение 1 ч, после чего прибавляли по каплям раствор транс-β-нитростирола (1,93 г, 13 ммолей). Реакционной смеси давали нагреться до комнатной температуры в течение 1 ч и затем «гасили» хлористым аммонием (насыщенным раствором, 40 мл), и продукт экстрагировали этилацетатом (2×40 мл). Объединенные органические экстракты затем промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали. Очистка хроматографией на силикагеле, элюирование смесью дихлорметан-метанол (9:1) дали указанное в заглавии соединение (4,1 г, 84%) в виде смолы светло-желтого цвета. МС, m/z: 397,4 (М+Н)+.
Этиловый эфир рац-4-(2-амино-1-фенилэтил)-1-бензилпиперидин-4-карбоновой кислоты
б) Раствор этилового эфира рац-1-бензил-4-(2-нитро-1-фенилэтил)пиперидин-4-карбоновой кислоты (3,18 г, 8 ммолей) в безводном этаноле (240 мл) гидрировали в присутствии Ni-Ренея (3 г) при давлении 60 бар и температуре 55°С в течение 3 ч. После охлаждения и уменьшения давления в реакционном сосуде смесь фильтровали через слой целита, и фильтрат упаривали, оставляя указанное в заглавии соединение (2,9 г, 99%) в виде прозрачного масла. МС, m/z: 367,4 (М+Н)+.
рац-8-Бензил-4-фенил-2,8-диазаспиро[4.5]декан-1-он
в) Раствор этилового эфира рац-4-(2-амино-1-фенилэтил)-1-бензилпиперидин-4-карбоновой кислоты (2,9 г, 8 ммолей) в толуоле (30 мл) нагревали при кипении в течение 4 ч. После охлаждения до комнатной температуры и упаривания смесь очищали хроматографией на силикагеле, элюируя смесью дихлорметан-метанол-водный аммиак (95:4,5:0,5), чтобы получить указанное в заглавии соединение (1,47 г, 58%) в виде твердого вещества белого цвета. МС, m/z: 321,4 (М+Н)+.
рац-4-Фенил-2,8-диазаспиро[4.5]декан-1-он
г) Суспензию рац-8-бензил-4-фенил-2,8-диазаспиро[4.5]декан-1-она (28,8 г, 90 ммолей) в смеси метанол-дихлорметан (4:1, 500 мл) гидрировали в присутствии Pd (10% на угле, 14 г, 132 ммоля) при давлении 2 бара в течение 48 ч при комнатной температуре. После фильтрования через слой целита реакционную смесь упаривали и остаток растворяли в растворе гидроксида натрия (2н., 200 мл). Продукт экстрагировали ДХМ (3×150 мл) и объединенные органические экстракты сушили над сульфатом натрия. Фильтрование и упаривание дали указанное в заглавии соединение (13,1 г, 63%) в виде твердого вещества белого цвета после затирания в диэтиловом эфире. МС, m/z: 231,4 (M+H)+.
Схема 1. стадия 1: фторпроизводное из соединения с Вос-защитной группой
рац-4-(4-Фторфенил)-2,8-диазаспиро[4.5]декан-1-он
4-Этиловый эфир 1-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты
а) К раствору этилового эфира 4-пиперидинкарбоновой кислоты (20 г, 127 ммолей) в смеси диоксан-вода (1:1, 120 мл) прибавляли триэтиламин (12,87 г, 127 ммолей) при 0°С, затем ди-трет-бутилкарбонат (35,2 г, 161 ммоль) и полученную смесь поддерживали при данной температуре в течение 2 ч. Затем продукт экстрагировали этилацетатом (3×100 мл) и объединенные органические экстракты промывали хлористоводородной кислотой (1н., 100 мл), насыщенным солевым раствором (100 мл), сушили над сульфатом натрия, фильтровали и упаривали. Очистка перегонкой в высоком вакууме (Кугельрор) дала указанное в заглавии соединение (29,0 г, 89%) в виде бесцветной жидкости, tкип. 140°С при 0,13 мбар. МС, m/z: 275,2 (М+HN4)+.
4-Этиловый эфир 1-трет-бутилового эфира рац-4-[1-(4-фторфенил)-2-нитроэтил]пиперидин-1,4-дикарбоновой кислоты
б) Раствор диизопропиламида лития получали обработкой диизопропиламина (6,98 г, 69 ммолей) с раствором бутиллития (1,6 М, 41,3 мл, 66 ммолей) при -78°С в безводном ТГФ (45 мл) в атмосфере аргона и давали нагреться до -20°С. Затем данный раствор, охлажденный до -60°С, прибавляли к раствору 4-этилового эфира 1-трет-бугилового эфира пиперидин-1,4-дикарбоновой кислоты (15,44 г, 60 ммолей) в безводном ТГФ (45 мл) при -60°С и давали нагреться до -40°С в течение 1 ч, после чего прибавляли по каплям раствор 4-фтор-транс-β-нитростирола (10,02 г, 60 молей) в безводном ТГФ (40 мл). Реакционной смеси давали нагреться до комнатной температуры в течение 1 ч и затем «гасили» раствором хлористого аммония (насыщенным, 250 мл), продукт экстрагировали диэтиловым эфиром (3×100 мл). Объединенные органические экстракты затем промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали, получая указанное в заглавии соединение (26,7 г, 99%) в виде смолы светло-желтого цвета. МС, m/z: 442,4 (M+HN4)+.
Этиловый эфир рац-4-(2-амино-1-фенилэтил)-1-трет-бутилпиперидин-1,4-дикарбоновой кислоты
в) Раствор 4-этилового эфира 1-трет-бутилового эфира рац-4-[1-(4-фторфенил)-2-нитроэтил]пиперидин-1,4-дикарбоновой кислоты (26,6 г, 60 ммолей) в безводном этаноле (600 мл) гидрировали в присутствии Ni-Ренея (25 г) при давлении 50 бар и температуре 50°С в течение 20 ч. После охлаждения и уменьшения давления в реакционном сосуде смесь фильтровали через слой целита и фильтрат упаривали, чтобы оставить указанное в заглавии соединение (23,4 г, 99%) в виде прозрачного масла, которое использовали непосредственно на следующей стадии.
трет-Бутиловый эфир рац-4-(4-фторфенил)-1-оксо-2,8-диазаспиро[4.5]декан-8-карбоновой кислоты
г) Раствор этилового эфира рац-4-(2-амино-1-фенилэтил)-1-трет-бутилпиперидин-1,4-дикарбоновой кислоты (23,4 г, 60 ммолей) в толуоле (200 мл) нагревали при кипении в течение 18 ч. После охлаждения до комнатной температуры упаривание дало указанное в заглавии соединение (17,7 г, 83%) в виде твердого вещества белого цвета после затирания с горячим пентаном. МС, m/z: 349,3 (М+Н)+.
рац-4-(4-Фторфенил)-2,8-диазаспиро[4.5]декан-1-он
д) Раствор трет-бутилового эфира рац-4-(4-фторфенил)-1-оксо-2,8-диазаспиро[4.5]декан-8-карбоновой кислоты (46,0 г, 132 ммоля) в дихлорметане (260 мл), содержащем трифторуксусную кислоту (150 мл, 1,32 моля), энергично перемешивали при 0°С в течение 15 мин. Затем реакционную смесь выливали в раствор гидроксида натрия (3н., 200 мл) и продукт экстрагировали дихлорметаном (3×100 мл). Объединенные органические экстракты после этого промывали водой (100 мл) и насыщенным солевым раствором (100 мл) и затем сушили над сульфатом натрия. Фильтрование и упаривание дали указанное в заглавии соединение (22,14 г, 68%) в виде твердого вещества белого цвета после затирания в этилацетате. МС, m/z: 249,2 (М+Н)+.
(R)-4-(4-Фторфенил)-2,8-диазаспиро[4.5]декан-1-он и (S)-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он
Энантиомеры рац-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-она разделяли с применением колонки Chiralpak AD размером 5×50 см при комнатной температуре, используя в качестве мобильной фазы смесь 15% этанол-85% гептан с детектированием в УФ-свете при 220 нм. Менее полярный компонент (пик 1) соответствовал (R)-энантиомеру (смотри ниже).
Установление абсолютной стереохимии: к раствору 4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-она (пик 1, 50 мг, 0,2 ммоля) в метаноле (10 мл) прибавляли 1R-(-)-камфорсульфоновую кислоту (46,8 г, 0,2 ммоля) и раствор перемешивали в течение 10 мин при комнатной температуре. Полученную смесь упаривали и остаток кристаллизовали из этилацетата. Рентгеноструктурный анализ монокристалла определил, что абсолютной конфигурацией является (R)-конфигурация, как соль
1R-(-)-камфорсульфоновой кислоты.
Получение структурных элементов 8
рац-1-(1-Оксо-4-фенил-2,8-диазаспиро[4.5]дец-8-ил)циклогексанкарбонитрил
К смеси рац-4-фенил-2,8-диазаспиро[4.5]декан-1-она (8,0 г, 34,7 ммоля) в уксусной кислоте (80 мл) прибавляли циклогексанон (3,4 г, 34,7 ммоля) с последующим прибавлением по каплям TMSCN (10,4 г, 104,2 ммоля), и полученную смесь перемешивали при комнатной температуре в течение 5 суток. Образовавшуюся смесь выливали в смесь льда с раствором гидроксида натрия (25%, 200 мл) и полученное твердое вещество белого цвета отделяли фильтрованием. Твердое вещество растворяли в дихлорметане (50 мл), промывали водой (40 мл) и сушили над сульфатом натрия. Фильтрование и упаривание дали указанное в заглавии соединение (7,25 г, 62%) в виде твердого вещества белого цвета после очистки хроматографией на силикагеле и элюировании смесью дихлорметан-метанол (9:1). МС, m/z: 338,3 (М+Н)+.
рац-1-[4-(4-Фторфенил)-1-оксо-2,8-диазаспиро[4.5]дец-8-ил]циклогексанкарбонитрил
Как описано выше, рац-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он (10,0 г, 40,3 ммоля) превращали в указанное в заглавии соединение (8,0 г, 56%), которое получали в виде твердого вещества белого цвета. МС, m/z: 356,5 (M+H)+.
(R)-1-[4-(4-Фторфенил)-1-оксо-2,8-диазаспиро[4.5]дец-8-ил]циклогексанкарбонитрил
Как описано выше (R)-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он (пик А, 150 мг, 0,4 ммоля) превращали в указанное в заглавии соединение (116 мг, 54%), которое получали в виде твердого вещества белого цвета. МС, m/z: 356,5 (M+H)+.
(S)-1-[4-(4-Фторфенил)-1-оксо-2,8-диазаспиро[4.5]дец-8-ил]циклогексанкарбонитрил
Как описано выше (S)-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он (пик Б, 150 мг, 0,4 ммоля) превращали в указанное в заглавии соединение (116 мг, 54%), которое получали в виде твердого вещества белого цвета. МС, m/z: 356,5 (М+Н)+.
Пример 1
рац-4-Фенил-8-(1-фенилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
К раствору рац-1-(1-оксо-4-фенил-2,8-диазаспиро[4.5]дец-8-ил)циклогексанкарбонитрила (400 мг, 1,2 ммоля) в безводном ТГФ (12 мл) в атмосфере аргона при 0°С прибавляли фенилмагнийбромид (1 М в ТГФ, 3,5 мл, 3,6 ммоля) и полученной смеси давали нагреться до комнатной температуры в течение ночи. Реакцию прекращали добавлением раствора хлористого аммония (насыщенного, 20 мл) и продукт экстрагировали этилацетатом (2×50 мл). Затем объединенные органические экстракты промывали насыщенным солевым раствором (50 мл), сушили над сульфатом натрия, фильтровали и упаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан-метанол-водный аммиак (95:4,5:0,5), чтобы получить указанное в заглавии соединение (430 мг, 94%) в виде твердого вещества белого цвета. МС, m/z: 389,3 (М+Н)+.
Пример 2
рац-4-Фенил-8-(1-n-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 1, рац-1-(1-оксо-4-фенил-2,8-диазаспиро[4.5]дец-8-ил)циклогексанкарбонитрил (200 мг, 0,6 ммоля) превращали в указанное в заглавии соединение (186 мг, 78%) (используя n-толилмагнийбромид вместо фенилмагнийбромида), которое получали в виде твердого вещества белого цвета. МС, m/z: 403,6 (М+Н)+.
Пример 3
рац-4-Фенил-8-(1-м-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
К раствору 3-йодтолуола (388 мг, 1,8 ммоля) в безводном ТГФ (6 мл) в атмосфере аргона при 60°С прибавляли изопропилмагнийхлорид (2 М раствор в ТГФ, 977 мкл, 2,0 ммоля), и полученному раствору давали нагреться до 0°С в течение 1 ч и затем до комнатной температуры в течение 10 мин. Полученный раствор после этого прибавляли по каплям к раствору рац-1-(1-оксо-4-фенил-2,8-диазаспиро[4.5]дец-8-ил)циклогексанкарбонитрила (200 мг, 0,6 ммоля) в безводном ТГФ (3 мл), и раствор перемешивали в течение ночи при комнатной температуре. Реакцию прекращали добавлением раствора хлористого аммония (насыщенного, 10 мл), и продукт экстрагировали этилацетатом (2×20 мл). Затем объединенные органические экстракты промывали насыщенным солевым раствором (20 мл), сушили над сульфатом натрия, фильтровали и упаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан-метанол-водный аммиак (95:4,5:0,5), чтобы получить указанное в заглавии соединение (170 мг, 71%) в виде твердого вещества белого цвета. МС, m/z: 403,6 (М+Н)+.
Пример 4
рац-4-Фенил-8-(1-о-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 3, рац-1-(1-оксо-4-фенил-2,8-диазаспиро[4.5]дец-8-ил)циклогексанкарбонитрил (200 мг, 0,6 ммоля) превращали в указанное в заглавии соединение (11 мг, 5%) (используя 2-йодтолуол вместо 3-йодтолуола), которое получали в виде твердого вещества белого цвета. МС, m/z: 403,6 (М+Н)+.
Пример 5
рац-8-[1-(3-Фторфенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 3, рац-1-(1-оксо-4-фенил-2,8-диазаспиро[4.5]дец-8-ил)циклогексанкарбонитрил (200 мг, 0,6 ммоля) превращали в указанное в заглавии соединение (146 мг, 61%) (используя 1-фтор-3-йодбензол вместо 3-йодтолуола), которое получали в виде твердого вещества белого цвета. МС, m/z: 407,5 (М+Н)+.
Пример 6
рац-8-[1-(3,4-Дифторфенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 3, рац-1-(1-оксо-4-фенил-2,8-диазаспиро[4.5]дец-8-ил)циклогексанкарбонитрил (200 мг, 0,6 ммоля) превращали в указанное в заглавии соединение (96 мг, 38%) (используя 1,2-дифтор-4-йодбензол вместо 3-йодтолуола), которое получали в виде твердого вещества белого цвета. МС, m/z: 425,6 (М+Н)+.
Пример 7
рац-8-[1-(4-Хлорфенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 3, рац-1-(1-оксо-4-фенил-2,8-диазаспиро[4.5]дец-8-ил)циклогексанкарбонитрил (200 мг, 0,6 ммоля) превращали в указанное в заглавии соединение (96 мг, 38%) (используя 1-хлор-4-йодбензол вместо 3-йодтолуола), которое получали в виде твердого вещества белого цвета. МС, m/z: 423,4 (М+Н)+.
Пример 8
рац-4-Фенил-8-[1-(4-трифторметилфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 3, рац-1-(1-оксо-4-фенил-2,8-диазаспиро[4.5]дец-8-ил)циклогексанкарбонитрил (200 мг, 0,6 ммоля) превращали в указанное в заглавии соединение (169 мг, 63%) (используя 4-йодбензотрифторид вместо 3-йодтолуола), которое получали в виде твердого вещества