Новые варианты полипептида papm бактерий рода streptomyces
Иллюстрации
Показать всеИзобретение относится к области микробиологии и фармакологии. Предложен новый рекомбинантный вариант полипептида РарМ. Полипептид обладает активностью SAM-зависимой N-метилтрансферазы и способен катализировать реакцию метилирования 4-амино-L-фенилаланина до 4-метиламино-L-фенилаланина с образованием мажоритарной изоформы PIB стрептограмина В. Полипептид получен путем по меньшей мере одной замены глицина в положении 249 серином и/или замены треонина в положении 192 изолейцином в последовательности полипептида РарМ дикого типа S. Pristinaespiralis. Предложены также нуклеиновая кислота, кодирующая его, вектор, содержащий такую нуклеиновую кислоту, клетка-хозяин, способ получения полипептида, штаммы, продуцирующие его. Изобретение может быть использовано в медицине. 15 н. и 22 з.п. ф-лы, 13 ил., 9 табл.
Реферат
Настоящее изобретение относится к новым вариантам полипептида PapM бактерий рода Streptomyces, обладающим улучшенной по отношению к полипептиду дикого типа субстратной селективностью и/или эффективностью. Оно также относится к кодирующим эти варианты нуклеиновым кислотам, к микроорганизмам, содержащим эти нуклеиновые кислоты, и к их применению для получения компонента В стрептограминов.
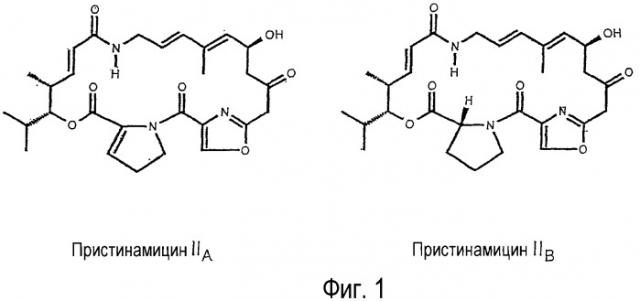
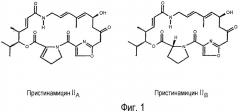
Пристинамицин представляет собой антибиотик, принадлежащий к семейству стрептограминов, к которому также относятся виргиниамицин и микамицин. Стрептограмины составляют небольшую однородную и оригинальную группу антибиотиков, образованных ассоциацией двух типов очень разных в химическом отношении молекул: стрептограмины А представляют собой полиненасыщенные макролактоны, а стрептограмины В являются депсипептидами (Cocito C.G. (1979) Microbiol. Rev., 43:145-198) (Cocito C.G. (1983) In Antibiotics, 6 :(Ed. F.E. Hahn), 296-332). В случае пристинамицина соединения А и В называют, соответственно, пристинамицинами II (PII) и пристинамицинами I (PI), а их строение представлено на фигурах 1 и 2.
Соединения А и В имеют синергическую антибактериальную и бактерицидную активность, в особенности направленную против грамположительных бактерий, таких как Стафилококки и Энтерококки (Cocito, 1979). Действие этих соединений связано с их фиксацией на субъединице 50S рибосом клеток-мишений, что приводит к ингибированию синтеза белка (Cocito, 1979); (Di Giambattista M., Chinali G. et Cocito C.G. (1989) J. Antim. Chemother., 24:485-507).
Стрептограмины в основном продуцируются актиномицетами. В частности, пристинамицин продуцируется нитевидной бактерией Streptomyces pristinaespiralis в форме природной смеси, состоящей на 30% из PI и на 70% из PII (Blanc et al., (1995), J. Bacteriol. 177 (18):5206-14). Для каждого типа молекулы происходит со-продукция нескольких изоформ, как это часто наблюдается в отношении природных метаболитов.
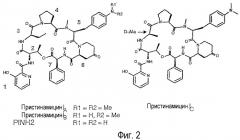
В случае пристинамицинов PI(компонентов В пристинамицинов) мажоритарной продуцируемой формой является PIA, состоящий из 7 следующих остатков, связанных между собой амидными связями и сложноэфирной связью (Фиг. 2): 3-гидроксипиколиновая кислота, L-треонин, D-аминомасляная кислота, L-пролин, 4-диметиламино-L-фенилаланин, 4-оксо-L-пипеколиновая кислота и L-фенилглицин. Вместе с PIA со-продуцируются несколько природных изоформ, соответствующих структурным изменениям главным образом в следующих остатках: D-аминомасляная кислота, 4-диметиламино-L-фенилаланин (L-DMPAPA) и 4-оксо-L-пипеколиновая кислота (Thibaut et al., (1997) J. Bacteriol. 179(3):697-704). Эти миноритарные формы синтезируются в количествах, зависящих от штаммов S. pristinaespiralis, но в основном составляющих величину порядка нескольких процентов, в то время как PIA составляет от 90% до 95% от количества продуцируемых PI. В частности, следует отметить, что различные штаммы S. pristinaespiralis синтезируют приблизительно 5% PIB, отличающегося от PIA наличием 4-метиламино-L-фенилаланина (L-MMPAPA) в положении 4 макроцикла (Фиг. 2). Несмотря на свое миноритарное положение, PIB оказался молекулой, представляющей особый интерес в силу своих различных фармакологических свойств (WO96/05219).
Другой аналог PIA, PINH2, отличающийся наличием 4-амино-L-фенилаланина в положении 4 (см. Фиг. 2), представляет интерес для разработки оригинальных продуктов гемисинтеза. До настоящего времени PINH2 можно было получить только способом, в котором 4-амино-L-фенилаланин добавляют в культуральную среду S. pristinaespiralis (WO96/01901).
Были рассмотрены различные подходы к улучшению продукции стрептограминов; первый подход состоит в изменении общей пропорции продуцируемых компонентов А (пристинамицины II) по отношению к продукции компонентов В (пристинамицины I); другой подход состоит в изменении пропорции различных изоформ в составе каждого из компонентов А и В. Тем не менее, ни один их подходов не позволил добиться достаточной продукции пристинамицина PIB, остающегося миноритарной формой компонентов В (пристинамицинов I) пристинамицина.
Первый подход, описанный в заявке WO93/20182, заключается в селекции микроорганизмов, способных специфически осуществлять продукцию компонентов А или компонентов В стрептограминов. Эти микроорганизмы получают обычными методами селекции, включающими первую факультативную стадию мутагенеза, осуществляемую на микроорганизме-продуценте стрептограминов, и вторую стадию идентификации микроорганизмов, селективно продуцирующих тот или другой из компонентов А или В стрептограминов. Этот метод позволяет, в частности, получить штаммы S. pristinaespiralis, селективно продуцирующие пристинамицины PII (компонент А) или пристинамицины PI (компонент В). Тем не менее, в указанном документе не описаны штаммы, селективно продуцирующие пристинамицины PI с пропорцией изоформ, измененной в пользу формы PIB по отношению к PIA, остающейся мажоритарной.
В заявке WO94/08014 описано выделение и идентификация генов, кодирующих ферменты, участвующие в пути биосинтеза компонентов А и в пути биосинтеза компонентов В стрептограминов. В ней также описана экспрессия этих генов с целью повышения уровня продукции компонентов А или В и применение этих генов для конструирования мутантов, блокируемых на разных стадиях путей биосинтеза компонентов А или В, что приводит к накоплению некоторых промежуточных продуктов этих путей биосинтеза. В частности, в заявке WO94/08014 описаны выделение и охарактеризовывание двенадцати генов snaA, snaB, snaC, snaD, papA, papM, samS, snbA, snbC, snbD, snbE и snbR, выделенных из банка геномных ДНК S. pristinaespiralis, и показано участие генов snaA, snaB, snaC, snaD в пути биосинтеза компонентов А, а также участие генов papA, papM, samS, snbA, snbC, snbD, snbE и snbR в пути биосинтеза компонентов В.
• Так, инактивация гена snaA в штамме S. pristinaespiralis позволяет получить штамм, который не продуцирует PIIA (одну из изоформ компонентов А пристинамицинов), а продуцирует исключительно PIIB (другую изоформу компонентов А пристинамицинов) в количестве, эквивалентном сумме PIIA и PIIB, продуцируемых контрольным штаммом, несущим дикую форму гена snaA. Продукция PI (совокупность изоформ компонентов В пристинамицина) остается одинаковой в штаммах, в которых ген snaA был инактивирован, и в контрольном штамме.
• Инактивация гена samS приводит к получению штамма, который продуцирует на 35% меньше PIA (одной из изоформ компонентов В пристинамицинов) и приблизительно в 10 раз больше PIB (другой изоформы компонентов В пристинамицинов) по сравнению с контрольным штаммом; уровень PIB достигает в этом случае 20% от общего количества продуцированных пристинамицинов типа I (PI). Несмотря на увеличение продукции PIB в этих штаммах, доля PIB не является мажоритарной и остается ниже доли PIA.
• Инактивация гена papa или гена snbA приводит к получению штаммов, продуцирующих только пристинамицины типа PII (компоненты А) и не продуцирующих пристинамицины типа PI (компоненты В).
• Инактивация гена snaD позволяет получить штаммы, которые, наоборот, продуцируют только пристинамицины типа PI и не продуцируют пристинамицины типа PII.
В заявке WO96/01901 описан оригинальный способ получения новых соединений, родственных компонентам В стрептограминов, но отличающихся от компонентов В, естественным образом продуцируемых микроорганизмами-продуцентами стрептограминов. Согласно этому способу, используют штамм микроорганизма, мутированный таким образом, чтобы изменить биосинтез предшественников компонентов В стрептограминов. В качестве мутантного штамма можно использовать, в частности, штаммы S. pristinaespiralis, в которых путь биосинтеза предшественников компонентов В изменен путем разрушения генов papa или pipA или hpaA. Эти штаммы уже не продуцируют пристинамицины PI (компоненты В), а продуцируют пристинамицины PII (компоненты А). Мутантный штамм культивируют в среде, дополненной оригинальным предшественником, отличным от предшественника, синтез которого изменен. Встраивание оригинальных предшественников в структуру депсипептида вместо природных предшественников приводит к получению новых соединений, родственных компонентам В стрептограминов и обладающих ценными терапевтическими свойствами.
Подход, описанный в вышеуказанной заявке WO96/01901, позволил получить штаммы микроорганизмов, продуцирующих в качестве мажоритарных изоформы компонентов В, которые естественным путем продуцируются как миноритарные формы. Тем не менее, в нем требуется дополнительно вводить в культуральную среду специфический предшественник, отсутствующий в естественном состоянии в штаммах микроорганизма.
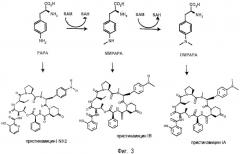
Фундаментальные биохимические и генетические исследования путей биосинтеза пристинамицина позволили выявить источник многочисленных изоформ, наблюдаемых для PI. В частности, было показано, что PIB образуется в результате встраивания в макроцикл с помощью пептидсинтетазы SnbDE L-MMPAPA, являющегося предшественником биосинтеза L-DMPAPA и встраиваемого в макроцикл PIA (Blanc et al., Mol. Microbiol (1997), 23(2):191-202); Thibaut et al, J. Bacteriol. (1997), 179 (3):697-704). Были идентифицированы 4 гена, участвующие в биосинтезе L-MMPAPA и L-DMPAPA, исходя из хоризмата papa, papB, papC и papM (Blanc et al., 1997).
Ген papM кодирует белок, катализирующий обе последовательные реакции метилирования, которые позволяют получить L-DMPAPA, исходя из 4-амино-L-фенилаланина через L-MMPAPA согласно схеме, представленной на фигуре 3. Эти реакции метилирования катализируются РарМ с очень схожими кинетическими параметрами (константой сродства и скоростью реакции) (Blanc et al., 1997). Последовательность гена рарМ S. pristinaespiralis и соответствующего полипептида (4-амино-L-фенилаланин-(N-фенил)-метилтрансферазы) представлены в последовательности SEQ ID N°1.
Настоящее изобретение основано на открытии того факта, что возможно улучшить продукцию некоторых миноритарных изоформ компонентов В стретограминов путем изменения ферментативной активности продукта гена рарМ.
В частности, изобретение основано на идентификации новых вариантов полипептида РарМ, обладающих улучшенной по сравнению с полипептидом дикого типа субстратной селективностью и/или эффективностью. Действительно, авторы смогли показать, что возможно осуществить мутагенез гена рарМ таким образом, что соответствующий белок оказывается неспособным катализировать вторую реакцию метилирования при сохранении активности, достаточной для первой реакции метилирования или, по меньшей мере, таким образом, что вторая реакция метилирования сильно ингибируется по сравнению с первой реакцией.
Присутствие таких ферментов в микроорганизмах-продуцентах стрептограминов, таких как штаммы S. pristinaespiralis, приводит к накоплению L-MMPAPA и, следовательно, к продукции в первую очередь PIB (Фиг. 3). И наоборот, также возможно осуществить мутагенез гена рарМ таким образом, чтобы соответствующий белок катализировал вторую реакцию метилирования с большей эффективностью по сравнению с первой реакцией метилирования, и присутствие таких ферментов в штаммах S. pristinaespiralis должна приводить к накоплению L-DMPAPA и, следовательно, к увеличению продукции PIA.
Изобретение также основано на открытии того факта, что микроорганизмы, продуцирующие неактивную форму полипептида РарМ, или мутанты, не экспрессирующие ген рарМ, позволяют накапливаться компонентам В стрептограминов, которые микроорганизмы дикого типа способны синтезировать естественным образом, но в слишком малых для выделения количествах. Таким образом, в настоящем изобретении дается описание конструирования рекомбинантных штаммов S. pristinaespiralis, продуцирующих главным образом соединение семейства PI, называемое PINH2, которое не синтезируется многочисленными дикими штаммами S. pristinaespiralis и которое соответствует включению 4-амино-L-фенилаланина в положении 4 макроцикла (Фиг. 2).
Первый объект изобретения относится к варианту полипептида РарМ, отличающемуся тем, что он имеет эффективность метилирования по отношению к субстратам метилирования, отличающуюся (в большую или меньшую сторону) от эффективности метилирования полипептида РарМ дикого типа по отношению к тем же субстратам.
Вариант полипептида РарМ отличается тем, что он имеет эффективность метилирования 1, определяемую по отношению Kcat1/Km1 по отношению к субстрату метилирования 1 и/или эффективность метилирования 2, определяемую по отношению Kcat2/Km2 по отношению к субстрату метилирования 2, отличающуюся от полипептида РарМ дикого типа. Предпочтительно, вариант РарМ по изобретению имеет эффективность метилирования 1 L-PAPA до L-MMPAPA, определяемую по отношению KcatPAPA/KmPAPA и/или эффективность метилирования 2 L-MMPAPA до L-DMPAPA, определяемую по отношению KcatMMPAPA/KmMMPAPA, отличающуюся от эффективности метилирования полипептида РарМ, представленного в виде SEQ ID N°1.
Согласно первому варианту осуществления, вариант РарМ по изобретению имеет эффективность метилирования 1 L-PAPA до L-MMPAPA, по меньшей мере в 2 раза, предпочтительно, по меньшей мере в 5 раз и, еще более предпочтительно, по меньшей мере в 10 раз превышающую эффективность метилирования 2 L-MMPAPA до L-DMPAPA. Такой вариант является особо предпочтительным для получения PIB. Предпочтительно, вариант согласно изобретению получают из последовательности полипептида РарМ дикого типа заменой одной или более аминокислот, выбранных из: остатка Gly 249 (а), остатка Thr 192 (b) или остатка, эквивалентного (а) или (b) в гомологичном полипептиде.
Под полипептидом, гомологичном РарМ, в рамках настоящего изобретения понимают полипептиды, происходящие или полученные из бактерий рода Streptomyces, таких как, в частности, Streptomyces olivaceus, Streptomyces ostreogriseus, Streptomyces mitakaensis, Streptomyces loïdensis, Streptomyces graminofaciens, Streptomyces diastaticus или других микроорганизмов, в которых аминокислотная последовательность отличается от аминокислотной последовательности SEQ ID N°1, заменой, делецией и/или вставкой одной или более аминокислот и которые имеют биологическую функцию, схожую с функцией полипептида РарМ. Такая последовательность гомологичного полипептида может иметь сходство по меньшей мере на 60% с последовательностью SEQ ID N 1, предпочтительно, по меньшей мере на 70% и еще более предпочтительно по меньшей мере на 80% с последовательностью SEQ ID N 1.
Согласно первому варианту осуществления вариант по изобретению происходит от полипептидной последовательности SEQ ID N 1 и имеет по меньшей мере одну замену в положении 249 глицина на серин.
Согласно другому варианту осуществления вариант по изобретению происходит от полипептидной последовательности SEQ ID N 1 и имеет по меньшей мере одну замену в положении 192 треонина на изолейцин.
Наконец, согласно еще одному варианту осуществления вариант по изобретению происходит от SEQ ID N 1 и имеет по меньшей мере одну замену в положении 249 глицина на серин и в положении 192 треонина на изолейцин.
Согласно другому варианту осуществления вариант РарМ по изобретению имеет эффективность метилирования 2 L-MMPAPA до L-DMPAPA, по меньшей мере в 2 раза, предпочтительно, по меньшей мере в 5 раз и, еще более предпочтительно, по меньшей мере в 10 раз превышающую эффективность метилирования 1 L-PAPA до L-MMPAPA. Такой вариант является особо предпочтительным для получения PIA.
Изобретение также относится к нуклеиновой кислоте, кодирующей определенный выше вариант полипептида. Нуклеиновой кислотой предпочтительно является нуклеиновая кислота, полученная в результате мутации нуклеотидной последовательности, представленной в виде SEQ ID N 1, или производных от нее последовательностей в силу вырожденности генетического кода. Предпочтительно, нуклеиновая кислота по изобретению включает по меньшей мере одну миссенс-мутацию выше звена NPPY, расположенного в положениях 193-196, и, предпочтительно, эта миссенс-мутация приводит к неконсервативному изменению аминокислот, например, замене цитозина в положении 658 тимином (С658Т) (мутантный аллель 66). Другая предпочтительная форма осуществления относится к нуклеиновой кислоте, отличающейся тем, что она включает по меньшей мере одну замену гуанина в положении 828 аденином (G828A) (мутантный аллель 49). Наконец, наиболее предпочтительная форма осуществления относится к нуклеиновой кислоте, отличающейся тем, что она включает по меньшей мере одну замену гуанина в положении 828 аденином (G828A) и по меньшей мере одну замену цитозина в положении 658 тимином (С658Т) (мутантный аллель 49/66).
Объектом изобретения также является применение определенной выше нуклеиновой кислоты для изменения пропорции изоформ компонентов В в штамме-продуценте стрептограминов. В качестве штаммов-продуцентов стрептограминов, которые могут быть использованы в рамках изобретения, можно назвать, в частности, штаммы Streptomyces olivaceus, Streptomyces ostreogriseus, Streptomyces mitakaensis, Streptomyces loïdensis, Streptomyces graminofaciens, Streptomyces diastaticus и пр. Нуклеиновые кислоты, кодирующие вариант РарМ, имеющий эффективность метилирования 1 РАРА до ММРАРА по меньшей мере в 2 раза, предпочтительно, по меньшей мере в 5 раз и, еще более предпочтительно, по меньшей мере в 10 раз превышающую эффективность метилирования 2 MMPAPA до DMPAPA, в частности пригодны для получения PIB при их экспрессии в штамме S. pristinaespiralis. Нуклеиновые кислоты, кодирующие вариант РарМ, имеющий эффективность метилирования 2 MMPAPA до DMPAPA по меньшей мере в 2 раза, предпочтительно, по меньшей мере в 5 раз и, еще более предпочтительно, по меньшей мере в 10 раз превышающую эффективность метилирования 1 РАРА до ММРАРА, в частности пригодны для получения PIA при их экспрессии в штамме S. pristinaespiralis.
Также объектом изобретения является любая рекомбинантная ДНК, содержащая определенную выше нуклеиновую кислоту.
Изобретение также относится к любому вектору экспрессии, с автономной репликацией и/или интегративному, содержащему определенную выше нуклеиновую кислоту или рекомбинантную ДНК, такому как, в частности, вектор, включающий в себя вектор или часть вектора pVRC1306, представленного на фигуре 11.
Объектом изобретения также являются клетки-хозяева, содержащие нуклеиновую кислоту, и/или рекомбинантную ДНК, и/или вектор экспрессии, как они определены выше. Клетки-хозяева по изобретению могут представлять собой как эукариотические, так и прокариотические клетки. Среди подходящих эукариотических клеток можно назвать животные клетки, дрожжи или грибы. В частности, в том, что касается дрожжей, можно назвать дрожжи рода Saccharomyces, Kluyveromyces, Pichia, Schwanniomyces или Hansenula. В отношении животных клеток можно назвать клетки COS, CHO, Cl127, икру шпорцевой лягушки и т.д. Среди грибов можно, в частности, назвать Micromonospora, Aspergillus ssp. или Trichoderma ssp. В качестве прокариотических клеток предпочтительно используют следующие бактерии Actinomycetes и, в частности, Streptomyces, E. coli (пример 7), Bacillus. Предпочтительно, рекомбинантные клетки по изобретению выбирают из клеток-продуцентов стрептограминов, в частности Streptomyces olivaceus, Streptomyces ostreogriseus, Streptomyces mitakaensis, Streptomyces loïdensis, Streptomyces graminofaciens, Streptomyces diastaticus. Рекомбинантные клетки по изобретению могут быть получены любым способом, позволяющим ввести в клетку чужеродную нуклеотидную последовательность. Таким способом может быть, в частности, трансформация, электропорация, конъюгация, слияние протопластов или любой другой известный специалисту способ.
Объектом изобретения также является способ получения варианта полипептида РарМ по изобретению, отличающийся тем, что культивируют клетку-хозяина, как она определена выше, и получают продуцированный полипептид.
Изобретение также относится к применению клетки-хозяина, как она определена выше, экспрессирующей вариант полипептида РарМ по изобретению, в реакции биоконверсии. В частности, эти клетки могут позволить трансформировать ароматические амины в монометилированные амины, в частности. 4-амино-L-фенилаланин в 4-метиламино-L-фенилаланин. Эти биоконверсии могут осуществляться либо при помощи целых клеток, либо при помощи неклеточных экстрактов из указанных клеток.
Другой объект изобретения относится к способу получения компонента В стрептограминов, отличающемуся тем, что:
- инактивируют в штамме-продуценте стрептограминов или потенциальном продуценте стрептограминов ген рарМ и вводят одну или несколько копий нуклеиновой кислоты, кодирующей определенный выше вариант рарМ,
- культивируют указанный штамм в условиях продукции стрептограминов,
- получают продуцированный компонент В стрептограминов.
Предпочтительно, штаммом-продуцентом стрептограминов является штамм-продуцент пристинамицинов, происходящий от S. pristinaespiralis, более предпочтительно, от штамма S. pristinaespiralis SP92 или S. pristinaespiralis АТСС25486. Он также может быть выбран из следующих штаммов: Streptomyces olivaceus АТСС12019, Streptomyces ostreogriseus АТСС27455, Streptomyces mitakaensis АТСС15297, Streptomyces loïdensis АТСС11415, Streptomyces graminofaciens, Streptomyces diastaticus.
Предпочтительно, штаммом-продуцентом стрептограминов является штамм, продуцирующий уменьшенное или неопределяемое количество компонента А стрептограминов. В качестве штаммов, не продуцирующих компонентов А стрептограминов, можно, в частности, назвать штамм S. osteogriseus Pr4Q031/CBS 142.93, описанный в заявке WO93/20182. Относительно примеров штаммов S. pristinaespiralis, которые не продуцируют компонентов А, можно назвать штамм SP213, полученный из SP92 (Blanc et al, 1994) после химического мутагенеза, или штамм S. pristinaespiralis Pr4R31 (депонированный как CBS182.92), описанный в заявке WO93/20182; штаммы SP213 и Pr4R31 специфически продуцируют пристинамицины PI и не продуцируют определяемых количеств PII (компонентов А).
Согласно предпочтительному варианту, введение нуклеиновой кислоты, кодирующей вариант РарМ по изобретению, происходит путем замещения дикой формы гена рарМ. В зависимости от варианта, экспрессируемого введенной нуклеиновой кислотой, возможно повысить продукцию различных компонентов В стрептограминов. Так, штамм S. pristinaespiralis, экспрессирующий вариант с отношением KcatPAPA.KmMMPAPA/KcatMMPAPA.KmPAPA, более высоким по сравнению с полипептидом дикого типа, приводит к предпочтительной продукции PIB. Наоборот, вариант, у которого это отношение уменьшено, должен позволить получить повышенную продукцию PIA. Предпочтительно, для получения PIB штамм S. pristinaespiralis содержит ген рарМ, имеющий по меньшей мере мутацию (G828A), или мутацию (С658Т), или двойную мутацию (G828A)(С658Т).
Изобретение также относится к способу получения PINH2, отличающемуся тем, что используют штамм, в котором дикая форма гена рарМ S. pristinaespiralis инактивирована и/или заменена нуклеиновой кислотой, кодирующей неактивную форму РарМ.
Также объектом изобретения является мутантный штамм S. pristinaespiralis, отличающийся тем, что он содержит нуклеиновую кислоту, кодирующую вариант полипептида РарМ по изобретению. Такой штамм может быть получен, в частности, трансформацией рекомбинантного штамма, в котором ген рарМ дикого типа разрушен и заменен кассетой Ω-Km (см. пример 8) с помощью суицидной плазмиды, обеспечивающей обмен этой кассеты с одним из мутантных аллелей рарМ. В качестве примера в настоящем изобретении описан штамм S. pristinaespiralis SP217, содержащий нуклеиновую кислоту, несущую мутацию С658Т (мутантный аллель 66) или штамм S. pristinaespiralis SP218, содержащий двойную мутацию С658Т и G828A (мутантный аллель 49/66). Эти мутации были введены в штамм S. pristinaespiralis SP213, в котором ген рарМ был предварительно разрушен и заменен кассетой Ω-Km. Идентичный подход позволил сконструировать штамм S. pristinaespiralis SP101 с введением мутантного аллеля 66 в штамм SP92. Штаммы S. pristinaespiralis SP101, SP218 и SP217, которые синтезируют вариант рарМ по изобретению, продуцируют главным образом PIB.
Также объектом изобретения является применение штамма S. pristinaespiralis для получения PINH2. Примером такого штамма служит, в частности, штаммSP216, полученный из штамма SP213 путем инактивации гена рарМ и продуцирующий главным образом PINH2.
Изобретение также относится к способу отбора вариантов полипептида РарМ или полипептида, кодируемого гомологичным геном, согласно которому:
• осуществляют стадию химического мутагенеза гена рарМ или гомологичного гена, клонированного в плазмиде,
• получают банк, трансформируя штамм-реципиент с помощью мутагенизированных плазмид со стадии (а),
• отбирают клоны, имеющие такую активность метилирования, при которой отношение «r» трансформированных количеств субстрата метилирования на единицу времени в условиях начальной скорости, где r = Субстрат1 /(Субстрат 1 + Субстрат 2), по меньшей мере на 20% больше, чем у полипептида дикого типа, и предпочтительно равно или превышает 0,6.
В этой связи настоящее изобретение показывает, каким образом можно осуществить in vitro химический мутагенез с помощью гидроксиламина гена рарМ, клонированного в плазмиде, для создания банка мутантов и для отбора из этого банка с помощью миниатюризованного ферментативного скрининга клонов Escherichia coli, которые экспрессируют мутированные гены рарМ, соответствующие которым белки имеют вышеописанные каталитические свойства, и для которых определенное выше отношение «r» равно или превышает 0,6.
Настоящее изобретение иллюстрируется следующими примерами, являющимися иллюстративными и неограничительными.
Чертежи
Фигура 1: пример структуры пристинамицинов II
Фигура 2: пример структуры пристинамицинов I
Фигура 3: путь биосинтеза ММРАРА и DMPAPA, предшественников, соответственно, PIB и PIA.
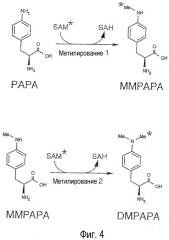
Фигура 4: принцип ферментативного теста, используемого для скрининга мутантов РарМ: маркировка одновременным метилированием ММРАРА и DMPAPA, исходя, соответственно, из РАРА и ММРАРА, в присутствии [14С-Ме]-SAM.
Фигура 5: плазмида pVRC706
Фигура 6: плазмида pUC4K
Фигура 7: последовательность и трансляция гена рарМ дикого типа. Положения мутаций, идентифицированных для клонов 49 и 66.
Фигура 8: плазмида pVRC721
Фигура 9: стратегия конструирования плазмиды pVRC1303
Фигура 10: двойной кроссинговер между плазмидой pVRC1303 и хромосомой S. pristinaespiralis. Структура хромосом рекомбинантных штаммов.
Фигура 11: стратегия конструирования pVRC1306
Фигура 12: простой направленный кроссинговер между плазмидой pVRC1306 и хромосомой рекомбинантного штамма SP216
Фигура 13: вторая рекомбинация, приводящая к рекомбинантному штамму, несущему один из мутантных аллелей гена рарМ
ЛИТЕРАТУРА
- Blanc et al., (1994) W094/08014.
- Blanc et al., (1995), J. Bacteriol. 177 (18): 5206-14.
- Blanc et al., Mol. Microbiol (1997), 23(2): 191-202.
- Chambers et al. (1988) Gene. Aug 15;68(1): 139-49.
- Cocito C. G. (1979) Microbiol. Rev., 43: 145-198.
- Cocito С. G. (1983) In Antibiotics, 6: (Ed. F. E. Hahn), 296-332.
- Dessen P. C., Fondrat C., Valencien C. et Mugnier C. (1990) Comp. Appl. in Biosciences, 6: 355-356.
- Di Giambattista M., Chinali G. et Cocito C. G. (1989) J. Antim. Chemother., 24: 485-507.
- Fellay et al., (1987) Gene. 52(2-3): 147-54.
- Hanahan et al. (1990) PNAS USA 87, pp 4645-4649 (1990).
- Hillemann D., Pülher A. et Wohlleben W. (1991) Nucl. Acids Res., 19: 727-731.
- Hopwood D. A., Bibb M. J., Chater K. F., Kieser Т., Bruton C. J., Kieser H. M., Lydiate D. J., Smith C. P., Ward J. M. et Scrempf H. (1985) A laboratory manual., The John Innes Fondation, Norwich, England.
- Humphreys et al. (1976) Mol Gen Genet. Apr 23;145(1): 101-8.
- Maniatis Т., Fritsh E. F. et Sambrook J. (1989) Molecular cloning: a laboratory manual. Cold Spring Harbor, N. Y.,
- Messing J., Crea R. et Seeburg P. H. (1981) Nucleic Acids Res., 9: 309.
- Schluckebier et al. (1995) Gene. May 19;157(1-2): 131-4.
- Thibaut et al., (1997) J. Bacteriol. 179(3): 697-704.
- Veira et Messing, Gene. 1982 Oct;19(3): 259-68.
ПРИМЕРЫ
Пример 1: методология и пропись ферментативного скрининга
Этот пример иллюстрирует скрининг мутантных форм фермента РарМ, имеющих новые кинетические характеристики, исходя из популяции ферментов, полученных мутагенной обработкой гидроксиламином (см. примеры 2 и 3). В частности, этот пример иллюстрирует получение мутантных форм РарМ, имеющих измененную селективность в отношении обоих естественных субстратов этого фермента.
Методология
Метилазу рарМ предварительно клонировали, очищали и охарактеризовывали (Blanc et al. 1994; Blanc et al. 1997). РарМ является бифункциональным ферментом, катализирующим как N-метилирование L-PAPA до L-MMPAPA, так и N-метилирование L-MMPAPA до L-DMPAPA (см. Фиг. 4).
L-PAPA и L-MMPAPA являются конкурентными субстратами РарМ, имеющими константу Михаэлиса (Km) соответственно 240 и 530 мкМ и в отношении которых максимальное быстродействие РарМ (Vmax) составляет соответственно 55 и 71 мкмоль/ч/мг РарМ (Blanc et al. 1997).
Отношение скоростей V1 и V2 метилирования, соответственно, L-PAPA и L-MMPAPA зависит от кинетических параметров РарМ (Km1 и Vmax1 для L-РАРА, Km2 и Vmax2 для L-ММРАРА), а также от концентраций S1 и S2 соответственно L-PAPA и L-MMPAPA согласно формуле:
V1/V2=(Vmax1/Km1)[S1]/(Vmax2/Km2)[S2]
Одновременное измерение обеих скоростей метилирования V1 и V2 при фиксированных концентрациях S1 и S2 позволяет определить отношение кинетических констант РарМ для L-PAPA и L-MMPAPA. Это отношение не зависит от количества использованного в исследовании РарМ. Когда селективность мутантного фермента РарМ повышается в отношении L-РАРА, отношение V1/V2 должно вырасти, и наоборот, это отношение должно уменьшиться, когда мутантный фермент РарМ метилирует главным образом L-ММРАРА.
Наконец, чтобы не допустить незначительных вариаций Km и, наоборот, получить либо сильные вариации Km, либо изменения Vmax, концентрации L-PAPA и L-MMPAPA установили на значениях приблизительно 6-кратного Km, чтобы обеспечить условия насыщения. В таких условиях с ферментом РарМ дикого типа скорости метилирования 1 и метилирования 2 практически равны.
Одновременное измерение обеих активностей метилирования РарМ описано в примере 7.1. Это измерение метилазных активностей РарМ осуществляют в присутствии 1,5 мМ L-РАРА, 3 мМ L-ММРАРА и 70 мкМ SAM.
Скрининг популяции мутантных ферментов
96-луночные планшеты банка клонов E. coli, продуцирующих мутантные ферменты РарМ, полученные как описано в примере 3, размораживали при 27°С. Затем к 200 мкл культуры на среде LB, содержащейся в каждой лунке, добавляли 25 мкл смеси А. Смесь А получали, последовательно добавляя (1) 3 мл буфера 50мМ Bis-Tris-пропана рН 10, в котором растворяли 12 мг L-РАРА и 71 мг (DL)-MMPAPA в форме дигидрохлорида, полученного как описано в WO96/01901, (2) 0,7 мл SAM 4 мМ в воде, (3) 0,7 мл [14C-Me]-SAM 25 мкCi/мл и 60 мCi/моль (AMERSHAM), (4) 0,6 мл буфера 100 мМ Bis-Tris-Пропана рН 6,8, (5) 56 мг ЭДТУ двунатриевой соли. Количества приведены для получения объема 5 мл смеси А. Планшет затем запечатывают клейкой пленкой, после чего инкубируют при 27°С в течение 2 часов. Реакцию останавливают с помощью 40 мкл останавливающего раствора. Останавливающий раствор (для объема 4 мл) получают смешиванием 2,2 мл раствора 24 мг/мл гептансульфоната натрия в воде с 1,8 мл концентрированной соляной кислоты. После центрифугирования планшетов при 3000 g в течение 5 мин. Около 100 мкл супернатанта из каждой лунки анализируют с помощью ВЭЖХ в системе, описанной в примере 7.1.
Для каждой лунки получают соответствующие зоны А1 и А2 пиков ММРАРА и DMPAPA, полученных в результате записи данных радиохимического анализа. Затем рассчитывают отношение r следующим образом:
r = A1/(A1+A2)
В случае метилазы РарМ дикого типа r=0,50±0,05.
Порог отношения r, установленного для мутантного фермента РарМ, существенно более активного в отношении метилирования 1 по сравнению с метилированием 2, составляет приблизительно 0,60.
ПРИМЕР 2: Мутагенез с помощью гидроксиламина гена рарМ
Этот пример иллюстрирует мутагенез гена рарМ из плазмидной ДНК Streptomyces, клонированной в плазмиде, которая может реплицироваться в E. coli.
2.1. Выбор мутагенного агента
Химический мутагенез осуществляли, используя гидроксиламин (NH2OH), который специфически связывается с остатками цитозина с образованием N4-гидроксицитозинов, которые становятся способны к образованию пар с остатками аденина. Таким образом, гидроксиламин вызывает переходы G:C > A:T. Выбор этого мутагенного агента представляет особый интерес для осуществления мутаций ДНК с высоким содержанием GC, таких как ДНК Streptomyces, которые содержат от 70 до 75% остатков GC.
2.2. Выбор плазмид для мутагенеза
Мутагенез был проведен одновременно на двух разных плазмидах, плазмиде pVRC706 и плазмиде pUC4K.
Плазмида pVRC706 (фигура 5) происходит от pMTL23 (Chambers et al., 1988), в которой между уникальными сайтами MluI и BamHI (конец, разрезанный BamHI, затупляли действием фермента Кленова в соответствии с прописью Sambrook tu al. (1989)) был клонирован фрагмент MluI-StuI размером 1,7 т.п.н., полученный из плазмиды pVRC409, несущей ген рарМ, который должен быть подвергнут мутагенезу (Blanc et al., 1994; Blanc et al., 1997). Клонирование конца StuI в сайте BamHI pMTL23, заполненном с помощью фермента Кленова, позволяет восстановить сайт BamHI, который может быть использован при последующих клонированиях. Клонирование в сайте MluI позволяет получить слияние в фазе между 32 первыми аминокислотами β-галактозидазы, кодируемой геном lacZ плазмиды pMTL23, и 11 последними аминокислотами гена рарВ, расположенного выше гена рарМ, что защищает трансляционное соединение между этими двумя генами, существование которого можно предположить при изучении нуклеотидной последовательности (Blanc et al., 1994). В этой конструкции экспрессия гена рарМ контролируется промотором Plac гена lacZ, индуцируемым добавлением 1 мМ IPTG. Предварительно было показано, что такая система экспрессии позволяет продуцировать в E. coli метилазу РарМ в форме активного растворимого белка, составляющего приблизительно 0,5% общего белка (Blanc et al., 1994).
Плазмида pUC4K (Фиг. 6) является производным вектора pUC4, несущего оба гена, придающих резистентность к ампициллину и к канамицину (Vieira et Messing, 1982). Эта плазмида была выбрана в качестве контрольной для мутагенеза по следующим причинам: (1) ее размер (3,9 т.п.н.) близок к плазмиде pVRC706 (4,4 т.п.н.), (2) обе плазмиды, pUC4K и pVRC706, имеют очень близкие строение и свойства, поскольку обе происходят от векторов серии pUC, и (3) присутствие обоих генов резистентности ampR и kanR, находящихся в pUC4K, позволяет легко рассчитать процент клонов, претерпевших мутагенез в одном из этих генов, путем подсчета клонов, чувствительных к выбранному антибиотику.
2.3. Пропись мутагенеза
Два мутагенеза с помощью гидроксиламина были проведены согласно протоколу Humprey et al (1976) с различной температурой инкубации: 80°С и 85°С: 5 мг плазмидной ДНК, очищенной на градиенте хлорида цезия, приводили в контакт с 0,4 М гидроксиламина (рН 6) в конечном объеме 100 мл в течение 35 минут при желаемой температуре (80°С или 85°С) в буфере, содержащем 0,05 М фосфата натрия и 0,5 мМ ЭДТУ. Реакцию мутагенеза останавливают добавлением 100 мл буфера, содержащего 0,1 М фосфата натрия и 1 мМ ЭДТУ и удаляют гидроксиламин с помощью 8 последовательных диализных бань против 2 литров буфера TES (10 мМ Tris рН 7,5, 1 мМ ЭДТУ и 100 мМ NaCl). Обработанную таким образом ДНК осаждают добавлением 1/10 объема ацетата натрия 3М (рН 8) и 2,5 объемов этанола 95%. Осадок ДНК промывают, высушивают, затем помещают в 100 мкл буфера ТЕ (10 мМ Tris-HCl и 1 мМ ЭДТУ, рН 7,5). Для каждой плазмиды осуществляют контроль реакции мутагенеза при используемой температуре в отсутствие гидроксиламина.
2.4. Получение штамма E. coli в качестве реципиента мутагенизированных плазмид
Штамм E. coli DH5α (supE44 DlacU169 (f80lacZDM15) hsdR17 recA1 endA1 gyrA96 thi-1 relA1), (Hanahan, 1990) использовали для оценки мутагенеза после трансформации плазмидами pVRC706 и pUCK4, мутагенизированных согласно вышеописанной прописи.
Компетентные для трансформации элктропорацией клетки E. coli DH5α получали согласно следующей прописи: культивирование 1 литра в среде LB проводили при 37°С до получения оптической плотности (при 600 нм) от 0,5 до 0,8. Затем клетки помещали на лед на 30 мин для прекращения их роста, затем центрифугировали при 4°С и 4000 g в течение 15 мин. Осажденные клетки последовательно промывали 1 л стерильной холодной воды, 0,5 л холодной воды и 20 мл холодного раствора, содержащего 10% глицерина. После каждой промывки клетки центрифугировали при 4°С и 4000 g в течение 15 мин. В конце осажденные клетки помещали в 2 мл 10%-ного глицерина. Подготовленные таким образом клетки могут быть непосредственно подвернуты электропорации или могут быть заморожены и могут храниться при -80°С в форме аликвот по 40 мл для последующего использования. Эффективность трансформации электрокомпетентных клеток составляет величину порядка 109 колоний/мкг плазмидной ДНК pUC18.
Полученные таким образом клетки E. coli DH5α были подвергнуты электропорации с эквивалентом 5 нг тестируемой плазмиды. Для этого 40 мкл электрокомпетентных клеток приводили в контакт в течение 1 мин при 4°С с 1-2 мкл раствора, содержащего 5 нг плазмидной ДНК. Электропоратор (Bio-Rad) регулируют на импульс 25 мФ и 2500 В. Сопротивление устройства контроля импульса устанавливают на 200 Ω. Смесь клетки/ДНК помещают в кювету для электропорации шириной 0,2 см и прикладывают электрический импульс. Обычно получают длительность импульса от 4,5 до 5 мс. После импульса быстро добавляют к клеткам 1 мл сред