Способ получения фермента пероксидазы из корней хрена
Иллюстрации
Показать всеСпособ предусматривает размельчение и гомогенизацию пророщенных корней хрена, экстракцию гомогенизата корней хрена 0,15±0,01 М раствором хлорида натрия. Отделяют балластные белки и осаждают пероксидазу солями сульфата аммония 45-48% насыщения и 85-90% насыщения соответственно. Гельфильтрацию раствора пероксидазы осуществляют на сефадексе G-100 с элюированием 0,15-0,2 М раствором хлорида натрия. Хроматографическую очистку проводят на карбоксиметилцеллюлозе. Осуществляют лиофильную сушку целевой пероксидазы. Проводят диализ против натрий-ацетатного буфера с рН 4,4-5,0 и диализ против калий-фосфатного буфера с рН 8,0±0,1. Осуществляют концентрирование с дополнительной очисткой на ДЭАЭ-целлюлозе с элюцией тем же буфером с последующим диализом против деионизованной воды. Способ позволяет получить пероксидазу с высокой удельной активностью и высоким выходом. Выход пероксидазы составляет 2,52-3,50 г/кг корней хрена, удельная активность - 640-700 Е.А./мг белка. 5 з.п. ф-лы, 2 ил., 1 табл.
Реферат
Изобретение относится к области биотехнологии, а именно к производству ферментов из растительного сырья, и может быть использовано для лабораторного и промышленного производства фермента пероксидазы из корней хрена для иммунологии и иммунохимии в качестве главной составной части конъюгатов для иммуноферментных анализов.
Известны различные способы получения пероксидазы из корней хрена [Paul К.G. The Enzymes. New Jork, Acad Press, 1963; Пат. Венгрии 172872, C07G 7/022; А.С. Болгарии 46675, C12N 9/08, 15.02.90; Пат. РФ 2130070, C12N 9/08,10.05.1999].
Известен способ получения пероксидазы из корней хрена, включающий гомогенизацию корней хрена, экстракцию фермента солевым раствором, осаждение фермента солями сульфата аммония, гельфильтрацию, спиртовое осаждение, электрофорез, переосаждение хлоридом аммония, фильтрацию через сефадекс G-50 и ДЭАЭ-целлюлозу и диализ [Paul К.G. The Enzymes. New Jork, Acad Press, 1963].
Основными недостатками данного способа являются невысокая активность и чистота полученного продукта, а также сложность его получения и большое количество стадий технологического процесса.
Известен также способ получения пероксидазы из корней хрена, по которому корни хрена гомогенизируют, затем экстрагируют фермент водой и осаждают пероксидазу солями сульфата аммония с последующей гельфильтрацией [Пат. Венгрии 172872, C07G 7/022].
Недостатком данного способа является низкий выход и низкая чистота фермента.
Известен способ [А.С. Болгарии 46675, C12N 9/08, 15.02.90], по которому корни хрена проращивают в течение 2-3 суток, затем гомогенизируют и экстрагируют фермент водой в течение суток. Водный экстракт центрифугируют с последующим фракционированием белков солями сульфата аммония, затем сульфатаммонийный осадок фермента растворяют в дистиллированной воде и подвергают ультрафильтрации на фильтрах "Милипор" PTGC 000 05. К полученному фильтрату прибавляют 0,5 М фосфатный буфер (рН 8) в соотношении 100 частей буфера на 1 часть фильтрата и пропускают через колонку с ионообменником ДЭАЭ-Сефадекс А-50, затем последовательно ультрафильтруют на "Милипор" PTGC 000 05, РТНК 000 05, PTGC 000 05 и подвергают лиофильной сушке.
Недостатком данного метода является недостаточно высокий выход пероксидазы, высокая трудоемкость и длительность процесса.
Наиболее близким является способ [Пат. РФ 2130070, C12N 9/08, 10.05.1999], в котором промытые водой корни хрена зачищают на 1/3 массы в присутствии 0,25% раствора пищевой аскорбиновой кислоты, используемого в качестве экстрагирующего раствора. Пероксидазу из очисток экстрагируют в течение 1 ч 0,25% раствором аскорбиновой кислоты, затем экстракт фильтруют и центрифугируют. К надосадочной жидкости добавляют 5% сульфита натрия и выдерживают в течение 24 ч при комнатной температуре для "созревания" фермента. "Созревший" раствор фермента концентрируют на ультрафильтрационных волоконных аппаратах с фильтрами, имеющими диаметр пор менее 40 кДа. К сконцентрированному в 10 раз раствору добавляют сульфат аммония до конечного насыщения 85-90%, центрифугируют, осадок растворяют в десятикратном объеме бидистиллированной воды и наносят на колонку, заполненную сефадексом G-25, элюцию проводят бидистиллированной водой. Собирают фракции, содержащие пероксидазу с величиной RZ>0,1. К собранным фракциям добавляют сульфат аммония до насыщения 85-90%, центрифугируют, осадок растворяют в 3-кратном по объему количестве бидистиллированной воды и наносят на колонку для гельфильтрации, заполненную сефадексом G-50, элюцию проводят бидистиллированной водой. Собирают фракции, содержащие пероксидазу, с величиной RZ>0,5. Фракции смешивают, дотитровывают до рН 4,4 и подвергают очистке на карбоксиметилцеллюлозе, фермент элюируют в градиенте концентраций от 5 мМ до 0,15 М ацетатного буфера (рН 4,4) (V=S-500 мл, R-500 мл). Собирают фракции с величиной RZ>2,7 и с концентрацией фермента не менее 10 мг/мл. Фракции объединяют, дотитровывают до рН 5,0 и лиофильно высушивают.
Недостатками данного метода являются недостаточно высокая чистота и активность и небольшие выходы пероксидазы.
Изобретение решает задачу создания промышленного способа получения пероксидазы из корней хрена, позволяющего получать пероксидазу с высокой чистотой, с высокой удельной активностью и с высоким выходом.
Поставленная задача решается способом получения фермента пероксидазы из корней хрена, который включает размельчение и гомогенизацию пророщенных корней хрена, экстракцию гомогенизата корней хрена, отделение балластных белков и осаждение пероксидазы солями сульфата аммония, гельфильтрацию раствора пероксидазы на сефадексе, хроматографическую очистку на карбоксиметилцеллюлозе, лиофильную сушку целевой пероксидазы, при этом измельченные корни хрена экстрагируют 0,15±0,01 М раствором хлорида натрия с рН=4,4±0,2; гельфильтрацию раствора пероксидазы осуществляют на сефадексе G-100 с элюированием 0,15-0,2 М раствором хлорида натрия с рН 4,4-5,0, проводят диализ против натрий-ацетатного буфера с рН 4,4-5,0 и диализ против калий-фосфатного буфера с рН 8,0±0,1 и концентрирование с дополнительной очисткой на ДЭАЭ-целлюлозе с элюцией тем же буфером с последующим диализом против деионизованной воды.
Дважды используют осаждение белков солями сульфата аммония: для отделения балластных белков используют 45-48% насыщение, а для осаждения пероксидазы используют 85-90% насыщение,
Хроматографической очистке пероксидазы на карбоксиметилцеллюлозе предшествует диализ против натрий-ацетатного буфера с рН 4,4-5,0.
Лиофильной сушке предшествует диализ раствора пероксидазы против деионизованной воды.
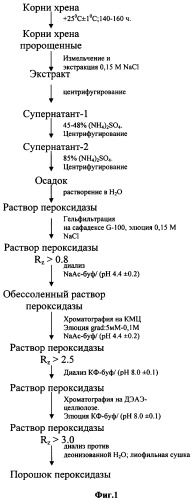
На Фиг.1 приведена принципиальная схема выделения пероксидазы из корней хрена.
Корни хрена отмывают под проточной водой и проращивают в течение 140-160 ч при температуре +25±1°С. Пророщенные корни измельчают и экстрагируют 0,15 М раствором хлорида натрия в течение 12±2 ч при постоянном перемешивании, затем центрифугируют.
К супернатанту-1 (Фиг.1) при непрерывном перемешивании добавляют 16,7±0,05 кг (45-48% насыщения) сульфата аммония, образовавшийся осадок отделяют центрифугированием, а к образовавшемуся супернатанту-2 (Фиг.1) добавляют еще 11,8±0,05 кг (85% насыщения) сульфата аммония, осадок (Фиг.1) отделяют центрифугированием и растворяют дистиллированной водой до конечного объема 200±10 мл. После центрифугирования супернатант, содержащий пероксидазу, наносят на колонку, заполненную сефадексом G-100, и элюируют 0,15 М раствором хлорида натрия со скоростью 100 мл/ч, в ходе элюции отбирают фракции по 20 мл. В собранных фракциях измеряют RZ=D408/D275. Фракции, в которых RZ не менее 0,8, объединяют и диализуют против натрий-ацетатного буфера (рН 4,4±0,2) (буфер-1), затем обессоленный раствор пероксидазы наслаивают на колонку, заполненную карбоксиметилцеллюлозой и уравновешенную буфером-1, и элюируют линейным градиентом 5 мМ - 0,1 М ацетатного буфера (рН 4,4±0,2) (V=S-0,5 л, R-0,5 л). В белковых фракциях измеряют величину RZ. Фракции, в которых значение RZ не менее 2,5, объединяют и диализуют против калий-фосфатного буфера (рН 8,0±0,1) (буфер-2), отдиализованный раствор фермента наслаивают на колонку, заполненную ДЭАЭ-целлюлозой, и элюируют буфером-2. Фракции, в которых значение RZ не менее 3,0, объединяют и диализуют против деионизованной воды, затем переносят в стерильную термостойкую колбу, замораживают жидким азотом и лиофильно сушат до полного высыхания препарата.
Существенными отличительными признаками предлагаемого способа получения биологически активных веществ являются:
- использование гельфильтрации на сефадексе G-100 для максимально полной очистки пероксидазы от низкомолекулярных примесей;
- диализ против натрий-ацетатного буфера (рН 4,4-5,0), позволяющий обессолить раствор пероксидазы и подготовить его к хроматографии на карбоксиметилцеллюлозе;
- диализ против калий-фосфатного буфера (рН 8,0±0,1), позволяющий перевести раствор пероксидазы в оптимальный буфер с оптимальным рН для нанесения на ДЭАЭ-целлюлозу;
- ионообменная хроматография пероксидазы на ДЭАЭ-целлюлозе как прием, обеспечивающий не только дополнительную очистку, но и концентрирование раствора фермента.
Таким образом, нами предлагается новый подход, позволяющий осуществлять переработку корней хрена с получением фермента пероксидазы высокой чистоты и удельной активности.
Отличие заявляемого способа от ближайшего аналога и прототипа состоит в следующем.
В заявляемом способе измельченные корни хрена экстрагируют 0,15±0,01 М раствором хлорида натрия с рН=4,4±0,2, тем самым достигается максимально полный переход фермента в раствор, и при этом фермент не теряет своей активности.
В аналоге изобретения [Пат. РФ 2130070, C12N 9/08, 10.05.1999] пероксидазу из очисток (без гомогенизации!) экстрагируют в течение 1 ч 0,25% раствором пищевой аскорбиновой кислоты, что может сказываться на выходе пероксидазы, поскольку очистки не гомогенизируются, а следовательно, фермент переходит в раствор далеко не полностью, при этом экстракция протекает в кислых условиях, что может привести к частичной инактивации фермента. В прототипе изобретения [А.С. Болгарии 46675, C12N 9/08, 15.02.90] фермент из гомогенизата корней хрена экстрагируют водой, что также приводит к низкому выходу пероксидазы из гомогенизата в раствор.
В отличие от аналога изобретения, где пероксидазу осаждают дважды 85-90% насыщением сульфатом аммония, и прототипа изобретения, где четыре раза проводят осаждение белков солями сульфата аммония, в заявляемом способе проводят отделение балластных белков 45-48% насыщением, а затем осаждают пероксидазу 85% насыщением.
В аналоге и прототипе изобретения концентрирование проводят методом ультрафильтрации, при этом в аналоге изобретения ультрафильтрация предшествует сульфатаммонийному осаждению пероксидазы, что приводит к большой вероятности соосаждения примесных белков, а соответственно, к более низкой чистоте конечного продукта. В заявляемом способе пероксидаза подвергается концентрированию на ионообменном сорбенте ДЭАЭ-целлюлоза на заключительной стадии технологического процесса, что приводит и к дополнительной очистке фермента.
В заявляемом способе гельфильтрацию проводят на сефадексе G-100 с элюированием 0,15±0,01 М раствором хлорида натрия (рН 4,4-5,0), что позволяет полностью избавиться от зеленоватого оттенка раствора пероксидазы, обусловленного наличием хлорофилла и родственных соединений, и веществ с меньшим, чем у пероксидазы, размером молекул. В аналоге изобретения гельфильтрацию проводят на сефадексе G-25, который по способности задерживать примесные частицы, учитывая размер молекулы пероксидазы (около 40 кДа), уступает сефадексу G-100.
Сущность изобретения иллюстрируется следующим примерами.
Пример 1. Получение грубого экстракта
50 кг корней хрена отмывают под проточной водой и проращивают в течение 140-160 ч при температуре +25±1°С. Пророщеные корни измельчают на лопастном гомогенизаторе и заливают 50 л 0,15-0,2 М раствором хлорида натрия (рН 4,4±0,2). Суспензию экстрагируют в течение 12±2 ч при постоянном перемешивании, затем центрифугируют.
К супернатанту-1 объемом 60 л для отделения балластных белков при непрерывном перемешивании добавляют сульфат аммония до 45-48% насыщения. (Под 100%-ным насыщением имеется в виду количество соли, при добавлении которого раствор становится насыщенным, а при дальнейшем добавлении соли раствор становится пересыщенным, и соль выпадает в осадок. Для растворов с сульфатом аммония 100% насыщением является добавление и полное растворение 70,7 г сульфата аммония в 100 мл дистиллированной воды.) Осадок-1 отделяют центрифугированием. Далее образовавшийся супернатант-2 объемом 55 л для осаждения пероксидазы насыщают сульфатом аммония до 85%, осадок-2 отделяют центрифугированием. Образовавшийся осадок-2 растворяют деионизованной водой до конечного объема 200±10 мл, нерастворившийся осадок-3 отделяют центрифугированием.
Гель-хроматография на сефадексе G-100.
Раствор пероксидазы наносят на колонку объемом 1 л, заполненную сефадексом G-100. Элюцию ведут 0,15-0,2 М раствором хлорида натрия (рН 4,4-5,0) со скоростью 100 мл/ч, в ходе элюции отбирают фракции по 20 мл. В собранных фракциях измеряют RZ=D408/D275. Фракции, в которых RZ не менее 0,8, объединяют.
Диализ-1.
В сборник помещают 5 л 5±0,1 мМ натрий-ацетатного буфера (рН 4,4-5,0) (буфер-1) и диализный мешок с объединенными фракциями пероксидазы. Диализ ведут при постоянном перемешивании в течение 24 ч, трижды меняя буфер в сборнике.
Хроматография на карбоксиметилцеллюлозе.
Обессоленный раствор фермента наслаивают на колонку объемом 1 л, заполненную карбоксиметилцеллюлозой и уравновешенную буфером-1. Элюцию ведут со скоростью 50 мл/ч в линейном градиенте 5 мМ-0,1 М ацетатного буфера (рН 4,4±0,2) (V=S-0,5 л, R-0,5 л). В белковых фракциях измеряют величину RZ. Фракции, в которых значение RZ не менее 2,5, объединяют.
Диализ-2.
В сборник помещают 5 л 20±0,1 мМ калий-фосфатного буфера (рН 8,0±0,1) (буфер-2) и диализный мешок с объединенными фракциями фермента. Диализ ведут аналогично.
Концентрирующая хроматография на ДЭАЭ-целлюлозе.
Раствор фермента с рН 8,0±0,1 наслаивают на колонку объемом 300 мл, заполненную ДЭАЭ-целлюлозой. Элюцию ведут буфером-2 со скоростью 50 мл/ч. Фракции, в которых значение RZ не менее 3,0, объединяют.
Диализ-3.
В сборник помещают 5 л деионизованной воды и диализный мешок с раствором пероксидазы. Диализ ведут аналогично.
Лиофильная сушка.
Раствор пероксидазы переносят в стерильную термостойкую колбу, замораживают жидким азотом и лиофильно сушат до полного высыхания препарата.
Пример 2 (сравнительный)
В данном примере выдержаны условия получения пероксидазы по прототипу, но для улучшения основных показателей пероксидазы изменены две существующие в прототипе стадии, а именно: для ультрафильтрационного концентрирования раствора пероксидазы используют два типа колонок с полыми волокнами, в отличие от прототипа, где используют один тип волокон, и дробное фракционирование белков солями сульфата аммония (как в заявляемом способе).
Получение грубого экстракта.
50 кг корней хрена отмывают под проточной водой и зачищают на 1/3 часть массы в присутствии 33,5 л 0,25% раствора пищевой аскорбиновой кислоты, в котором полученные очистки выдерживают в течение 1 ч для экстракции фермента пероксидазы. Далее экстракт центрифугируют на проточной центрифуге и выдерживают в течение 24 ч для "созревания" фермента.
Первичная очистка и концентрирование.
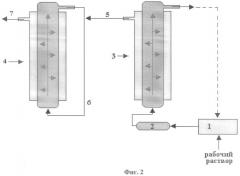
В полученный экстракт добавляют 1,7 кг (5% по весу) сульфита натрия и экстракт подвергают концентрированию и первичной очистке методом ультрафильтрации на установке с полыми полимерными волокнами УПВ-6, укомплектованной колонками с фильтрами, имеющими размеры пор 60 кДа и 5 кДа. Принципиальная схема установки представлена на Фиг.2, где показаны центробежный насос 1; предфильтр 2; колонка с волокнами, имеющими размер пор 60 кДа 3; колонка с волокнами, имеющими размер пор 5 кДа 4; фильтрат пероксидазы 5; концентрированный раствор пероксидазы 6; фильтрат, содержащий низкомолекулярные белки 7.
Фракционирование белков солями сульфата аммония.
К концентрату объемом 6 л для отделения балластных белков при непрерывном перемешивании добавляют сульфат аммония до 45-48% насыщения. Осадок отделяют центрифугированием. Далее образовавшийся супернатант объемом 5,7 л для осаждения пероксидазы насыщают сульфатом аммония до 85%, осадок отделяют центрифугированием, который растворяют бидистиллированной водой до конечного объема 200±10 мл, нерастворившийся осадок отделяют центрифугированием.
Гель-хроматография на сефадексе G-25 и G-50.
Дальнейшую очистку пероксидазы проводят на колонке для гельфильтрации, заполненной сефадексом G-25 и уравновешенной бидистиллированной водой. Раствор пероксидазы наносят на колонку, элюирование проводят бидистиллированной водой. Собирают фракции, в которых RZ не менее 0,2. К собранным фракциям добавляют сульфат аммония до 90% насыщения, перемешивают до полного растворения соли и центрифугируют. Осадок растворяют в 3-кратном по объему количестве бидистиллированной воды и наносят на колонку для гельфильтрации, заполненную сефадексом G-50 и уравновешенную бидистиллированной водой. Элюирование проводят бидистиллированной водой. Собирают фракции, в которых RZ не менее 0,6. С помощью 50% уксусной кислоты значение рН во фракциях с пероксидазой устанавливают на уровне 4,4.
Хроматография на карбоксиметилцеллюлозе.
Фракции пероксидазы наслаивают на колонку объемом 1 л, заполненную карбоксиметилцеллюлозой, предварительно уравновешенную 5 мМ ацетатным буфером с рН 4,4. Элюирование проводят линейным градиентом 5 мМ-0,15 М ацетатного буфера (рН 4,4±0,2) (V=S-0,5 л, R-0,5 л) в течение 1 часа. В белковых фракциях измеряют величину RZ. Фракции, в которых значение RZ не менее 2,7, объединяют, устанавливают рН 5,0 добавлением аммиака и лиофильно высушивают.
Сравнительные данные по примеру 1 и 2 приведены в таблице.
| ТаблицаСравнительные данные основных параметров качества пероксидазы из корней хрена при использовании двух способов получения. | ||
| Наименование технологического параметра, единицы измерения. | Пример 1 (заявляемый способ) | Пример 2 (известный способ) |
| Выход по массе пероксидазы, г/кг корней хрена. | 2,52-3,50 | 0,21-0,85 |
| Удельная активность препарата, Е.А./мг белка* | 640-700 | 560-610 |
| Чистота по спектрофотометру RZ=D408/D275 | 3,00-3,20 | 2,70-3,00 |
| * - Удельная активность вычислялась с использованием данных, приведенных в работе СТП 103.34-83. Правила вычисления и обработки результатов количественного анализа. НИКТИ БАВ, 1983. |
Таким образом, как видно из примеров и таблицы, заявляемый способ получения пероксидазы из корней хрена (пример 1) позволяет получать пероксидазу с высокими выходами, с чистотой и активностью, достаточной для использования данного фермента в качестве составной части конъюгатов для иммуноферментных анализов. А в условиях прототипа (пример 2) даже при усовершенствовании двух стадий, улучшающих показатели, выход, удельная активность и чистота целевой пероксидазы ниже аналогичных показателей заявляемого способа.
Данный способ может быть использован в промышленном получении пероксидазы из корней хрена.
1. Способ получения фермента пероксидазы из корней хрена, включающий размельчение и гомогенизацию пророщенных корней хрена, экстракцию гомогенизата корней хрена, отделение балластных белков и осаждение пероксидазы солями сульфата аммония, гельфильтрацию раствора пероксидазы на сефадексе, хроматографическую очистку на карбоксиметилцеллюлозе, лиофильную сушку целевой пероксидазы, отличающийся тем, что измельченные корни хрена экстрагируют 0,15±0,01 М раствором хлорида натрия; гельфильтрацию раствора пероксидазы осуществляют на сефадексе G-100, проводят диализ против натрий-ацетатного буфера с рН 4,4-5,0 и диализ против калий-фосфатного буфера с рН 8,0±0,1, и концентрирование с дополнительной очисткой на ДЭАЭ-целлюлозе с элюцией тем же буфером с последующим диализом против деионизованной воды.
2. Способ по п.1, отличающийся тем, что измельченные корни хрена экстрагируют 0,15±0,01 М раствором хлорида натрия с рН 4,4±0,2.
3. Способ по п.1, отличающийся тем, что дважды используют осаждение белков солями сульфата аммония: для отделения балластных белков используют 45-48% насыщение, а для осаждения пероксидазы используют 85-90% насыщение.
4. Способ по п.1, отличающийся тем, что гельфильтрацию проводят на сефадексе G-100 с элюированием 0,15-0,2 М раствором хлорида натрия с рН 4,4-5,0.
5. Способ по п.1, отличающийся тем, что хроматографической очистке пероксидазы на карбоксиметилцеллюлозе предшествует диализ против натрий-ацетатного буфера с рН 4,4-5,0.
6. Способ по п.1, отличающийся тем, что лиофильной сушке предшествует диализ раствора пероксидазы против деионизованной воды.