Фармацевтические композиции, направленные на рецепторы erbb1
Иллюстрации
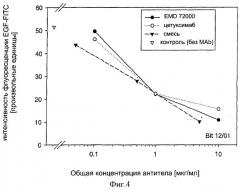
Показать всеИзобретение относится к фармацевтическим композициям, предназначенным для лечения опухолей. Композиция содержит две различные молекулы моноклональных антител MAb 425 и MAb 225 в мышиной, химерной или гуманизированной модификации, каждое из которых содержит эпитопы, одновременно связывающиеся с различными участками в пределах одного и того же связывающего лиганд домена рецептора ErbB1. Композиция может вызывать повышение поперечного связывания различных или одинаковых рецепторов ErbB и усиливать индукцию модуляции специфического пути передачи сигнала. Использование композиции позволяет снизить дозы композиций и средств, применяемые в терапии опухолей, и тем самым уменьшить количество побочных эффектов, связанных с введением высоких доз. 3 н. и 7 зав.п. ф-лы, 5 ил.
Реферат
Область техники изобретения
Изобретение относится к фармацевтическим композициям, содержащим различные биологические молекулы, предпочтительно моноклональные антитела, каждое из которых содержит эпитопы, которые одновременно связываются с различными эпитопами одного и того же домена рецептора ErbB, в особенности домена рецептора ErbB1. Предпочтительные антитела в соответствии с настоящим изобретением представляют собой MAb 425 и MAb 225 каждое в его мышиной, химерной и гуманизированной модификации. Изобретение относится к применению и к способам улучшенного лечения предпочтительно опухолей при помощи указанных композиций.
Предпосылки создания изобретения
Известно, что биологические молекулы, такие как моноклональные антитела (MAb) или другие белки / полипептиды, а также небольшие химические соединения, направленные на различные рецепторы и другие антигены на поверхности опухолевых клеток, пригодны для лечения опухолей, что используется свыше двадцати лет. Что касается подхода с применением антител, то большинство таких MAb химеризуют или гуманизируют для улучшения переносимости иммунной системой человека. MAb или вышеупомянутые химические вещества специфически связываются с их структурами-мишенями в клетках опухолей и в большинстве случаев также в нормальных тканях и могут вызывать различные действия, которые зависят от специфичности их эпитопов и/или функциональных свойств конкретного антигена. Полагают, что MAb к орфановым рецепторам или другим нефункциональным молекулам поверхности клеток, а также MAb к структурам, расположенным снаружи по отношению к лиганд-связывающему участку функционально активных рецепторов (например, рецепторы фактора роста с киназной активностью) индуцируют первичные иммунные эффекторные функции против клетки-мишени (антитело-зависимая цитотоксичность, опосредованная клетками (ADCC), комплемент-зависимая цитотоксичность (CDC)). Дополнительно, в зависимости от свойств антигена и MAb, связывание антигена может приводить к поперечному связыванию рецепторов. Последующая интернализация комплексов рецептор-антитело может приводить к пролонгированию снижающей модуляции плотности рецепторов на поверхности клеток.
MAb или небольшие химические молекулы, которые связываются с эпитопом в пределах лиганд-связывающего участка или в непосредственной близости к нему конкурируют за связывание с естественными лигандами с их рецептором и таким образом уменьшают или полностью ингибируют связывание лиганда и могут вытеснять уже связанные лиганды с их рецепторов. Это блокирование рецептора ингибирует лиганд-зависимую активацию рецептора и последующую передачу сигнала. Например, блокирование рецепторов ErbB, таких как рецептор фактора роста эпидермиса (EGFR), моноклональными антителами вызывает различные действия в клетках, включая ингибирование синтеза ДНК и пролиферацию, задержку клеточного цикла и апоптоз, а также антиметаститические и антиангиогенные действия.
Рецепторы ErbB представляют собой характерный рецептор тирозинкиназ, которые вовлечены в злокачественные новообразования, как установлено в 80-х годах прошлого века. Тирозинкиназы представляют собой класс ферментов, которые катализируют перенос конечного фосфата аденозинтрифосфата на остатки тирозина в белковых субстратах. Полагают, что тирозинкиназы при помощи субстратного фосфорилирования играют решающую роль в передаче сигнала при разнообразных клеточных функциях. Несмотря на то, что точно механизмы передачи сигнала все еще неясны, для тирозинкиназ было показано, что они являются важными факторами, которые принимают участие в пролиферации клеток, карциногенезе и дифференциации клеток.
Тирозинкиназы могут быть разделены на тирозинкиназы рецепторного типа и нерецепторного типа. Оба типа тирозинкиназ - рецепторного и нерецеторного типа - вовлечены в пути передачи сигналов в клетках, приводящие к многим патогенным состояниям, включая злокачественные новообразования, псориаз и гипериммунные ответы. Многие тирозинкиназы вовлечены в рост клеток, а также в ангиогенез (развитие кровеносных сосудов). Тирозинкиназы нерецепторного типа также включают множество подсемейств, такие как Src, Frk, Btk, Csk, Abl, Zap70, Fes/Fps, Fak, Jak, Ack и LIMK. Каждое из этих подсемейств также подразделяется в зависимости от разных рецепторов. Например, подсемейство Src является одним из наибольших и включает Src, Yes, Fyn, Lyn, Lck, Blk, Hck, Fgr и Yrk. Подсемейство ферментов Src связано с онкогенезом. Для более подробного обсуждения тирозинкиназ нерецепторного типа см. Bolen Oncogene, 8:2025-2031 (1993).
Тирозинкиназы рецепторного типа имеют внеклеточную, трансмембранную и внутриклеточную части, в то время как тирозинкиназы нерецепторного типа являются полностью внутриклеточными. Тирозинкиназы, связанные с рецептором, представляют собой трансмембранные белки, которые включают внеклеточный лиганд-связывающий домен, трансмембранную последовательность и цитоплазматический домен тирозинкиназы. Тирозинкиназы рецепторного типа включают большое количество трансмембранных рецепторов с разнообразной биологической активностью.
Были идентифицированы разные подсемейства тирозинкиназ рецепторного типа. Такие тирозинкиназы включают рецепторы фактора роста фибробластов (FGF), рецепторы фактора роста эпидермиса (EGF) семейства основного класса ErbB и рецепторы фактора роста производных тромбоцитов (PDGF). Также сюда включают рецепторы фактора роста нервов (NGF), рецепторы нейротрофического фактора, имеющего происхождение из головного мозга (BDNF), рецепторы нейротрофина-3 (NT-3) и рецепторы нейротрофина-4 (NT-4).
Одно подсемейство тирозинкиназы рецепторного типа, обозначенное как подсемейство HER или ErbB, включает EGFR (ErbB1), HER2 (ErbB2 или p185neu), HER3 (ErbB3) и HER4 (ErbB4 или tyro2). Лиганды этого подсемейства рецепторов включают фактор роста эпителия (EGF), TGF-α, амфирегулин, HB-EGF, бетацеллюлин, херегулин и нейрегулины. Подсемейство PDGF включает семейство FLK, которое включает рецептор вставочного домена киназы (KDR).
EGFR, кодируемый геном ErbB1, вовлечен и является одной из причин возникновения злокачественных опухолей у людей. В частности, усиленная экспрессия EGFR наблюдается при раке молочной железы, мочевого пузыря, легких, головы, шеи и желудка, а также при глиобластомах. Усиленная экспрессия рецептора EGFR часто связана с усиленной выработкой лиганда EGFR, трансформирующего фактора роста альфа (TGF-α), в подобных опухолевых клетках приводит к активации рецептора при помощи аутокринной стимуляции (Baselga и Mendelsohn, Pharmac. Ther. 64:127-154 (1994)).
Рецептор EGF представляет собой трансмембранный гликопротеин, который имеет молекулярный вес 170,000 и был обнаружен во многих типах эпителиальных клеток. Он активируется по крайней мере тремя лигандами, такими как EGF, TGF-α, (трансформирующий фактор роста альфа) и амфирегулин. Было показано, что и фактор роста эпидермиса (EGF), и трансформирующий фактор роста альфа (TGF-α) связываются с рецетором EGF и приводят к пролиферации клеток и росту опухолей. Эти факторы роста не связываются с HER2 (Ulrich и Schlesinger, 1990, Cell 61, 203). В противоположность некоторым семействам факторов роста, которые индуцируют димеризацию рецептора в силу их димерной природы (например, PDGF), мономерные факторы роста, такие как EGF, включают два связывающих участка к их рецепторам и, следовательно, могут в большинстве случаев перекрестно связывать два соседних рецептора EGF (Lemmon и др., 1997, EMBO J. 16, 281). Недавние исследования (J. Schlessinger, 2002, Cell 110, 669) показали, что димеризация рецептора опосредуется взаимодействиями между рецепторами, при которых петля, которая выпячивается из соседних рецепторов, опосредует димеризацию и активацию рецептора.
Димеризация рецептора является необходимой для стимуляции присущей каталитической активности и для аутофосфорилирования рецепторов факторов роста по остаткам тирозина. Последние являются пригодными в качестве стыковочных участков для различных адапторных белков или ферментов, которые одновременно инициируют многие каскады передачи сигналов. У высших эукариот простой линейный метаболический путь эволюционирует в интенсивно взаимодействующую многослойную сеть, в которой комбинационная экспрессия и активация компонентов путем развития обеспечивает возможность осуществления специфических биологических ответных реакций. Сеть ErbB может объединять не только свои входящие сигналы, но также гетерологические сигналы, включая гормоны, лимфокины, нейромедиаторы и индукторы стресса.
Следует отметить, что рецепторы тирозинкиназы белков (РТК) способны подвергаться как гомо-, так и гетеродимеризации, причем гомодимерные комбинации рецепторов являются менее митогенными и трансформирующими (не инициируют сигналы или слабо инициируют сигналы) по сравнению с соответствующими гетеродимерными комбинациями. Гетеродимеры, содержащие ErbB2, являются наиболее эффективными комплексами (см. обзорные статьи Yarden и Sliwkowski, 2001, Nature Reviews, Molecular cell Biology, том 2, 127-137; Tzahar и Yarden, 1998, ВВ А1377, М25-М37).
Было показано, что антитела к рецептору EGF хотя блокируют связывание EGF и TGF-α с рецептором, способны ингибировать пролиферацию опухолевых клеток. Принимая во внимание эти полученные данные, было выявлено много мышиных и крысиных моноклональных антител к рецептору EGF и изучена их способность ингибировать рост опухолевых клеток в условиях in vitro и in vivo (Modjtahedi и Dean, 1994, J. Oncology 4, 277). Гуманизированное моноклональное антитело 425 (hMAb 425, US 5,558,864; ЕР 0531 472) и химерное моноклональное антитело 225 (cMAb 225), оба к рецептору EGF, выявляют эффективность при клинических исследованиях. Было показано, что антитело С225 (цетуксимаб) ингибирует EGF-опосредованный рост опухолевых клеток в условиях in vitro и ингибирует образование человеческих опухолей в условиях in vivo у бесшерстых мышей. Антитела, так же как в целом все антитела к EGFR, обладают, прежде всего, синергетическим действием с определенными химиотерапевтическими веществами (например, доксорубицином, адриамицином, таксолом и цисплатином) и уничтожают человеческие опухоли в условиях in vivo на модели мышиных ксенотрансплантов (см., например, ЕР 0667165). Ye и др. (1999, Oncogene 18, 731) показали, что клетки рака яичника человека могут успешно поддаваться лечению комбинацией как химерного cMAb 225, так и гуманизированного MAb 4D5 к рецептору HER2.
Другой представитель семейства ErbB, HER2 (ErbB2 или p185neu), был первоначально идентифицирован в качестве продукта трансформации гена из нейробластом крыс, подвергнутых химиотерапии. Активированная форма neu протоонкогена возникает вследствие точечной мутации (валина на глутаминовую кислоту) в трансмембранном участке кодуруемого белка. Амплификация человеческого гомолога neu наблюдается при раке молочной железы и яичников и коррелирует с неблагоприятным прогнозом (Slamon и др., Science, 235: 177-182 (1987); Slamon и др., Science, 244:707-712 (1989); US 4,968,603). ErbB2 (HER2) имеет молекулярный вес приблизительно 185,000 и обладает значительной гомологией к рецептору EGF (HER1), несмотря на то, что специфический лиганд для HER2 до сих пор еще не был окончательно идентифицирован. Антитело 4D5 к рецептору HER2 дополнительно обнаруживает чувствительность к цитотоксическим действиям TNF-α в клеточных линиях опухолей молочной железы, которые сверхэкспрессируют ErbB2 (патент US 5677171). Рекомбинантная гуманизированная модификация мышиного антитела 4D5 к ErbB2 (huMAb4D5-8, rhuMAb HER2 или HERCEPTIN®; US 5821337) обладает клинической активностью у пациентов с метастазами рака молочной железы, что сверхэкспрессируют ErbB2, которые предварительно получали интенсивное противораковое лечение (Baselga и др., J. Clin. Oncol. 14:737-744 (1996)). HERCEPTIN ® был разрешен к применению в 1998 для лечения пациентов с метастатическим раком молочной железы, который сверхэкспрессирует белок ErbB2.
Кроме антител к ErbB, существуют различные небольшие химические молекулы, которые, как известно, являются эффективными ингибиторами молекул рецепторов ErbB, блокируя участок связывания естественных лигандов (см. подробное описание) или блокируя остатки тирозина связывающего участка рецептора киназы, таким образом предотвращая фосфорилирование и дальнейший каскад передачи сигналов. Одним из таких характерных представителей, который обнаруживает высокую эффективность при клинических исследованиях, является Иресса (IressaТМ, ZD-1839), которая может применятся при NSCLC (немелкоклеточном раке легкого).
Несмотря на то что в настоящее время развиваются и представлены на рынке некоторые перспективные лекарственные средства и способы лечения опухолей, существует настоятельная потребность в дополнительных средствах и фармацевтических композициях и комбинациях с улучшенными свойствами и повышенной эффективностью.
Сущность изобретения
Изобретение основано на результатах исследований авторов изобретения, которые обнаружили, что определенные рецепторные тирозинкиназы, такие как молекулы антитела рецептора ErbB, предпочтительно молекулы антитела рецептора ErbB1 (EGFR), которые свырхэкспрессируются на поверхностях патологических клеток, например, опухолевых клеток, имеют специфичные эпитопные участки в пределах домена, связывающего естественный лиганд, с которыми одновременно могут связываться различные молекулы антител только с незначительным взаимным препятствием или без него. Очевидно, эти молекулы антитела обладают связывающими эпитопами, которые, благодаря их трехмерной конфигурации, являются относительно небольшими по сравнению с общим размером связывающего домена молекулы рецептора. Они вызывают повышение модулирующей активности опосредуемого пути передачи сигнала, предпочтительно повышают блокирование рецептора ErbB и, таким образом, полный каскад передачи сигнала. Настоящее изобретение описывает, во-первых, новую концепцию лечения опухолей, которая предполагает введение особи одного или нескольких биологически и терапевтически эффективных средств, которые блокируют или ингибируют рецептор ErbB рецептор, предпочтительно EGF рецептор (EGFR) (ErbB1), путем связывания указанного(ых) средства(средств) по крайней мере с первым и вторым различными эпитопами, предпочтительно в пределах домена, связывающего естественный лиганд, одного и того же рецептора. Было обнаружено, что, например, две или больше, предпочтительно две, разных антагонистичных к рецептору молекулы одновременно могут связываться с одним и тем же доменоми рецептора, предпочтительно одной и той же молекулы рецептора, без взаимного препятствия или конкурирования, что дает возможность повысить плотность антагонистичного связывания с рецептором и обеспечить (путем снижения способности связывать естественные (агонистические) лиганды, такие как EGF или TGF-α) более значительное ингибирование пути передачи сигнала соответствующими молекулами рецепторов в виде мономерных или димерных единиц. Это может приводить к значительному ингибированию роста опухоли и/или усилению апоптоза солидных опухолей или метастаз опухолей. Указанные молекулы могут представлять собой небольшие химические и синтетические соединения или белки, полипептиды или пептиды, иммуноглобулины, такие как антитела или их фрагменты, или иммуноконъюгаты. Предпочтительные молекулы представляют собой антитела к ErbB, в особенности антитела к EGFR и Her2, как описано выше и в дальнейшем, и их фрагменты, предпочтительно F(ab')2. В предпочтительном варианте осуществления настоящего изобретения два различных антитела к EGFR вводятся особи, предпочтительно MAb 425 в гуманизированной, химерной или мышиной модификации или его фрагмент, такой как F(ab')2, и MAb 225 в гуманизированной, химерной или мышиной модификации или его фрагмент, такой как F(ab')2. Наиболее предпочтительным является совместное применение гуманизированного MAb 425 и химерного MAb 225 в виде полного антитела или в виде F(ab')2 фрагмента.
Однако также является возможным применять относительно короткие синтетические (поли)пептиды, имеющие происхождение и полученные из указанных сконструированных антител, содержащих аминокислотную последовательность одного, двух или трех CDR соответствующего антитела, в котором, необязательно, для повышения связывающего сродства и/или степени сродства к рецептору, некоторые аминокислоты в пределах антигенсвязывающего участка или в непосредственной близости от него (1-5 аминокислот) могут быть модифицированы предпочтительно путем замещения. Такие синтетические пептиды, которые могут связываться с рецептором со сродством, сравнимым с соответствующими антителами, обладают преимуществами, поскольку могут быть легко и недорого получены. Также представляется возможным синтезировать один единичный пептид, который содержит аминокислотные последовательности, имеющие происхождение от указанных CDR, в качестве первой молекулы, а также в качестве второй молекулы, например, (поли)пептид, содержащий аминокислотную последовательность, имеющую происхождение от 1-3 CDR MAb 425 и 1-3 CDR Mab 225.
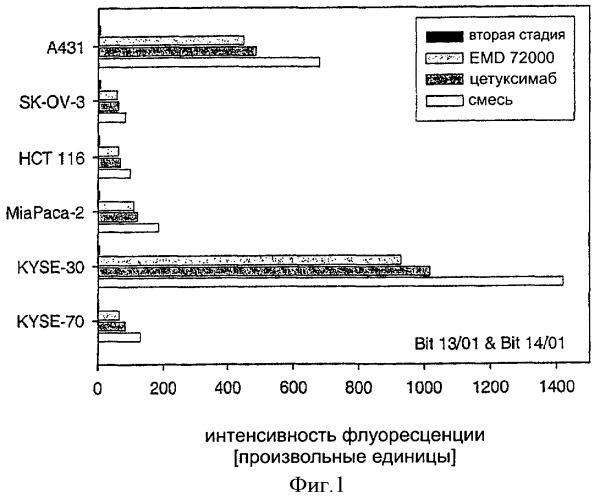
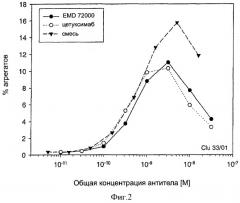
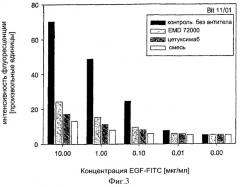
Было обнаружено, что фармацевтические композиции в соответствии с настоящим изобретением могут вызывать повышение поперечного связывания / димеризацию различных или одинаковых рецепторов ErbB, усиливать блокирование / ингибирование рецепторов ErbB и усиливать индукцию модуляции специфического пути передачи сигнала, опосредуемого рецептором ErbB, по сравнению с единичной молекулой, содержащей только один их указанных связывающих участков. Другими словами: смесь, например MAb 425 и MAb 225, выявляет улучшенное ингибирование и снижающую регуляцию на EGFR по сравнению с подходом, когда MAb 425 или 225 применяются в качестве единичного средства в аналогичной концентрации.
Несмотря на то, что вышеописанные исследования осуществляли только для рецепторов ErbB в качестве молекул рецепторов-мишеней, следует обратить внимание на то, что научный принцип, открытый изобретателями и описанный выше и в дальнейшем, также может применяться для других биологических рецепторов, отличных от ErbB.
Необязательно композиция в соответствии с настоящим изобретением включает дополнительные терапевтически активные соединения, которые могут способствовать и улучшать эффективность вышеописанных молекул. Такими средствами могут являться цитотоксические средства и предпочтительно антагонистические молекулы, такие как антагонисты тирозинкиназы, другие ErbB антагонисты, антагонисты рецептора гормона роста, антагонисты протеинкиназы, антиангиогенные средства или цитокины. Такие вещества, пригодные для применения, согласно настоящему изобретению более подробно описаны ниже.
В соответствии с настоящим изобретением терапевтически активные вещества также могут применяться в виде фармацевтического набора, включающего упаковку, содержащую одно или больше указанных антагонистических средств в общем или раздельных контейнерах. Лечение при помощи этих комбинаций необязательно может включать лучевую терапию. В большинстве случаев введение может сопровождаться лучевой терапией, при этом лучевая терапия может осуществляться в основном одновременно или перед или после введения лекарственного средства. Введение различных средств в комбинированной терапии в соответствии с изобретением также может осуществляться в основном одновременно или последовательно. Опухоли, которые на поверхностях своих клеток несут рецепторы, вовлеченные в развитие кровеносных сосудов опухоли, могут успешно лечиться комбинированной терапией в соответствии с настоящим изобретением.
Известно, что опухоли используют альтернативные пути для своего развития и роста. Если один путь блокирован, они часто обладают способностью переключаться на другой путь при помощи экспрессии и использования других рецепторов и других путей передачи сигналов. Поэтому фармацевтические композиции в соответствии с настоящим изобретением могут блокировать несколько таких возможных стратегий развития опухоли и, следовательно, обеспечивать различные преимущества. Комбинации в соответствии с настоящим изобретением полезны для лечения и предотвращения опухолей, опухолеподобных нарушений, неоплазий и метастаз опухолей, которые развиваются и растут вследствие активации их соответствующих рецепторов гормонов, присутствующих на поверхности опухолевых клеток. Предпочтительно, сочетания различных средств по настоящему изобретения вводятся в комбинации в низких дозах, при этом такие дозы являются ниже тех доз, которые обычно используются в медицине. Преимущество снижения доз соединений, композиций, средств и терапий по настоящему изобретению, что вводятся особи, состоит в уменьшении количества побочных эффектов, связанных с введением высоких доз. Например, при снижении дозы средства, описанного выше и ниже, происходит уменьшение частоты и степени тошноты и рвоты по сравнению с наблюдаемыми при введении высших доз. При снижении количества побочных действий улучшается качество жизни раковых больных. Дополнительными преимуществами снижения количества побочных эффектов является улучшение соблюдения больным режима и схемы лечения, снижение числа госпитализаций, необходимых для лечения побочных эффектов, и уменьшение введения обезболивающих средств, необходимых для лечения боли, связанной с побочными действиями. Альтернативно, способы и комбинации по настоящему изобретению могут также обеспечивать максимальную терапевтическую эффективность при высших дозах.
Комбинации в соответствии с изобретением выявляют неожиданный синергетический эффект. При введении комбинации лекарственных средств действительно наблюдается сокращение и распад опухоли при клинических исследованиях, в то время как не наблюдается существенного неблагоприятного взаимодействия лекарственных средств.
В целом изобретение относится к:
- фармацевтической композиции, содержащей одно или несколько биологически и/или терапевтически эффективных молекул антител (или их фрагмент), которые обладают способностью связываться с различными эпитопами связывающего домена молекулы рецептора ErbB, где указанная одна или несколько молекул антитела содержат по крайней мере участок связывания, который связывается с первым специфическим эпитопом указанного связывающего домена рецептора и по крайней мере другой участок связывания, который связывается с вторым специфичным эпитопом одного и того же связывающего домена рецептора ErbB;
- соответствующей фармацевтической композиции, содержащей две или больше молекул антитела, причем одна молекула антитела содержит по крайней мере участок связывания, который связывается с первым специфическим эпитопом указанного связывающего домена рецептора, и по крайней мере другая молекула антител содержит по крайней мере другой участок связывания, который связывается с вторым специфичным эпитопом одного и того же связывающего домена рецептора;
- соответствующей фармацевтической композиции, в которой по крайней мере одна из указанных молекул антител связывается с эпитопом в пределах связывающего домена рецептора, с которым связывается естественный лиганд рецептора;
- соответствующей фармацевтической композиции, которая вызывает усиление блокирования и/или ингибирования рецептора ErbB и усиливает индукцию изменения специфического пути передачи сигнала, опосредуемого рецептором ErbB, по сравнению с единичной молекулой, содержащей только один из указанных участков связывания;
- соответствующей фармацевтической композиции, которая вызывает повышение поперечного связывания и/или димеризацию различных рецепторных молекул, обладающей одинаковой или различной специфичностью;
- соответствующей фармацевтической композиции, в которой указанный рецептор ErbB представляет собой рецептор EGF рецептор (EGFR);
- соответствующей фармацевтической композиции, содержащей первое и второе моноклональное антитело (или их биологически активный фрагмент), каждое из которых направлено на различные эпитопы рецептора EGF;
- соответствующей фармацевтической композиции, в которой первое антитело представляет собой мышиное, химерное или гуманизированное MAb 425;
- соответствующей фармацевтической композиции, в которой второе антитело представляет собой мышиное, химерное или гуманизированное MAb 225;
- соответствующей фармацевтической композиции, в которой указанное первое антитело представляет собой гуманизированное MAb 425 (h425) и указанное второе антитело представляет собой химерное MAb 225 (с225, цетуксимаб);
- соответствующей фармацевтической композиции, которая дополнительно содержит цитотоксическое средство;
- фармацевтическому набору, который содержит
(i) первую упаковку, содержащую по крайней мере первую биологически активную молекулу антитела (или ее фрагмент), которая связывается с первым специфическим эпитопом связывающего домена на молекуле рецептора ErbB, и
(ii) вторую упаковку, содержащую по крайней мере вторую молекулу антитела или ее фрагмент, которая связывается с отличным вторым специфическим эпитопом связывающего домена одной и той же молекулы рецептора ErbB;
- соответствующему фармацевтическому набору, в котором по крайней мере одна из указанных молекул антител связывается с эпитопом в пределах связывающего домена рецептора, с которым связывается естественный лиганд рецептора;
- соответствующему фармацевтическому набору, в котором указанная первая молекула антитела представляет собой мышиное, химерное или гуманизированное моноклональное антитело 425 или его биологически активный фрагмент, а указанная вторая молекула антитела представляет собой мышиное, химерное или гуманизированное моноклональное антитело 225 или его биологически активный фрагмент;
- соответствующему фармацевтическому набору, содержащему первую упаковку, которая содержит гуманизированное MAb 425 (h425), и вторую упаковку, которая содержит химерное MAb 225 (с225);
- соответствующему фармацевтическому набору, который дополнительно включает третью упаковку, содержащую дополнительное лекарственное средство, обладающей способностью усиливать эффективность лекарственных средств, которые содержатся в первой и второй упаковках;
- соответствующему фармацевтическому набору, в котором указанное дополнительное лекарственное средство представляет собой цитотоксическое средство;
- способу лечения заболеваний, связанных с опухолями, у пациента, который предусматривает введение указанному пациенту терапевтически эффективного количества (i) по крайней мере первой молекулы антитела (или ее фрагмента), которая связывается с первым специфическим эпитопом связывающего домена молекулы рецептора ErbB, и (ii) по крайней мере второй молекулы антитела, которая связывается с отличным вторым специфическим эпитопом участка связывания одной и той же молекулы рецептора ErbB;
- соответствующему способу, в котором по крайней мере одна из указанных молекул антител связывается с эпитопом в пределах связывающего домена рецептора, с которым связывается естественный лиганд рецептора;
- соответствующему способу, в котором указанная молекула антитела, которая связывается с указанным эпитопом, блокирует и/или ингибирует рецептор, индуцируя таким образом модуляцию специфического пути передачи сигнала, опосредуемого рецептором;
- соответствующему способу, в котором связывание указанной молекулы антитела вызывает поперечное связывание и/или димеризацию различных молекул рецептора, обладающих одинаковой или различной специфичностью;
- соответствующему способу, в котором указанная первая молекула антитела представляет собой гуманизированное моноклональное антитело 425 (h425) или его биологически активный фрагмент, а указанная вторая молекула представляет собой химерное или моноклональное антитело 225 (с225) или его биологически активный фрагмент.
В предпочтительном варианте осуществления изобретения рецептор ErbB представляет собой рецептор EGF (EGFR) и антитела, направленные на различные эпитопы на этот рецептора, представляют собой антитела к EGFR.
Таким образом, изобретение относится, в частности, к:
- фармацевтической композиции, содержащей первую и вторую молекулу антитела или ее часть, обладающую способностью связываться с различными эпитопами, расположенными на молекулах рецептора ErbB одинакового или различного типа, где указанная первая молекула антитела или ее часть содержит участки связывания, которые связываются с первым специфическим эпитопом на молекуле рецептора типа ErbB1, и указанная вторая молекула антитела содержит участки связывания, которые связываются с вторым специфическим эпитопом на молекуле рецептора ErbB1 такого же типа;
- фармацевтической композиции, в которой по крайней мере указанный первый или второй эпитоп на молекуле рецептора типа ErbB1 расположен в пределах связывающего домена рецептора ErbB1;
- фармацевтической композиции, в которой указанный первый и второй эпитоп на молекуле рецептора типа ErbB1 расположены в пределах связывающего домена рецептора ErbB1;
- фармацевтической композиции, в которой указанный связывающий домен рецептора представляет собой связывающий домен естественного лиганда указанного типа молекулы рецептора ErbB1;
- фармацевтической композиции, в которой первое и второе антитело или их фрагмент связываются с различными эпитопами в пределах связывающего домена естественного(ых) лиганда(ов) указанного типа молекулы рецептора ErbB1;
- фармацевтической композиции, где блокирование и/или ингибирование рецептора ErbB, и индукция понижающей регуляции специфического пути передачи сигнала, опосредуемого рецептором ErbB, усиливается по сравнению с композицией, содержащей единичную молекулу антитела, которая связывается с указанным первым или вторым эпитопом только на указанном типе молекулы рецептора ErbB1;
- фармацевтической композиции, где индукция поперечного связывания и/или димеризации молекул рецептора ErbB, обладающих одинаковой или различной специфичностью, усиливается по сравнению с композицией, содержащей единичную молекулу антитела, которая связывается с указанным первым или вторым эпитопом только на указанном типе молекулы рецептора ErbB1;
- фармацевтической композиции, в которой указанные молекулы рецептора ErbB вовлечены в поперечное связывание и/или димеризацию и выбраны из ErbB1 и ErbB2 (Her-2);
- фармацевтической композиции, в которой указанные первое и/или второе антитела представляют собой моноспецифическое антитело;
- фармацевтической композиции, в которой первое антитело представляет собой мышиное, химерное или гуманизированное MAb 425;
- фармацевтической композиции, в которой второе антитело представляет собой мышиное, химерное или гуманизированное MAb 225;
- фармацевтической композиции, в которой указанное первое антитело представляет собой гуманизированное MAb 425 (h425) и указанное второе антитело представляет собой химерное MAb 225 (с225);
- фармацевтической композиции в соответствии с п.1-12, которая дополнительно содержит цитотоксическое средство;
- фармацевтической композиции, в которой указанное цитотоксическое средство представляет собой химиотерапевтическое средство;
- фармацевтической композиции, в которой указанное химиотерапевтическое средство выбрано из любого соединения из группы, включающей: цисплатин, доксорубицин, гемцитабин, доцетаксел, паклитаксел, блеомицин;
- фармацевтической композиции, в которой указанное цитотоксическое средство представляет собой ингибитор рецептора ErbB, ингибитор рецептора VEGF, ингибитор тирозинкиназы, ингибитор протеинкиназы А, антиангиогенное средство или цитокин;
- фармацевтической композиции, в которой указанная первая и/или указанная вторая молекула антитела представляет собой иммуноконъюгат, в котором антитело слито своей С-концевой частью с биологически эффективным пептидом, полипептидом или белком необязательно при помощи линкерного пептида;
- фармацевтической композиции, в которой белок представляет собой цитокин;
- фармацевтическому набору, содержащему (i) первую упаковку, которая содержит первую молекулу антитела или ее часть, содержащую участки связывания, которые связываются с первым специфическим эпитопом, расположенным на молекуле рецептора ErbB1, и (ii) вторую упаковку, которая содержит вторую молекулу антитела, содержащую участки связывания, которые связываются с вторым отличным эпитопом на молекуле рецептора ErbB1 такого же типа;
- фармацевтическому набору, в котором по крайней мере указанный первый или второй эпитоп на рецепторе ErbB1 расположен в пределах связывающего домена рецептора ErbB1;
- фармацевтическому набору, в котором указанный первый и второй эпитоп на рецепторе ErbB1 расположены в пределах связывающего домена рецептора ErbB1;
- фармацевтическому набору, в котором по крайней мере одна из указанных молекул связывается с эпитопом в пределах связывающего домена рецептора ErbB1, с которым связывается естественный лиганд рецептора;
- фармацевтическому набору, в котором указанная первая молекула антитела представляет собой мышиное, химерное или гуманизированное моноклональное антитело 425, и указанная вторая молекула представляет собой мышиное, химерное или гуманизированное моноклональное антитело 225;
- фармацевтическому набору, который содержит первую упаковку, содержащую гуманизированное MAb 425 (h425) и вторую упаковку, содержащую химерное MAb 225 (с225);
- фармацевтическому набору в соответствии с любым из п.19-24, который дополнительно содержит третью упаковку, содержащую цитотоксическое средство;
- фармацевтическому набору, в котором указанное цитотоксическое средство представляет собой химиотерапевтическое средство;
- фармацевтическому набору, в котором указанное химиотерапевтическое средство выбрано из любого соединения из группы, включающей: цисплатин, доксорубицин, гемцитабин, доцетаксел, паклитаксел, блеомицин;
- фармацевтическому набору, в котором указанное цитотоксическое средство представляет собой ингибитор рецептора ErbB, ингибитор рецептора VEGF, ингибитор тирозинкиназы, ингибитор протеинкиназы А, антиангиогенное средство, или цитокин;
- применению фармацевтической композиции или фармацевтического набора, как определено выше и в любом из пунктов формулы, для приготовления лекарственного средства для лечения опухолей, метастаз опухолей и заболеваний, связанных с опухолями, которые сверхэкспрессируют рецепторы ErbB, в особенности рецепторы ErbB1.
Подробное описание изобретения
Изобретение основывается на наблюдении, что две или больше различных молекул, предпочтительно моноклональных антител (MAb) со специфичностями к различным иммуногенным структурам могут связываться с их этитопами в одно и то же время и без препятствия, которые могут быть расположены на одном и том же ErbB, предпочтительно ErbB1, домене рецептора, например в пределах лиганд-связывающего домена ErbB (ErbB1). Применение двух или больше химических или биологических молекул, обладающих описанными свойствами, такие как моноспецифические MAb или комбинации антител, направленных на одинаковые или различные рецепторы, может значительно улучшать терапевтическую эффективность по сравнению с эффективностью, наблюдаемой при лечении только одним моноспецифическим антителом.
- Два или больше MAb независимо связываются с различными эпитопами на их мишенях-рецепторах (например, EGFR).
- Благодаря независимому связыванию с различными эпитопами рецептора количество связанного антитела на рецептор и, следовательно, на клетку может повышаться для одной той же дозы антитела или концентрации. В оптимальных условиях с насыщающими концентрациями или дозами для каждого антитела число связанных молекул антитела на рецептор и клетку теоретически может удваиваться в случае применения двух антител к различным эпитопам. При каждом дополнительном применяемом антителе можно добиться линейного повышения связанного белкового антитела на рецептор и на клетку.
- Клетки с плотностью антител ниже пороговой величины для антитело-зависимых иммунных эффекторных действий, которые не чувствительны к лечению антителами в обычных условиях, обнаруживают повышенное количество антител на их поверхности после лечения двумя или большим количеством антител, направленных к различным эпитопам одного и того же рецептора и, следовательно, потенциально становятся чувствительными к ADCC и CDC.
- По сравнению с эффективностью блоки