Комплексная лекарственная форма с контролируемым высвобождением для перорального введения лекарственного средства против диабета и способ ее получения
Иллюстрации
Показать всеКомбинированная лекарственная форма с контролируемым высвобождением для перорального введения, содержащая а) часть с контролируемым высвобождением, содержащую метформин или его фармацевтически приемлемую соль в качестве активного ингредиента, и комбинацию полиэтиленоксида и природной смолы в качестве носителя для контролируемого высвобождения и b) часть с быстрым высвобождением, содержащую антидиабетическое лекарственное средство на основе сульфонилмочевины в качестве активного ингредиента, нанесенную на часть с контролируемым высвобождением, предназначена для лечения диабета, поскольку она способна поддерживать эффективную концентрацию лекарственных средств в крови на постоянном уровне. 2 н. и 17 з.п. ф-лы, 18 табл., 9 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к пероральной комбинированной лекарственной форме с контролируемым высвобождением двух лекарственных средств против диабета и способу ее получения.
Уровень техники
Метформин представляет собой пероральное средство для лечения, разработанное для того, чтобы способствовать регуляции повышенного уровня сахара в крови пациентов, активируя рецептор глюкозы в печени. Он вызывает потерю веса, уменьшает уровень триглицеридов и липопротеинов низкой плотности (LDL) в крови и увеличивает уровень липопротеинов высокой плотности (HDL) у страдающего диабетом пациента. Следовательно, его можно использовать в качестве основного лекарственного средства при инсулиннезависимом сахарном диабете (NIDDM).
Метформин в таблетированной форме и его гидрохлорид в настоящее время продается как Глюкофаж® (компания Bristol-Myers Squibb) и его ежедневную дозировку определяют индивидуально как на основе эффективности, так и на основе переносимости, не превышая максимальную рекомендованную дозу 2,550 мг в день. Побочными эффектами метформина являются потеря аппетита, вздутие живота, тошнота и диарея, в то время как кожная сыпь или крапивница могут возникнуть в редких случаях. Таких побочных эффектов можно избежать, уменьшая минимальную и/или поддерживающую дозу или вводя лекарственную форму с контролируемым высвобождением.
Глимепирид, одно из производных сульфонилмочевины для перорального применения, использовали в качестве лекарственного средства у пациентов с инсулиннезависимым сахарным диабетом, у которых не наступало улучшений при диетотерапии, упражнениях с поднятием груза и при потере веса, и его таблетированная форма продается как амарил® (Aventis Pharmaceuticals Inc.).
Лекарственные средства на основе сульфонилмочевины, включающие в себя глимепирид, как известно, взаимодействуют с β-клетками для того, чтобы увеличилась секреция инсулина и проявились долговременные эффекты уменьшения уровня глюкозы в крови.
В патенте США №6031004 описано лекарственное средство, содержащее производное сульфонилмочевины, такое как глибурид, глипизид и глимепирид, таблетированное с новой солью метформина, для лечения инсулиннезависимого сахарного диабета; в WO 00/03742 описан способ промышленного производства комбинированной лекарственной формы, охватывающий (а) образование гранул посредством влажной грануляции смеси метформина и глибенкламида, (b) смешивание гранул со вспомогательным средством для таблетирования и растворителем, (с) таблетирование смеси и (d) покрытые полученных таблеток гидрофильным целлюлозным полимером. Однако для данной комбинированной лекарственной формы обнаружили проблему неудовлетворительного характера высвобождения.
В патенте США №6682759 описан способ промышленного производства комбинированной лекарственной формы, охватывающий (a) таблетирование гидрохлорида метформина с контролируемым высвобождением, используя гидроксипропилметилцеллюлозу и полиэтиленоксид, и (b) распыление на полученную таблетку глимепирида, диспергированного в водной гидроксипропилметилцеллюлозе при отсутствии стабилизатора. Однако данная комбинированная лекарственная форма имеет проблему уменьшения эффективных концентраций лекарственных средств из-за образования производных лекарственных средств; дициандиамидное производное метформина и сульфаниламидное производное глимепирида.
Следовательно, существовала постоянная потребность в разработке улучшенной лекарственной формы с контролируемым высвобождением для перорального введения комбинации средств для лечения диабета, который способен поддерживать эффективность лекарственного средства посредством равномерного высвобождения за заданный период.
Раскрытие изобретения
Соответственно, задачей настоящего изобретения является создание комбинированной лекарственной формы с контролируемым высвобождением для перорального введения метформина и антидиабетического лекарственного средства на основе сульфонилмочевины, которую можно легко изготовить и которая способна поддерживать равномерное высвобождение лекарственных средств в течение длительного периода времени, и разработка способа ее получения.
Согласно одному из аспектов настоящего изобретения предлагается комбинированная лекарственная форма с контролируемым высвобождением для перорального введения, содержащая a) часть с контролируемым высвобождением, содержащую метформин или его фармацевтически приемлемую соль в качестве активного ингредиента, и носитель для контролируемого высвобождения, состоящий из полиэтиленоксида и натуральной смолы и b) часть с быстрым высвобождением, нанесенную на часть с контролируемым высвобождением, содержащую антидиабетическое лекарственное средство на основе сульфонилмочевины в качестве активного ингредиента.
Краткое описание чертежей
Вышеупомянутые и другие задачи и признаки настоящего изобретения станут очевидны из следующего ниже описания изобретения, принятого во внимание совместно со следующими ниже сопровождающими чертежами, на которых соответственно показаны:
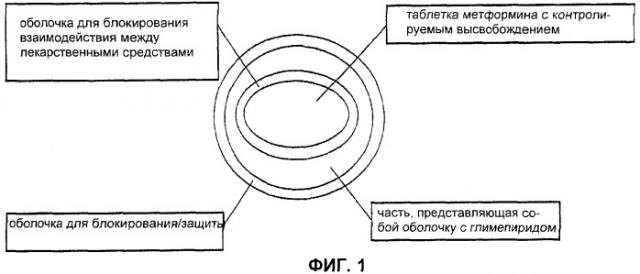
Фиг.1 - схематическая диаграмма ингредиентов комбинированной лекарственной формы с контролируемым высвобождением по изобретению;
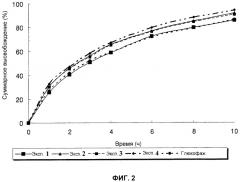
Фиг.2 - профили высвобождения лекарственных средств in vitro для таблеток с контролируемым высвобождением, полученных в примерах с 1 по 4 настоящего изобретения, и содержащего метформин лекарственной формы для сравнения (таблетка с контролируемым высвобождением Glucophage® Глюкофаж® XR, компания Bristol-Myers Squibb) соответственно;
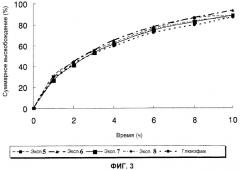
Фиг.3 - профили высвобождения лекарственных средств in vitro для таблеток с контролируемым высвобождением, полученных в примерах с 5 по 8 настоящего изобретения, и лекарственной формы для сравнения (таблетка с контролируемым высвобождением Глюкофаж® XR) соответственно;
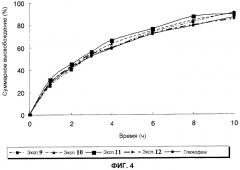
Фиг.4 - профили высвобождения лекарственных средств in vitro для таблеток с контролируемым высвобождением, полученных в примерах с 9 по 12 настоящего изобретения, и лекарственной формы для сравнения (таблетка с контролируемым высвобождением Глюкофаж® XR) соответственно;
Фиг.5 - профили высвобождения лекарственных средств in vitro для таблеток с контролируемым высвобождением, полученных в примере 12 настоящего изобретения, комбинированной лекарственной формы с контролируемым высвобождением, полученной в примере 13, и лекарственной формы для сравнения (таблетка с контролируемым высвобождением Глюкофаж® XR, компания Bristol-Myers Squibb) соответственно;
Фиг.6 - профили высвобождения лекарственных средств in vitro для комбинированной лекарственной формы с контролируемым высвобождением, полученной в примере 13 настоящего изобретения, и содержащего глимепирид лекарственной формы для сравнения (таблетка амарил®, Aventis Pharmaceuticals Inc.) соответственно;
Фиг.7 - профиль высвобождения лекарственного средства in vitro для таблетки с контролируемым высвобождением, полученной в примере 12 настоящего изобретения, как функция скорости вращения порта высвобождения;
Фиг.8 - профиль высвобождения in vitro сравнительной лекарственной формы (таблетка с контролируемым высвобождением Глюкофаж® XR) как функция скорости вращения порта высвобождения; и
Фиг.9 - иллюстрирует стабильность глимепирида как функцию от величины pH раствора.
Подробное описание изобретения
Комбинированная лекарственная форма с контролируемым высвобождением по изобретению для перорального введения содержит a) часть с контролируемым высвобождением, содержащую метформин или его фармацевтически приемлемую соль в качестве активного ингредиента, и носитель для контролируемого высвобождения, состоящий из полиэтиленоксида и натуральной смолы, и b) часть с быстрым высвобождением, нанесенную на часть с контролируемым высвобождением, содержащую антидиабетическое лекарственное средство на основе сульфонилмочевины в качестве активного ингредиента.
Каждый ингредиент лекарственной формы по изобретению подробно описан ниже.
1. Часть с контролируемым высвобождением
Часть с контролируемым высвобождением лекарственной формы по настоящему изобретению содержит активный ингредиент, носитель для контролируемого высвобождения, фармацевтически приемлемую добавку и контролирующее высвобождение средство. Количество части с контролируемым высвобождением может находиться в диапазоне от 85 до 99,5% мас. в пересчете на общую массу лекарственной формы.
(1) Активный ингредиент для контролируемого высвобождения
Активный ингредиент части с контролируемым высвобождением представляет собой метформин, который используют при инсулиннезависимом сахарном диабете, или его фармацевтически приемлемую соль, например хлорид, сукцинат или фумарат.
(2) Носитель для контролируемого высвобождения
Носитель для контролируемого высвобождения представляет собой комбинированную смесь полиэтиленоксида и натуральной смолы. Средняя молекулярная масса полиэтиленоксида может составлять от 100000 до 7000000 или можно также использовать смесь двух или более полиэтиленоксидов с различной молекулярной массой. Примерами натуральной смолы являются ксантановая смола, смола белой акации, гуаровая смола и их смесь.
Согласно настоящему изобретению массовое соотношение активного ингредиента и носителя для контролируемого высвобождения может находиться в диапазоне от 1:0,01 до 1:1 и, предпочтительно, от 1:0,1 до 1:0,95. Массовое соотношение полиэтиленоксид:натуральная смола может находиться в диапазоне от 1:0,1 до 1:10, предпочтительно, от 1:0,5 до 1:5.
(3) Фармацевтически приемлемая добавка
Часть с контролируемым высвобождением может дополнительно содержать фармацевтически приемлемые добавки, и типичные добавки включают в себя носитель, приемлемый для пероральной твердой лекарственной формы, такой как нейтрализованные носители-растворители, связующие вещества, смазывающие вещества или их смесь.
Нейтрализованные носители-растворители могут представлять собой лактозу, декстрин, крахмал, микрокристаллическую целлюлозу, одноосновной фосфат калия, карбонат кальция, сахарид или диоксид кремния и тому подобное.
Связующие вещества по настоящему изобретению могут представлять собой поливинилпирролидон или желатин.
Смазывающие вещества по настоящему изобретению могут представлять собой цинковую или магниевую соль стеариновой кислоты и тому подобное.
Дополнительно, можно также использовать любую общепринятую добавку, используемую в фармацевтической области для получения пероральной лекарственной формы.
Согласно настоящему изобретению массовое соотношение активный ингредиент для контролируемого высвобождения:каждая из фармацевтически приемлемых добавок может находиться в диапазоне от 1:0,0005 до 1:0,3, предпочтительно, от 1:0,001 до 1:0,1.
(4) Контролирующее высвобождение средство
Для того чтобы точно контролировать паттерн высвобождения активного ингредиента, селективное контролирующее высвобождение средство, такое как воск и смесь поливинилацетат/поливинилпирролидон, которое способствует проявлению носителем для контролируемого высвобождения его гелеобразующего свойства in vivo, можно дополнительно использовать в качестве необязательного ингредиента в лекарственной форме по настоящему изобретению.
Массовое соотношение активный ингредиент:селективное контролирующее высвобождение средство предпочтительно находится в диапазоне от 1:0 до 1:0,9, в то время как количество указанного средства предпочтительно находится в диапазоне от 0,001 до 0,1% мас. в пересчете на общую массу лекарственной формы.
2. Часть внутренней оболочки (Внутренний разделительный слой)
Для того чтобы предотвратить возможные обоюдные взаимодействия между активными ингредиентами части с контролируемым высвобождением и части с быстрым высвобождением так, чтобы скорость быстрого высвобождения активного ингредиента из части с быстрым высвобождением могла бы оставаться неизменной, комбинированная лекарственная форма с контролируемым высвобождением по изобретению может дополнительно содержать часть, представляющую собой внутреннюю оболочку в качестве внутреннего разделительного слоя, нанесенную на поверхность части с контролируемым высвобождением. Часть, которая представляет собой внутреннюю оболочку, можно использовать в количестве, находящемся в диапазоне от 0,5 до 5% мас. в пересчете на общую массу лекарственной формы.
Типичные примеры пленкообразующих веществ (пленкообразующее средство и покровное вещество), используемых в части внутренней оболочки по настоящему изобретению, включают в себя гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, гидроксиэтилцеллюлозу, ацетофталат целлюлозы, этилцеллюлозу, метилцеллюлозу, полиметакрилат, полиэтиленгликоль, тальк, диоксид титана и их смесь. Дополнительно, любые общепринятые добавки, используемые в фармацевтической области для приготовления пероральных твердых лекарственных форм, можно также использовать.
3. Часть с быстрым высвобождением
В лекарственной форме по настоящему изобретению часть с быстрым высвобождением нанесена на поверхность части с контролируемым высвобождением или на поверхность части внутренней оболочки, если она присутствует. Часть с быстрым высвобождением может содержать активный ингредиент для быстрого высвобождения, стабилизирующее вещество и пленкообразующее вещество и ее можно использовать в количестве, находящемся в диапазоне от 0,5 до 15% мас. в пересчете на общую массу лекарственной формы.
(1) Активный ингредиент для быстрого высвобождения
Активный ингредиент части с быстрым высвобождением представляет собой антидиабетическое лекарственное средство на основе сульфонилмочевины, такое как глимепирид, глибурид, глипизид и гликлазид.
(2) Стабилизирующее вещество
Для того чтобы увеличить стабильность активного ингредиента, часть с быстрым высвобождением может дополнительно содержать стабилизирующее вещество. Типичные примеры стабилизирующего вещества включают в себя антиоксидант, такой как бутилгидроксианизол, бутилокситолуол и токоферол; неорганическое основание, такое как гидроксид натрия и аммиак; органическое основание, такое как меглюмин (N-метилглюкамин), этаноламин и пропаноламин; основную аминокислоту, такую как аргинин, лизин и гистидин, и тому подобное. В дополнение, любые общепринятые добавки, используемые в фармацевтической области для приготовления пероральной твердой лекарственной формы, можно также использовать. Согласно настоящему изобретению массовое соотношение активный ингредиент для быстрого высвобождения:стабилизирующее вещество может находиться в диапазоне от 1:0,01 до 1:1, предпочтительно, от 1:0,1 до 1:0,5.
(3) Пленкообразующее вещество
Пленкообразующее вещество, используемое для части внутренней оболочки, можно также использовать в качестве пленкообразующего вещества части с быстрым высвобождением. Массовое соотношение активный ингредиент для быстрого высвобождения:пленкообразующее вещество может находиться в диапазоне от 1:5 до 1:50, предпочтительно, от 1:10 до 1:30.
4. Часть наружной оболочки
Для того чтобы защитить комбинированную лекарственную форму настоящего изобретения от внешних воздействий, лекарственная форма по изобретению может дополнительно содержать слой пленочного покрытия в качестве части наружной оболочки.
Пленкообразующее вещество (пленкообразующее средство или покровное вещество), используемое в части наружной оболочки, может быть таким же, как и средство, используемое в части внутренней оболочки. Количество части наружной оболочки может находиться в диапазоне от 0,5 до 5% в пересчете на общую массу композиции.
Комбинированную лекарственную форму с контролируемым высвобождением для перорального введения можно получить способом, предусматривающим стадии:
1) смешивания метформина или его фармацевтически приемлемой соли с первым гидрофильным носителем для контролируемого высвобождения и гранулирования полученной смеси;
2) смешивания гранул, полученных на стадии 1, со вторым гидрофильным носителем для контролируемого высвобождения, который идентичен или отличается от первого гидрофильного носителя;
3) добавления фармацевтически приемлемой добавки к смеси, полученной на стадии 2, чтобы получить часть с контролируемым высвобождением;
4) нанесения оболочки на часть с контролируемым высвобождением, полученной на стадии 3, для того, чтобы предотвратить возможные взаимодействия между активными ингредиентами конечной лекарственной формы с контролируемым высвобождением; и
5) нанесения антидиабетического лекарственного средства на основе сульфонилмочевины на покрытый оболочкой препарат с контролируемым высвобождением, полученный на стадии 4.
Способ может дополнительно охватывать стадию нанесения части наружной оболочки.
Следующие ниже примеры предназначены для того, чтобы дополнительно иллюстрировать настоящее изобретение, не ограничивая его объем.
Примеры
I. Получение таблетки метформина с контролируемым высвобождением
Пример 1
Каждый из 500 г метформина-HCl (Hwail Pharm. Co., Ltd), 80 г полиэтиленоксида (Polyox® WSR Agglutinant, молекулярная масса 5000000, Union Carbide) и 100 г ксантановой смолы (Cpkelco) фильтровали через ячейку сита № 30 и смешивали вместе. Смесь помещали в высокоскоростную мешалку (SPG-2, Fujipaudal) и связующий раствор, приготовленный из 20 г поливинилпирролидона (Kollidon® K-90, BASF), растворенного в дистиллированной воде, добавляли к смеси, после чего следовало перемешивание при скорости 100-1000 об/мин в течение 3 мин для получения гранул. Гранулы высушивали и фильтровали через ячейку сита № 30. После этого 200 г смеси поливинилацетата/поливинилпирролидона (Kollidon SR, BASF), 80 г воска (Compritol® 888ATO, Gattefosse) и 10 г диоксида кремния добавляли к гранулам и перемешивали в течение 30 мин. В заключение 10 г порошка стеарата магния добавляли к смеси, перемешивали в течение 3 мин и прессовали, чтобы получить таблетку, содержащую композицию из таблицы 1.
| Таблица 1 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 8 | |
| Ксантановая смола | 10 | |
| Поливинилпирролидон | 2 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Воск | 8 | |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
Примеры со 2 по 5
Таблетки, содержащие композиции, перечисленные в таблицах со 2 по 5, получали, повторяя процедуру из примера 1, за исключением использования ксантановой смолы в части смеси или использования полиэтиленоксидов, обладающих различными молекулярными массами. В дополнение, связующее вещество поливинилпирролидон также исключали из образующей гранулы части в данных примерах.
| Таблица 2Композиция таблетки из примера 2 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 5 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Воск | 13 | |
| Ксантановая смола | 10 | |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
| Таблица 3Композиция таблетки из примера 3 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox® N10, М.W 100000) | 5 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Воск | 13 | |
| Ксантановая смола | 10 | |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
| Таблица 4Композиция таблетки из примера 4 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox® 1105, М.W 900000) | 5 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Воск | 13 | |
| Ксантановая смола | 10 | |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
| Таблица 5Композиция таблетки из примера 5 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox® WSR, М.W 5000000) | 10 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Воск | 8 | |
| Ксантановая смола | 10 | |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
Пример 6
Таблетку, содержащую композицию, показанную в таблице 6, получали, повторяя процедуру из примера 1 за исключением использования связующего вещества поливинилпирролидон (Kollidon® K-90, BASF) во время стадии образования гранул.
| Таблица 6 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox® WSR, М.W 5000000) | 10 | |
| Ксантановая смола | 10 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Воск | 8 | |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
Пример 7
Таблетку, содержащую композицию, показанную в таблице 7, получали, повторяя процедуру из примера 1, за исключением использования изопропилового спирта вместо дистиллированной воды во время стадии образования гранул.
| Таблица 7 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 8 | |
| Ксантановая смола | 10 | |
| Поливинилпирролидон | 2 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Воск | 8 | |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
Примеры с 8 по 10
Таблетки, содержащие композиции, показанные в таблицах с 8 по 10, получали, повторяя процедуру из примера 1, за исключением использования смеси дистиллированная вода/изопропиловый спирт (1:1 (об/об)) вместо дистиллированной воды во время стадии образования гранул.
| Таблица 8Композиция таблетки из примера 8 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 8 | |
| Ксантановая смола | 10 | |
| Поливинилпирролидон | 2 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 28 |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
| Таблица 9Композиция таблетки из примера 9 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 16 | |
| Ксантановая смола | 10 | |
| Поливинилпирролидон | 2 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
| Таблица 10Композиция таблетки из примера 10 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 8 | |
| Ксантановая смола | 18 | |
| Поливинилпирролидон | 2 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
Пример 11
Таблетку, содержащую композицию, показанную в таблице 11, получали, повторяя процедуру из примера 1, за исключением использования смеси дистиллированная вода/изопропиловый спирт (1:1 (об/об)) вместо дистиллированной воды во время стадии образования гранул, а также использования ксантановой смолы (Cpkelco) и смолы плодоворожкового дерева (Sigma) в части смеси.
| Таблица 11 | ||
| Ингредиенты | Содержание(% мас.) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 10 | |
| Поливинилпирролидон | 2 | |
| Часть смеси | Смесь поливинилацетат/поливинилпирролидон | 20 |
| Ксантановая смола | 10 | |
| Смола плодоворожкового дерева | 6 | |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
Пример 12
Таблетку, содержащую композицию, показанную в таблице 12, получали, повторяя процедуру из примера 1, за исключением использования смеси дистиллированная вода/изопропиловый спирт (1:1 (об/об)) вместо дистиллированной воды во время стадии образования гранул, а также использования ксантановой смолы (Cpkelco) и смолы плодоворожкового дерева (Sigma) без использования смеси поливинилацетат/поливинилпирролидон (Kollidon SR, BASF) в части смеси.
| Таблица 12 | ||
| Ингредиенты | Содержание(% мас) | |
| Часть, образующаягранулы | Метформин-HCl | 50 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 10 | |
| Поливинилпирролидон | 2 | |
| Часть смеси | Ксантановая смола | 21 |
| Смола плодоворожкового дерева | 15 | |
| Диоксид кремния | 1 | |
| Стеарат магния | 1 | |
| Все ингредиенты | 100 |
II. Получение комбинированной лекарственной формы метформин/глимепирид
Пример 13
Таблетку метформина с контролируемым высвобождением, полученную в примере 12, покрывали оболочкой согласно следующим ниже стадиям.
(1) 20 г гидроксипропилметилцеллюлозы (HPMC2910, Shin-Etsu) растворяли в солянокислой смеси этанол/метилен (объемная доля 7/3), к ней добавляли 2,7 г полиэтиленгликоля 6000 (Sanyo chemical In.) и взбалтывали, чтобы получить гомогенный раствор. Гомогенный раствор фильтровали через ячейку сита № 200 и распыляли на таблетку метформина с контролируемым высвобождением, полученную в примере 12 для того, чтобы получить часть с контролируемым высвобождением, содержащую таблетку метформина с контролируемым высвобождением.
(2) 2,0 г глимепирида (Cipla) растворяли в солянокислой смеси этанол/метилен (объемная доля 7/3), к ней добавляли 30 г гидроксипропилметилцеллюлозы (HPMC2910, Shin-Etsu) и взбалтывали до растворения. 0,5 г меглюмина (N-метилглюкамин, Sigma) и 4,0 г полиэтиленгликоля 6000 (Sanyo chemical In.) добавляли к смеси и полученный гомогенный раствор фильтровали через ячейку сита № 200. После этого отфильтрованный раствор распыляли на часть с контролируемым высвобождением, содержащую метформин для того, чтобы получить на ней пленку, содержащую глимепирид.
(3) 20 г гидроксипропилметилцеллюлозы (HPMC2910, Shin-Etsu) растворяли в солянокислой смеси этанол/метилен (объемная доля 7/3), к ней добавляли 2,4 г диоксида титана (Kronos International). Затем смесь гранулировали в гомогенизирующем измельчителе, к полученной смеси добавляли 2,7 г полиэтиленгликоля 6000 (Sanyo chemical In.), чтобы получить гомогенный раствор, который фильтровали через ячейку сита № 200. Затем отфильтрованный раствор распыляли на таблетку метформина с контролируемым высвобождением, покрытую пленкой с глимепиридом, чтобы получить комбинированную лекарственную форму, содержащую композицию, показанную в таблице 13.
| Таблица 13 | |||
| Ингредиенты | Содержание(% мас.) | ||
| Часть с контролируемым высвобождением | Часть, образующаягранулы | Метформин-HCl | 46,11 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 9,22 | ||
| Поливинилпирролидон | 1,84 | ||
| Часть смеси | Ксантановая смола | 19,37 | |
| Смола плодоворожкового дерева | 13,83 | ||
| Диоксид кремния | 0,92 | ||
| Стеарат магния | 0,92 | ||
| Часть внутренней оболочки | Гидроксипропилметилцеллюлоза | 1,85 | |
| Полиэтиленгликоль 6000 | 0,25 | ||
| Часть с быстрым высвобождением | Глимепирид | 0,18 | |
| Гидроксипропилметилцеллюлоза | 2,77 | ||
| Полиэтиленгликоль 6000 | 0,37 | ||
| Меглюмин | 0,05 | ||
| Часть оболочки | Гидроксипропилметилцеллюлоза | 1,85 | |
| Полиэтиленгликоль 6000 | 0,25 | ||
| Диоксид титана | 0,22 | ||
| Всего в таблетках | 100 |
Пример 14
Комбинированную лекарственную форму, содержащую композицию, показанную в таблице 14, получали, повторяя процедуру из примера 13, за исключением использования 0,5 г бутилгидроксианизола вместо меглюмина в качестве стабилизирующего вещества части с быстрым высвобождением.
| Таблица 14 | |||
| Ингредиенты | Содержание(% мас.) | ||
| Часть с контролируемым высвобождением | Часть, образующаягранулы | Метформин-HCl | 46,11 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 9,22 | ||
| Поливинилпирролидон | 1,84 | ||
| Часть смеси | Ксантановая смола | 19,37 | |
| Смола плодоворожкового дерева | 13,83 | ||
| Диоксид кремния | 0,92 | ||
| Стеарат магния | 0,92 | ||
| Часть внутренней оболочки | Гидроксипропилметилцеллюлоза | 1,85 | |
| Полиэтиленгликоль 6000 | 0,25 | ||
| Часть с быстрым высвобождением | Глимепирид | 0,18 | |
| Гидроксипропилметилцеллюлоза | 2,77 | ||
| Полиэтиленгликоль 6000 | 0,37 | ||
| Бутилгидроксианизол | 0,05 | ||
| Часть оболочки | Гидроксипропилметилцеллюлоза | 1,85 | |
| Полиэтиленгликоль 6000 | 0,25 | ||
| Диоксид титана | 0,22 | ||
| Всего в таблетках | 100 |
Пример 15
Комбинированную лекарственную форму, содержащую композицию, показанную в таблице 15, получали, повторяя процедуру из примера 13, за исключением использования 0,5 г токоферола (Roche, Швейцария) вместо меглюмина в качестве стабилизирующего вещества части с быстрым высвобождением.
| Таблица 15 | |||
| Ингредиенты | Содержание(% мас.) | ||
| Часть с контролируемым высвобождением | Часть, образующаягранулы | Метформин-HCl | 46,11 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 9,22 | ||
| Поливинилпирролидон | 1,84 | ||
| Часть смеси | Ксантановая смола | 19,37 | |
| Смола плодоворожкового дерева | 13,83 | ||
| Диоксид кремния | 0,92 | ||
| Стеарат магния | 0,92 | ||
| Часть внутренней оболочки | Гидроксипропилметилцеллюлоза | 1,85 | |
| Полиэтиленгликоль 6000 | 0,25 | ||
| Часть с быстрым высвобождением | Глимепирид | 0,18 | |
| Гидроксипропилметилцеллюлоза | 2,77 | ||
| Полиэтиленгликоль 6000 | 0,37 | ||
| Токоферол | 0,05 | ||
| Часть оболочки | Гидроксипропилметилцеллюлоза | 1,85 | |
| Полиэтиленгликоль 6000 | 0,25 | ||
| Диоксид титана | 0,22 | ||
| Всего в таблетках | 100 |
Сравнительный пример 1
Комбинированную лекарственную форму, содержащую композицию, показанную в таблице 16, получали из таблетки метформина с контролируемым высвобождением, полученной в примере 12, повторяя процедуру нанесения пленки, приведенную в примере 13, за исключением того, что не использовали стабилизирующее вещество меглюмин.
| Таблица 16 | |||
| Ингредиенты | Содержание(% мас.) | ||
| Часть с контролируемым высвобождением | Часть, образующаягранулы | Метформин-HCl | 46,13 |
| Полиэтиленоксид(Polyox®WSR, М.W 5000000) | 9,23 | ||
| Поливинилпирролидон | 1,84 | ||
| Часть смеси | Ксантановая смола | 19,38 | |
| Смола плодоворожкового дерева | 13,84 | ||
| Диоксид кремния | 0,92 | ||
| Стеарат магния | 0,92 | ||
| Часть внутренней оболочки | Гидроксипропилметилцеллюлоза | 1,85 | |
| Полиэтиленгликоль 6000 | 0,25 | ||
| Часть с быстрым высвобождением | Глимепирид | 0,18 | |
| Гидроксипропилметилцеллюлоза | 2,77 | ||
| Полиэтиленгликоль 6000 | 0,37 | ||
| Часть оболочки | Гидроксипропилметилцеллюлоза | 1,85 | |
| Полиэтиленгликоль 6000 | 0,25 | ||
| Диоксид титана | 0,22 | ||
| Всего в таблетках | 100 |
Тестовый пример 1: Испытание на высвобождение in vitro 1
Для того чтобы исследовать воздействие природной смолы и полиэтиленоксида в качестве носителей для контролируемого высвобождения на скорость высвобождения лекарственного средства, таблетки, полученные в примерах с 1 по 12, совместно с таблеткой с контролируемым высвобождением Глюкофаж® XR (компания Bristol-Myers Squibb) в качестве сравнительной лекарственной формы подвергали испытаниям на высвобождение in vitro в соответствии со способом испытания на высвобождение, описанным в фармакопее Кореи (способ с лопастной мешалкой). Паттерн высвобождения метформина-HCl из каждой из таблеток измеряли при следующих ниже условиях.
- Устройство для испытания на высвобождение: Erweka DT 80 (Erweka, Германия).
- Раствор высвобождения: 2 раствор для испытания на распадаемость, описанного в фармакопее Кореи (искусственный желудочный сок).
- Температура раствора высвобождения: 37±0,5°C.
- Количество раствора высвобождения: 900 мл.
- Скорость вращения: 50 об/мин.
- Продолжительность измерения: Аликвоты раствора высвобождения собирали через 1, 2, 3, 4, 6, 8 и 10 ч, фильтровали через мембрану 0,45 мкм и использовали в качестве исследуемых образцов. После каждого измерения раствора высвобождения систему испытания на высвобождение повторно заполняли равным количеством свежеприготовленного раствора высвобождения.
- Способ анализа: поглощение раствора образцов и стандартного раствора измеряли при 233 нм, используя дистиллированную воду в качестве сравнения для того, чтобы вычислить соответствующее соотношение высвобождения.
- Вычисление высвобожденного количества: Суммарное высвобожденное количество.
Как можно увидеть на фиг. со 2 по 4, скорость высвобождения становится меньше, когда увеличивается количество полиэтиленоксида или природной смолы. В особенности таблетка из примера 12 высвобождает лекарственное средство непрерывно с паттерном высвобождения схожим с паттерном высвобождения сравнительной лекарственной формы.
Тестовый пример 2: Испытание на высвобождение in vitro 2
Для того чтобы исследовать, как нанесение пленки на таблетку с контролируемым высвобождением, полученную в примере 13, влияет на скорость высвобождения лекарственных средств, испытание на высвобождение in vitro проводили, повторяя способ по тестовому примеру 1 за исключением использования препарата с контролируемым высвобождением полученной в примере 12 комбинированной лекарственной формы, полученной в примере 13, и таблетки с контролируемым высвобождением Глюкофаж® XR в качестве сравнительной лекарственной формы.
Как можно увидеть на фиг.5, комбинированная лекарственная форма с контролируемым высвобождением из примера 13 демонстрирует непрерывный паттерн высвобождения лекарственного средства, схожий с паттерном высвобождения комбинированной лекарственной формы, полученной в примере 12, и сравнительной лекарственной формы.
Тестовый пример 3: Испытание на высвобождение in vitro 3
Для того чтобы исследовать, как нанесение глимепирида на комбинированную лекарственную форму с контролируемым высвобождение