Противосудорожное средство
Иллюстрации
Показать всеИзобретение относится к области органической химии и медицины и касается применения 3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола в качестве противосудорожного средства. Средство обладает высокой активностью, низкой токсичностью; отсутствием влияния на психолокомоторную активность, отсутствием потенцирования длительности действия снотворных препаратов. 6 табл.
Реферат
Изобретение относится к области медицины, а именно к новым лекарственным средствам, обладающим противосудорожным эффектом.
Задача, на решение которой направлено изобретение, заключается в поиске эффективного низкотоксичного лекарственного средства для предупреждения судорожных состояний различной этиологии, а также в расширении ассортимента противосудорожных средств.
Поставленная задача решается путем использования в качестве противосудорожного средства 3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола общей формулы 1, включая его пространственные изомеры, в том числе оптически активные формы.
Соединение 1 было впервые получено и описано в статье (Irina V.Il'ina, Konstantin Р.Volcho, Dina V.Korchagina, Vladimir A.Barkhash, Nariman F.Salakhutdinov. Helv. Chim. Acta, 2007, 90, №2, 353-368), никаких его фармакологических свойств на настоящий момент не описано.
В качестве единственной близкой структурной аналогии можно отметить (1R,2S,5R)-ментол формулы 2:
Для соединения 2 было обнаружено (А.С.Hall, C.M.Turcotte, B.A.Betts, Yeung, A.Wing-Yee, S.Abena, L.A.Burk. Eur. J. Pharmacol. 2004, 506, №1, 9-16), что оно in vitro проявляет свойства агониста ГАМК-ергической нейромедиаторной системы, однако не было проведено ни подтверждения наличия этих свойств in vivo, ни тестов на иных нейромедиаторных системах.
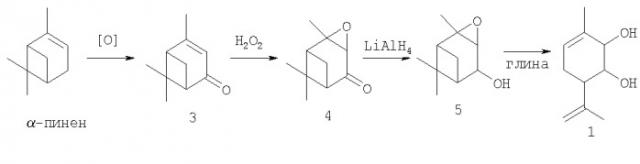
Соединение 1 может быть синтезировано в соответствии со схемой 1 исходя из монотерпена α-пинена, широко распространенного в отечественном растительном сырье, с использованием технологичных и доступных реагентов.
Схема 1.
Стадия окисления α-пинена в вербенон 3 может проводиться в соответствии с любой ранее предложенной методикой, например окислением кислородом в присутствии катализаторов (М.Lajunen, A.M.P.Koskinen. Tetrahedron Lett., 1994, 35, 4461-4464). Дальнейшие превращения вербенона 3 могут быть проведены, например, по разработанной ранее методике (I.V.Il'ina, K.P.Volcho, D.V.Korchagina, V.A.Barkhash, N.F.Salakhutdinov. Helv. Chim. Acta, 2007, 90, №2, 353-368).
Острая токсичность соединения 1 определялась на белых беспородных мышах массой 20-22 г при однократном внутрижелудочном введении по методу Кербера.
Показано, что соединение 1 является умеренотоксичным веществом: ЛД50 больше 2000 мг/кг, т.е. не менее чем в 3.5 и 4 раза ниже, чем среднесмертельная доза известных антиконвульсантов сибазона и карбамазепина, соответственно, при аналогичном способе введения.
Для исследования антиконвульсивной активности соединения 1 был использован набор стандартных тестов: «открытое поле», взаимодействие со снотворным препаратом хлоралгидратом (300 мг/кг внутрибрюшинно); судороги, вызванные стимулятором центрального генеза - коразолом (90 мг/кг внутрибрюшинно), Н-холиномиметиком - никотином (20 мг/кг, внутрибрюшинно), М-холиномиметиком - ареколином (15 мг/кг внутрибрюшинно), а также тест с предшественником дофамина L-Дофа (200 мг/ кг внутрибрюшинно), характеризующий воздействие на дофаминергическую (адренергическую) системы.
В тестах «открытое поле» и взаимодействие с L-Дофа эффект оценивали по изменению количества различных видов движений и общего эмоционального состояния животных. Регистрация двигательных актов производилась автоматически в установке «TRUSCAN» (COULBOURN INSTRUMENTS, США).
Изучаемое соединение вводили в дозах 0.5, 1.0 и 10 мг/кг однократно внутрижелудочно за час до тестирования. Эталон сравнения сибазон вводили в дозе 2.5 мг/кг.
Все полученные экспериментальные данные обрабатывали с использованием t-критерия Стьюдента.
Результаты исследования влияния соединения 1 на поведенческие реакции мышей в тесте «открытое поле» (таблицы 1 и 1а) свидетельствуют о том, что соединение 1 во всех дозах по сравнению с контролем не оказывает достоверного влияния на двигательную активность.
Взаимодействие соединения 1 со снотворным препаратом - хлоралгидратом изучали при однократном внутрижелудочном введении в дозе 10 мг/кг. О способности изменения длительности хлоралгидратового сна судили по времени утраты и восстановления рефлекса переворачивания мышей. Результаты, представленные в таблице 2, свидетельствуют о том, что соединение 1 в дозе 10 мг/кг достоверно (Р<0.05) по сравнению с эталоном увеличивало время наступления сна и уменьшало его продолжительность.
Противосудорожную активность также оценивали по проценту выживших животных после внутрибрюшинного введения коразола в токсической дозе 90 мг/кг. Исследуемое соединение вводили мышам внутрижелудочно в дозах 0.5, 1 и 10 мг/кг за час до воспроизведения судорог. Результаты представлены в таблице 3.
В данном тесте показано, что соединение 1 проявило дозозависимый эффект, так в дозах 0.5 и 10 мг/кг оно полностью блокировало развитие судорог и, соответственно, наступление летальных исходов, тем самым проявляя противосудорожное действие в отношении вводимой дозы конвульсанта. В дозе 1 мг/кг наблюдалось незначительное (на 12.5%) усиление токсического действия коразола.
При воспроизведении никотиновых судорог происходит возбуждение Н-холинорецепторов в продолговатом мозге. Соединение 1 вводили однократно внутрижелудочно в дозах 0.5, 1.0 и 10 мг/кг за час до воспроизведения судорог. Установлено, что соединение 1 полностью блокирует развитие никотиновых судорог в дозах 0.5 и 10 мг/кг, проявляя противосудорожный эффект. Результаты опытов представлены в таблице 4.
Противосудорожное действие агента 1 изучали также в тесте ареколинового тремора (влияние на мускариновые рецепторы). Соединение 1 вводилось однократно внутрижелудочно в дозах 0.5, 1.0 и 10 мг/кг. Критерием эффекта считалась продолжительность тремора. В этом тесте для агента 1 установлен прямой дозозависимый эффект. Однако достоверное уменьшение продолжительности ареколинового тремора, а следовательно, и проявление противосудорожного эффекта по сравнению с контролем обнаружено только при введении агента в дозе 10 мг/кг. Результаты опытов представлены в таблице 5.
В тесте с L-Дофа, характеризующем воздействие на дофаминергическую (адренергическую) систему, показано, что соединение 1 в дозе 10 мг/кг способствует усилению угнетающего действия предшественника дофамина, проявляющемуся в увеличении неподвижного момента, резком снижении количества двигательных актов, тем самым проявляя потенцирующее влияние на дофаминергическую систему. Результаты опытов представлены в таблице 6.
Таким образом, можно заключить, что соединение 1 проявляет противосудорожное действие в тестах «никотиновые» и «коразоловые» судороги, ареколиновый тремор, возможно, связанное с влиянием агента на нейромедиаторные (ГАМК-ергическую и Н, М-холинергическую) системы, вовлеченные в регуляцию судорожного ответа. Кроме того, изучаемый агент потенцирует действие предшественника дофамина, проявляя стимулирующее влияние на дофаминергическую систему.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез эпоксида вербенола 5.
К раствору 10.0 г вербенона 3 в 100 мл метанола прибавляют 20 мл 30%-ной Н2О2, смесь охлаждают до 12°С и добавляют 5 мл 6N водного раствора NaOH. Смесь перемешивают 2 ч при 12-15°С. К реакционной смеси прибавляют 100 мл воды, продукт экстрагируют диэтиловым эфиром (3х80 мл). Органический слой промывают водой, высушивают над MgSO4. Растворитель отгоняют. Получают 7.55 г (68%) эпоксида вербенона 4. 1Н-ЯМР: 0.96 (с, Me (9)); 1.37 (с, Me (8)); 1.44 (с, Me (10)); 2.01 (д, J (7an, 7c)=10, 1Han-C (7)); 2.20 (д.д.д, J=10, J (7c, 1) = 5.5, J (7c, 5)=5.5, 1Hc-C (7)); 2.24 (д.д, J (1, 7c) = 5.5, J (1, 5) = 5.5, 1Н-С (1)); 2.34 (д.д.д, J (5, 1) = 5.5, J (5, 7c) = 5.5, J (5, 3) = 1.7, 1Н-С (5)); 3.05 (д, J (3,5) = 1.7, 1Н-С (3)).
К суспензии 0.24 г LiAlH4 в 5 мл диэтилового эфира при 0°С прибавляют 1.0 г эпоксида вербенона 4. Реакционную смесь перемешивают 4.5 ч при 0°С, добавляют 5 мл воды и экстрагируют диэтиловым эфиром. Органический слой высушивают над К2СО3, растворитель отгоняют. Получают 0.84 г (83%) эпоксида вербенола 5. 1Н-ЯМР: 1.05 (с, Ме (8)); 1.25 (с, Ме (9)); 1.32 (с, Ме (10)); 1.34 (д, J (7an, 7cin)=9.5, Han-C(7)); 1.83-1.91 (м, 2Н, Н-С(1), Н-С(5)); 1.91-1.99 (д.м, J (7cin, 7an)=9.5, Нcin-С(7)); 2.70 (ш.с, ОН); 2.96 (д, J=2, Н-С(3)); 4.03 (д, J(4,5)=3, Н-С(4)). 13С-ЯМР: 45.30 (д, С1), 60.55 (с, С2), 60.30 (д, С3), 69.95 (д, С4), 46.70 (д, С5), 40.62 (с, С6), 22.07 (т, С7), 27.17 (к, С8), 22.07 (к, С9), 21.97 (к, С10). HR-MC: 168.11486 (М+, C10H16O2 +; calc. 168.11502).
Пример 2. Синтез 3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола 1 на глине асканит-бентонит.
К суспензии 0.5 г глины асканит-бентонит, прокаленной в течение 3 ч при 120°С, в 8 мл СН2Cl2 г прибавляют раствор 0.200 г эпоксида вербенола 5 в 7 мл CH2Cl2, перемешивают 40 минут при 20°С. Добавляют 5 мл диэтилового эфира. Катализатор отфильтровывают, растворитель упаривают. Полученную реакционную смесь делят на колонке с 10 г силикагеля, элюент - раствор диэтилового эфира в гексане от 10 до 90%. Получают 0.094 г (47%) 3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола 1. 1H-NMR: 1.75 (д.д.д.д, J 10,5a) = 2.5, J(10,4) = 1.5, J(10,5e) = 1.5, J(10,2) = 1, Me(10)); 1.78 (ш.с, Ме(9)); 1.93 (д.д.д.к, J(5e,5a) = 17.5, J(5e,4) = 5, J(5e.6a) = 5, J(5e,10) = 1.5, He-C(5)); 2.16 (д.д.д.к.д, J=17.5, J(5a,6a)=11, J(5a,4) = 2.5, J(5a,10) = 2.5, J(5a,2) = 1, Ha-C(5)); 2.35 (ш.д.д, J(6a,5a) = 11, J(6a,5e) = 5, Ha-C(6)); 2.44 (ш.с, 2 ОН); 3.77 (ш.д, J(2,1) = 3, H-C(2)); 3.82 (д.д, J(1,2)=3, J(1,6) = 2, H-C(1)); 4.79 и 4.90 (ш.с и м, 2Н-С(8)); 5.56 (д.д.к, J(4,5e) = 5, J(4,5a) = 2.5, J(4,10) = 1.5, H-C(4)). 13C-NMR: 71.39 (д, С1), 71.82 (д, С2), 131.76 (с, С3), 124.89 (д, С4), 24.65 (т, С5), 39.82 (д, С6), 145.67 (с, С7), 111.46 (т, С8), 22.55 (к, С9), 20.72 (к, С10). HR-МС: 168.11503 (M+, C10H16O2 +; calc. 168.11502).
Пример 3. Синтез (1R,2R,6S)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1) на глине К10.
К суспензии 30.0 г глины К10 (Fluka), прокаленной в течение 3 ч при 110°С, в 200 мл CH2Cl2 прибавляют при перемешивании раствор 11.50 г эпоксида (-)-цис-вербенола ((1R,2R,4S,5R,6S))-5 (=-44 (с 12, CHCl3)) в 150 мл СН2Cl2. Реакционную смесь перемешивают 1 ч при 22°С. Катализатор отфильтровывают, промывают этилацетатом, растворитель отгоняют. Остаток делят колоночной хроматографией на силикагеле, элюент - раствор этилацетата в гексане от 5 до 100%. Получают 5.10 г (44%) (1R,2R,6S)-3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола ((1R,2R,6S)-1) (=-46 (с 18, CHCl3)).
Пример 4. Влияние соединения 1 на психо-локомоторную активность в тесте «открытое поле».
Изучение влияния соединения 1 на психо-локомоторную активность проводили на белых беспородных мышах-самцах массой 22-25 г в тесте « открытое поле». Изучаемые соединения вводили в дозе 0.5, 1 и 10 мг/кг, эталон сравнения сибазон - в дозе 2.5 мг/кг внутрижелудочно за час до тестирования. Эффект оценивали по изменению количества различных видов движений и общего эмоционального состояния животных на приборе фирмы TruScan (США). Результаты представлены в таблице 1.
Анализ полученных данных показал, что соединение 1 не имеет статистически значимых различий с эталонным препаратом по влиянию на психо-локомоторную активность животных.
| Таблица 1 | ||||||||
| Влияние соединения 1 на показатели двигательной активности мышей в дозах 0.5 и 1 мг/кг | ||||||||
| Группа, доза | А | Б | В | Г | Д | Е | Ж | 3 |
| Контроль | 9.2±2.0 | 108.3±1.9 | 11.7±1.9 | 362.2±24.3 | 2.9±0.2 | 4.0±0.9 | 4.3±1.0 | 0.0±0.0 |
| 1,0.5 мг/кг | 11.0±1.0 | 104.4±2.3 | 15.6±2.3 | 252.4±20.2* | 2.0±0.2* | 3.4±0.5 | 4.0±0.6 | 0.0±0.0 |
| 1,1 мг/кг | 11.3±1.3 | 104.7±1.8 | 15.3±1.8 | 316.3±24.9 | 2.6±0.2 | 4.3±1.3 | 5.0±1.7 | 0.0±0.0 |
| Таблица 1а | ||||||||
| Влияние соединения 1 на показатели двигательной активности мышей в дозе 10 мг/кг | ||||||||
| Группа, доза | А | Б | В | Г | Д | Е | Ж | З |
| Контроль | 12.9±0.6 | 102.6±0.9 | 17.4±0.9 | 299.6±32.8 | 2.5±0.3 | 2.4±0.6 | 3.0±0.9 | 0.6±0.04 |
| Сибазон, 2.5 мг/кг | 10.3±0.7 | 107.0±2.1 | 13.0±2.1 | 385.5±38.1 | 3.2±0.3 | 7.0±1.2* | 8.0±1.1* | 0.0±0.0 |
| 1,10 мг/кг | 13.0±0.9 | 102.2±1.8 | 17.8±1.8 | 273.4±24.4 | 2.3±0.2 | 3.4±0.8* | 4.6±1.1 | 0.9±0.03 |
| *Р<0.05; достоверность по сравнению с контрольной группой; | ||||||||
| А - общая двигательная активность (кол-во актов); Б - двигательная активность (сек); | ||||||||
| В - неподвижный момент (сек); Г - дистанция движения (см); | ||||||||
| Д - скорость движения (см /сек); Е - количество исследованных отверстий; | ||||||||
| Ж - время исследовательских реакций (сек); З - количество вертикальных вставаний. |
Пример 5. Влияние соединения 1 на продолжительность действия снотворного препарата - хлоралгидрата.
| Таблица 2 | ||
| Группа | Время засыпания (в мин) | Длительность сна (в мин) |
| Контроль. Хлоралгидрат | 3.88±0.13 | 94.4±6.6 |
| 1 + хлоралгидрат | 5.0±0.46* (29%) | 76.63±10.15 (19%) |
| Сибазон + хлоралгидрат | 4.00±0.15 | 240.0±10.40* |
| *Р<0.001 по сравнению с контрольной группой |
При взаимодействии соединения 1 с хлоралгидратом время засыпания удлинялось на 29%, а продолжительность сна укорачивалось на 19% по отношению к контролю, что говорит о некотором стимулирующим влиянии на подкорку головного мозга. В группе с сибазоном наблюдалось сильное потенцирование действия снотворного препарата.
Пример 6. Влияние соединения 1 на судороги, вызванные коразолом.
Противосудорожную активность оценивали по проценту выживших животных после внутрибрюшинного введения коразола в токсической дозе 90 мг/кг. Исследуемое соединение вводили мышам внутрижелудочно в дозах 0.5, 1 и 10 мг/кг за час до воспроизведения судорог. Результаты представлены в таблице 3.
| Таблица 3 | ||||
| Противосудорожная активность соединения 1 в тесте «коразоловые судороги» | ||||
| Процент гибели животных в группе (%) | ||||
| Контроль | 1 | 1 | 1 | Сибазон |
| коразол | 0.5 мг/кг | 1 мг/кг | 10 мг/кг | 2.5 мг/кг |
| 37.5% | 0% | 50% | 0% | 0% |
В данном тесте показано, что соединение 1 проявило дозозависимый эффект: в дозах 0.5 и 10 мг/кг оно полностью блокировало развитие клонических судорог и, соответственно, наступление летальных исходов, тем самым проявив противосудорожное действие в отношении вводимой дозы конвульсанта. В дозе 1 мг/кг наблюдалось незначительное (на 12.5%) усиление токсического действия коразола.
Пример 7. Влияние соединения 1 на судороги, вызванные никотином.
Противосудорожную активность оценивали по проценту выживших животных после внутрибрюшинного введения никотина в токсической дозе 20 мг/кг. Исследуемое соединение вводили мышам внутрижелудочно в дозах 0.5, 1 и 10 мг/кг за час до воспроизведения судорог. Результаты представлены в таблице 4.
| Таблица 4 | ||||
| Противосудорожная активность соединения 1 в тесте «никотиновые судороги» | ||||
| Процент гибели животных в группе, % | ||||
| Контроль | 1 | 1 | Контроль | 1 |
| никотин | 0.5 мг/кг | 1 мг/кг | никотин | 10 мг/кг |
| 25% | 12.5% | 25% | 40% | 10% |
Из данных таблицы 4 видно, что соединение 1 проявило дозозависимый эффект, а именно в дозе 0.5 мг/кг блокировало развитие никотиновых судорог на 50%, в дозе 10 мг/кг - на 40%, проявляя в значительной степени противосудорожный эффект. В дозе 1 мг/кг - не оказывало влияние на действие никотина.
Пример 8. Влияние соединения 1 на тремор, вызванный ареколином.
Противосудорожную активность оценивали по продолжительности тремора, вызванного внутрибрюшинным введением ареколина в дозе 15 мг/кг. Исследуемое соединение вводили мышам внутрижелудочно в дозах 0.5, 1 и 10 мг/кг за час до воспроизведения судорог. Результаты представлены в таблице 5.
| Таблица 5 | |||||
| Противосудорожная активность соединения 1 в тесте «ареколиновый тремор» | |||||
| № п/п | Контроль | 10.5 мг/кг | 11 мг/кг | Контроль | 110 мг/кг |
| М±m | 531.9±41.7 | 510.9±43.1 | 469.0±50.4 | 625.0±30.5 | 497.5±30.6* |
| * Р<0.05 относительно контрольной группы |
Установлено, что только в дозе 10 мг/кг соединение 1 достоверно (Р<0.05) уменьшает продолжительность тремора, вызванного М-холиномиметиком ареколином.
Пример 9. Взаимодействие соединения 1 с предшественником дофамина L-ДОФА.
Изучение влияния соединения на дофаминергическую систему осуществляли путем внутрибрюшинного введения L-ДОФА в дозе 200 мг/кг. Эффект оценивали в тесте «открытое поле» по изменению параметров двигательной активности. Изучаемое соединение вводили однократно внутрь в дозе 10 мг/кг за час до воспроизведения теста. Результаты представлены в таблице 6.
При взаимодействии соединения 1 с L-ДОФА показано, что данное соединение способствует усилению угнетающего действия предшественника дофамина, проявляющемуся в увеличении неподвижного момента, резком снижении количества двигательных актов, тем самым проявляя потенцирующее влияние на дофаминергическую систему.
Таким образом, предлагаемый в качестве противосудорожного средства 3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диол отличается в лучшую сторону от транквилизаторов бензодиазепинового ряда типа сибазона следующим:
- Простым синтезом из доступного природного соединения α-пинена;
- Не менее чем в 3.5 раза меньшей токсичностью;
- Отсутствием влияния на психо-локомоторную активность;
- Отсутствием потенцирования длительности действия снотворных препаратов;
- Проявлением холиноблокирующего действия.
| Таблица 6 | ||||||||
| Влияние соединения 1 на двигательную активность при воздействии L-Дофа | ||||||||
| Группа, доза | А | Б | В | Г | Д | Е | Ж | 3 |
| Контроль | 10.0±0.9 | 106.2±2.4 | 13.8±2.4 | 375.0±43.1 | 3.1±0.4 | 2.8±0.0 | 0.0±0.0 | 13.2±1.6 |
| L-Дофа, 200 мг/кг. в/б | 11.2±1.3 | 21.0±2.4 | 99.0±2.4 | 34.2±5.4 | 0.28±0.05 | 0.0±0.0 | 0.0±0.0 | 0.0±0.0 |
| 1, 10 мг/кг | 7.6±1.2 | 13.0±1.8* | 107.0±1.8* | 19.2±2.4 | 0.14±0.02 | 0.0±0.0 | 0.0±0.0 | 0.0±0.0 |
| А - общая двигательная активность (кол-во актов); Б - двигательная активность (сек); | ||||||||
| В - неподвижный момент (сек); Г - дистанция движения (см); | ||||||||
| Д - скорость движения (см/сек); Е - количество исследованных отверстий; | ||||||||
| Ж - время исследовательских реакций (сек); З - количество вертикальных вставаний. |
Применение 3-метил-6-(проп-1-ен-2-ил)циклогекс-3-ен-1,2-диола формулы 1: в качестве противосудорожного средства.