Фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к медицине и биохимии и описывает парентеральные фармацевтические композиции, включающие аналог соматостатина и винную кислоту. Изобретение обеспечивает высокую стабильность и одновременно хорошую местную применимость. 3 н. и 5 з.п. ф-лы.
Реферат
Изобретение относится к парентеральным фармацевтическим композициям, включающим аналог соматостатина и новые аналоги соматостатина.
Соматостатин является тетрадекапептидом, имеющим структуру
После выделения и описания соматостатина продолжаются интенсивные поиски более мощных и более стабильных его аналогов.
Аналоги соматостатина описаны, например, в WO 97/01579. Указанные аналоги соматостатина включают последовательность аминокислот формулы I
в которой X1 обозначает радикал формулы (а) или (б)
где R1 обозначает необязательно замещенный фенил,
R2 обозначает -Z1-CH2-R1, -CH2-CO-О-CH2-R1,
или
где Z1 обозначает О или S, и
Х2 обозначает α-аминокислоту, имеющую ароматический остаток в боковой цепи Сα, или аминокислотную единицу, выбранную из Dab, Dpr, Dpm, His, (Bzl)HyPro, тиенил-Ala, циклогексил-Ala и тетра-бутл-Ala, остаток Lys в указанной последовательности соответствует остатку Lys9 в нативном соматостатине-14.
В контексте настоящего изобретения под аналогом соматостатина подразумевается пептид с прямой цепью или циклический, являющийся производным природного пептида соматостатина-14 и включающий последовательность формулы I, в котором дополнительно один или несколько аминокислотных единиц были изъяты и/или замещены одним или несколькими другими аминокислотными радикалами, и/или в котором одна или несколько функциональных групп были замещены одной или несколькими другими функциональными группами, и/или одна или несколько групп были замещены одной или несколькими другими изостерическими группами. В целом данное понятие относится ко всем модифицированным производным нативного соматостатина-14, включающим указанную выше последовательность формулы I, которые обладают связывающим сродством в наномолярном диапазоне, по меньшей мере, к одному подтипу рецептора соматостатина, описанному ниже.
Предпочтительными являются аналоги соматостатина, у которых остатки в положениях с 8 по 11 соматостатина-14 представлены последовательностью формулы I, приведенной выше.
Более предпочтительными являются приведенные выше аналоги соматостатина, включающие гексапептидную единицу, остатки в положениях с 3 по 6 указанной гексапептидной единицы, включающие последовательность формулы I. Еще более предпочтительно, если остатки в положениях 1 и 2 гексапептидной единицы гексапептида соматостатина могут быть любыми известными в данной области, например, описанными A.S.Dutta в кн.: «Small Peptides», изд-во Elsevier, 1993, т. 19, сс.292-354, или заместителями для Phe6 и/или Phe7 соматостатина-14.
Еще более предпочтительными являются циклические гексапептиды соматостатина, например, циклические гексапептиды соматостатина, включающие гексапептидную единицу под номерами с 1 по 6, остатки в положениях с 3 по 6 указанной гексапептидной единицы, имеющие аминокислотную последовательность формулы I, приведенной выше, например, соединение формулы Ia
в которой обозначения X1 и Х2 соответствуют приведенным выше обозначениям, А обозначает двухвалентный остаток, выбранный из Pro,
и
где R3 обозначает NR8R9-С2-6алкилен, гуанидино-С2-6алкилен или
С2-6алкилен-СООН, R3а обозначает Н, С1-4алкил или независимо имеет одно из значений, данных для R3, R3b обозначает Н или С1-4алкил, Ra обозначает ОН или
NR5R6, Rb обозначает -(CH2)1-3- или -СН(СН3)-, R4 обозначает Н или СН3, R4a обозначает необязательно замещенный в кольце бензил, каждый из R5 и R6 независимо обозначает Н, С1-4алкил, ω-амино-С1-4алкилен, ω-гидрокси-С1-4алкилен или ацил, R7 обозначает простую связь или С1-6алкилен, каждый из R8 и R9 независимо обозначает Н, С1-4алкил, ω-гидрокси-С2-4алкилен, ацил или СН2OH-(СНОН)с-СН2-, где с обозначает 0, 1, 2, 3 или 4, или R8 и R9 образуют вместе с атомом азота, к которому они присоединены, гетероциклическую группу, которая может содержать дополнительный гетероатом, и R11 обозначает необязательно замещенный в кольце бензил, -(CH2)1-3-OH, СН3-СН(ОН)- или -(CH2)1-5-NR5R6, и ZZa обозначает природную или искусственную α-аминокислотную единицу.
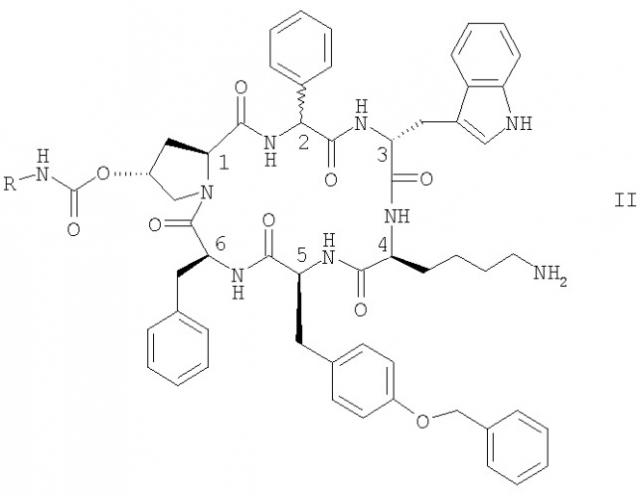
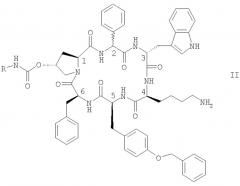
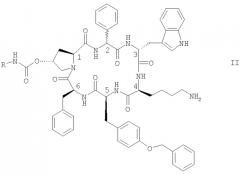
Особенно предпочтительными являются соединения формулы II
в которой конфигурация в положении С-2 является (R) или (S) или их смесью, и где R обозначает NR1R2-C2-6алкилен или гуанидин-С2-6алкилен, и каждый из R1 и R2 независимо обозначает Н или С1-4алкил, в свободной форме, в форме соли или в защищенной форме.
Предпочтительно R обозначает NR1R2-C2-6алкилен. Предпочтительные соединения формулы II обозначают соединения, в которых R обозначает 2-аминоэтил, а именно цикло[{4-(NH2-C2H4-NH-CO-О-)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe] (упоминается в настоящей заявке как соединение А) и цикло[{4-(NH2-C2H4-NH-CO-О-)Pro}-DPhg-DTrp-Lys-Tyr(4-Bzl)-Phe], в свободной форме, в форме соли или в защищенной форме. Phg обозначает -HN-СН(С6Н5)-СО- и Bzl обозначает бензил.
Эти соединения в свободной форме, в форме соли или в защищенной форме упоминаются ниже как «соединения настоящего изобретения».
Из-за протеолитического распада аналогов соматостатина настоящего изобретения весьма желательна системная доставка, например, парентеральное введение. Однако парентеральное введение может быть очень болезненным в месте введения, особенно при повторном введении.
В настоящее время обнаружено, что парентеральные композиции, включающие соединение настоящего изобретения и винную кислоту, показывают особенно интересные свойства, например, хорошую переносимость и высокую стабильность.
Соединение настоящего изобретения в защищенной форме соответствует аналогу соматостатина, в котором, по меньшей мере, одна из аминогрупп защищена и которое после снятия защиты приводит к образованию соединения формулы II, предпочтительно физиологически элиминируемого. Приемлемые аминозащитные группы описаны, например, Т.W.Greene в кн.: «Protective Groups in Organic Synthesis», изд-во J.Wiley & Sons, Нью-Йорк, 1981, cc. 219-287, содержание которой приводится в настоящей заявке в виде ссылки. Примером такой аминозащитной группы является ацетил.
Соединение настоящего изобретения может существовать, например, в свободной форме или в форме соли. К солям относятся кислотные аддитивные соли, например, неорганических кислот, полимерных кислот или органических кислот, например, соляной кислоты, уксусной кислоты, молочной кислоты, аспарагиновой кислоты, бензойной кислоты, янтарной кислоты или памоиновой кислоты. Кислотные аддитивные соли могут существовать в качестве моно- и дивалентных солей, например, в зависимости от того, внесен 1 или 2 эквивалента кислоты. Предпочтительными солями являются лактат, аспартат, бензоат, сукцинат и памоат, в том числе моно- и ди- соли, более предпочтительны диаспартат и монопамоат.
Соединения настоящего изобретения могут приготовляться с помощью традиционных способов.
Одним из объектов настоящего изобретения является парентеральная композиция, включающая соединение настоящего изобретения и винную кислоту.
Согласно настоящему изобретению обычно концентрация соединения настоящего изобретения в композиции настоящего изобретения составляет примерно от 0,05 до примерно 1 мг/мл композиции, особенно от 0,1 до 1 мг/мл.
Удобно, когда отношение массы соединения настоящего изобретения (в количестве, соответствующем свободной форме) к массе винной кислоты составляет примерно от 0,001 до примерно 2, предпочтительно примерно от 0,05 до примерно 0,6.
Количество соединения настоящего изобретения в композиции настоящего изобретения составляет примерно от 0,005 мас.% до примерно 0,1 мас.% от общей массы состава.
Предпочтительно используется винная кислота в мелкоизмельченной кристаллической форме. Более предпочтительным является использование кристаллической D(-) или L(+) винной кислоты. Количество винной кислоты в составе предпочтительно составляет примерно от 0,01 мас. % до примерно 1,5 мас.%, предпочтительно примерно от 0,01 мас.% до примерно 0,3 мас.%, более предпочтительно примерно 0,15 мас.%. Предпочтительно молярность винной кислоты в итоговой композиции составляет примерно 10 мМ.
В соответствии с настоящим изобретением дополнительно к винной кислоте и соединению настоящего изобретения фармацевтическая композиция предпочтительно содержит также основной компонент, выбранный и добавленный в композицию таким образом, что величина рН фармацевтической композиции, определяемая винной кислотой, доводится до значения рН, составляющей примерно от 4 до примерно 4,5, предпочтительно примерно 4,2.
Предпочтительно основным компонентом является основание, например, гидроксид натрия или гидроксид калия, или основная соль, например, гидрокарбонат натрия, карбонат натрия, гидрокарбонат калия, карбонат калия. Предпочтительно основной компонент вносят в таком количестве, что образующаяся в результате этого фармацевтическая композиция имеет доведенное буфером значение рН, согласно указанному выше.
Предпочтительно фармацевтическая композиция настоящего изобретения приготавливается на водной основе.
Композиции настоящего изобретения могут дополнительно включать тонический агент, например, маннит, хлорид натрия, глюкозу, декстрозу, сахарозу или глицерины. Предпочтительно тоническим агентом является маннит.
Количество тонического агента выбирают таким образом, чтобы скорректировать изотоничность композиции настоящего изобретения, например, предпочтительно маннита может быть примерно от 1 мас.% до примерно 5 мас.%, предпочтительно примерно 4,95 мас.%. Удобно, когда маннит присутствует в соотношении маннита к винной кислоте в пропорции примерно от 20 до примерно 40, предпочтительно примерно 33.
Композиции настоящего изобретения могут содержать дополнительные эксципиенты, обычно применяемые в парентеральных композициях с целью обеспечения требуемой стабильности и терапевтической эффективности. К эксципиентам могут относиться, например, антиоксидант или консервант.
Антиоксиданты могут применяться для защиты действующего агента от окислительного распада, в частности, в условиях повышенной температуры при стерилизации. В качестве антиоксидантов может быть выбрано любое из соединений, известных в данной области. Сходным образом количество применяемого антиоксиданта может быть определено с помощью обычных экспериментов. Предпочтительно композиции настоящего изобретения не содержат антиоксиданта.
Консервант, например, фенол, может предпочтительно добавляться в композицию, когда она перерабатывается для многодозовых флаконов, картриджей или шприцов. Предпочтительно композиции настоящего изобретения не содержат консерванта.
Ссылки приводятся на большое количество литературы по данному вопросу для этих и других упоминаемых в настоящем изобретении эксципиентов и методик, в частности, в кн.: «Handbook of Pharmaceutical Excipients» под ред. Ainley Wade, Paul J.Weller, изд-во Американской фармацевтической ассоциации, Вашингтон, США и изд-во «Pharmaceutical Press», Лондон, 2-е изд.; в кн.: «Lexikon der Hilfsstoffe für Pharmazie, Kosmetik und angrenzende Gebiete», под ред. H.P.Fiedler, изд-во Cantor, Aulendorf, 4-е изд., а также в предыдущих изданиях, упоминаемых в настоящей заявке в виде ссылки.
Предпочтительно композиция настоящего изобретения содержит в качестве действующего ингредиента только соединение настоящего изобретения, например, соединение формулы II, например, соединение А.
Действия, которые могут применяться для приготовления композиций настоящего изобретения, могут быть обычными, или известными в данной области, или основывающимися на таких методиках, которые, описаны, например, в книге L. Lachman и др. «The Theory and Practice of Industrial Pharmacy», 1986, 3-е изд.; в книге Н. Sucker и др. «Pharmazeutische Technologie», Thieme, 1991; в кн.: «Hager′s Handbuch der pharmazeutischen Praxis», изд-во Springer Verlag, 1971, 4-е изд.; в кн.: «Remington′s Pharmaceutical Sciences», изд-во Mack Publ., Co., 1970, 13-е изд.; или в последующих изданиях.
Обычно соединение настоящего изобретения, винная кислота и необязательно другие ингредиенты, как упоминалось, в требуемом количестве, растворяются в водном растворителе, предпочтительно в воде для инъекций, и значение рН корректируется основанием. Получаемый раствор затем может разбавляться водой для получения итогового желаемого объема. Получаемый раствор может фильтроваться через стерильный фильтр, например, Millipak® фильтр. Предпочтительно в ходе описанного выше приготовления не допускается контакт кислорода (воздуха) с раствором соединения настоящего изобретения. Обычно это достигается продувкой, например, азота в содержащем раствор контейнере. Фармацевтическая композиция может быть упакована в атмосфере двуокиси углерода или другого инертного газа для предупреждения распада, предпочтительно в атмосфере двуокиси углерода, например, наполненного во флаконы, например стеклянные флаконы, ампулы, например стеклянные ампулы, или шприцы, например заполненные шприцы, и стерилизована паром или прогревом.
Раствор может быть высушен заморозкой обычным способом в асептических условиях для получения порошка для инъекций, который может применяться для восстановления требуемого раствора для парентерального введения незадолго перед введением путем смешивания порошка с необходимым количеством растворителя, например с водой для инъекций.
В еще одном варианте осуществления настоящего изобретении предусматривается другой вариант композиции для парентерального введения, забуференный при значении рН примерно от 4 до примерно 4,5, предпочтительно примерно 4,2, и включающий в качестве действующего ингредиента соединение А или его фармацевтически приемлемую соль, например, лактат, моно- или диаспартат, сукцинат, предпочтительно диаспартат.
Эти композиции могут включать те же компоненты, которые описаны выше для композиций, включающих винную кислоту, в которой винная кислота/тартрат замещены другим буфером, например, ацетатом/уксусной кислотой, лактатом/молочной кислотой и глицином/HCl.
Композиции настоящего изобретения применяются:
а) для предупреждения или лечения расстройств с этиологией, включающей или ассоциированной с избыточной GH-секрецией и/или с избытком IGF-1, например, при лечении акромегалии, а также при лечении сахарного диабета I или II типа, особенно его осложнений, например, ангиопатии, диабетической пролиферативной ретинопатии, диабетического макулярного отека, нефропатии, нейропатии и феномена «утренней зари», а также других метаболических расстройств, связанных с высвобождением инсулина или глюкагона, например, при ожирении, например, патологическом ожирении или гипоталамическом, или гиперинсулинемическом ожирении,
б) для лечения кишечно-кожных и панкреатико-кожных свищей, синдрома раздраженного кишечника, воспалительных заболеваний, например, базедовой болезни, воспалительного заболевания кишечника, псориаза или ревматоидного артрита, поликистозной болезни почек, демпинг-синдрома, синдрома водянистого стула, СПИД-ассоциированной диареи, индуцированной химиотерапией диареи, острого или хронического панкреатита и опухолей, секретирующих желудочно-кишечные гормоны (например, GEP-опухоли, например, випомас, глюкагономас, инсулиномас, карциноиды и т.п.), злокачественных лимфоцитов, например, лимфом или лейкемий, гепатоцеллюлярной карциномы, а также желудочно-кишечного кровотечения, например, варикозного кровотечения пищевода,
в) для предупреждения или лечения ангиогенеза, воспалительных расстройств, описанных выше, включая воспаления глаз, макулярного отека, например, кистоидного макулярного отека, идиопатического кистоидного макулярного отека, экссудативного возрастного макулярного перерождения, расстройств, связанных с хориоидальной реваскуляризацией, и пролиферативной ретинопатии,
г) для предупреждения или лечения заболеваний сосудистых трансплантатов, например, васкулопатии алло- или ксенотрансплантатов, например, атеросклероза трансплантированных сосудов, например, в трансплантатах органов, например, сердца, легких, сочетанных сердца - легких, печени, почек или поджелудочной железы, или для предупреждения или лечения стеноза венозного трансплантата, рестеноза и/или закупорки сосудов с последующим повреждением сосудов, например, вызванной процедурами катетеризации или процедурами васкулярного соскабливания, например, чрескожной транслюминальной ангиопластикой, обработкой лазером или другими инвазивными процедурами, которые нарушают целостность внутренней оболочки стенки сосудов или эндотелия,
д) для лечения опухолей, экспрессирующих или аккумулирующих рецепторы соматостатина, например, опухолей гипофиза, например, болезни Кушинга, гастроэнтеропанкреатита, карциноидов, центральной нервной системы, груди, простаты (включая прогрессирующий, не поддающийся лечению рак простаты), опухолей яичника или толстой кишки, мелкоклеточного рака легких, злокачественной обструкции кишечника, параганглиомы, рака почек, рака кожи, нейробластомы, феохромоцитомы, медуллярных карцином щитовидной железы, миелом, лимфом, лимфомы Ходкина и неходкинской лимфомы, опухолей костей и их метастаз, а также аутоиммунных и воспалительных расстройств, например, ревматоидного артрита, базедовой болезни или других воспалительных заболеваний глаз.
Предпочтительно композиции настоящего изобретения полезны для лечения акромегалии и рака, например, болезни Кушинга.
Активность и свойства композиций настоящего изобретения могут быть показаны с помощью стандартных клинических тестов или тестов на животных.
Подходящие дозы композиции настоящего изобретения, конечно, могут варьировать, например, в зависимости от состояния, требующего лечения (например, типа заболевания или природы устойчивости), применяемого лекарственного средства, ожидаемого эффекта и способа введения.
При постоянном применении эффективное количество лекарственного средства может вводиться в виде двух или трех доз, распределенных по времени, например, путем парентерального введения, например, внутривенозным капельным вливанием, внутримышечной или подкожной инъекцией (инъекциями), или подкожным вливанием, например, постоянным подкожным вливанием, предпочтительно подкожной инъекцией или вливанием, с полной суточной дозой, поделенной на порции, или за единый период введения. При введении подкожной инъекцией наиболее предпочтительно введение от 3 раз в неделю до 3 раз в сутки, предпочтительно от двух раз в неделю до двух раз в сутки. Соединение настоящего изобретения также может вводиться в форме, например, подкожной болюсной инъекции.
Предпочтительно композиция настоящего изобретения подходит для подкожного введения.
После инъекции композиция настоящего изобретения хорошо переносится местно. В частности, парентеральное введение композиции настоящего изобретения, например, подкожной инъекцией, в месте инъекции переносится спокойно или приводит к чувству жжения.
Помимо хорошей местной переносимости после инъекции, композиция настоящего изобретения проявляет свойства хорошей стабильности. Например, менее 2,5% продуктов распада было обнаружено после 4 недель хранения при 60°С. Например, если хранить, защищая от света при температуре от 2°С до 8°С, композиции настоящего изобретения стабильны на протяжении 24 месяцев. Особенно хорошая стабильность может наблюдаться у диаспартата соединения А.
Как правило, удовлетворительные результаты получают при введении, например, подкожном введении, доз в количестве примерно от 0,01 до примерно 1,2 мг, предпочтительно примерно от 0,1 до примерно 0,6 мг соединения настоящего изобретения на инъекцию, или примерно от 0,001 до примерно 0,009 мг/кг массы тела животного в сутки, введенных однократно или поделенных на дозы для приема до 4 раз в сутки. Приемлемые суточные дозы для пациентов, таким образом, составляют примерно от 0,1 до примерно 0,6 мг соединения настоящего изобретения, например, соединения формулы II, например, соединения А.
Приводящиеся ниже примеры иллюстрируют композиции настоящего изобретения.
Примеры 1-7.
Винную кислоту и маннит растворяют в воде для инъекций, при этом через раствор пропускают азот. Затем вносят диаспартат соединения А, раствор корректируют гидроксидом натрия до величины рН 4,20 и добавляют воду для инъекций до 1,0 мл. В асептических условиях раствор фильтруют через стерильный фильтр Millipak-200® с размером пор ≤0,22 мкм, после чего его вносят в ампулы и стерилизуют автоклавированием.
| Пример 1 | Пример 2 | Пример 3 | Пример 4 | |
| Диаспартат соединения А (соответствующий количеству соединения А) | 0,251 (0,200) | 0,315 (0,251) | 0,376 (0,300) | 0,472 (0,376) |
| Винная кислота кристаллическая | 1,501 | 1,501 | 1,501 | 1,501 |
| Манит | 49,500 | 49,500 | 49,500 | 49,500 |
| Гидрат окиси натрия 1 н. для инъекций | рН до 4,20 | рН до 4,20 | рН до 4,20 | рН до 4,20 |
| Вода для инъекций | до 1 мл | до 1 мл | до 1 мл | до 1 мл |
| Пример 5 | Пример 6 | Пример 7 | |
| Диаспартат соединения А (соответствующий количеству соединения А) | 0,752 (0,600) | 0,786 (0,627) | 1,129 (0,900) |
| Винная кислота кристаллическая | 1,501 | 1,501 | 1,501 |
| Манит | 49,500 | 49,500 | 49,500 |
| Гидрат окиси натрия 1 н. для инъекций | рН до 4,20 | рН до 4,20 | рН до 4,20 |
| Вода для инъекций | до 1 мл | до 1 мл | до 1 мл |
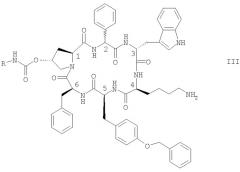
В качестве еще одного объекта настоящего изобретения предусматриваются новые соединения формулы III
в которой R обозначает NR1R2-С2-6алкилен или гуанидин-С2-6алкилен, и каждый из R1 и R2 независимо обозначает Н или С1-4алкил, в свободной форме, в форме соли или в форме комплекса, или в защищенной форме.
Предпочтительно R обозначает NR1R2-С2-6алкилен. Предпочтительным соединением формулы III является соединение, в котором R обозначает 2-амино-этил, также называемое цикло[{4-(NH2-C2H4-NH-CO-О-)Pro}-DPhg-DTrp-Lys-Tyr(4-Bzl)-Phe] и упоминаемое в настоящем описании как соединение Б, в свободной форме, в форме соли, или в форме комплекса, или в защищенной форме. Обозначения Phg и Bzl указаны выше. Эти соединения в свободной форме, в форме соли, или в форме комплекса, или в защищенной форме упоминаются ниже в качестве «новых соединений настоящего изобретения».
Соединение формулы III, например, соединение Б, в защищенной форме соответствует указанной выше молекуле, в которой, по меньшей мере, одна из аминогрупп является защищенной и которая в результате снятия защитной группы приводит к образованию соединения формулы III, предпочтительно физиологически элиминируемого. Приемлемые аминозащитные группы описаны, например, Т.W. Greene в кн.: «Protective Groups in Organic Synthesis», изд-во J.Wiley & Sons, Нью-Йорк, 1981, сс.219-287, содержание которых упоминается в настоящем изобретении в виде ссылок. Примером такой аминозащитной группы является ацетил.
Когда соединение формулы III, например, соединение Б, представлено в форме комплекса, оно может быть соединением формулы III, содержащим хелатирующую группу в боковой цепи аминогруппы Pro и образующим комплекс с выявляемым или радиотерапевтическим элементом. Соединение Б, содержащее хелатирующую группу, упоминается в настоящем описании в качестве конъюгирующего соединения Б.
Примерами хелатирующих групп являются, например, производные поли-аминополикарбоновых кислот или ангидридов, например, производных нециклических лигандов, например, диэтилентриаминпентауксусная кислота (DTPA), этиленгликоль- -0,0′- бис(2-аминоэтил)-N,N,N′,N′-тетрауксусная кислота (EGTA), N,N′-бис(гидроксибензил)этилендиамин-N,N′-диуксусная кислота (HBED) и триэтилентетраамингексауксусная кислота (ТТНА), являющаяся производным замещенной DTPA, например, пара-изотиоцианатобензил -DTPA, являющийся производным макроциклических лигандов, например, 1,4,7,10-тетра-азациклододекан-N,N′,N′′,N′′′-тетрауксусная кислота (DOTA), 1,4,8,11-тетра-азациклотетрадекан-N,N′,N′′,N′′′-тетрауксусная кислота (ТЕТА), или 1,4,7,10-тетра-азациклотридекан-N,N′,N′′,N′′′-тетрауксусная кислота (TITRA).
Хелатирующая группа присоединена непосредственно или через спейсер к боковой цепи аминогруппы Pro. К приемлемым спейсерам относятся известные в данной области, например, описанные в GB-A-2225579, например, двухвалентный остаток аминокарбоновой кислоты, например, β-Ala или двухвалентный остаток, полученный из 6-аминокапроновой кислоты.
Предпочтительными являются хелатирующие группы, производные DTPA, DOTA или ТЕТА. Хелатирующие группы, производные DTPA или DOTA, наиболее предпочтительны.
Понятие «выявляемый элемент» означает любой элемент, предпочтительно ион металла, который проявляет свойство, обнаруживаемое с помощью диагностической техники in vivo, например, ион металла, который испускает фиксируемую радиацию, или ион металла, который может влиять на релаксацию ЯМР-свойств. Понятие «радиотерапевтический элемент» означает любой элемент, который испускает радиацию, оказывающую благотворный эффект на состояние, подвергаемое лечению.
К приемлемым элементам относятся, например, тяжелые элементы или редкоземельные ионы, например, такие, которые используются в САТ-сканировании (компьютерная осевая томография), парамагнитные ионы, например, Gd3+, Fe3+, Mn2+ и Cr2+, флуоресцирующие ионы металла, например, Eu3+, и радионуклиды, например, радиолантаниды, в частности, γ-эмитирующий радионуклид, β-эмитирующий радионуклид, α-эмитирующий радионуклид, Оже-е--эмитирующий радионуклид или позитрон-эмитирующий радионуклид, например, 68Ga, 18F или 86Y.
К подходящим γ-эмитирующим радионуклидам относятся те, которые пригодны для методов диагностики, γ-эмитирующие радионуклиды преимущественно имеют период полураспада от 1 ч до 40 суток, предпочтительно от 5 ч до 4 суток, более предпочтительно от 12 ч до 3 суток. Примерами являются радиоизотопы галлия, индия, технеция, иттербия, рения, тербия, лютеция, таллия и самария, например, 67Ga, 111In, 99mTc, 161Tb, 169Yb, 186Re или 177Lu.
К приемлемым β-эмитирующим радионуклидам относятся те, которые подходят для радиотерапевтических целей, например, 90Y, 67Cu,186Re, 188Re, 169Er, 121Sn, 127Te, 177Lu, 143Pr, 198Au, 109Pd, 165Dy, 142Pr или l53Sm.
К приемлемым α-эмитирующим радионуклидам относятся те, которые используются в терапевтической практике, например. 211At, 212Bi или 201Tl.
Соединения формулы III, например, соединение Б, могут существовать, например, в свободной форме или в форме соли. К солям относятся кислотные аддитивные соли, например, соли неорганических кислот, полимерных кислот или органических кислот, например, соляной кислоты, уксусной кислоты, молочной кислоты, аспарагиновой кислоты, бензойной кислоты, янтарной кислоты или памоиновой кислоты. Кислотные аддитивные соли могут существовать в качестве моно- и дивалентных солей, например, в зависимости от того, добавлен 1 или 2 кислотных эквивалента к соединению Б в свободной основной форме. Предпочтительными солями являются лактаты, аспартаты, бензоаты, сукцинаты и памоаты, в том числе моно- и дисоли, более предпочтительны диаспартат и монопамоат.
Конъюгированные соединения формулы III, например, соединение Б, могут дополнительно существовать в форме солей, образуемых с группами карбоновых кислот, когда присутствуют в хелатирующих группах, например, соли щелочных металлов, например, натрия или калия, или замещенные или незамещенные соли аммония.
Настоящее изобретение также предусматривает способ получения соединения формулы III, например, соединение Б. Оно может быть получено по аналогии с известными способами, например:
а) циклизацией линейного пептида в защищенной, полимер-связанной или незащищенной форме таким путем, что получают соединение формулы III, например, соединение Б, и затем необязательно удаляют защитную группу(группы),
б) для получения конъюгированного соединения формулы III, например, конъюгированного соединения Б, связывают вместе хелатирующую группу и соединение формулы III, например, соединение Б, в защищенной или незащищенной форме и затем необязательно удаляют защитную группу и восстанавливают соединение формулы III, например, соединение Б, или конъюгированное соединение формулы III, например, конъюгированное соединение Б, получаемое таким образом в свободной форме, в форме соли или необязательного комплекса с обнаруживаемым радиотерапевтическим элементом.
Обычно не является принципиальным, какая аминокислота выбирается в положении на С-конце для начала образования пептидной цепи, поскольку линейный пептид будет циклизован, важно только, чтобы последовательность аминокислот в линейном пептиде соответствовала требуемому соединению формулы III, например, соединению Б. Однако могут быть другие факторы, которые могут отдавать предпочтение одной стартовой аминокислоте над другой. Когда соединение формулы III, например, соединение Б, получают твердофазным синтезом, первая аминокислота предпочтительно присоединяется к смоле, например, коммерчески доступной смоле на основе полистирола, через подходящий линкер, например, линкер, который может расщепляться в мягких условиях для сохранения в интактном состоянии защиты боковой цепи, например, SASRIN или необязательно замещенный линкер на основе тритила, например, 4-(гидроксидифенилметил)бензойная кислота, в которой одна из фенильных групп может необязательно быть замещенной, например, С1. Сборка определенной пептидной цепи может быть эффективным при использовании обычного метода, например, с использованием аминокислотных единиц, в которых концевые аминогруппы являются Fmoc-защищенными, имеющиеся аминогруппы боковых цепей защищены различными аминозащитными группами, например, Вос или СВО. Предпочтительно линейный пептид циклизуется таким образом, что образуется связь между Tyr(4-Bzl)-OH и Phe, например, Phe-{4-(NHR1-C2H4-NH-CO-O-)Pro}-DPhg-DTrp(R2)-Lys(ε-NHR3)-Tyr(4-Bzl)-OH или его функциональное производное, где каждый из R1, R2 и R3 является аминозащитной группой. Стадия циклизации а) может быть легко выполнена с помощью известных методов, например, через азид, активный сложный эфир, смешанный ангидрид или карбодиимид. Затем защитная группа снимается, например, расщеплением, например, с помощью трифторуксусной кислоты или путем гидрогенизации.
Циклизация пептида также может выполняться непосредственно на твердом носителе, первая аминокислота на Nα- и С-концах защищена от присоединения по боковой цепи, например, ε-амино-функция Lys или путем заякоривания остова молекулы. Линейная последовательность затем синтезируется методами стандартного твердофазного синтеза (SPPS). После снятия С-концевой защиты пептид циклизуется, например, согласно описанному выше. После этого циклический пептид отщепляется от смолы и теряет защиту.
При желании боковую цепь в Pro могут внедрять в аминокислоту до или после стадии циклизации пептида а). Так, Pro в качестве стартовой аминокислоты или стартовый линейный или циклический пептид, в котором в каждом случае Pro замещен в кольце ОН, может быть преобразован с целью получения соединения формулы III, например, соединения Б, или желаемой единицы Pro или соответствующего линейного пептида, соответственно, в котором Pro замещен NHR1-C2H4-NH-CO-O-.
Комплексообразование конъюгированного соединения формулы III, например, конъюгированного соединения Б, может быть произведено путем взаимодействия конъюгированного соединения формулы III, например, конъюгированного соединения Б, с соответствующим выявляемым или радиотерапевтическим элемент-несущим соединением, например, солью металла, предпочтительно водорастворимой солью. Реакция может проводиться по аналогии с известными методами, например, описанными Perrin в кн.: «Organic Ligand, Chemical Data», изд-во Pergamon Press, Нью-Йорк, 1982, серия 22; Krejcant, Tucker в Biophys. Biochem. Res. Com. 77. 1977, с.581; Wagner, Welch в J.Nucl. Med. 20, 1979, с.428.
Последующие примеры иллюстрируют новые соединения формулы III. Все значения температуры приводятся в °С.
Аббревиатуры:
| АсОН | = уксусная кислота |
| Boc | = трет-бутоксикарбонил |
| Bzl | = бензил |
| СВО | = карбобензокси |
| DIPCI | = N,N′-диизопропилкарбодиимид |
| DIPEA | = диизопропилэтиламин |
| DMF | = диметилформамид |
| DPPA | = дифенилфосфорилазид |
| Fmoc | = флуоренилметоксикарбонил |
| НОВТ | = 1-гидроксибензотриазол |
| Osu | = N-гидроксисукцинимид |
| TFA | = трифторуксусная кислота |
| THF | = тетрагидрофуран |
Пример 8. цикло[{4-(NH2-C2H4-NH-CO-O-)Pro}-DPhg-DTrp-Lvs-Tyr(4-Bzl)-Phe]
А. Синтез Fmoc-Pro(4-OCO-NH-CH2-CH2-NH-Boc)-OH
Гидрохлорид метилового эфира L-гидроксипролина взаимодействует с Fmoc-Osu в водном 1,0 н. углекислом натрии/THF при комнатной температуре. После завершения реакции Fmoc-Pro(4-OH)-Ome выделяют осаждением. Затем Fmoc-Pro(4-OH)-Ome добавляют по каплям в раствор трифосгена (0,6 эквивалента) в THF для получения хлоркарбоната промежуточного соединения. Через 1 ч вносят диметиламинопиридин (1,0 эквивалент) и N-Boc-диаминоэтан (6,0 эквивалентов) и реакцию проводят при перемешивании при комнатной температуре. После завершения реакции растворитель удаляют in vacuo и образуемый Fmoc-Pro(4-OCO-NH-CH2-CH2-NH-Boc)-Ome экстрагируют из двухфазной системы этилацетат/0,1 М НС1 для получения сырца продукта (МН+=554), который очищают кристаллизацией из этилацетата. Затем метиловый эфир удаляют с образованием свободной кислоты путем обработки 1 н. NaOH в диоксане/воде и продукт Fmoc-Pro(4-OCO-NH-CH2-CH2-NH-Boc)-OH очищают на силикагеле, [(M+Na)]+=562.
Б. H-Phe-Pro(4-OCO-NH-CH2-CH2-NH-Boc)-DPhg-DTrp(Boc)-Lvs(Boc)-Tyr(Bzl)-OH
Коммерчески доступную Fmoc-Tyr(Bzl)-O-CH2-Ph(3-OCH3)-O-CH2-полистирольную смолу (SASRIN-смола, 2,4 ммоля) применяют в качестве исходного материала и выполняют стандартные действия, состоящие из повторяющихся циклов по снятию защиты с Nα (пиперидин/DMF, 2:8), повторяющихся промываний DMF и присоединений (DIPCI: 4,8 ммолей/НОВТ: 6 ммолей, DMF). Следующие аминокислотные производные последовательно соединяются: Fmoc-Lys(Boc)-OH, Fmoc-DTrp(Boc)-OH, Fmoc-DPhg-OH, Fmoc-Pro(4-OCO-NH-CH2-CH2-NH-Boc)-OH, Fmoc-Phe-OH. Присоединения (2 эквивалента аминокислот) продолжаются или повторяются до завершения реакции, т.е. до полного исчезновения остаточных аминокислотных групп, мониторинг которых осуществляют по отрицательному нингидриновому Кайзер-тесту. Перед снятием полностью синтезированного защищенного линейного пептида со смолы снимают Nα-Fmoc защиту с последнего остатка.
B. H-Phe-Pro(4-OCO-NH-CH2-CH2-NH-Boc)-DPhg-DTrp(Boc)-Lys(Boc)-Tyr(Bzl)-ОН
После промывания СН2Cl2 соединенные пептид-смолу переносят на колонку или вакуум-фильтр с мешалкой и фрагмент пептида удаляют и элюируют с помощью краткой обработки 2% TFA в СН2Cl2 в течение 1 ч. Элюат немедленно нейтрализуют насыщенным раствором NaHCO3. Органический растворитель отделяют и упаривают, а предшественник с защищенной боковой цепью (МН+=1366) циклизируют без последующей очистки.
Г. Трифторацетат цикло[-Pro(4-ОСО-NH-СН2-СН2-NH2)-DPhg-DTrp-Lys-Tyr(Bzl)-Phe-]
Указанный выше линейный фрагмент растворяют в DMF (4 ммолях), охлаждают до минус 5°С и обр