Кристаллическая полиморфная форма бисульфатной соли антагониста тромбинового рецептора
Иллюстрации
Показать всеИзобретение относится к новому соединению, представляющему собой кристаллическую полиморфную форму бисульфатной соли со свойствами антагониста тромбиновых рецепторов, которая показывает в порошке картину дифракции рентгеновских лучей, практически идентичную представленной на фиг.1, или которая показывает график дифференциальной сканирующей калориметрии, практически идентичный представленному на фиг.3, и которое представлено формулой для соединения 2:
а также к способу получения соединения 2. Изобретение относится также к фармацевтической композиции, включающей полиморфную форму бисульфатной соли и по крайней мере один разбавитель или носитель, и к применению полиморфной формы соединения 2 для лечения различных физиологических нарушений, например тромбоза. 5 н. и 11 з.п. ф-лы, 3 ил., табл.3.
Реферат
Область изобретателя
Изобретение относится к кристаллической полиморфной форме бисульфатной соли антагониста тромбинового рецептора, к способу получения этой бисульфатной соли и к способам применения бисульфатной соли.
Предпосылки создания изобретения
Известно, что тромбин характеризуется многими видами активности в клетках различных типов, известно также, что тромбиновые рецепторы присутствуют в таких типах клеток, как тромбоциты человека, клетки гладкой мускулатуры в сосудах, клетки эндотелия и фибробласты. В соответствии с этим не исключена возможность того, что антагонисты тромбинового рецептора, известные также как антагонисты активируемого протеазами рецептора, могут быть использованы для лечения тромботических, воспалительных, атеросклеротических заболеваний и фибропролиферативных расстройств, а также других расстройств, в которых тромбин и его рецептор играют патологическую роль.
Пептиды, представляющие собой антагонисты тромбинового рецептора, были обнаружены при изучении зависимости структура-активность благодаря замене аминокислот в тромбиновых рецепторах. В работе Bematowicz и др., J. Med. Chem., T. 39, с.4879-4887 (1996), представлены тетра- и пентапептиды в качестве эффективных антагонистов тромбинового рецептора, например это N-транс-циннамоил-n-фторФен-n-гуанидиноФен-Лей-Арг-NH2 и N-транс-циннамоил-n-фторФен-n-гуанидиноФен-Лей-Apr-Apr-NH2. Пептидные антагонисты тромбинового рецептора известны также по заявке на международный патент №94/03479, опубликованной 17 февраля 1994 г.
В соответствии с литературными данными предполагалось, что антагонисты тромбинового рецептора могут найти применение для лечения различных заболеваний и болезненных состояний, включая, например, тромбоз, сосудистый рестеноз, глубокий венозный тромбоз, легочную эмболию, церебральный инфаркт, заболевания сердца, синдром рассеянной внутрисосудистой коагуляции, гипертензию, воспаления, ревматизм, астму, гломерулонефрит, остеопороз, заболевания нервной системы и/или злокачественные опухоли (Suzuki, Shuichi, заявка на международный патент (РСТ) №0288092 (2002), заявка на международный патент №0285850 (2002) и заявка на международный патент №0285855 (2002)), аритмию, воспаления, стенокардию, удар, атеросклероз, ишемические состояния, нарушения, связанные с ангиогенезом, рак и нейродегенеративные нарушения (Zhang, Han-cheng, заявка на международный патент (РСТ) №0100659 (2001), заявка на международный патент №0100657(2001) и заявка на международный патент №0100656 (2001)), нарушения в печени, в почках и в легких (Chambers, R.C., "Coagulation cascade proteases and tissue fibrosis," Biochemical Society Transactions, 2002, 30(2), cc.194-200), рак (Nguyen, Quang-De, "RhoA- and RhoD-dependent regulatory switch of Ga subunit signaling by PAR-1 receptors in cellular invasion," FASEB Journal, 2002, 16(6), сс.565-576), меланому (Tellez, Carmen, "Role and regulation of the thrombin receptor (PAR-1) in human melanoma," Oncogene 22, 2003, сс.3130-3137), карциному почечных клеток (Kaufman R., "Meizothrombin, an intermediate of prothrombin cleavage potently activates renal carcinoma cells by interaction with PAR-type thrombin receptors," Oncology Reports, 2003, 10(2), сс.493-496), болезни почек, острую почечную недостаточность, хроническую почечную недостаточность, сосудистый гомеостаз почек (Tognetto, Michele, "Proteinase-activated receptor-1 (PAR-1) activation contracts the isolated human renal artery in vitro," British Journal of Pharmacology, 2003, 139(1), сс.21-27), гломерулонефрит (Ahn, Ho-Sam, "Nonpeptide thrombin receptor antagonists," Drugs of the Future, 2001, 26(11), сс.1065-1085), воспаление (Meli, Rosaria, "Thrombin and PAR-1 activating peptide increase iNOS expression in cytokine-stimulated C6 glioma cells," Journal of Neurochemistry, 2001, 79(3), сс.556-563), хронические заболевания дыхательных путей (Roche, Nicolas, "Effect of acute and chronic inflammatory stimuli on expression of protease-activated receptors 1 and 2 alveolar macrophages," Journal of Allergy and Clinical Immunology, 2003, 111(2), сс.367-373), воспаление мочевого пузыря (D'Andrea, Michael R., "Expression of protease-activated receptor-1, -2, -3 and -4 in control and experimentally inflamed mouse bladder," American Journal of Pathology, 2003, 162(3), сс.907-923), нейродегенеративные и/или нейротоксические заболевания, болезненные состояния и травмы (Traynelis, Stephen Francis, "Treatment of neurodegenerative diseases and conditions using PAR-1 antagonists," заявка на международный патент (РСТ) №0271847 (2002)), радиационный фиброз, дисфункцию эндотелия (Wang, Junru, "Deficiency of microvascular thrombomodulin and up-regulation of protease-activated receptor-1 in irradiated rat intestine: possible link between endothelial dysfunction and chronic radiation fibrosis," American Journal of Pathology, июнь 2002, 160(6), сс.2063-72), периодонтальные заболевания (Tanaka, Nobuhisa, "Thrombin-induced Ca2+ mobilization in human gingival fibroblasts is mediated by protease-activated receptor-1 (PAR-1)," Life Sciences, 2003, 73, сс.301-310) и травмы (Strukbva S.M., "Thrombin, a regulator of reparation processes in wound healing," Bioorganicheskaya Khimiya, 1998, 24(4), сс.288-292).
Предполагается также, что антагонисты тромбинового рецептора являются потенциальными антиангиогенами (Chan, Barden, "Antiangiogenic property of human thrombin," Microvascular Research, 2003, 66(1), сс.1-14), факторами устойчивости для раковых клеток по отношению к химиотерапии (Schiller H., "Thrombin as a survival factor for cancer cells: thrombin activation in malignant efrusions in vivo and inhibition of idarubicin-induced cell death in vitro,'' Int'l. J. of Clinical Pharmacology and Therapeutics, 2002, 40(8), сс.329-335.), ингибиторами агрегации тромбоцитов и ингибиторами пролиферации клеток гладкой мускулатуры, эндотелиальных клеток, фибробластов, почечных клеток, клеток остеосаркомы, мышечных клеток, раковых клеток и/или глиальных клеток (Suzuki, см. выше).
Замещенные антагонисты тромбинового рецептора описаны в патентах США №6063847, №6326380 и в сериальном №10/271715.
Заявка США №10/412982, которая в полном объеме включена в данный текст в качестве ссылки, относится к классу антагонистов тромбиновых рецепторов, представленных соединениями приведенной далее формулы (I)
и к их фармацевтически приемлемым солям и сольватам, где заместители и структурные особенности имеют приведенное в тексте значение. Описан также общий способ получения таких соединений, представляющих собой антагонисты тромбиновых рецепторов.
В заявке на патент США №10/412982 описан также специфический антагонист тромбинового рецептора, представляющий собой соединение по примеру 11; в таблице 1 оно представлено как соединение 1. Далее представлена структура соединения 1:
Соединение 1 проявляет высокую активность (эффективность) в качестве антагониста тромбинового рецептора и избирательность, оно может быть использовано для лечения тромбоза, других сердечно-сосудистых и отличных от сердечно-сосудистых болезненных состояний. Дополнительная заявка на патент США №10/705282, включенная в данное описание в качестве ссылки, относится к различным показаниям к применению и к композициям лекарственных форм для антагонистов тромбиновых рецепторов.
Определенные преимущества могут быть получены за счет улучшения термодинамических свойств соединения 1. Кроме того, определенные преимущества могут быть получены за счет получения стабильной кристаллической формы соединения, относящегося к соединению 1, которая имеет постоянные физические свойства. Целью изобретения является достижение этих и других преимуществ, которые будут представлены по ходу описания.
Описание изобретения
Изобретение относится к кристаллической полиморфной форме 1 соединения 2 формулы
порошок которого показывает картину дифракции рентгеновских лучей с характеристическим расположением пиков при 11,2, 16,4, 19,2 и 21,0 градусов 2Θ. В более предпочтительном случае кристаллическая полиморфная форма показывает в порошке картину дифракции рентгеновских лучей с характеристическим расположением пиков при 9,9, 11,2, 16,4, 19,2, 21,0, 22,1, 23,7 и 26,7 градусов 2Θ. В еще более предпочтительном случае кристаллическая полиморфная форма в порошке показывает картину дифракции рентгеновских лучей с характеристическим расположением пиков при 9,9, 11,2, 12,6, 14,5, 16,4, 19,2, 21,0, 22,1, 23,7, 26,7, 28,2 и 30,8 градусов 2Θ.
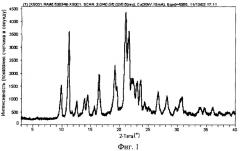
В другом варианте реализации изобретение относится к кристаллической полиморфной форме 1 соединения 2, которая в порошке показывает картину дифракции рентгеновских лучей с характеристическим расположением пиков, в основном соответствующим картине дифракции рентгеновских лучей порошка, представленной на фиг.1.
В другом варианте реализации изобретение относится к кристаллической полиморфной форме 1 соединения 2, которая показывает картину дифференциальной сканирующей калориметрии, соответствующую в основном картине дифференциальной сканирующей калориметрии, представленной на фиг.3.
В другом варианте реализации изобретение относится к способу получения соединения 2 из соединения 1 в соответствии с реакцией:
включающему:
а) перемешивание соединения 1 в органическом растворителе с образованием смеси,
б) нагревание смеси до температуры около 40-80°С и
в) прибавление серной кислоты к нагретой смеси.
В еще одном варианте реализации изобретение относится к кристаллической полиморфной форме 1 соединения 2, которую получают представленным выше способом.
В предпочтительном случае органический растворитель выбирают из группы, состоящей из спирта, нитрила, сложного эфира, кетона, простого эфира и их смесей. В более предпочтительном случае органический растворитель представлен ацетонитрилом. Предпочтительно, когда серная кислота находится в виде смеси с ацетонитрилом. В предпочтительном случае температура равна примерно 50°С.
В еще одном варианте реализации изобретение относится к фармацевтической композиции, включающей кристаллическую полиморфную форму 1 соединения 2 и не менее чем один разбавитель или носитель.
В другом варианте реализации изобретение относится к способу ингибирования тромбиновых рецепторов, включающему введение в организм млекопитающего при необходимости такого лечения эффективного количества кристаллической полиморфной формы 1 соединения 2.
В еще одном варианте реализации изобретение относится к способу лечения тромбоза, атеросклероза, рестеноза, гипертензии, стенокардии, аритмии, сердечной недостаточности, инфаркта миокарда, гломерулонефрита, тромботического удара, тромбоэмболического удара, заболеваний периферических сосудов, воспалительных нарушений, церебральной ишемии или рака, включающему введение в организм млекопитающего при необходимости такого лечения эффективного количества кристаллической полиморфной формы 1 соединения 2.
В другом варианте реализации изобретение относится к способу лечения тромбоза, атеросклероза, рестеноза, гипертензии, стенокардии, аритмии, сердечной недостаточности, инфаркта миокарда, гломерулонефрита, тромботического удара, тромбоэмболического удара, заболеваний периферических сосудов, воспалительных нарушений, церебральной ишемии или рака, включающему введение в организм млекопитающего при необходимости такого лечения эффективного количества кристаллической полиморфной формы 1 соединения 2 в комбинации с не менее чем одним дополнительным сердечно-сосудистым препаратом. В предпочтительном случае не менее чем один дополнительный сердечно-сосудистый препарат выбирают из группы, состоящей из ингибиторов биосинтеза тромбоксана А2, антагонистов гликопротеинов IIb/IIIa, антагонистов тромбоксана, ингибиторов аденозиндифосфата, ингибиторов циклооксигеназы, антагонистов ангиотензина, антагонистов эндотелина, ингибиторов ангиотензинконвертирующего фермента, ингибиторов нейтральной эндопептидазы, антикоагулянтов, диуретиков и ингибиторов агрегации тромбоцитов. В более предпочтительном случае не менее чем один дополнительный сердечно-сосудистый препарат представлен аспирином или бисульфатом клопидогреля.
В еще одном варианте реализации изобретение относится к очищенной форме кристаллической полиморфной формы 1 соединения 2.
Более полное понимание изобретения будет получено на основании представленных далее чертежей, описания и формулы изобретения.
Краткое описание чертежей
На фиг.1 представлена картина дифракции рентгеновских лучей на порошке кристаллизованной из ацетонитрила формы 1 соединения 2, полученная с помощью дифрактометра Rigaku MiniFlex. На графике представлены интенсивности пиков, определенные по показаниям счетчика в секунду по отношению к углу дифракции 2Θ в градусах.
На фиг.2 представлена картина дифракции рентгеновских лучей на порошке формы 2 соединения 2, полученной из суспензии бисульфатной соли в ацетоне при комнатной температуре. Графическая картина получена с помощью дифрактометра Rigaku MiniFlex. На графике представлены интенсивности пиков, определенные по показаниям счетчика в секунду по отношению к углу дифракции 2Θ в градусах.
На фиг.3 представлено графическое изображение термограммы модулированной дифференциальной сканирующей калориметрии формы 1 соединения 2, полученной кристаллизацией из ацетонитрила. На графике представлен нормализованный тепловой поток в единицах Ватт/грамм (Вт/г) по отношению к температуре исследуемого образца в градусах Цельсия.
Детальное описание
Как показано в заявке на патент США с серийным №10/412982, соединение 1 представляет собой эффективный антагонист тромбинового рецептора.
Тем не менее, оказалось, что форма соединения 1, представленная свободным основанием, отмечена невысокой стабильностью кристаллического состояния. Оказалось, что бисульфатная соль соединения 1 проявляет улучшенные показатели стабильности и имеет в основном ту же самую активность. В рамках данного текста понятие «бисульфат» относится к структурной единице -HSO4. Соединение 2 имеет приведенное далее строение:
Было показано, что существуют две определенные полиморфные формы соединения 2. Эти две формы обозначены здесь как форма 1 и форма 2. Оказалось, что форма 2 нестабильна, в течение времени она переходит в кристаллическую структуру формы 1. Две кристаллические формы бисульфатной соли могут рассматриваться как полиморфные.
Полиморфизм может быть охарактеризован как способность соединения кристаллизоваться в различных кристаллических формах, сохраняя при этом ту же самую химическую формулу. Кристаллическая полиморфная форма данного лекарственного препарата химически идентична любой другой полиморфной форме этого лекарственного препарата, поскольку она содержит те же самые атомы, соединенные друг с другом тем же самым образом, однако они различаются по кристаллическим формам, что может сказываться на одном или на нескольких физических свойствах, например на стабильности, растворимости, температуре плавления, объемной плотности, свойствах сыпучести, биодоступности и т.д.
Соединение 2 имеет по крайней мере одну связь, вращение вокруг которой затруднено. Все таутомеры и ротамеры рассматриваются как входящие в объем притязаний изобретения.
Соединение 2 может существовать как в сольватированном, так и в несольватированном виде, включая гидратные формы. В общем случае сольватированные формы с такими фармацевтически приемлемыми растворителями, как вода, этанол и подобные им, эквивалентны несольватированным формам в том, что касается их применения в соответствии с изобретением.
Используемые далее в описании понятия, если не указано иное, следует понимать в соответствии с приведенными далее значениями.
Понятие «пациент» относится как к человеку, так и к другим животным.
Понятие «млекопитающее» относится как к людям, так и к другим млекопитающим животным.
Понятие «полиморфная форма» относится к такой кристаллической форме вещества, которая отличается от других кристаллических форм, но которая имеет ту же самую химическую формулу.
Понятие «спирт» относится к органическому соединению с гидроксильной группой (-ОН).
Понятие «нитрил» относится к органическому соединению с группой .
Понятие «сложный эфир» относится к органическому соединению формулы RC(O)OR, где две группы R независимо друг от друга означают алкильные или арильные группы, а скобки означают, что помещенный в них атом кислорода связан с углеродом двойной связью.
Понятие «кетон» относится к органическому соединению, содержащему карбонильную группу (С=O), соединенную с двумя алкильными группами.
Понятие «наполнитель» относится к преимущественно инертному веществу, используемому в качестве разбавителя и для придания формы или консистенции лекарственной форме.
Понятие «эффективный» или «терапевтически эффективный» предназначено для описания соответствующих настоящему изобретению соединения или композиции, проявляющих активность в качестве антагониста тромбиновых рецепторов и обеспечивающих поэтому желаемый терапевтический, ингибирующий, профилактический эффект или эффект улучшения состояния больного. Понятие «эффективное количество» или «терапевтически эффективное количество» предназначено для описания количества соответствующего настоящему изобретению соединения или композиции, проявляющего активность в качестве антагониста тромбиновых рецепторов и обеспечивающего поэтому желаемый терапевтический, ингибирующий, профилактический эффект или эффект улучшения состояния больного.
Подготовка образцов
Форму 1 соединения 2 анализируют в виде сухого порошка при исследовании дифракции рентгеновских лучей на порошке и методом модулированной дифференциальной сканирующей калориметрии. Для измельчения и классификации материала перед проведением анализа используют микронизатор. Через газовые форсунки, расположенные на равном расстоянии друг от друга по периферии камеры для измельчения, подают пропущенный через фильтр азот. Во время проведения операции включают высокоскоростной вортекс, а материал вводят в вортекс в области периферической стенки. Значительные градиенты скорости около газовых форсунок заставляют взвешенные частицы сталкиваться, что приводит к уменьшению их размеров в результате соударений. Более тяжелые частицы крупных размеров удерживаются в зоне измельчения центробежной силой. Скорость подачи и давление измельчающего газа представляют собой главные факторы, определяющие размер частиц на выходе. Измельчающий газ выходит через отверстие в верхней части по центру камеры и увлекает микронизированный продукт в используемый в качестве сборника мешок. Загрузку микронизируют в четырехдюймовом микронизаторе при скорости подачи 150 грамм в минуту (г/мин) и при размалывающем давлении 3,5 бар. Размолотый материал собирают в барабаны с вкладышами из двойных полиэтиленовых пакетов и хранят в холодильнике.
После микронизации проводят анализ образцов с минимальной подготовкой для того, чтобы не допустить какого-либо изменения их формы. Образцы слегка растирают, чтобы убедиться в том, что не произошло слипания. Для этих анализов не используют растворители, не проводят сушку или другие операции по подготовке. Данные по дифракции рентгеновских лучей на порошке и дифференциальной сканирующей калориметрии показывают, что речь в каждом отдельном идет об одной единственной форме.
Дифракция рентгеновских лучей на порошке
Анализ с помощью дифракции рентгеновских лучей на порошке проводят на дифрактометре Rigaku MiniFlex® (изготовлен в 1999 г.). В приборе используется вариабельная раздвижная щель с конфигурацией оси сканирования Θ/2Θ и медный источник излучения (Кα). Берут порошкообразный полиморфный образец и с помощью пестика ручным способом с минимальным усилием последовательно наносят его на поверхность низкого фонового рассеивателя, представляющего собой алюминиевую пластину с кремниевым покрытием. Для проверки точности позиционирования пика используют кристаллический силиконовый стандарт. Образец находится в нормальных условиях, при этом его вращают со скоростью 54 оборота в минуту (об/мин) для снижения влияния предпочтительной ориентации кристаллов. Данные рассчитывают с помощью программы для обработки изображений JADE® версии 5.0 Materials Data Inc. ("MDI"). Программа автоматически проводит конечную фильтрацию, учитывает фон и измеряет площадь и высоту каждого пика. Полученную с помощью рентгеновских лучей картину фильтруют с помощью девятиточечного параболического фильтра Savitzky-Golay, однако в других случаях важно получить необработанную картину без коррекции фона или удаления пика К-α2.
Используя описанные выше методики и оборудование, анализируют способом дифракции рентгеновских лучей порошок формы 1 соединения 2. Полученная картина дифракции рентгеновских лучей порошкового образца представлена на фиг.1. Показана зависимость интенсивности пиков (ось у - это данные показаний счетчика в секунду) для угла 2Θ (ось х - это 2Θ в градусах). В дополнение к этому получена зависимость показаний счетчика, нормализованных по времени получения данных по этапам, для угла 2Θ. Положения пиков (на оси x 2Θ), соответствующие этим кривым, представлены в таблице 1. Положения этих пиков дифракции рентгеновских лучей на порошковом образце характеризуют кристаллическую полиморфную форму 1 соединения 2.
| Таблица 1 | |
| Положения пиков дифракции рентгеновских лучей на порошковом образце формы 1 соединения 2 | |
| 2Θ (°) | |
| 9,90 | |
| 11,24 | |
| 11,77 | |
| 12,64 | |
| 13,96 | |
| 14,48 | |
| 15,68 | |
| 16,44 | |
| 17,97 | |
| 19,22 | |
| 19,52 | |
| 21,04 | |
| 21,58 | |
| 22,38 | |
| 23,06 | |
| 23,70 | |
| 24,36 | |
| 25,06 | |
| 25,89 | |
| 26,68 | |
| 28,20 | |
| 29,74 | |
| 30,78 | |
| 32,16 | |
| 34,06 | |
| 34,66 | |
| 36,12 | |
| 37,30 |
Таблица 1 характеризует кристаллическую структуру соединения 2 на основании расположения пиков дифракции рентгеновских лучей на порошке формы 1; из нее могут быть выбраны и сгруппированы по относительной интенсивности наиболее характеристические положения пиков для того, чтобы отличить эту кристаллическую структуру от других. Такая выборка отличительных пиков представлена в таблице 2. В соответствии с этим кристаллическая структура формы 1 соединения 2 может быть идентифицирована по расположению пиков в группе №1, включающей 4 положения характеристических пиков в картине дифракции рентгеновских лучей на порошке. В более предпочтительном случае кристаллическая структура формы 1 соединения 2 может быть идентифицирована по расположению пиков в группе №2, включающей 4 положения характеристических пиков в картине дифракции рентгеновских лучей на порошке из группы 1 и в дополнение к ним еще 4 положения пиков. В еще более предпочтительном случае кристаллическая структура формы 1 соединения 2 может быть идентифицирована по расположению пиков в группе №3, включающей 8 положений характеристических пиков в картине дифракции рентгеновских лучей на порошке из группы 2 и в дополнение к ним еще 4 положения пиков.
| Таблица 2 | |
| Положения характеристических пиков дифракции рентгеновских лучей на порошковом образце формы 1 соединения 2 | |
| Группа № | Положения пиков (градусов 2Θ) |
| 1 | 11,2 |
| 16,4 | |
| 19,2 | |
| 21,0 | |
| 2 | 9,9 |
| 11,2 | |
| 16,4 | |
| 19,2 | |
| 21,0 | |
| 22,1 | |
| 23,7 | |
| 26,7 | |
| 3 | 9,9 |
| 11,2 | |
| 12,6 | |
| 14,5 | |
| 16,4 | |
| 19,2 | |
| 21,0 | |
| 22,1 | |
| 23,7 | |
| 26,7 | |
| 28,2 | |
| 30,8 |
Способом дифракции рентгеновских лучей исследовался также порошок формы 2 соединения 2. Кристаллы формы 2 синтезируют из суспензии бисульфатной соли в ацетоне при комнатной температуре. Кристаллы формы 2 не подвергают микронизации. Подготовка образцов кристаллов, аналитическое оборудование и техника проведения анализа, используемые для исследования кристаллической структуры формы 2, аналогичным тем, которые описаны выше для исследования формы 1. Полученная картина дифракции рентгеновских лучей порошкового образца формы 2 представлена на фиг.2. Характер расположения пиков дифракции рентгеновских лучей на порошковом образце соответствующей формы 2 кристаллической структуры соединения 2 представлен в таблице 3. Сравнение положений пиков дифракции рентгеновских лучей порошковых форм, представленных в таблицах 1 и 3, подтверждает вывод о том, что формы 1 и 2 представляют собой разные кристаллические полиморфные формы бисульфатной соли соединения 2.
| Таблица 3 | |
| Положения пиков дифракции рентгеновских лучей на порошковом образце полиморфной формы 2 соединения 2 | |
| 2Θ Угол (°) | |
| 5,36 | |
| 10,22 | |
| 10,72 | |
| 12,92 | |
| 13,38 | |
| 15,02 | |
| 16,67 | |
| 19,16 | |
| 19,72 | |
| 21,14 | |
| 21,79 | |
| 23,06 | |
| 24,89 | |
| 26,60 | |
| 27,02 | |
| 28,24 | |
| 29,67 | |
| 30,70 | |
| 33,92 | |
| 34,71 |
Специалисту в данной области известно, что определение положений пиков дифракции рентгеновских лучей порошка определенной кристаллической формы того же самого соединения может изменяться в пределах ошибки. В заявке на патент США №10/449650 максимальное значение 2-сигма от образца к образцу для положений всех пиков с использованием одинакового способа подготовки образцов и ограниченного числа аналитических приборов определено равным 0,4. Способы калибровки, использованные на предназначенных для получения этих данных приборах, находились в рамках промышленных стандартов, но они были не столь точны, как требовалось бы для этого случая. Принимая во внимание то, что способы подготовки образцов могут изменяться, а для определения положений пиков могут быть использованы другие аналитические приборы, к этим данным можно предложить ошибку в пределах ±0,5 для 2Θ в градусах. Способ стандартизированной подготовки образцов, использование того же самого аналитического прибора и высокая точность калибровки могут повысить воспроизводимость до примерно ±0,3 градуса 2Θ или еще точнее.
Дифференциальная сканирующая калориметрия
Прибором для дифференциальной сканирующей калориметрии, использованным для исследования полиморфного образца, являлся TAInstruments®, модель 2920 (производства 2001 года), который был оборудован системой для охлаждения. Камеру ячейки дифференциального сканирующего калориметра с образцом промывают газообразным азотом ультравысокой чистоты со скоростью 40 мл/мин. Прибор калибруют индием высокой чистоты. Точность измерения температуры образца по данной методике лежит около ±1°С, а теплота плавления может быть определена с относительной ошибкой около ±5%. Образец помещают в стандартную алюминиевую чашечку для дифференциальной сканирующей калориметрии с крышечкой, которая имеет два прокола иглой для сброса давления. На дно чашечки помещают около 2 мг порошкообразного образца и слегка утрамбовывают для того, чтобы он контактировал с чашечкой. Определяют точную массу образца и фиксируют ее с точностью до сотой доли миллиграмма. В приборе используют пустую чашечку для сравнения. Прибор программируют для уравновешивания образца при температуре около 0°С в течение примерно 1 минуты и после этого начинают динамический подъем температуры со скоростью 2°С/мин до примерно 250°С с показателем модулирования ±1°С каждые 40 секунд.
Тепловой поток, который нормализован по массе образца, откладывают на графике по отношению к измеренной температуре образца. Данные соответствуют ваттам на грамм (Вт/г). График построен так, чтобы эндотермические пики были направлены вниз. В этом анализе определяют соответствующий плавлению эндотермический пик для экстраполированных начальной и конечной температур, пиковую температуру и теплоту плавления.
Графическая картина дифференциальной сканирующей калориметрии для формы 1 соединения 2 представлена на фиг.3. Фиг.3 показывает, что начало плавления лежит около 200,6°С, а эндотерме плавления соответствует температура 206,4°С. Теплота плавления составляет около 52,3 джоулей на грамм (Дж/г). Сочетание температуры плавления и теплоты плавления может быть использовано для выявления этой формы среди других.
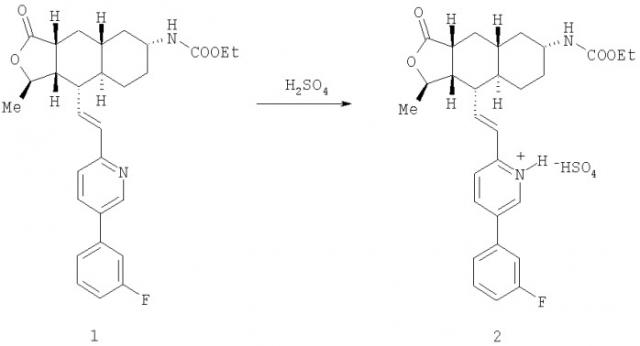
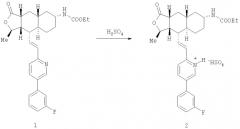
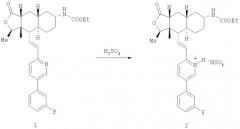
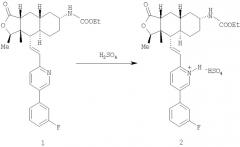
Пример 1. Синтез бисульфатной соли
Представленное далее получение бисульфатной соли, представляющей собой соединение 2, иллюстрируется схемой I, в которой использованы следующие сокращения: Me означает метильную группу, Et означает этильную группу, F означает атом фтора.
Схема I: общий способ получения соединения 2
В предпочтительном случае получение соединения 2 проводят в органическом растворителе, выбираемом из группы, состоящей из спирта (например, метанола, этанола, изопропилового спирта), нитрила (например, ацетонитрила), сложного эфира (например, этилацетата), кетона (например, ацетона), простого эфира (например, тетрагидрофурана) и их смесей.
В общем случае соединение 1 прибавляют к растворителю или к смеси растворителей и нагревают (если это необходимо) для того, чтобы перевести соединение 1 в раствор. Используемый способ нагревания может изменяться (например, подвод тепла может быть достаточным для повышения температуры растворителя до примерно 40-80°С) в зависимости от концентрации соединения 1 в растворителе. После образования раствора продолжают нагревание, поддерживая температуру. Медленно прибавляют раствор серной кислоты в том же самом растворителе. Кристаллы могут выпадать из раствора во время прибавления раствора серной кислоты. В альтернативном варианте соединение 1 может контактировать с растворителями в виде суспензии или иной смеси, не растворяясь в нем.
При использовании в представленном выше процессе в качестве растворителей изопропилового спирта, ацетона, ацетонитрила, этилацетата, изопропилацетата и тетрагидрофурана в каждом отдельном случае получают кристаллическую полиморфную форму 1.
Предпочтительно также, когда в используемом для реакции растворителе получают насыщенный раствор соединения 2 для того, чтобы контролировать кристаллизацию и уменьшать и/или предотвращать осаждение образующегося продукта на стенках. Осаждение продукта приводит к снижению выхода и к включению растворителя в выделяемое кристаллическое целевое соединение. Часто содержание включенного растворителя не удается понизить до предпочтительного уровня даже после продолжительной сушки. В предпочтительном случае осаждение соединения 2 из раствора проводят с помощью небольшого количества кристаллического соединения 2 (например, от примерно 0,1 мас.% до примерно 0,2 мас.%) для того, чтобы исключить возможность осаждения продукта на стенках.
Типичный способ получения представлен далее. Около 5 г соединения 1 растворяют в примерно 25 мл ацетонитрила. Раствор перемешивают около 10 минут и после этого нагревают до примерно 50°С. К нагретой реакционной смеси прибавляют около 6 мл 2 М раствора серной кислоты в ацетонитриле. Соединение 2 осаждается во время прибавления серной кислоты в ацетонитриле. После прибавления раствора серной кислоты реакционную смесь перемешивают 1 час и после этого охлаждают до комнатной температуры. Осажденное твердое вещество отфильтровывают и промывают ацетонитрилом в количестве около 30 мл. Влажное твердое вещество сушат в вакууме при комнатной температуре в течение 1 часа, затем примерно 12 часов при 80°С и получают около 5 г кристаллической формы соединения 2. Выход составляет около 85%. Полученный продукт анализируют в виде порошка способом дифракции рентгеновских лучей и дифференциальной сканирующей калориметрии, получая при этом соответственно графики, представленные на фиг.1 и 3, показывающие, что речь действительно идет о полиморфной форме 1.
Активность соединения, фармацевтические композиции и способы применения
В одном из вариантов реализации изобретение относится к форме 1 соединения 2, к фармацевтическим композициям на его основе для лечения различных отклонений в состоянии здоровья, симптомов и болезней и к способу получения соединения 2. Соединение 2 проявляет активность как антагонист тромбиновых рецепторов, который может быть использован для лечения болезней, ассоциирующихся с тромбозом, атеросклерозом, рестенозом, гипертензией, стенокардией, аритмией, сердечной недостаточностью, церебральной ишемией, ударом, нейродегенеративными заболеваниями и раком. Антагонисты тромбиновых рецепторов известны также как антагонисты активируемых протеазами рецепторов. Этот класс соединений, к которому относится и соединение 2, в типичном случае связывается и с каннабиноидными рецепторами (CB2), благодаря чему они могут найти применение для лечения ревматоидного артрита, эритематоза системной волчанки, рассеянного склероза, диабета, остеопороза, ренальной ишемии, церебрального удара, церебральной ишемии, нефрита, воспалительных процессов в легких и в желудочно-кишечном тракте, а также таких нарушений в дыхательных путях, как обратимая обструкция дыхательных путей, хроническая астма и бронхит.
Лекарственные формы и дозировки
При получении фармацевтических композиций на основе описываемых в настоящем изобретении соединений инертные фармацевтически приемлемые носители могут быть как твердыми, так и жидкими. Твердые лекарственные формы включают порошки, таблетки, диспергирующиеся гранулы, капсулы, крахмальные капсулы и суппозитории. Порошки и таблетки могут содержать от примерно 0,1 до примерно 95 процентов активного ингредиента. Подходящими твердыми носителями, которые известны в этой области, являются, например, микрокристаллическая целлюлоза, сахар или лактоза. Таблетки, порошки, крахмальные капсулы и капсулы могут быть использованы в качестве твердых лекарственных форм для приема через рот. Примеры фармацевтически приемлемых носителей и способы получения различных композиций представлены в A. Gennro (ред.), The Science and Practice of Pharmacy, 20-е издание, Lippincott Williams & Wilkins, Балтимор, Мэриленд, (2000).
Жидкие лекарственные формы включают растворы, суспензии и эмульсии. В качестве примера можно назвать водные или водно-пропиленгликолевые растворы для парентеральных инъекций или прибавление подсластителей и средств для замутнения в предназначенные для приема через рот растворы, суспензии и эмульсии. Жидкие лекарственные формы могут также включать растворы для интраназального введения.
Аэрозольные лекарственные формы, предназначенные для ингаляций, могут включать растворы и твердые вещества в виде порошков, которые могут сочетаться с таким фармацевтически приемлемым носителем, как инертный сжатый газ, например азот.
Речь может также идти о твердых лекарственных формах, которые предназначены для перевода их непосредственно перед применением в жидкие лекарственные формы как для введения через рот, так и для парентерального введения. В число таких жидких форм входят растворы, суспензии и эмульсии.
Соответствующие изобретению соединения могут быть также введены через кожу. Композиции для накожного применения могут быть представлены кремами, лосьонами, аэрозолями и/или эмульсиями, они могут быть также введены в состав пластырей матричного или резервуарного типа для накожного введения, которые обычно используются для этих целей.
В предпочтительном случае форму 1 соединения 2 вводят через рот. В предпочтительном случае фармацевтический препарат представляет собой унитарную лекарственную форму. В таком виде лекарственный препарат делят на унитарные дозы подходящего размера, содержащие соответствующие количества активной компоненты, например эффективное количество для достижения поставленной цели.
Дневная доза формы 1 соединения 2 для лечения болезни или болезненных состояний, представленных выше, составляет от примерно 0,001 до примерно 100 мг на кг массы тела в день, в предпочтительном случае от примерно 0,001 до примерно 10 мг/кг. Для средней массы тела 70 кг уровень дозирования в соответствии с этим составляет от примерно 0,1 до примерно 700 мг лекарства в день, принимаемых в виде