Производные диазаспиропиперидина
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным диазаспиропиперидина формулы I
где А-В означает -CH2-СН2-, -СН2-O- или -O-СН2-;
Х означает водород или гидрокси; R1 означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, циано, CF3, -OCF3, (низш.)алкокси, -SO2-(низш.)алкила, или гетероарилом, содержащим два атома азота; R2 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, CF3 или (низш.)алкокси; R3 означает водород или (низш.)алкил; n означает 0, 1 или 2, и их фармацевтически активным солям. Изобретение также относится к лекарственному средству на основе соединений формулы I, а также к их применению для получения лекарственного средства для лечения неврологических и нейропсихиатрических заболеваний. 3 н. и 9 з.п. ф-лы., 1 табл.
Реферат
Настоящее изобретение относится к соединениям формулы I
где А-В означает -СН2-СН2-, -СН2-O- или -О-СН2-;
Х означает водород или гидрокси;
R1 означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, циано, CF3, -OCF3, (низш.)алкокси, -SO2-(низш.)алкила, или гетероарилом;
R2 означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, CF3 или (низш.)алкокси;
R3 означает водород или (низш.)алкил;
n означает 0, 1 или 2,
и к их фармацевтически активным солям.
Настоящее изобретение относится к соединениям общей формулы I, содержащей их фармацевтической композиции и их применению в лечении неврологических и невропсихиатрических расстройств.
Неожиданно было найдено, что соединения общей формулы I являются эффективными ингибиторами глицинового переносчика 1 (GlyT-1) и обладают значительной селективностью по отношению к ингибиторам глицинового переносчика 2 (GlyT-2).
Шизофрения является прогрессирующим и разрушительным неврологическим заболеванием, характеризуемым эпизодическими позитивными симптомами, такими, как иллюзии, галлюцинации, нарушения мышления и психоз, и постоянными негативными симптомами, такими, как вялая эмоциональная реакция, нарушенное внимание и социальный уход, и нарушения познавательной способности (D.A.Lewis и J.A.Lieberman, Neuron, 2000, 28: 325-33). В течение десятилетий исследование было сосредоточено на гипотезе "допаминэргической гиперреактивности", которая привела к терапевтическим вмешательствам, включающим блокаду допаминэргической системы (R.J.Vandenberg и K.R.Aubrey, Exp. Opin. Ther. Targets, 2001, 5 (4): 507-518; A.Nakazato и S.Okuyama и др., 2000, Exp. Opin. Ther. Patents, 10 (1): 75-98). Данный фармакологический подход плохо применим к негативным симптомам и симптому нарушенной познавательной способности, которые являются самыми лучшими прогностическими факторами функционального результата (Т.Sharma, Br.J. Psychiatry, 1999, 174 (доп.28): 44-51).
Дополнительная модель шизофрении была предложена в середине шестидесятых годов, основанная на психотомиметическом действии, вызываемом блокадой глутаматной системы соединениями, подобными фенциклидину (РСР) и родственными агентами (кетамин), которые являются неконкурентными антагонистами рецептора N-метил-D-аспартата (NMDA). Что интересно, у здоровых волонтеров психотомиметическое действие, индуцированное РСР, включает позитивные и негативные симптомы, а также дисфункцию познавательной способности, так близко напоминающие шизофрению у пациентов (D.C.Javitt и др., 1999, Biol. Psychiatry, 45: 668-679 и ссылки в контексте). Кроме того, трансгенные мыши, экспрессирующие пониженные уровни субъединицы рецептора NMDAR1, проявляют поведенческие аномалии, подобные тем, которые наблюдались при индуцированных фармакологическим способом моделей шизофрении, поддерживая модель, при которой сниженная рецепторная активность NMDA приводит к подобному шизофрении поведению (A.R.Mohn и др., 1999, Cell, 98: 427-236).
Глутаматная нейротрансмиссия, в особенности рецепторная активность NMDA, играет решающую роль в пластичности синапсов, обучении и запоминании, такие рецепторы, как NMDA, по-видимому, служат в качестве дифференциального переключателя для синхронизации порога синаптической пластичности и формирования памяти (D.O.Hebb, 1949, The organization of behavior, Wiley, NY; T.V.Bliss и G.L.Collingridge, 1993, Nature, 361: 31-39). Трансгенные мыши, сверхэкспрессирующие субъединицу NR2B рецептора NMDA, обладают повышенной синаптической пластичностью и превосходной способностью к обучению и запоминанию (J.P.Tang и др., 1999, Nature, 401 - 63-69).
Так, если дефицит глутамата вовлечен в патофизиологию шизофрении, повышенная передача глутамата, в особенности посредством активации рецептора NMDA, прогнозировала бы получение как антипсихотических эффектов, так и проявлений усиления познавательной способности.
Известно, что аминокислота глицин обладает по меньшей мере двумя важным функциями в ЦНС. Она действует как ингибиторная аминокислота, связывая чувствительные к стрихнину глициновые рецепторы, и также влияет на возбуждающую активность, действуя в качестве незаменимого совместного агониста с глутаматом для рецепторной функции N-метил-D-аспартата (NMDA). В то время как глутамат высвобождается из синаптических окончаний зависимым от активности способом, глицин, по-видимому, присутствует на более постоянном уровне и, видимо, модулирует/контролирует рецептор для его ответа на глутамат.
Одним из наиболее эффективных способов контроля синаптических концентраций нейромедиатора является влияние на их повторное поглощение в синапсах. Нейромедиаторные переносчики путем удаления нейромедиаторов из внеклеточного пространства могут контролировать их внеклеточное время жизни и тем самым модулировать интенсивность синаптической передачи (R.R.Gainetdinov и др., 2002, Trends in Pharm. Sci., 23 (8): 367-373).
Переносчики глицина, которые образуют часть семейства натриевых и хлоридных нейромедиаторных переносчиков, играют важную роль в прекращении глицинэргических действий и поддержании концентрации внеклетчного глицина путем повторного поглощения в пресипаптических нервных окончаниях и проходящих снаружи тонких глиальных процессах.
Два различных гена глицинового переносчика были клонированы (GlyT-1 и GlyT-2) от мозга млекопитающего, которые дают начало двум переносчикам примерно с 50% гомологией аминокислотных последовательностей. Переносчик GlyT-1 представляет собой четыре изоформы (1a, 1b, 1с и 1d), являющиеся результатом альтернативного сплайсинга и альтернативного использования промоторов. Только две из этих изоформ были найдены в мозге грызунов (GlyT-1а и GlyT-1b). Переносчик GlyT-2 также в некоторой степени гетерогенен. В мозге грызунов были идентифицированы две изоформы GlyT-2 (2а и 2b). Известно, что GlyT-1 локализован в ЦНС и в периферических тканях, тогда как GlyT-2 специфичен для ЦНС. GlyT-1 преимущественно распространен в глиальных клетках и найден не только в областях, соответствующих чувствительным к стрихнину глициновым рецепторам, но также и за пределами этих областей, где, как было предположено, включен в модуляцию рецепторной функции NMDA (В.Lopez-Corcuera и др., 2001, Mol. Mem. Biol., 18: 13-20). Таким образом, одна стратегия для усиления рецепторной активности NMDA состоит в увеличении концентрации глицина в локальном микроокружении синаптических рецепторов NMDA путем ингибирования переносчика GlyT-1 (R.Bergereon и др., 1998, Proc. Natl. Acad. Sci. USA, 95: 15730-15734; L. Chen и др., 2003, J. Neurophysiol., 89 (2): 691-703).
Ингибиторы переносчиков глицина пригодны для лечения неврологических и психоневрологических нарушений. Большинство подразумеваемых болезненных состояний составляют психозы, шизофрения (R.E.Armer и D.J.Miller DJ, 2001, Exp. Opin. Ther. Patents, 11 (4): 563-572), психотические расстройства настроения, такие, как острая большая депрессия, расстройства настроения, ассоциированные с психотическими расстройствами, такими как острая мания или депрессия, ассоциированная с биполярными расстройствами, и расстройства настроения, ассоциированные с шизофренией (Е.Т.Pralong и др., 2002, Prog. Neurobiol., 67: 173-202), аутистические расстройства (M.L.Carlsson, 1998, J. Neural Transm. 105: 525-535), расстройства познавательной способности, такие, как деменции, включая возрастную деменцию и сенильную деменцию типа болезни Альцгеймера, расстройства памяти у млекопитающих, включая человека, синдром дефицита внимания и боли (R.E.Armer и D.J.Miller, 2001, Exp. Opin. Ther. Patents, 11 (4): 563-572).
Таким образом, усиление активации рецепторов NMDA посредством ингибирования переносчика GlyT-1 может привести к созданию препаратов, которые лечат психоз, шизофрению, деменцию и другие заболевания, при которых нарушены процессы познавательной способности, такие как синдром дефицита внимания или болезнь Альцгеймера.
Объектами по настоящему изобретению являются соединения формулы I как таковые, применение соединений формулы I и их фармацевтически приемлемых солей для приготовления лекарственных средств для лечения заболеваний, связанных с активацией рецепторов NMDA посредством ингибирования переносчика GlyT-1, их приготовление, лекарственные средства, основанные на соединении по изобретению и их получение, а также применение соединений формулы I при контроле и предупреждении болезней, таких как психозы, дисфункция запоминания и обучения, шизофрения, деменция и другие болезни, при которых нарушены процессы познавательной способности, такие как синдром дефицита внимания или болезнь Альцгеймера.
Предпочтительными показаниями для применения соединений по настоящему изобретению являются шизофрения, нарушение познавательной способности и болезнь Альцгеймера.
Более того, изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры.
Термин «(низш.)алкил», как он использован в контексте, означает группу с насыщенной линейной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
Термин «галоид» означает хлор, йод, фтор или бром.
Термин «арил» означает одновалентный циклический ароматический углеводородный радикал, состоящий из одного или нескольких конденсированных колец, из которых по меньшей мере одно кольцо имеет ароматическую природу, например фенил или нафтил.
Термин «гетероарил» означает циклический ароматический углеводородный радикал, содержащий один, два или три гетероатома, выбранных из группы, состоящей из кислорода, серы или азота, например пиридил, пиразинил, пиримидинил, пиридазинил, триазинил, тиазолил, тиенил, фурил, пирролил, имидазолил, пиразолил, оксазолил, изотиазолил или изоксазолил.
Термин «фармацевтически приемлемые кислотно-аддитивные соли» охватывает соли с неорганическими и органическими кислотами, такими, как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, n-толуолсульфоновая кислота и тому подобное.
Предпочтительными соединениями формулы I являются соединения формулы
где А-В означает -СН2-СН2- или -СН2-О-;
Х означает водород или гидрокси;
R1 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида (низш.)алкила, циано, CF3, -OCF3, (низш.)алкокси, -SO2-(низш.)алкила, или гетероарилом;
R2 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида или (низш.)алкокси;
R3 означает водород;
n означает 1,
и их фармацевтически активные соли.
Наиболее предпочтительными являются соединения, где n означает 1, а А-В означает -СН2-СН2-. Особенно предпочтительными соединениями из этой группы являются те, в которых R1 и R2 означают оба фенил, необязательно замещенный (низш.)алкилом, галоидом или CF3, например, следующие соединения:
цис-рац-4-фенил-8-(2-фенилциклогексил)-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-4-фенил-8-(2-n-толилцикогексил)-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-8-[2-(4-фторфенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-4-(4-фторфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-4-(4-фторфенил)-8-[2-(4-трифторметилфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он,
8-[2-(4-фторфенил)-2-гидроксициклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он,
4-(4-фторфенил)-8-[2-(3-фторфенил)-2-гидроксициклогексил]-2,8-диазаспиро[4.5]декан-1-он,
4-(4-фторфенил)-8-[2-(2-фторфенил)-2-гидроксициклогексил]-2,8-диазаспиро[4.5]декан-1-он,
8-[2-(3-хлорфенил)-2-гидроксициклогексил]-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он или
4-(4-фторфенил)-8-транс-(4-гидрокси-4-фенилтетрагидропиран-3-ил)-2,8-диазаспиро[4.5]декан-1-он.
Кроме того, предпочтительными являются соединения, в которых Х означает водород.
Изобретение относится также к соединениям, в которых Х означает гидрокси.
Объектами по настоящему изобретению являются, кроме того, соединения, в которых n означает 1, а А-В означает -СН2-О-.
Данные соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например способами, описанными ниже, которые включают
а) взаимодействие соединения формулы
с соединением формулы
с образованием соединения
где заместители имеют значения, определенные выше, или
б) взаимодействие соединения формулы
с соединением формулы
с образованием соединения формулы
где заместители имеют значения, определенные выше, или
в) при необходимости разделение рацемических форм на соответствующие энантиомеры и
при необходимости превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
Соединения формулы I могут быть получены в соответствии с вариантами способа а), б) или в) и со следующими схемами 1, 2 и 3.
Использованы следующие аббревиатуры:
ЛДА - диизопропиламид лития
ТФК - трифторуксусная кислота
ДХМ - дихлорметан
ТГФ - тетрагидрофуран
ПМГС - полиметилгидросилоксан
ДМСО - диметилсульфоксид
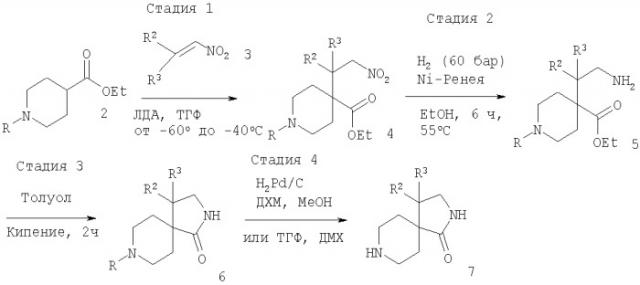
Исходя из соответствующим образом 1-замещенного пиперидин-4-алкилкарбоксилата 2, обработка с походящим основанием, обычно ЛДА, затем обработка с соответствующим образом замещенным нитроалкеном 3 приводит к нитроалкану 4. Восстановление аминогруппы, облегченное применением Ni-Ренея и водорода, обычно при давлении 60 бар и 55°С в этаноле в качестве растворителя, приводит к образованию соединения 5. Последующая циклизация путем нагревания в толуоле при кипении дает амид 6. Удаление защитной группы при стандартных условиях (обработка с ТФК в ДХМ для защитной группы R = трет-бутилоксикарбонил (Boc) или гидрогенолиз с Pd/C в ДХМ и метаноле для защитной группы R = бензил (Bn)) дает диазаспиропиперидины 7 (схема 1).
Схема 1
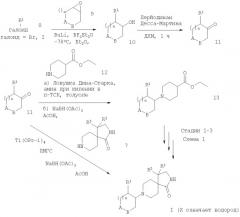
Дальнейшее взаимодействие соединений формулы 7 с соответствующими соединениями формулы 11 (которые могут быть получены реакцией арилгалоидов формулы 8 с бутиллитием и последующей реакцией с эпоксидом формулы 9 для получения спиртов формулы 10, которые окисляют в соответствующие кетоны формулы 11 с перйодинаном Десса-Мартина) в присутствии тетраизопропоксититана и триацетоксиборогидрида натрия дает соединения формулы I (схема 2). Альтернативно реакция соединений формул 7 и 11 в присутствии тетраизопропоксититана и триацетоксиборогидрида натрия (в присутствии или без ПМГС) также дает продукты формулы I. Альтернативная стратегия, при которой полное восстановительное аминирование кетонов формулы 11 с соединениями формулы 12 в приборе с ловушкой Дина-Старка дает промежуточный енамин, который может быть восстановлен in situ в соединение формулы 13. Следующие стадии 1-3, которые описаны на схеме 1, дают соединение формулы I.
Схема 2
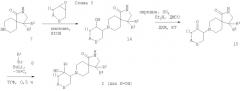
Соединения формулы I при Х=ОН получают взаимодействием соединений формулы 7 с оксидами формулы 9 в кипящем этаноле. Образующийся β-аминоспирт формулы 14 затем может быть окислен в кетон, предпочтительно с комплексом пиридин-SO3 в присутствии триэтиламина в ДМСО, давая соединения формулы 15, которые затем обрабатывают ариллитиевыми реагентами (образованные обменом галоида на металл), чтобы обеспечить подход к требуемым продуктам формулы I (схема 3).
Все соединения формул 1, 4, 5, 6, 7, 11, 10, 13, 14, 15 обычно образуются в ходе последовательных реакций в равной смеси (R,R,S)-, (S,S,R)-, (R,R,R)- и (S,S,S)-энантиомеров (рацемических форм) согласно методикам, описанным ниже. Они могут разделяться на хиральные нерацемические энантиомеры препаративной ВЭЖХ с использованием колонки Chiralpak OD или AD (5×50 см) при комнатной температуре с применением мобильной фазы этанол-гептан и с УФ-детектированием при 220 нм.
Кислотно-аддитивные соли основных соединений формулы I могут быть превращены в соответствующие свободные основания путем обработки по меньшей мере стехиометрическим эквивалентом подходящего основания, такого, как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
Соединения формулы I и их фармацевтически применимые кислотно-аддитивные соли обладают ценными фармакологическими свойствами. Конкретно было найдено, что соединения по настоящему изобретению являются эффективными ингибиторами глицинового переносчика-1 (GlyT-1).
Соединения исследовали в соответствии с тестом, приведенным ниже.
Растворы и материалы
Полная среда DMEM: питательная смесь F-12 (Gibco Life Technologies), 5% эмбриональной бычьей сыворотки (FBS) (Gibco Life Technologies), 1% пенициллина/стрептомицина (Gibco Life Technologies), 0,6 мг/мл гигромицина (Gibco Life Technologies), 1 мМ глутамин (Gibco Life Technologies).
Буфер поглощения (UB): 150 мМ NaCl, 10 мМ Hepes-трис, рН 7,4, 1 мМ CaCl2, 2,5 мМ KCl, 2,5 мМ MgSO4, 10 мМ (+)-D-глюкоза.
Клетки Flp-in™-CHO (по каталогу Invitrogen № R758-07), устойчиво трансфицированные кДНК mGlyT-1b.
Анализ ингибирования поглощения глицина (mGlyT-1b)
В день 1 клетки млекопитающего (Flp-in™-CHO), трансфицированные кДНК mGlyT-1b, помещали при плотности 40000 клеток/лунку в полную среду F-12 без гигромицина в 96-луночные культуральные планшеты. В день 2 среду аспирировали и клетки промывали дважды буфером поглощения (UB). Затем клетки инкубировали в течение 20 мин при 22°С с каждым из следующих вариантов: (i) без потенциального конкурента, (ii) 10 мМ нерадиоактивный глицин, (iii) одна концентрация потенциального ингибитора. Использовали диапазон концентраций потенциального ингибитора, чтобы получить данные для расчета концентрации ингибитора, приводящей к 50% эффекту (например, IC50 - концентрации конкурента, ингибирующего поглощение глицина на 50%). Затем незамедлительно прибавляли раствор, содержащий 60 нМ [3Н]-глицин (11-16 Ки/ммоль) и 25 мкМ нерадиоактивный глицин. Планшеты инкубировали при осторожном встряхивании, реакцию останавливали аспирацией смеси и промыванием (три раза) охлажденным льдом буфером UB. Клетки лизировали со сцинтилляционной жидкостью, встряхивали 1 ч и радиоактивность в клетках считали, используя сцинтилляционный счетчик.
Активность соединения в качестве ингибитора глицинового переносчика 1 (GlyT-1) зависит от его рацемической или энантиомерной формы.
Предпочтительные соединения проявляют IC50 (нМ) в отношении GlyT-1 менее 100.
| Пример № | IC50 (нМ) некоторых энантиомеров |
| 1 | 61 |
| 2 | 105 |
| 6 | 48 |
| 7 | 36,43 |
| 10 | 91 |
| 11 | 70 |
| 15 | 95,77 |
| 16 | 69 |
| 17 | 73 |
| 29 | 91 |
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут применяться в качестве лекарственных средств, например, в форме фармацевтических композиций. Фармацевтические композиции могут быть введены перорально, например, в форме таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение может быть также осуществлено ректально, например, в форме суппозиториев, парентерально, например, в форме инъекционных растворов.
Соединения формулы I могут быть переработаны с фармацевтически инертными неорганическими или органическими носителями для приготовления фармацевтических композиций. Например, лактоза, кукурузный крахмал или их производные, тальк, стеариновые кислоты или их соли и т.д. могут использоваться в качестве таких носителей для таблеток, таблеток с нанесенным покрытием, драже и твердых желатиновых капсул. Соответствующими носителями для мягких желатиновых капсул являются, например, растительные масла, воск, жиры, полутвердые и жидкие полиолы и тому подобное. В зависимости от природы активного вещества никакие носители, однако, не требуются в случае мягких желатиновых капсул. Соответствующими носителями для приготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и тому подобное. Соответствующими носителями для суппозиториев являются, например, природные и затвердевшие масла, воск, жиры, полужидкие или жидкие полиолы и тому подобное.
Более того, фармацевтические композиции могут содержать консерванты, солюбилизаторы, стабилизаторы, скользящие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать и другие терапевтически ценные вещества.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом по настоящему изобретению, как и способ для их получения, который включает приведение одного или нескольких соединений формулы I и/или фармацевтически приемлемых их кислотно-аддитивных солей и, если требуется, одного или нескольких терапевтически ценных веществ в галенову форму введения вместе с одним или несколькими терапевтически инертными носителями.
Наиболее предпочтительными показаниями по настоящему изобретению являются те, которые включают нарушения центральной нервной системы, например, лечение или предупреждение шизофрении, повреждение познавательной способности и болезнь Альцгеймера.
Доза может изменяться в широких пределах и, безусловно, должна будет приведена к индивидуальным требованиям в каждом конкретном случае. В случае перорального введения доза для взрослых может меняться от примерно 0,01 мг до 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Ежедневная доза может вводиться в виде однократной дозы или в разделенных дозах, и, кроме того, верхний предел может быть также превышен, когда это необходимо по показаниям.
Следующие примеры иллюстрируют настоящее изобретение без его ограничения. Все температуры даны в градусах Цельсия.
Получение структурных элементов 11
рац-2-(4-Фторфенил)циклогексанон
рац-2-(4-Фторфенил)циклогексанол
а) К раствору 1-бром-4-фторбензола (12,5 мл, 114 ммолей) в диэтиловом эфире (250 мл) при -78°С прибавляли бутиллитий (1,6 М, 68 мл, 109 ммолей) в атмосфере аргона. Через 5 мин при данной температуре прибавляли циклогексеноксид (11,0 мл, 109 ммолей), затем диэтилэфират трехфтористого бора (13, 8 мл, 109 ммолей), при этом температура повышалась примерно до -50°С. Через 4 ч при данной температуре реакцию прекращали добавлением хлорида аммония (насыщенного раствора, 200 мл) и разбавляли водой (50 мл). Затем продукт экстрагировали диэтиловым эфиром (3×100 мл) и объединенные органические экстракты сушили над сульфатом натрия. Фильтрация и упаривание дали приведенное в заглавии соединение (11,9 г, 56%) в виде кристаллов белого цвета после растирания в гексане. МС (m/z): 194,1 (М+).
рац-2-(4-Фторфенил)циклогексанон
bi) К раствору рац-2-(4-фторфенил)циклогексанола (3,8 г, 20 ммолей) в ДХМ (320 мл) прибавляли перйодинан Десса-Мартина [1,1,1-трис(ацетилокси)-1,1-дигидро-1,2-бензйодоксол-3(1H)-он] (10 г, 24 ммоля) при комнатной температуре и через 2 ч реакционную смесь промывали раствором бикарбоната натрия (10%, 150 мл). Затем органическую фазу отделяли и промывали раствором тиосульфита натрия (10%, 150 мл), затем сушили над сульфатом натрия, фильтровали и упаривали. Очистка хроматографией на силикагеле, элюирование смесью этилацетат-гексан (1:4) дали упомянутое в заглавии соединение (3,4 г, 89%) в виде кристаллов белого цвета. МС (m/z): 192,1 (М+).
рац-2-(4-Фторфенил)циклогексанон
bii) Альтернативно к раствору рац-2-(4-фторфенил)циклогексанола (7,5 г, 39 ммолей) в безводном ДМСО (67 мл) прибавляли триэтиламин (27 мл, 190 ммолей) в атмосфере аргона, образующуюся смесь охлаждали до 0°С и затем прибавляли по каплям в течение 15 мин раствор комплекса триоксид серы-пиридин (18,4 г, 116 ммолей) в безводном ДМСО. Через 1 ч смесь разбавляли водой (200 мл) и продукт экстрагировали ДХМ (2×100 мл). Затем объединенные органические экстракты сушили над сульфатом натрия, потом фильтровали и упаривали. Очистка фильтрацией через слой силикагеля, элюирование смесью этилацетат-гексан (1:4) дали упомянутое в заглавии соединение (7,1 г, 95%) в виде кристаллов белого цвета. МС (m/z): 192,1 (М+).
рац-2-n-Толилциклогексанон
рац-2-n-Толилциклогексанол
а) К раствору n-толилбромида (17,1 г, 100 ммолей) в безводном ТТФ (100 мл) прибавляли магний (2,43 г, 100 ммолей) и затем образующуюся смесь охлаждали до -20°С, прибавляли комплекс CuBr-диметилсульфид (2,0 г, 10 ммолей) и смесь перемешивали при -20°С в течение 10 мин. Затем прибавляли по каплям раствор циклогексеноксида (10 мл, 100 ммолей) в безводном ТГФ (10 мл) и реакционную смесь нагревали до температуры 0°С, при которой начиналась экзотермическая реакция. При охлаждении баней со льдом температура могла поддерживаться ниже 25°С. Затем реакционную смесь перемешивали при 0-5°С в течение дополнительных 2 ч, после чего «гасили» раствором хлорида аммония (насыщенным, 30 мл) и продукт экстрагировали трет-бутилметиловым эфиром. Затем объединенные органические экстракты промывали водой, сушили над сульфатом натрия, фильтровали и упаривали. Перекристаллизация из гексана дала упомянутое в заглавии соединение (9,9 г, 52%) в виде кристаллов белого цвета. МС (m/z): 190,1 (М+).
рац-2-n-Толилциклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-n-толилциклогексанол (4,86 г, 26 ммолей) превращали в соединение, указанное в заглавии (4,68 г, 97%), которое получали в виде кристаллов белого цвета. МС (m/z): 188,1 (М+).
рац-2-(4-Трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 4-бромбензотрифторид (10,0 г, 44 ммоля) превращали в соединение, указанное в заглавии (5,64 г, 52%), которое получали в виде твердого вещества белого цвета. МС (m/z): 244,1 (М+).
рац-2-(4-Трифторметилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-трифторметилфенил)циклогексанол (5,5 г, 23 ммоля) превращали в указанное в заглавии соединение (5,26 г, 96%), которое получали в виде твердого вещества белого цвета. МС (m/z): 242,1 (М+).
рац-2-(4-Трифторметоксилфенил)циклогексанон
рац-2-(4-Трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 1-бром-4-(трифторметокси)бензол (10,3 г, 43 ммоля) превращали в указанное в заглавии соединение (6,7 г, 60%), которое получали в виде твердого вещества белого цвета. МС (m/z): 260,1 (М+).
рац-2-(4-Трифторметоксилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-трифторметоксилфенил)циклогексанол (6,6 г, 25 ммолей) превращали в указанное в заглавии соединение (5,36 г, 82%), которое получали в виде твердого вещества белого цвета. МС (m/z): 258,2 (М+).
рац-2-(3-Фторфенил)циклогексанон
рац-2-(3-Фторфенил)циклогексанол
а) Как описано для структурного элемента 11, стадия а), 1-бром-3-фторбензол (10,0 г, 57 ммолей) превращали в указанное в заглавии соединение (5,1 г, 46%), которое получали в виде твердого вещества белого цвета. МС (m/z): 194,1 (M+).
рац-2-(3-Фторфенил)циклогексанон
Как описано для структурного элемента 11, стадия bi), рац-2-(3-фторфенил)циклогексанол (5,0 г, 26 ммолей) превращали в указанное в заглавии соединение (3,9 г, 80%), которое получали в виде твердого вещества белого цвета. МС (m/z): 192,1 (М+).
рац-2-(3-Трифторметилфенил)циклогексанон
рац-2-(3-Трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 3-бромбензотрифторид (10,0 г, 44 ммоля) превращали в указанное в заглавии соединение (4,87 г, 45%), которое получали в виде твердого вещества белого цвета. МС (m/z): 244,1 (М+).
рац-2-(3-Трифторметилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(3-трифторметилфенил)циклогексанол (4,7 г, 19 ммолей) превращали в указанное в заглавии соединение (4,34 г, 93%), которое получали в виде масла светло-желтого цвета. МС (m/z): 242,1 (М+).
рац-2-(3-Фтор-4-метилфенил)циклогексанон
рац-2-(3-Фтор-4-метилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 4-бром-2-фтортолуол (10,0 г, 53 ммоля) превращали в указанное в заглавии соединение (6,35 г, 58%), которое получали в виде твердого вещества белого цвета. МС (m/z): 208,3 (М+).
рац-2-(3-Фтор-4-метилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(3-фтор-4-метилфенил)циклогексанол (6,2 г, 30 ммолей) превращали в указанное в заглавии соединение (5,53 г, 91%), которое получали в виде твердого вещества белого цвета. МС (m/z): 206,1 (М+).
рац-2-(4-Метил-3-трифторметилфенил)циклогексанон
рац-2-(4-Метил-3-трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 4-метил-3-(трифторметил)бромбензол (4,2 г, 18 ммолей) превращали в указанное в заглавии соединение (1,95 г, 43%), которое получали в виде твердого вещества белого цвета. МС (m/z): 208,3 (M+).
рац-2-(4-Метил-3-трифторметилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-метил-3-трифторметилфенил)циклогексанол (1,91 г, 7 ммолей) превращали в указанное в заглавии соединение (1,8 г, 95%), которое получали в виде твердого вещества белого цвета. МС (m/z): 256,1 (M+).
рац-2-(4-Фтор-3-метилфенил)циклогексанон
рац-2-(4-Фтор-3-метилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 5-бром-2-фтортолуол (10,0 г, 53 ммоля) превращали в указанное в заглавии соединение (5,47 г, 50%), которое получали в виде твердого вещества белого цвета. МС (m/z): 208,2 (М+).
рац-2-(4-Фтор-3-метилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-фтор-3-метилфенил)циклогексанол (5,4 г, 26 ммолей) превращали в указанное в заглавии соединение (14,7 г, 88%), которое получали в виде масла светло-желтого цвета. МС (m/z): 206,1 (М+).
рац-2-(4-Хлор-3-трифторметилфенил)циклогексанон
рац-2-(4-Хлор-3-трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 5-бром-2-хлорбензотрифторид (8,32 г, 30 ммолей) превращали в указанное в заглавии соединение (4,4 г, 52%), которое получали в виде твердого вещества белого цвета. МС (m/z): 278,1 (М+).
рац-2-(4-Хлор-3-трифторметилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-хлор-3-трифторметилфенил)циклогексанол (4,3 г, 15 ммолей) превращали в указанное в заглавии соединение (4,13 г, 97%), которое получали в виде твердого вещества белого цвета. МС (m/z): 276,1 (М+).
Получение структурных элементов 7
рац-4-Фенил-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир рац-1-бензил-4-(2-нитро-1-фенилэтил)пиперидин-4-карбоновой кислоты
a) Раствор диизопропиллития (14 ммолей) получали обработкой диизопропиламина (1,37 г, 14 ммолей) бутиллитием (1,6 М, 8,5 мл, 14 ммолей) при -78°С в безводном ТГФ (10 мл) в атмосфере аргона и давали нагреться до -20°С. Затем данный раствор охлаждали до -60°С, прибавляли к раствору 1-бензилпиперидин-4-этилкарбоксилата (3,05 г, 12 ммолей) в ТГФ (8 мл) при -60°С и давали нагреться до -40°С в течение 1 ч, после чего по каплям прибавляли раствор транс-β-нитростирола (1,93 г, 13 ммолей) в ТГФ (8 мл). Реакционной смеси давали нагреться до комнатной температуры в течение 1 ч, затем прекращали реакцию добавлением раствора хлорида аммония (насыщенного, 40 мл) и продукт экстрагировали этилацетатом (2×40 мл). Объединенные органические экстракты затем промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Очистка хроматографией на силикагеле при элюировании смесью дихлорметан-метанол (9:1) дала указанное в заглавии соединение (4,1 г, 84%) в виде смолы светло-желтого цвета. МС (m/z): 397,4 (М+Н)+.
Этиловый эфир рац-4-(2-амино-1-фенилэтил)-1-бензилпиперидин-4-карбоновой кислоты
b) Раствор этилового эфира рац-1-бензил-4-(2-нитро-1-фенилэтил)пиперидин-4-карбоновой кислоты (3,18 г, 8 ммолей) в безводном этаноле (240 мл) гидрировали в присутствии Ni-Ренея (3 г) при давлении 60 бар и температуре 55°С в течение 3 ч. После охлаждения и снижения давления в реакционном сосуде смесь фильтровали через слой целита и фильтрат упаривали, получая в остатке указанное в заглавии соединение (2,9 г, 99%) в виде прозрачного масла. МС (m/z): 367,4 (М+Н)+.
рац-Бензил-4-фенил-2,8-диазаспиро[4.5]декан-1-он
c) Раствор этилового эфира рац-4-(2-амино-1-фенилэтил)-1-бензилпиперидин-4-карбоновой кислоты (2,9 г, 8 ммолей) в толуоле (30 мл) нагревали при кипении в течение 4 ч. После охлаждения до комнатной температуры и упаривания смесь очищали хроматографией на силикагеле, элюируя смесью дихлорметан-метанол-гидроксид аммония (95:4,5:0,5), чтобы получить указанное в заглавии соединение (1,47 г, 58%) в виде твердого вещества белого цвета. МС (m/z): 321,4 (М+Н)+.
рац-4-Фенил-2,8-диазаспиро[4.5]декан-1-он
d) Суспензию рац-бензил-4-фенил-2,8-диазаспиро[4.5]декан-1-она (28,8 г, 90 ммолей) в смеси метанол-дихлорметан (4:1, 500 мл) гидрировали в присутствии Pd (10% на угле, 14 г, 132 ммоля) при давлении 2 бара в течение 48 ч при комнатной температуре. После фильтрации через слой целита реакционную смесь упаривали и остаток растворяли в растворе гидроксида натрия (2 н., 200 мл). Продукт экстрагировали дихлорметаном (3×150 мл) и объединенные органические экстракты сушили над сульфатом натрия. Фильтрация и упаривание дали указанное в заглавии соединение (13,1 г, 63%) в виде твердого вещества белого цвета после растирания в диэтиловом эфире. МС (m/z): 231,4 (M+H)+.
Схема 1, стадия 1: фторпроизводное из соединения с Вос-защитной группой рац-4-(4-Фторфенил)-2,8-диазаспиро[4.5]декан-1-он
4-Этиловый эфир 1-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты
К раствору этилового эфира 4-пиперидинкарбоновой кислоты (20 г, 127 ммолей) в смеси диоксан-вода (1:1, 120 мл) прибавляли триэтиламин (12,87 г, 127 ммолей) при 0°С, затем ди-трет-бутилдикарбонат (35,2 г, 161 ммоль) и полученную смесь выдерживали при данной температуре в течение 2 ч. Продукт затем экстрагировали этилацетатом (3×100 мл) и объединенные органические экстракты промывали хлористоводородной кислотой (1 н., 100 мл), насыщенным солевым раствором (100 мл), сушили над сульфатом натрия, фильтровали и упаривали. Очистка перегонкой в высоком вакууме (Кугельрор) дала указанное в заглавии соединение (29,0 г, 89%) в виде бесцветной жидкости, т.кип. 140°С при 0,13 мбар. МС (m/z): 275,2 (M+NH4)+.
4-Этиловый эфир 1-трет-бутилового эфира рац-4-[1-(4-фторфенил)-2-нитроэтил]пиперидин
1,4-дикарбоновой кислоты
b) Раствор диизопропиллития получали обработкой диизопропиламина (6,98 г, 69 ммолей) бутиллитием (1,6 М, 41,3 мл, 66 ммолей) при -78°С в безводном ТГФ (45 мл) в атмосфере аргона и давали нагреться до -20°С. Затем данный раствор охлаждали до -60°С, прибавляли к раствору 4-этилового эфира 1-трет-бутиловото эфира пиперидин-1,4-дикарбоновой кислоты (15,44 г, 60 ммолей) в безводном ТГФ (45 мл) при -60°С и давали нагреться до -40°С в течение 1 ч, после чего прибавляли по каплям раствор 4-фтор-транс-β-нитростирола (10,02 г, 60 ммолей) в безводном ТГФ (40 мл). Реакционной смеси давали нагреться до комнатной температуры в течение 1 ч и затем прекращали реакцию добавлением раствора хлорида аммония (насыщенного, 250 мл), продукт экстрагировали диэтиловым эфиром (3×100 мл). Объединенные органические экстракты затем промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали, получая указанное в заглавии соединение (26,7 г, 99%) в виде смолы светло-желтого цвета. МС (m/z): 442,4 (M+NH4)+.
Этиловый эфир рац-4-(2-амино-1-фенилэтил)-1-трет-бутилпиперидин-1,4-дикарбоновой кислоты
c) Раствор 4-этилового эфира 1-трет-бутилового эфира рац-4-[1-(4-фторфенил)-2-нитроэтил]пиперидин-1,4-дикарбоновой кислоты (26,6 г, 60 ммолей) в безводном этаноле (600 мл) гидрировали в присутствии Ni-Ренея (25 г) при 50 давлении бар и температуре 50°С в течение 20 ч. После охлаждения и снижения давления в реакционном сосуде смесь фильтровали через слой целита и фильтрат упаривали, оставляя указанное в заголовке соединение (23,4 г, 99%) в виде прозрачного масла, которое использовали непосредственно на следующей стади