Молекула нуклеиновой кислоты, кодирующая hpv31 l1, экспрессирующий вектор, клетка-хозяин, вирусоподобная частица и способ ее получения, вакцина, фармацевтическая композиция и способы с их использованием
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и генетической инженерии. Предлагается синтетическая молекула ДНК, кодирующая белок HPV31 L1, а также вирусоподобные частицы HPV31, вакцина и фармацевтическая композиция, включающие в себя вирусоподобные частицы HPV31. Изобретение может быть использовано для терапии вируса папилломы. 9 н. и 8 з.п. ф-лы, 6 ил.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая заявка пользуется приоритетом временной заявки США No. 60/457,172, поданной 24 марта 2003 г., содержание которой включено в настоящую заявку в виде ссылки во всей ее полноте.
Область техники, к которой относится изобретение
Изобретение относится в целом к терапии вируса папилломы человека (HPV). Более точно, изобретение относится к синтетическим полинуклеотидам, кодирующим белок HPV31 L1, и рекомбинантным векторам и организмам-хозяевам, содержащим упомянутые полинуклеотиды. Изобретение также относится к вирусоподобным частицам HPV31 (VLPs) и их применению в вакцинах и фармацевтических композициях, предназначенных для профилактики и лечения HPV.
Уровень техники
Существует более 80 типов вирусов папилломы человека (HPV), многие из которых связаны с широким разнообразием биологических фенотипов - от доброкачественных пролиферативных папиллом до злокачественных карцином (см. для обзора McMurray et al., Int. J. Exp. Pathol. 82(1): 15-33 (2001)). HPV6 и HPV11 - это типы, наиболее часто связанные с доброкачественными папилломами, доброкачественные остроконечные кондиломы и/или небольшие дисплазии генитальной или дыхательной слизистых. HPV16 и HPV18 являются типами высокого риска, наиболее часто связанные с in situ и инвазивными карциномами шейки матки, влагалища и анального прохода. Более чем 90% карцином шейки матки связаны с инфицированием типами HPV16, HPV18 или менее широко распространенными онкогенными типами HPV31, -33, -45, -52 и -58 (Schiffman et al., J. Natl. Cancer Inst. 85(12): 958-64 (1993)). Наблюдение, что ДНК HPV обнаруживается в 90-100% случаев раковых заболеваний шейки матки, представляет собой строгое эпидемиологическое доказательство того, что HPVs вызывают карциномы шейки матки (см. Bosch et al., J. din. Pathol. 55: 244-265 (2002)).
Папилломавирусы представляют собой маленькие (50-60 нм) простые икосаэдрические ДНК-содержащие вирусы, кодирующие до восьми ранних и два поздних гена. Открытые рамки считывания (ORFs) вирусных геномов обозначены от E1 до E7, а также L1 и L2, где "E" обозначает ранние, а "L" - поздние гены. L1 и L2 кодируют белки вирусных капсидов, тогда как E-гены связаны с такими функциями, как вирусная репликация и клеточная трансформация.
Белок L1 - мажорный капсидный белок и имеет молекулярный вес 55-60 кДа. Белок L2 - это минорный капсидный белок. Иммунологические данные предполагают, что большая часть структуры белка L2 повторяет структуру белка L1. Оба белка - L1 и L2 - являются высококонсервативными у различных папилломавирусов.
Экспрессия белка L1 или комбинации белков L1 и L2 в дрожжах, клетках насекомых, клетках млекопитающих или бактериях приводит к самосборке вирусоподобных частиц (VLPs) (см. для обзора Schiller and Roden, в: Papillomavirus Reviews: Current Research on Papillomaviruses; Lacey, ed. Leeds, UK: Leeds Medical Information, pp 101-12 (1996)). VLPs морфологически сходны с аутентичными вирионами и способны индуцировать высокий титр нейтрализующих антител при введении животным или человеку. Поскольку VLPs не содержат потенциально онкогенного вирусного генома, они представляют собой безопасную альтернативу для использования живых вирусов в разработке вакцины к HPV (см. для обзора Schiller and Hidesheim, J. Clin. Virol. 19: 67-74 (2000)). Поэтому гены L1 и L2 были идентифицированы как иммунологическая мишень для разработки профилактической и терапевтической вакцин к инфекции и заболеваниям, вызываемым HPV.
Разработка вакцины к HPV и ее коммерческое производство были затруднены проблемами, связанными с получением высокого уровня экспрессии капсидных белков в успешно трансформированных организмах-хозяевах, ограничивающим продукцию очищенного белка. Поэтому, несмотря на то, что нуклеотидные последовательности дикого типа, кодирующие белки HPV L1, такие как белки HPV31 L1, идентифицированы (Goldsborough et al., Virology 171(1): 306-311 (1989), было бы весьма желательно разработать легко возобновляемый источник суммарных белков HPV, который использует нуклеотидные последовательности, кодирующие HPV31 L1, оптимизированные для экспрессии в избранной клетке-хозяине. Кроме того, было бы полезно получить большие количества HPV31 L1 VLPs, обладающих иммунными свойствами нативных белков, для использования в разработке вакцины.
Сущность изобретения
Настоящее изобретение относится к композициям и способам получения и усиления иммунных свойств белковых продуктов, экспрессирующихся генами HPV31 L1, которые связаны с раком шейки матки. Конкретно, настоящее изобретение относится к полинуклеотидам, кодирующим белок HPV31 L1, где упомянутые полинуклеотиды свободны от внутренних сигналов, терминирующих транскрипцию, которые распознавались бы клетками дрожжей. Также предлагаются синтетические полинуклеотиды, кодирующие HPV31 L1, в которых полинуклеотиды кодон-оптимизированы для высокого уровня экспрессии в клетках дрожжей. Изобретение также относится к вирусоподобным частицам HPV31 (VLPs) и позволяет использование упомянутых VLPs в иммуногенных композициях и вакцинах для профилактики и/или лечения болезни, вызываемой HPV, или связанного с HPV ракового заболевания.
Настоящее изобретение относится к синтетическим молекулам ДНК, кодирующим белок HPV31 L1. Один из аспектов изобретения состоит в том, что нуклеотидную последовательность синтетической молекулы изменяют таким образом, чтобы устранить терминирующие транскрипцию сигналы, которые распознаются клетками дрожжей. Другой аспект состоит в том, что кодоны синтетических молекул построены так, чтобы использовались кодоны, предпочтительные для клеток дрожжей. Синтетические молекулы могут быть использованы в качестве источника белка HPV31 L1, который может проходить самосборку в VLPs. Упомянутые VLPs могут быть использованы в основанных на VLP вакцинах.
Особый вариант осуществления изобретения включает в себя синтетическую молекулу нуклеиновой кислоты, которая кодирует белок HPV31 L1, представленный в последовательности SEQ ID NO:4, упомянутая молекула нуклеиновой кислоты содержит последовательность нуклеотидов, представленную в последовательностях SEQ ID NO:2 или SEQ ID NO:3.
Как изложено выше, изобретение относится к синтетическим полинуклеотидам, кодирующим ген HPV31 L1, который свободен от терминирующих транскрипцию сигналов, распознаваемых клетками дрожжей. Изобретение также относится к синтетическим полинуклеотидам, кодирующим HPV31 L1, как описано выше, которые, кроме того, изменены таким образом, что содержат кодоны, предпочтительные для клеток дрожжей.
Также предлагаются рекомбинантные векторы и рекомбинантные как прокариотические, так и эукариотические клетки-хозяева, которые содержат молекулы нуклеиновой кислоты, описываемой в настоящей заявке.
Настоящее изобретение относится к способу экспрессии белка HPV31 L1 в рекомбинантной клетке-хозяине, включающему в себя: (a) введение вектора, включающего в себя нуклеиновую кислоту, кодирующую белок HPV31 L1, в дрожжевую клетку-хозяин; причем молекула нуклеиновой кислоты свободна от внутренних терминирующих транскрипцию сигналов, которые распознаются клетками дрожжей, и (б) культивирование дрожжевой клетки-хозяина при условиях, которые позволяют экспрессию упомянутого белка HPV31 L1.
Далее, изобретение относится к способу экспрессии белка HPV31 L1 в рекомбинантной клетке-хозяине, включающему в себя: (a) введение вектора, содержащего нуклеиновую кислоту, которая кодирует белок HPV31 L1, в дрожжевую клетку-хозяин, причем молекула нуклеиновой кислоты является кодон-оптимизированной для оптимальной экспрессии в дрожжевой клетке-хозяине и (б) культивирование дрожжевой клетки-хозяина при условиях, которые позволяют экспрессию упомянутого белка HPV31 L1.
В предпочтительном варианте осуществления нуклеиновая кислота включает в себя последовательность нуклеотидов, описанную в SEQ ID NO:2 или SEQ ID NO:3.
Настоящее изобретение также относится к вирусоподобным частицам HPV31 (VLPs), способам получения HPV31 VLPs и способам использования HPV31 VLPs.
В предпочтительном варианте осуществления изобретения HPV31 VLPs продуцируются в дрожжах. В еще более предпочтительном варианте осуществления вид дрожжей выбирают из группы, состоящей из: Saccharomyces cerevisiae, Hansenula polymorpha, Pichia pastoris, Kluyvermyces fragilis, Kluveromyces lactis и Schizosaccharomyces pombe.
Другим аспектом изобретения являются вирусоподобные частицы (VLP) HPV31, которые включают в себя белок HPV31 L1, продуцируемый геном HPV31 L1, свободным от терминирующих транскрипцию сигналов, которые распознаются клетками дрожжей.
Еще один аспект изобретения - это HPV31 VLP, которая включает в себя белок HPV31 L1, продуцируемый кодон-оптимизированным геном HPV31 L1. В предпочтительном варианте осуществления этого аспекта изобретения кодон-оптимизированный ген HPV31 L1 состоит, в значительной степени, из последовательности нуклеотидов, представленной в SEQ ID NO:2 или SEQ ID NO:3.
Изобретение также относится к способу индуцирования иммунного ответа у животных, включающему в себя введение животным вирусоподобных частиц HPV31. В предпочтительном варианте осуществления HPV31 VLPs продуцируются кодон-оптимизированным геном. В еще более предпочтительном варианте осуществления HPV31 VLPs продуцируются геном, свободным от терминирующих транскрипцию последовательностей, распознаваемых клетками дрожжей.
Еще один аспект изобретения относится к способу профилактики или лечения связанного с HPV рака шейки матки, включающему введение млекопитающим вакцины, содержащей HPV31 VLPs. В предпочтительном варианте осуществления этого аспекта изобретения HPV31 VLPs продуцируются в дрожжах.
Изобретение также относится к вакцине, включающей в себя вирусоподобные частицы (VLPs) HPV31.
В альтернативном варианте осуществления этого аспекта изобретения вакцина также включает в себя VLPs по меньшей мере одного дополнительного типа HPV. В предпочтительном варианте осуществления по меньшей мере один дополнительный тип HPV выбирают из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV55, HPV56, HPV58, HPV59 и HPV68.
Изобретение также относится к фармацевтическим композициям, включающим в себя вирусоподобные частицы HPV 31. Далее, изобретение относится к фармацевтическим композициям, включающим в себя HPV31 VLPs и VLPs по меньшей мере еще одного типа HPV. В предпочтительном варианте осуществления по меньшей мере один дополнительный тип HPV избирается из группы, включающей в себя: HPV6, HPV11, HPV16, HPV18, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV55, HPV56, HPV58, HPV59 и HPV68.
В патентном описании и присоединенных пунктах патентной формулы единственное число включает в себя множественные ссылки, если из контекста с очевидностью не следует иное.
В описании и пунктах формулы изобретения используются следующие определения и сокращения.
Термин «промотор» относится к распознающему сайту цепи ДНК, с которым связывается РНК-полимераза. Промотор образует с РНК-полимеразой комплекс инициации, который запускает и направляет транскрипционную активность. Комплекс может быть модифицирован активирующими последовательностями, именуемыми «энхансеры» или «активирующие последовательности», или ингибирующими последовательностями, именуемыми «сайленсерами».
Термин «вектор» относится к некоторым средствам, благодаря которым фрагменты ДНК могут быть введены в организм-хозяин или ткань-хозяин. Существуют различные типы векторов, включающие в себя плазмиду, вирус (включая аденовирус) и космиды.
Определение "последовательность 31 L1 дикого типа" относится к представленной в заявке последовательности SEQ ID NO:1. Хотя последовательность дикого типа HPV 31 L1 была описана ранее, нет ничего необычного, что обнаруживаются минорные вариации последовательности в ДНК, полученных из клинических образцов. Поэтому эталонная последовательность HPV31 L1 дикого типа была изолирована из клинических образцов, для которых ранее было продемонстрировано содержание ДНК HPV 31 (см. Пример 1). Последовательность 31 L1 дикого типа использовалась как эталонная для сравнения с кодон-оптимизированной последовательностью HPV 31 L1, описанной в настоящей заявке (см. Фиг.1).
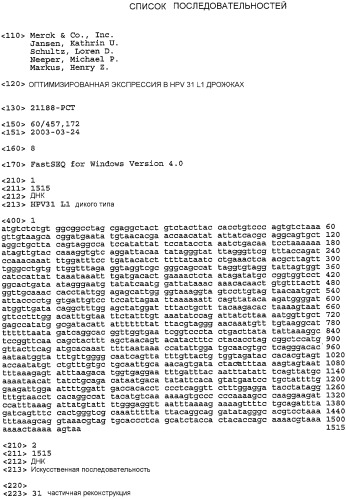
Определение "частичная реконструкция 31 L1" относится к конструктам, описанным в заявке (SEQ ID NO:2), в которых нуклеотидная последовательность HPV31 L1 частично реконструирована таким образом, что она содержит предпочтительные для клеток дрожжей кодоны для оптимальной экспрессии в дрожжах. Частичная реконструкция L1 включает в себя изменения в средней части нуклеотидной последовательности HPV 31 L1 дикого типа (нуклеотиды 697-1249). Полная последовательность HPV 31 L1 также реконструировалась с предпочтительными для дрожжей кодонами, и упоминается в настоящей заявке как "полная реконструкция 31 L1» (SEQ ID NO:3).
Термин "эффективное количество» означает, что введена достаточная композиция вакцины для продуцирования адекватного уровня полипептида, чтобы возник иммунный ответ. Специалистам в данной области техники известно, что этот уровень может варьироваться.
"Консервативное замещение аминокислоты" означает замену одного аминокислотного остатка на другой, химически сходный, аминокислотный остаток. Примерами такого консервативного замещения являются: замещение одного гидрофобного остатка (изолейцин, лейцин, валин или метионин) на другой; замещение одного полярного остатка на другой полярный остаток с таким же зарядом (например, аргинин на лизин; глютаминовая кислота на аспарагиновую кислоту).
Термин «млекопитающие [относящийся к млекопитающим]» означает любое млекопитающее, в том числе человека.
"VLP" или "VLPs" означают вирусоподобную частицу или вирусоподобные частицы [соответственно].
Термин «синтетический» означает, что ген HPV31 L1 был модифицирован таким образом, что он содержит последовательность нуклеотидов, которая не идентична последовательности нуклеотидов, присутствующей во встречающемся в природе гене HPV31 L1 дикого типа. Как определено выше, синтетические молекулы, предлагаемые в настоящей заявке, включают в себя последовательность нуклеотидов, измененную так, чтобы устранить терминирующие транскрипцию сигналы, распознаваемые клетками дрожжей. Также в заявке предлагаются синтетические молекулы, включающие в себя кодоны, которые предпочтительны для экспрессии в клетках дрожжей. Синтетические молекулы, предлагаемые в настоящей заявке, кодируют те же аминокислотные последовательности, что и ген HPV31 L1 дикого типа.
Краткое описание чертежей
Фиг.1 представляет сравнение последовательностей, показывающее нуклеотиды, которые изменены в частично (SEQ ID NO:2) и полностью реконструированных (SEQ ID NO:3) генах 31 L1 (см. Пример 2). Эталонной последовательностью является последовательность 31 L1 дикого типа (SEQ ID NO:1; см. Пример 1). Нуклеотиды в частичной и полной реконструкциях последовательности 31 L1, которые идентичны эталонной последовательности, показаны точками. Измененные нуклеотиды показаны в соответствующих положениях. Номер нуклеотида указан в скобках.
Фиг.2 показывает полную реконструкцию нуклеотидной последовательности 31 L1 (SEQ ID NO:3) и аминокислотной последовательности (SEQ ID NO:4). Номера нуклеотидов показаны слева.
Фиг.3 суммирует отличия между тремя конструктами последовательностей HPV 31 L1, которые перечислены слева. В четвертой колонке показана идентичность нуклеотидов в процентах между указанным конструктом и последовательностью 31 L1 дикого типа, а в пятой колонке показана аминокислотная идентичность. В последней колонке показаны номера нуклеотидов, которые заменены на предпочтительные для клеток дрожжей последовательности кодонов, и участок, в котором внесены изменения.
Фиг.4 показывает нозерн-блотт, исследованный специфическим зондом на HPV 31 L1 при строгих условиях (см. Пример 4). Стрелки слева показывают положение полноразмерного и укороченного транскриптов HPV 31 L1. Полосы, помеченные "31 wt", получены с тем же препаратом РНК дрожжей, содержащим последовательность 31 L1 дикого типа. Полоса, помеченная "16", содержит РНК из HPV16, которая не распознается зондом на HPV 31 L1 вследствие строгих условий. Полоса, помеченная "Neg", получена из экстракта дрожжей, не содержащего последовательностей, кодирующих L1. Полосы, помеченные "31 R", получены из РНК двух изолированных колоний, экспрессирующих частично реконструированную последовательность 31 L1.
Фиг.5 показывает часть данных двух экспериментов по количественному радиоиммуноанализу с захватом (RIA) в импульсах в минуту (имп/мин)/мг общего белка (см. Пример 7). Показатель в имп/мин, полученный при RIA, является относительным показателем количества HPV 31 L1 VLPs. Данные RIA показывают увеличение экспрессии 31 L1 VLP в экстракте белка дрожжей, полученном с реконструированных генных последовательностей с предпочтительными для клеток дрожжей кодонами.
Фиг.6 показывает эталонный образец 31 L1 VLPs, описанных в настоящей заявке, визуализированный с помощью просвечивающей электронной микроскопии (см. Пример 8). Масштабная линейка соответствует 100 нм.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Большинство карцином шейки матки связаны с инфекциями вирусами папилломы человека (HPV) специфических онкогенных типов. Настоящее изобретение относится к композициям и способам получения и усиления иммунности к белковым продуктам, экспрессируемым генами онкогенных типов HPV. Более конкретно, изобретение относится к полинуклеотидам, кодирующим HPV31 L1 и вирусоподобным частицам (VLPs) HPV31, и описывает применение упомянутых полинуклеотидов и VLPs
в иммуногенных композициях и вакцинах для профилактики и/или лечения раковых заболеваний, связанных с HPV.
Нуклеотидная последовательность HPV31 L1 была раскрыта ранее (Goldsborough et al., Virology 171(1): 306-311 (1989); Genbank Accession # J04353). Настоящее изобретение относится к синтетическим молекулам ДНК, кодирующим белок HPV31 L1. Синтетические молекулы по изобретению включают в себя последовательность нуклеотидов, в которой некоторые нуклеотиды заменены таким образом, чтобы удалить терминирующие транскрипцию сигналы, которые распознаются клетками дрожжей. В альтернативном варианте реализации кодоны синтетических молекул построены таким образом, чтобы для повышения уровня экспрессии использовать кодоны, предпочтительные для клеток дрожжей. Синтетические молекулы могут быть использованы как источник белка HPV31 L1, который может самособираться в VLPs. Упомянутые VLPs могут быть использованы в вакцинах, основанных на VLP, для получения эффективного иммунопрофилактического средства против инфекции вирусом папилломы через нейтрализующие антитела и иммунность, опосредованную клеткой. Такие вакцины, основанные на VLP, также пригодны для лечения уже наличествующих инфекций HPV.
Экспрессия HPV VLPs в клетках дрожжей предоставляет преимущества в экономичности и легкости адаптации способа к выращиванию в больших количествах с помощью ферментеров. Однако многие белки HPV L1, в том числе HPV31 L1 (см. Пример 4), слабо экспрессируются в клетках дрожжей. Было определено в соответствии с изобретением, что низкий уровень экспрессии HPV31 L1 обусловлен усечением транскрипта мРНК в результате присутствия терминирующих сигналов транскрипции, распознаваемых клетками дрожжей. Путем изменения ДНК HPV31 L1 с устранением каких-либо последовательностей, сходных с терминирующими сайтами транскрипции у дрожжей, возможно облегчить транскрипцию полноразмерной мРНК, что приводит к усилению экспрессии белка HPV31 L1.
Соответственно, в некоторых вариантах осуществления изобретения были произведены изменения ДНК HPV31 L1 с целью устранить какие-либо последовательности, потенциально сходные с терминирующими транскрипцию сигналами в клетках дрожжей. Эти изменения обеспечивают экспрессию полноразмерных транскриптов HPV31, в отличие от усеченных транскриптов (см. Пример 4), увеличивая выход экспрессии.
Как отмечено выше, синтетические ДНК по изобретению включают изменения по сравнению с последовательностью HPV31 L1 дикого типа таким образом, что в них удалены распознаваемые клетками дрожжей терминирующие сайты транскрипции. Специалистам в данной области техники известно, что новые молекулы ДНК могут быть сконструированы таким образом, чтобы они кодировали белок HPV31 L1, но не содержали при этом сайтов, терминирующих транскрипцию. Технологии для обнаружения последовательностей, терминирующих транскрипцию, хорошо известны в данной области техники. Терминирование транскрипции и формирование 3'-конца мРНК дрожжей требует наличия трех сигналов: (1) эффективного элемента, такого как TATATA или связанных с ним последовательностей, которые усиливают эффективность позиционирования элементов, расположенных далее по ходу считывания; (2) позиционирующего элемента (элементов), который определяет расположение сайта поли (A) и (3) сайта полиаденилирования (обычно поли(A)n).
В научной литературе известно множество описаний последовательностей, кодирующих сигналы, терминирующие транскрипцию у дрожжей. См., например, Guo and Sherman, Trends Biochem. Set. 21: 477-481 (1986); Guo and Sherman, Mol. Cell. Biol. 16(6); 2772-2776 (1996); Zaret et al, Cell 28: 563-573 (1982); Henikoff et al. Cell 33: 607-614 (1983); Thalenfeld et al, J. Biol. Chem. 258(23); 14065-14068 (1983); Zaret et al, J. Mol. Biol. 176: 107-135 (1984); Heidmann et al, Mol. Cell Biol 14: 4633-4642 (1984); и Russo, Yeast 11:447-453 (1985). Поэтому у специалистов в данной области техники нет затруднений в определении того, какие последовательности надо удалить, чтобы сконструировать синтетический ген HPV31 L1, который бы продуцировал полноразмерный транскрипт мРНК в соответствии с изобретением. Также, анализы и процедуры определения того, присутствуют ли в синтетической последовательности терминирующие транскрипцию последовательности, хорошо изучены в данной области техники, так что средний специалист в состоянии определить, включает ли в себя сконструированная последовательность HPV31 L1 терминирующие последовательности, которые необходимо удалить.
Как описано выше, изобретение относится к молекуле нуклеиновой кислоты, кодирующей белок 31 L1 типа HPV, каковая молекула нуклеиновой кислоты свободна от внутренних терминирующих транскрипцию сигналов, которые распознаются клетками дрожжей. В показательном варианте осуществления изобретения молекулы синтетической нуклеиновой кислоты включают в себя последовательность нуклеотидов, описанную в SEQ ID NO:2 или SEQ ID NO:3.
В типичном варианте осуществления изобретения последовательности гена HPV31 L1 «оптимизированы» для обеспечения высокого уровня экспрессии в условиях клеток дрожжей. Кодон-оптимизированные гены HPV31 L1, рассматриваемые в настоящем изобретении, включают в себя синтетические молекулы, кодирующие HPV31 L1, которые лишены внутренних сигналов, терминирующих транскрипцию, распознаваемых клетками дрожжей, и содержат по меньшей мере один кодон, который является оптимизированным для высокого уровня экспрессии в клетках дрожжей.
«Триплетный» кодон из четырех возможных нуклеотидных оснований может существовать в более чем 60 вариантах. Поскольку эти кодоны соответствуют только 20 различным аминокислотам (а также инициации и терминированию [транскрипции]), некоторые аминокислоты могут кодироваться более, чем одним кодоном - это феномен, известный как избыточность кодонов. По еще не полностью понятным причинам альтернативные кодоны не одинаково представлены в эндогенных ДНК различных типов клеток. Действительно, вероятно, существует вариабельная природная иерархия или «предпочтительность» определенных кодонов в определенных типах клеток. Одним из примеров этого может служить то, что аминокислота лейцин определяется любым из шести кодонов ДНК, включающих в себя CTA, CTC, CTG, CTT, TTA и TTG. Исчерпывающий анализ частот кодонов в геноме микроорганизмов показал, что эндогенная ДНК E. coli чаще всего содержит кодон CTG, соответствующий лейцину, тогда как ДНК дрожжей и миксомицетов наиболее часто включают в себя кодон TTA, определяющий лейцин. С точки зрения этой иерархии в целом полагают, что вероятность получения высоких уровней экспрессии богатого лейцином полипептида в E. coli как организме-хозяине зависит до некоторой степени от частоты повторяемости кодона. Например, вероятно, что ген, обогащенный кодонами TTA, хуже экспрессируется в E. coli, тогда как обогащенный CTG ген, вероятно, в этом организме-хозяине экспрессируется в высокой степени. Сходным образом, предпочтительным кодоном для экспрессии богатого лейцином полипептида в дрожжевых клетках-хозяевах является кодон TTA.
Использование феномена предпочтительности кодонов в технологиях рекомбинантных ДНК известна, и этот феномен может служить объяснением для множества предыдущих неудач в получении высоких уровней экспрессии эндогенных генов в успешно трансформированных организмах - во встроенном гене менее «предпочтительный» кодон может быть представлен многократно, и механизмы экспрессии клетки-хозяина в результате не могут действовать эффективно. Этот феномен предполагает, что синтетические гены, сконструированные с включением предпочтительных для клетки-хозяина кодонов, дают оптимальную форму чуждого генетического материала для использования в реализации технологий рекомбинантных ДНК. Таким образом, один из аспектов изобретения состоит в том, что ген HPV31 является кодон-оптимизированным для экспрессии в клетках дрожжей. В предпочтительном варианте осуществления изобретения, как было обнаружено, использование альтернативных кодонов, кодирующих последовательность того же самого белка, может устранить затруднения экспрессии белков HPV31 L1 клетками дрожжей.
В соответствии с настоящим изобретением сегменты гена HPV31 L1 были преобразованы в последовательности, имеющие последовательности, транслируемые идентичным образом, но с использованием альтернативного кодона, как описано Sharp and Cowe (Synonymous Codon Usage in Saccharomyces cerevisiae. Yeast 7: 657-678 (1991)), что включено настоящим документом по ссылке. Методология в целом состоит в идентификации кодонов в последовательности дикого типа, которые обычно не связаны с сильно экспрессирующимися генами дрожжей, и замещении их оптимальными кодонами с целью получения высокого уровня экспрессии в клетках дрожжей. Новая последовательность гена затем проверяется на нежелательные последовательности, генерируемые этими замещениями кодонов (например, последовательности "ATTTA", незапланированное формирование сайтов распознавания сплайсинга интронов, нежелательная рестрикция сайтов ферментов и т.д.). Нежелательные последовательности удаляются путем замещения существующих кодонов другими кодонами, кодирующими ту же аминокислоту. Сегменты синтетического гена затем тестируются на усиление экспрессии.
Способы, описанные выше, использовались для сегментов синтетического гена HPV31 L1, и привели к получению гена, включающие в себя кодоны, оптимизированные для высокого уровня экспрессии. В то время как описанная выше процедура суммирует нашу методологию дизайна кодон-оптимизированных генов, для использования их в вакцинах против HPV, специалистам в данной области техники ясно, что сходная эффективность вакцины или повышенная экспрессия генов может быть достигнута благодаря небольшим вариациям в процедуре или небольшим вариациям в последовательности.
Соответственно изобретение относится к синтетическому полинуклеотиду, включающему в себя последовательность нуклеотидов, кодирующих белок HPV31 L1 или биологически активный фрагмент или мутантную форму белка HPV31 L1, чья полинуклеотидная последовательность включает в себя кодоны, оптимизированные для экспрессии в дрожжевых клетках-хозяевах. Упомянутые мутантные формы белка HPV31 L1 включают в себя, но не ограничиваются этим: консервативное замещение аминокислот, усечение на амино-конце, усечение на карбоксильном конце, делеции или вставки. Любой такой биологически активный фрагмент и/или мутант кодирует белок или фрагмент белка, который по меньшей мере в значительной степени имитирует иммунобиологические свойства белка HPV31 L1, как показано в последовательности SEQ ID NO:4. Синтетические полинуклеотиды по изобретению кодируют молекулы мРНК, которые экспрессируют функциональный белок HPV31 L1, так чтобы он был пригоден для разработки терапевтической или профилактической вакцины.
Один из аспектов изобретения относится к кодон-оптимизированной молекуле, кодирующей белок HPV31 L1, описанной SEQ ID NO:4, причем упомянутая нуклеиновая кислота включает в себя последовательность, описанную в SEQ ID NO:2.
Другим аспектом изобретения является кодон-оптимизированная молекула нуклеиновой кислоты, которая кодирует белок HPV31 L1, описанный в SEQ ID NO:4, причем молекула упомянутой нуклеиновой кислоты включает в себя последовательность нуклеотидов, описанную в SEQ ID NO:3.
Изобретение также относится к рекомбинантным векторам и рекомбинантным клеткам-хозяевам, как прокариотическим, так и эукариотическим, которые содержат молекулы нуклеиновой кислоты, описанной в настоящем описании.
Синтетическая ДНК HPV31 или ее фрагменты, сконструированные способами, описанными в заявке, могут быть рекомбинантно экспрессированы путем молекулярного клонирования в вектор, который содержит соответствующие промотор и другие регуляторные элементы транскрипции, и перенесены в прокариотическую или эукариотическую клетку-хозяин для продуцирования рекомбинантного HPV31 L1. Технологии таких манипуляций в данной области техники описаны (Sambrook et al. Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, (1989); Current Protocols in Molecular Biology, Ausubel et al.. Green Pub. Associates and Wiley-Interscience, New York (1988); Yeast Genetics: A Laboratory Course Manual, Rose et al. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, (1990), которые настоящим включаются в заявку по ссылке во всей их полноте).
Таким образом, изобретение, кроме того, относится к способу экспрессирования белка HPV31 L1 в рекомбинантной клетке-хозяине, включая в себя: (a) введение вектора, включающего в себя нуклеиновую кислоту, кодирующую белок HPV31 L1, в дрожжевую клетку-хозяин; причем молекула нуклеиновой кислоты является кодон-оптимизированной для оптимальной экспрессии в дрожжевой клетке-хозяине, и (б) культивирование дрожжевой клетки-хозяина в условиях, которые позволяют экспрессию упомянутого белка HPV31 L1.
Изобретение также относится к способу экспрессии белка HPV31 L1 в рекомбинантной клетке-хозяине, включая в себя: (a) введение вектора, содержащего нуклеиновую кислоту, кодирующую белок HPV31 L1 в дрожжевую клетку-хозяин, причем молекула нуклеиновой кислоты свободна от внутренних терминирующих транскрипцию сигналов, которые распознаются клетками дрожжей, и (б) культивирование дрожжевой клетки-хозяина в условиях, позволяющих экспрессию упомянутого белка HPV31 L1.
Изобретение, кроме того, относится к способу экспрессирования белка HPV31 L1 в рекомбинантной клетке-хозяине, включающему в себя: (a) введение вектора, содержащего нуклеиновую кислоту, описанную в SEQ ID NO:2 или SEQ ID NO:3, в дрожжевую клетку-хозяин и (б) культивирование клетки-хозяина в условиях, позволяющих экспрессию упомянутого белка HPV31 L1.
Синтетические гены по изобретению могут быть собраны в экспрессионную кассету, которая содержит последовательности, сконструированные для достижения эффективной экспрессии белка HPV58 L1 в клетке-хозяине. Предпочтительно, кассета содержит синтетический ген с оперативно связанными с ним соответствующими последовательностями контроля транскрипции и трансляции, такими, как промоторная и терминирующая последовательности. В предпочтительном варианте осуществления промотором является GAL1 из S. cerevisiae, хотя специалистам в данной области техники известно, что может быть использован любой из множества других известных дрожжевых промоторов, таких как GAL10, GAL 7, ADH1, TDH3 или PGK, или другие гены-промоторы эукариот. Предпочтительным терминатором транскрипции является ADH1 из S. cerevisiae, хотя может быть использован также и другой известный терминатор транскрипции. Комбинация промотор GAL1 - терминатор ADH1 является особенно предпочтительной.
Другим аспектом изобретения является вирусоподобная частица HPV31 (VLP), способ получения HPV31 VLPs и способ использования HPV31 VLPs. VLPs могут самособираться, когда L1 - мажорный капсидный белок папилломавирусов человека и животных - экспрессируется в клетках дрожжей, клетках насекомых, клетках млекопитающих или бактериях (см. для обзора Schiller and Roden, in Papillomavirus Reviews: Current Research on Papillomaviruses; Lacey, ed. Leeds, UK: Leeds Medical Information, pp 101-12 (1996)). Морфологически неразличимые HPV VLPs могут быть также получены экспрессированием комбинации капсидных белков L1 и L2. VLPs состоят из 72 пентамеров в икосаэдрической структуре при T=7 (Baker et al., Biophys. J. 60(6): 1445-56 (1991)).
VLPs морфологически сходны с аутентичными вирионами и способны вызвать высокий уровень нейтрализующих антител при введении животному. Показано, что иммунизация кроликов (Breitburd et al., J. Virol. 69(6): 3959-63 (1995)) и собак (Suzich et aL, Proc. Natl. Acad. Sci. USA 92(25): 11553-57 (1995)) с помощью VLPs способна как индуцировать формирование нейтрализующих антител, так и защищать против экспериментальной инфекции вирусом папилломы. Однако, поскольку VLPs не содержат потенциально онкогенного вирусного генома и могут самособираться из одиночного гена, они представляют собой альтернативу использованию живого вируса в разработке вакцины к HPV (см. для обзора Schiller and Hidesheim, J. Clin. Virol. 19: 67-74 (2000)).
Таким образом, изобретение относится к вирусоподобным частицам, включающим в себя рекомбинантный белок L1 или рекомбинантные белки L1 + L2 HPV31.
В предпочтительном варианте осуществления изобретения HPV31 VLPs продуцируются в дрожжах. В еще более предпочтительном варианте реализации вид дрожжей избирается из группы, состоящей из: Saccharomyces cerevisiae, Hansenula polymorpha, Pichia pastoris, Kluyvermyces fragilis, Kluveromyces lactis и Schizosaccharomyces pombe.
Другой аспект изобретения относится к HPV31 VLP, которая включает в себя белок HPV31 L1, продуцируемый геном HPV31 L1, свободным от внутренних сигналов, терминирующих транскрипцию, которые распознаются клетками дрожжей.
Еще один аспект изобретения относится к HPV31 VLP, которая включает в себя белок HPV31 L1, продуцируемый кодон-оптимизированным геном HPV31 L1. В предпочтительном варианте осуществления этого аспекта изобретения кодон-оптимизированный ген HPV31 L1 состоит, в существенной своей части, из последовательности нуклеотидов, описанных в SEQ ID NO:2 или SEQ ID NO:3.
Еще один аспект изобретения относится к способу продуцирования HPV31 VLPs, включающему в себя: (a) трансформацию клеток дрожжей с помощью молекулы рекомбинантной ДНК, кодирующей белок HPV31 L1 или белки HPV31 L1 + L2; (б) культивирование трансформированных дрожжей в условиях, которые позволяют экспрессию молекулы рекомбинантной ДНК с получением рекомбинантного белка HPV31; и (в) выделение рекомбинантного белка HPV31 для получения HPV31 VLPs.
В предпочтительном варианте осуществления этого аспекта изобретения дрожжи трансформируются геном HPV31 L1, свободным от терминирующих транскрипцию сигналов, которые распознаются клетками дрожжей. В другом предпочтительном варианте осуществления дрожжи трансформируются с помощью кодон-оптимизированного гена HPV31 L1 для получения HPV31 VLPs. В особенно предпочтительном варианте осуществления кодон-оптимизированный ген HPV31 L1 состоит, главным образом, из последовательности нуклеотидов, описанной в SEQ ID NO:2 или SEQ ID NO:3.
Изобретение также относится к способу индуцирования иммунного ответа у животных, включающему в себя введение животному вирусоподобных частиц. В предпочтительном варианте осуществления HPV31 VLPs продуцируются геном, свободным от внутренних последовательностей терминирования транскрипции, распознающихся клетками дрожжей. В еще более предпочтительном варианте осуществления HPV31 VLPs продуцируются кодон-оптимизированным геном.
Еще одним аспектом изобретения является способ профилактики или лечения рака шейки матки, связанного с HPV, включающий в себя введение млекопитающему вакцины, содержащей HPV31 VLPs. В предпочтительном варианте осуществления этого аспекта изобретения HPV31 VLPs продуцируются в дрожжах.
Изобретение также относится к вакцине, содержащей вирусоподобные частицы (VLPs) HPV31.
В альтернативном варианте осуществления этого аспекта изобретения вакцина также содержит VLPs по меньшей мере одного дополнительного типа HPV. В предпочтительном варианте осуществления по меньшей мере один дополнительный тип HPV избирается из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV55, HPV56, HPV58, HPV59 и HPV68.
В предпочтительном варианте осуществления этого аспекта изобретения вакцина также включает в себя HPV16 VLPs.
В другом предпочтительном варианте осуществления изобретения вакцина также включает в себя HPV16 VLPs и HPV18 VLPs.
В еще одном предпочтительном варианте осуществления вакцина также содержит HPV6 VLPs, HPV11 VLPs, HPV16 VLPs и HPV18 VLPs.
Изобретение также относится к фармацевтическим композициям, содержащим вирусоподобные частицы HPV 31. Далее, изобретение относится к фармацевтическим композиция