Способ получения мононитрата сертаконазола и моногидрат мононитрата сертаконазола
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения мононитрата сертаконазола взаимодействием 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этанола с 3-бромметил-7-хлорбензо[b]тиофеном в присутствии гидросульфата тетрабутиламмония и гидроксида натрия в толуоле при 30-45°С. Полученное свободное основание сертаконазола переводят в моногидрат мононитрата сертаконазола, затем последний переводят в мононитрат сертаконазола. Описан и охарактеризован промежуточный продукт моногидрат мононитрата сертаконазола. Настоящий способ позволяет значительно упростить технологию процесса. 2 н. и 4 з.п. ф-лы, 5 ил., 2 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения имидазольных соединений, а именно сертаконазола, и его солей и псевдополиморфов.
Уровень техники
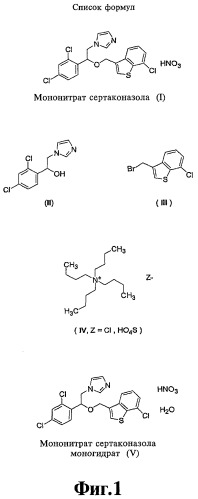
Сертаконазол (WHO-INN) является антигрибковым агентом, широко используемым в терапии инфекций, вызываемых грибками и дрожжами у людей и животных. Название "сертаконазол" означает 1-[2-(7-хлорбензо[b]тиофен-3-ил-метокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол. Обычно сертаконазол используется в виде мононитратной соли (I).
Спецификация ЕР 151477 описывает получение мононитрата сертаконазола (I) посредством реакции 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этанола (II) с гидридом натрия и 3-бромметил-7-хлорбензо[b]тиофеном (III) в гексаметилфосфорамиде (НМРА) и обработки получающегося свободного основания сертаконазола азотной кислотой.
Спецификация CN 1358719 (CAPLUS 2003:711267) описывает синтез мононитрата сертаконазола (I) посредством этерификации 3-бромметил-7-хлорбензо[b]тиофена (III) 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этанолом (II) при молярном соотношении 1:1 в системе толуол-вода (3:1 по объему) в присутствии гидроксида натрия и 50% раствора хлорида тетрабутиламмония (IV, Z=Cl) при 80°С в течение 4 часов, последующей экстракции этиловым эфиром с получением свободного основания сертаконазола, образования соли при взаимодействии с азотной кислотой и перекристаллизации из 95% этанола. Окончательное содержание мононитрата сертаконазола в продукте, полученном таким способом, составляет >98,5%.
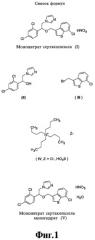
Молекулярные формулы приведены на фиг.1/I-V.
Раскрытие и осуществление изобретения
Настоящее изобретение относится к новому химическому процессу получения мононитрата сертаконазола (I).
В особенности, изобретение включает процесс получения мононитрата сертаконазола (I), который более эффективен чем таковой, описанный в ЕР 151477 и CN 1358719, и который неожиданно может давать мононитрат сертаконазола (I) клинического стандарта качества (>99,5%). В данном контексте, мононитрат сертаконазола (I) клинического стандарта качества означает материал достаточной чистоты для введения людям. Размер частиц продукта, полученного таким способом, составляет 10 мкм или менее для по меньшей мере 40% (по объему) от всего образца и 30 мкм или менее для по меньшей мере 95% (по объему) от всего образца, который представляет собой материал, пригодный для непосредственного использования в фармацевтических составах.
В отличие от спецификации ЕР 151477, процесс по настоящему изобретению не требует использования опасных растворителей, таких как гексаметилфосфорамид, известный в качестве химического мутагена (The Merck Index, page 844, 13 th Edition, 2001, Merck&Co., Inc.), и этиловый эфир, известный как легковоспламеняющаяся и взрывоопасная жидкость (ibid, page 677). Более того, процесс по настоящему изобретению намного более эффективен, чем описанный в спецификации CN 1358719 (CAPLUS 2003:711267), так как стехиометрические количества исходных соединений, необходимых для получения 1000 г конечного мононитрата сертаконазола (I), ниже чем количества, использованные в CN 1358719 (Таблица 1).
| Таблица 1. | ||
| Основные стехиометрические различия для получения 1000 г мононитрата сертаконазола (I). | ||
| Вещество | Настоящее изобретение | CN 1358719 |
| Реагент (II), {1-(2,4-Дихлорфенил)-2-(1Н-имидазол-1-ил)-этанол} | 2,40 моль | 3,39 моль |
| Реагент (III), {3-бромметил-7-хлорбензо[b]тиофен} | 2,62 моль | 3,39 моль |
| Катализатор (IV, Z=HSO4, Cl) {Тетрабутиламмоний} | 0,121 моль {Z=HSO4} | 0,488 моль {Z=Cl} |
| Молярное соотношение IV:II | 0,050 | 0,144 |
Ключевая стадия во всем процессе включает дегидрирование непосредственного прекурсора, мононитрата сертаконазола (V) моногидрата, в мононитрат сертаконазола (I).
Мононитрат сертаконазола моногидрат (V) не был описан ранее и также составляет часть настоящего изобретения. Мононитрат сертаконазола моногидрат (V) также можно назвать полиформом мононитрата сертаконазола.
В предпочтительном варианте дегидрирование проводится в смеси этанола и воды при 75-80°С, и медленным добавлением (6-8 часов) этого раствора к водному раствору азотной кислоты, охлажденному до 5-15°С, фильтрованием, высушиванием при 60-70°С, просеиванием и окончательным высушиванием при 80-90°С. Полученный таким образом мононитрат сертаконазола (I) имеет достаточную чистоту и надлежащий размер частиц для непосредственного использования в фармацевтических составах. Получение мононитрата сертаконазола моногидрата (V) включает на первой стадии реакцию 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этанола (II) с избытком 3-бромметил-7-хлорбензо[b]тиофена (III) в присутствии гидросульфата тетрабутиламммония (IV, Z=HO4S) и гидроксида натрия в толуоле при 30-45°С, с последующим добавлением воды, охлаждением смеси до температуры 0-15°С, фильтрованием, промывкой полученного твердого материала водой и толуолом, кипячением свободного основания сертаконазола в абсолютном этаноле до полного растворения, нагреванием массы при 60-80°С и добавлением воды, дальнейшим охлаждением до 5-15°С, отфильтровыванием полученного твердого продукта и промывкой его смесью этанола и воды, повторным растворением полученного чистого свободного основания сертаконазола в абсолютном этаноле при 70-80°С, охлаждением смеси до температуры 65-75°С, последующим добавлением 60% водного раствора азотной кислоты, выдерживанием при этой температуре 10-20 минут при рН ниже 2, охлаждением смеси до 5-15°С и выдерживанием при этой температуре от 30 минут до 2 часов, последующим фильтрованием и промывкой с получением мононитрата сертаконазола моногидрата (V).
В другом варианте молярное отношение реагент II: реагент III - от 0,85 до 0,95.
В другом варианте молярное отношение катализатора (IV, Z=HSO4) к лимитирующему реагенту (II) - от 0,025 до 0,060.
В другом варианте молярное отношение катализатора (IV, Z=HSO4) к лимитирующему реагенту (II) - от 0,045 до 0,055. В наиболее предпочтительном варианте молярное отношение катализатора (IV, Z=HSO4) к лимитирующему реагенту (II) равно 0,050.
Фармацевтические композиции означают средства для наружного применения, такие как добавки для ванн, кремы, гели, мази, пасты для кожи, медицинские пластыри, пенки для кожи, шампуни, растворы для приготовления спреев для кожи, суспензии для приготовления спреев для кожи, порошки для приготовления спреев для кожи, жидкости для кожи, растворы для кожи, суспензии для кожи, эмульсии для кожи, порошки для кожи, чрезкожные пластыри, коллодии, медицинские лаки для ногтей, припарки, палочки для кожи, губки для кожи, пропитанные перевязки и им подобные; вагинальные препараты, такие как вагинальные кремы, вагинальные гели, вагинальные мази, вагинальные пенки, вагинальные растворы, вагинальные суспензии, вагинальные эмульсии, таблетки для приготовления вагинальных растворов, вагинальные суппозитории, твердые вагинальные капсулы, мягкие вагинальные капсулы, вагинальные таблетки, шипучие вагинальные таблетки, медицинские вагинальные тампоны, вагинальные системы доставки и им подобные; препараты для слизистой рта и горла, такие как жидкости для полоскания, концентраты для полосканий, порошки для приготовления растворов для полосканий, таблетки для приготовления растворов для полосканий, растворы для слизистой горла, суспензии для слизистой горла, капли для слизистой горла, спреи для слизистой горла, подъязычные спреи, жидкости для полоскания рта, таблетки для приготовления растворов для полоскания рта, растворы для десен, гели для слизистой горла, пасты для слизистой горла, гели для десен, пасты для десен, подъязычные таблетки, муко-адгезивные таблетки для медленного растворения в щечном кармане, таблетки для медленного растворения в щечном кармане, лепешки, прессованные лепешки, пастилки и им подобные;
зубные препараты, такие как зубные гели, зубные палочки, зубные вставки, зубные порошки, зубные растворы, зубные суспензии, зубные эмульсии, зубные пасты и им подобные.
Другим вариантом настоящего изобретения является мононитрат сертаконазола (I), характеризующийся размерами частиц 10 мкм или менее для как минимум 40% всего образца и 30 мкм или менее для как минимум 95% всего образца.
Другим вариантом настоящего изобретения является мононитрат сертаконазола моногидрат (V).
Настоящее изобретение далее будет описано более детально на следующих примерах. Технические границы настоящего изобретения не лимитированы этими примерами.
Пример 1
Мононитрат сертаконазола моногидрат (V) (псевдополиморф мононитрата сертаконазола)
В 2-литровую колбу загрузили 308 мл толуола, 100 г 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этанола (II) (0,389 моль) и 6,67 г гидросульфата тетрабутиламмония (IV, Z=HSO4) (0,0196 моль). Затем добавляли 155 г гидроксида натрия (чистота 49%; 1,905 моль). Смесь нагревали до 35-40°С и перемешивали 15 минут. Раствор, состоящий из 111,11 г 3-бромметил-7-хлорбензо[b]тиофена (III) (0,425 моль) и 595 мл толуола, добавляли в течение не менее 30 минут, удерживая температуру реакционной смеси между 37 и 40°С. После добавления систему выдерживали при 37-40°С в течение 2,5 часов и затем добавляли воду (635 мл). Смесь охлаждали до 5-10°С и выпавший сертаконазол отфильтровывали и промывали водой и холодным толуолом (5-10°С), получая 179,7 г сырого свободного основания сертаконазола (161,7 г в сухом состоянии).
Полученное свободное основание сертаконазола загружали в 2-литровый реактор, содержащий 848 мл абсолютного этанола. Смесь кипятили до полного растворения. Затем реакционную смесь нагревали до температуры 68-72°С и добавляли 236 мл воды. Смесь охлаждали до 10°С и выдерживали при этой температуре 1 час. Образующееся твердое вещество отфильтровывали и промывали предварительно охлажденными до 10°С 160 мл абсолютного этанола и 51 мл воды. Было получено сырое (177,9 г) чистое свободное основание сертаконазола (158 г в высушенном состоянии). Полученное чистое свободное основание сертаконазола загружали в 2-литровый реактор и снова растворяли в 932 мл абсолютного этанола при 75°С. Смесь затем охлаждали до температуры 67-70°С и добавляли раствор, содержащий 53,7 г (0,512 моль) 60% азотной кислоты в 193 мл воды. Температуру стабилизировали на 15 минут, проверяя, чтобы рН был ниже 2. Смесь охлаждали до 10°С и выдерживали 1 час. Выпавшее вещество отфильтровывали и промывали водой, получая 215,9 г мононитрата сертаконазола моногидрата (V) (псевдополиморф мононитрата сертаконазола). Выход 88,7%.
Аналитические данные
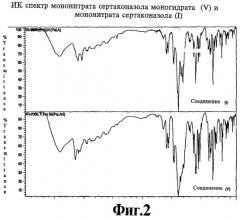
ИК (инфракрасная спектроскопия): Использовался Magna-IR 550 Nicolet спектрометр с базой данных на программном обеспечении Omnic 2,1. Полученный ИК-спектр мононитрата сертаконазола моногидрата (V) в сравнении с мононитратом сертаконазола (I) приведен на фиг.2.
ДСК (дифференциальная сканирующая калориметрия): Использовался прибор Mettler TA-8000, включающий компоненты DSC-820 и TG-50 и весы МТ-5, снабженный базой данных на программном обеспечении TAS 810 1,1. Образец продукта от 1 до 5 мг взвешивали в 40 мкл алюминиевом тигеле, соблюдая следующие условия.
Температурный интервал 110-180°С
Скорость нагрева: 10°С/мин
Поток азота: 100 мл/мин.
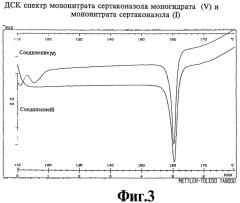
Полученные результаты ДСК мононитрата сертаконазола моногидрата (V) в сравнении с мононитратом сертаконазола (I) приведены на фиг.3.
Микроскопия: Использовался блок Nikon-Eclipse E-600 с поляризованным светом, снабженный нагревающей поверхностью Linkam THMS 600, базой данных Linksys и программой обработки изображений. Некоторые частицы продукта суспендировали в минеральном масле на стекле и образец исследовали под увеличением, зависящим от размеров частиц, и использованием поляризованного света или без него. Микрофотографии мононитрата сертаконазола моногидрата (V) и мононитрата сертаконазола (I) приведены на фиг.4.
Диффракция рентгеновских лучей. Использовался прибор Siemens D-500 для измерения диффракции рентгеновских лучей в порошках. Дифрактограммы мононитрата сертаконазола моногидрата (V) и мононитрата сертаконазола (I) приведены на фиг.5. Данные кристаллов и структурных уточнений для мононитрата сертаконазола моногидрата (V) приведены в Таблице 2.
| Таблица 2 | ||
| Данные кристалла и структурное уточнение мононитрата сертаконазола моногидрата (V) | ||
| Эмпирическая формула | C20H15Cl3N2OS. HNO3. Н2O | |
| Вес по формуле | 518,78 | |
| Температура | 293(2) °К | |
| Длина волны | 0,71069 Å | |
| Кристаллическая система | Моноклинная | |
| Пространственная группа | P21/c | |
| Параметры кристаллической ячейки | а=16,049(2) Å | α=90° |
| b=8,946(7) Å | β=102,046(7)° | |
| с=15,990(3) Å | γ=90° | |
| Объем | 2245(2) Å3 | |
| Z | 4 | |
| Плотность(вычислено) | 1,535 мг/м3 | |
| Коэффициент поглощения | 0,540 мм-1 | |
| Размеры кристалла | 0,1×0,1×0,2 мм | |
| Тета-пределы накопления данных | От 1,30 до 30,07° | |
| Пределы индекса | -3≤h≤16, -12≤k≤12, -22≤I≤21 | |
| Получено отражений | 11440 | |
| Независимых отражений | 5861 [R(int)=0,1748] | |
| Метод уточнения | Полноматриксный метод наименьших квадратов по F2 | |
| Данные/ограничения/параметры | 3246/1/336 | |
| Коэффициент F2 | 0,980 | |
| Окончательные индексы R [I>2σ(I)] | R1=0,0644,WR2=0,1302 | |
| Индексы R (все данные) | R1=0,3270, WR2=0,2365 | |
| Коэффициент экстинкции | 0,0000(6) | |
| Наибольший диффракционный пик и яма | 0,356 и -0,429 е. Å3 |
Пример 2
Мононитрат сертаконазола (I)
Мононитрат сертаконазола моногидрат (V) (215,9 г, 0,344 моль), полученный как описано выше, растворяли в 991 мл абсолютного этанола и 150 мл воды. Смесь нагревали при 75-80°С и затем добавляли к другому раствору, охлажденному до 10°С и содержащему 2,8 л воды и 1,7 г 60%-ной азотной кислоты, в течение примерно 6-8 часов. По окончании добавления смесь перемешивали 15 минут при 10°С. Полученное вещество было отфильтровано, высушено при 65°С, просеяно и окончательно высушено при 85°С с получением 162,2 г мононитрата сертаконазола (I). Выход 93,9%. Общий выход 83,3%. Размер частиц составлял 10 мкм для 40% всего образца и 30 мкм для 95% всего образца. Т.пл. 158-160°С. Содержание мононитрата сертаконазола в полученном продукте было >99,5%.
1. Способ получения мононитрата сертаконазола (I), в котором сначала осуществляют химическую реакцию 1-(2,4-дихлорфенил)-2-(1Н-имидазол-1-ил)этанола (II) с 3-бромметил-7-хлорбензо[b]тиофеном (III) в присутствии гидросульфата тетрабутиламмония (IV) и гидроксида натрия в толуоле при 30-45°С, после чего к смеси добавляют воду, ее охлаждают до температуры 0-15°С и затем твердое вещество отделяют фильтрованием и промывают водой и толуолом; полученное таким образом свободное основание сертаконазола смешивают с абсолютным этанолом и нагревают в колбе с обратным холодильником до полного растворения; смесь нагревают до 60-80°С и к ней добавляют воду, затем смесь охлаждают до 5-15°С; полученное твердое вещество отделяют фильтрованием и промывают раствором этанола в воде; полученное чистое свободное основание сертаконазола растворяют в абсолютном этаноле при 70-80°С, смесь охлаждают до 65-75°С, добавляют раствор, содержащий 60% азотную кислоту в воде, и выдерживают при этой температуре 10-20 мин, поддерживая рН ниже 2; смесь охлаждают до 5-15°С и выдерживают при этой температуре от 30 мин до 2 ч; затем твердое вещество отделяют фильтрованием и промывают с получением мононитрата сертаконазола моногидрата (V); а затем полученный мононитрат сертаконазола моногидрат растворяют в растворе этанола в воде, смесь нагревают до 75-80°С и добавляют к охлажденному до 5-15°С водному раствору азотной кислоты, фильтруют, сушат при 60-70°С, просеивают и окончательно высушивают при 80-90°С.
2. Способ по п.1, в котором молярное соотношение реагента II к реагенту III составляет от 0,85 до 0,95.
3. Способ по п.1 или 2, в котором молярное соотношение катализатора (IV) к лимитирующему реагенту II составляет от 0,025 до 0,060.
4. Способ по п.3, в котором молярное соотношение катализатора (IV) к лимитирующему реагенту II составляет от 0,045 до 0,055.
5. Способ по п.3, в котором молярное соотношение катализатора (IV) к лимитирующему реагенту II составляет 0,050.
6. Мононитрат сертаконазола моногидрат (V).