Жидкие фармацевтические композиции, содержащие производные 3,7-диазабицикло(3,3,1)нонана, для лечения антиаритмических реакций
Иллюстрации
Показать всеНастоящее изобретение относится к способу лечения и/или профилактики антиаритмических приступов у человека, предпочтительно при конверсии недавнего начала предсердной фибрилляции (Afib) или трепетания в нормальный синусовый ритм (NSR) у пациентов, включающему ступенчатое, полностью прерывное или частично непрерывное введение жидкой фармацевтической композиции, содержащей терапевтически эффективное количество производных 3,7-диазабицикло[3,3,1]нонана формулы (1). Изобретение обеспечивает более эффективное лечение. 13 з.п. ф-лы, 2 ил., 9 табл.
Реферат
Настоящее изобретение относится к применению производных 3,7-диазабицикло[3,3,1]нонана, предпочтительно производных 9,9-алкилен-3,7-диазабицикло[3,3,1]нонана и наиболее предпочтительно к применению тедисамила, и их физиологически приемлемых кислотно-аддитивных солей и/или сольватов в виде жидких фармацевтических препаратов для лечения и/или профилактики антиаритмических явлений у человека, предпочтительно при конверсии недавнего начала фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм у пациентов. Кроме того, изобретение относится к способу лечения и фармацевтическим продуктам.
Производные 9,9-алкилен-3,7-диазабициклононана формулы I и их фармакологическая активность известны из опубликованного патента ЕР 103833, соответствующего патента US 4550112 и патента FI 76338. Соединения формулы I являются подгруппой производных 9,9-N,N'-тетразамещенных 3,7-диазабицикло[3,3,1]нонана, приведенных в описаниях упомянутых выше патентов, и могут быть получены описанными в них способами. Описания упомянутых выше патентов раскрывают, что соединения обладают полезными кардиотоническими свойствами, особенно эффектами сохранения кислорода и воздействиями на скорость сердечных сокращений и сердечный ритм в частности, и отличаются высокой физиологической переносимостью. Так, соединения проявляют удовлетворительное антиаритмическое действие даже при низких дозах. Более того, нежелательное отрицательное воздействие на сократительную способность сердца чрезвычайно мало, т.е. соединения обладают особенно благоприятным отношением антиаритмического или рефракторного периода продолжающейся сердечной деятельности к отрицательным инотропным вторичным активностям.
Кроме того, в патенте US 5164401 на имя Burow и др. соединения имеют также продолжительное диуретическое действие с благоприятным соотношением между натриевой и калиевой экскрецией.
Кроме того, специальные соли и их получение из производных 3,7-диазабицикло[3,3,1]нонана, в особенности производных 9,9-алкилен-3,7-диазабицикло[3,3,1]нонана, описаны в патенте US 324732. Так, патент US 5324732 описывает соли упомянутых соединений с фумаровой кислотой, содержащие 1,5 моля фумаровой кислоты на моль соединения.
Фибрилляция предсердий (Afib) является наиболее широко распространенной устойчивой сердечной аритмией, требующей госпитализации и поражающей миллионы людей во всем мире. Преобладание Afib увеличивается с возрастом и при наличии структурного сердечного заболевания, она немного чаще встречается у мужчин, чем у женщин. Фибрилляция предсердий ассоциируется со значительной смертностью и распространенностью заболевания и значительно влияет на качество жизни. Восстановление нормального синусового ритма (NSR) у пациентов с этими аритмиями может улучшить их гемодинамическое состояние, ослабить симптомы и, возможно, снизить опасность эмболии. Хотя это может быть достигнуто с использованием электроимпульсной терапии при постоянном токе, методика имеет ограничения, такие как общая анестезия и госпитализация. Соответственно в качестве притягательной альтернативы предложена фармакологическая конверсия; с этой целью было испытано множество антиаритмических препаратов. Однако многие из этих агентов обладают серьезными побочными эффектами, такими как потенциал для проаритмии, нарушение функции левого желудочка (LV) или экстракардиальные нежелательные эффекты. Следовательно, существует необходимость в создании новых антиаритмических препаратов не только с хорошей клинической эффективностью, но также с благоприятным профилем безопасности.
Тедисамил является антиаритмическим агентом нового класса III, который блокирует множественные калиевые каналы и замедляет синусовый ритм. Он продлевает потенциальную продолжительность как атриального, так и вентрикулярного действия путем блокирования переходного внешнего Ito, АТФ-зависимого IK-АТФ и замедленного выпрямительного калиевых токов IKr, IKs
и IKu. Тедисамил продлевает потенциальную продолжительность действия сильнее в предсердиях, чем в желудочках. В отличие от других препаратов, селективно блокирующих калиевые каналы, тедисамил не обладает обратимыми зависимыми от интенсивности воздействиями на атриальную рефрактерность, которая делает его намного менее похожим на проаритмический препарат. Наконец, тедисамил обладает также значительными антистенокардическими и антиишемическими свойствами. Настоящее проспективное, рандомизированное, контролируемое испытание выявило эффективность и безопасность тедисамила для быстрой конверсии фибрилляции предсердий (Afib) или трепетания предсердий (Aflu).
Объектом изобретения является обеспечение новых фармацевтических композиций и новых способов лекарственного лечения пациентов, нуждающихся в лечении и/или профилактике антиаритмических состояний.
Другим объектом изобретения является обеспечение новых антиаритмических композиций, имеющих улучшенный эффект у человека, нуждающегося в лечении и/или профилактике антиаритмических состояний. Дальнейшей целью настоящего изобретения является обеспечение фармацевтических продуктов, связанных с упомянутыми выше целями.
Цели изобретения достигаются путем неожиданного обнаружения того факта, что известные благоприятные фармакологические свойства производных 3,7-диазабицикло[3,3,1]нонана, предпочтительно производных 9,9-алкилен-3,7-диазабицикло[3,3,1]нонана и наиболее предпочтительно тедасамила, и их фармацевтически приемлемых кислотно-аддитивных солей и/или сольватов, и/или депо-форм упомянутых соединений особенно могут быть в дальнейшем усилены при лечении и/или профилактике антиаритмических состояний у пациентов, предпочтительно при конверсии недавнего начала фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм (NSR) человека, когда вводятся в виде жидкой композиции в соответствии со специфическим путем введения или схемой вместо полностью однократного и/или продолжительного введения. В соответствии с дальнейшими аспектами по изобретению цели достигаются путем обеспечения антиаритмической жидкой фармацевтической композиции, включающей антиаритмическое количество, эффективное у человека, по меньшей мере, одного активного в антиаритмическом отношении производного 3,7-диазабицикло[3,3,1]нонана, как описано в настоящем изобретении, способа лечения и фармацевтических продуктов, адаптированных или пригодных для специфического и изобретательского пути введения или схемы.
Предметом изобретения поэтому является жидкая фармацевтическая композиция, включающая терапевтически эффективное количество по крайней мере одного производного 3,7-диазабицикло[3,3,1]нонана, по крайней мере, физиологически приемлемой его кислотно-аддитивной соли и/или сольвата, и/или депо-формы, для лечения и/или профилактики антиаритмических состояний у пациентов, предпочтительно при конверсии недавнего начала фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм (NSR) человека, жидкая фармацевтическая композиция, которая предпочтительно применима для ступенчатого, для полностью прерывистого и/или необязательно для только частично непрерывного введения, предпочтительно для двухступенчатого введения двух непрерывно вводимых фаз.
В частности, предмет изобретения имеет отношение к жидкой фармацевтической композиции, которая отличается тем, что она пригодна для инфузии, предпочтительно для ступенчатого инфузионного введения, причем необязательно каждый этап является частично непрерывным инфузионным введением, предпочтительно для двухступенчатого инфузионного введения двух вводимых непрерывной инфузией фаз.
Термин «жидкая» означает любую текучую форму производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемую кислотно-аддитивную соль и/или сольват, и/или депо-форму, пригодные для введения человеку. Следовательно, жидкая композиция может быть раствором, эмульсией, включая микроэмульсию и наноэмульсию, или суспензией, включая микросуспензию и наносуспензию. Термины «ступенчатое» и/или «полностью прерывистое» указывают, что жидкая композиция по изобретению не применяется на этапе полностью однократного и/или непрерывного введения или в схеме с полностью однократным и/или непрерывным введением, но применяется или на одном этапе по крайней мере с двумя фазами по схеме различно вводимой дозы, или по крайней мере в два этапа по схеме различно вводимой дозы. Каждая фаза или этап могут быть сами или непрерывными или только частично непрерывными. Наиболее предпочтительно, когда каждая фаза или этап является непрерывным.
Производные 3,7-диазабицикло[3,3,1]нонана, их физиологически приемлемые кислотно-аддитивные соли и/или сольваты, и/или их депо-формы, которые могут быть применены по настоящему изобретению в фармацевтических композициях для лечения и/или профилактики антиаритмических состояний у пациентов, предпочтительно для конверсии недавнего начала фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм (NSR) человека, являются производными 3,7-диазабицикло[3,3,1]нонана, соответствующими формуле I:
где
R1 означает алкильную группу, содержащую 1-6 атомов углерода, алкиленовую группу, содержащую 3-6 атомов углерода, имеющую двойную связь, которая не связывает непосредственно атом азота, циклоалкилалкильную группу, содержащую 4-9 атомов углерода, или бензильную группу,
R2 означает (низш.)алкильную группу, и
R3 означает (низш.)алкильную группу или
R2 и R3 образуют вместе алкиленовую цепь, содержащую 3-6 атомов углерода, и
R4 означает алкильную группу, содержащую 1-6 атомов углерода, алкенильную группу, содержащую 3-6 атомов углерода, имеющую двойную связь, которая не связывает непосредственно атом азота, циклоалкилалкильную группу, содержащую 4-9 атомов углерода, группу, соответствующую формуле а:
где
R5 означает водород, галоид, (низш.)алкил или (низш.)алкокси, и
Z означает алкиленовую цепь, содержащую 1-3 атома углерода, или пропениленовую цепь, имеющую двойную связь, которая сопряжена с фенильной группой, или группу, соответствующую формуле б:
где
R6 означает водород, галоид, (низш.)алкил или (низш.)алкокси, и
R7 означает водород, галоид, (низш.)алкил или (низш.)алкокси, или их физиологически приемлемую кислотно-аддитивную соль и/или сольват.
Особенно полезными соединениями по изобретению являются соединения формулы I, где R1 означает алкильную группу, содержащую 1-6 атомов углерода, или циклоалкилалкильную группу, содержащую 4-7 атомов углерода. В дополнительных предпочтительных соединениях формулы I заместитель R4 означает алкильную группу, содержащую 1-6 атомов углерода, циклоалкилалкильную группу, содержащую 4-7 атомов углерода, или группу, соответствующую формуле б.
Предпочтительными соединениями, полезными по настоящему изобретению, являются соединения формулы I, где R1 означает алкильную группу, содержащую 3-6 атомов углерода, или циклоалкилалкильную группу, содержащую 4-7 атомов углерода, и R4 означает алкильную группу, содержащую 3-6 атомов углерода, или циклоалкилалкильную группу, содержащую 4-7 атомов углерода. Упомянутое производное 3,7-диазабицикло[3,3,1]нонана может быть производным 9,9-алкилен-3,7-диазабицикло[3,3,1]нонана формулы I, где R2 и R3 образуют вместе алкиленовую цепь, содержащую 4-5 атомов углерода, а R1 и R4 означают каждый независимо один от другого линейную или разветвленную алкильную группу из 3-4 атомов углерода или циклопропилметильную группу, и их физиологически приемлемые кислотно-аддитивные соли и/или сольваты. Предпочтительными солями для данной группы соединений являются соли фумаровой кислоты с производным 9,9-алкилен-3,7-диазабицикло[3,3,1]нонана, содержащие 1,5 моля фумаровой кислоты на моль соединения формулы I.
Дополнительными предпочтительными полезными соединениями по настоящему изобретению являются соединения, выбранные из группы, состоящей из N,N'-дициклопропилметил-9,9-тетраметилен-3,7-диазабицикло[3,3,1]нонана
(тедисамила), N-изобутил-N'-изопропил-9,9-пентаметилен-3,7-диазабицикло[3,3,1]нонана и их физиологически приемлемых кислотно-аддитивных солей и/или сольватов. Предпочтительными солями для данной группы соединений являются соли фумаровой кислоты с N,N'-дициклопропилметил-9,9-тетраметилен-3,7-диазабицикло[3,3,1]нонаном (тедисамилом) или N-изобутил-N'-изопропил-9,9-пентаметилен-3,7-диазабицикло[3,3,1]нонаном, содержащие 1,5 моля фумаровой кислоты на моль упомянутого производного 9,9-алкилен-3,7-диазабицикло[3,3,1]нонана.
Альтернативно в качестве кислотно-аддитивных солей производных 3,7-диазабицикло[3,3,1]нонана соли с хлористоводородной кислотой являются также очень полезными в контексте по настоящему изобретению.
Особенно предпочтительными производными 3,7-диазабицикло[3,3,1]нонана являются производное 9,9-алкилен-3,7-диазабицикло[3,3,1]нонана тедисамил и его физиологически совместимые кислотно-аддитивные соли и/или сольваты, и/или депо-формы. Они являются наиболее предпочтительно применяемыми в качестве соединений в жидких фармацевтических композициях. Если применяется кислотно-аддитивная соль тедисамила, она может предпочтительно применяться по изобретению в форме гидрохлорида тедисамила или в форме полуторафумарата тедисамила. Дополнительные фармакологически совместимые кислотно-аддитивные соли тедисамила известны из ЕР 103833. Так, соли с неорганическими кислотами, например, серной кислотой или галоидоводородными кислотами, особенно хлористоводородной кислотой; или с органическими кислотами, например, низшими алифатическими монокарбоновыми или дикарбоновыми кислотами, такими как уксусная кислота, фумаровая кислота, винная кислота, молочная кислота, малеиновая кислота, лимонная кислота или салициловая кислота; или с сульфоновыми кислотами, например, низшими алкилсульфоновыми кислотами, такими как метансульфоновая кислота или бензолсульфоновая кислота, необязательно замещенными в бензольном кольце галоидом или (низш.)алкилом, такая как n-толуолсульфоновая кислота, являются полезными в качестве физиологически приемлемых кислотно-аддитивных солей соединений формулы I.
Неожиданно было найдено, что 3,7,9,9-тетразамещенные производные 3,7-диазабицикло[3,3,1]нонана, соответствующие формуле I, отличаются превосходными усиленными эффектами у пациентов с антиаритмическими состояниями, в особенности при конверсии недавнего начала фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм (NSR) человека, в дополнение к вышеупомянутым уже известным общим свойствам воздействия на сердце, при введении в виде жидкой фармацевтической композиции ступенчато, полностью прерывистым и/или необязательно только частично непрерывным путем, предпочтительно при применении в виде двухступенчатого введения двух вводимых непрерывно фаз по схеме по настоящему изобретению, как описано в более иллюстративных подробностях ниже, в частности, при введении в режиме инфузии.
Например, жидкая фармацевтическая композиция по настоящему изобретению может быть содержащей первое терапевтически эффективное количество упомянутого производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, являющееся достаточным для лечения и/или профилактики антиаритмических состояний у пациентов, вводится в течение первого периода времени примерно 10±2 мин, предпочтительно примерно 10±1 мин, наиболее предпочтительно примерно 10±0,5 мин, и впоследствии второе терапевтически эффективное количество упомянутого производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, являющееся достаточным для продолжения лечения и/или профилактики, вводится в течение второго периода времени примерно 20±5 мин, предпочтительно примерно 20±3 мин, наиболее предпочтительно примерно 20±1 мин. Данные периоды времени являются наиболее рекомендуемыми, однако квалифицированный специалист может модифицировать до некоторой степени данную схему дозирования.
Дальнейший вариант воплощения по изобретению относится к фармацевтическим продуктам. Следовательно, изобретение относится к фармацевтическому продукту и/или упаковке, содержащей в качестве лекарственного средства в жидкой фармацевтической композиции терапевтически эффективное количество, по меньшей мере, одного производного 3,7-диазабицикло[3,3,1]нонана, по меньшей мере, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, как определено выше, этикетку, листок и/или упаковочный вкладыш, указывающие, что упомянутое производное 3,7-диазабицикло[3,3,1]нонана может быть введено ступенчато, полностью прерывисто и/или необязательно только частично непрерывно, предпочтительно для двухступенчатого введения двух непрерывно вводимых фаз. Такой фармацевтический продукт и/или такая упаковка по изобретению могут отличаться тем, что на этикетке, листке или упаковочном вкладыше излагается, что жидкая фармацевтическая композиция применима для инфузии, предпочтительно для ступенчатого инфузионного введения, причем необязательно каждый этап является частично непрерывным инфузионным введением, предпочтительно для двухступенчатого инфузионного введения двух фаз, вводимых непрерывной инфузией. В частности, в данном варианте воплощения по изобретению фармацевтический продукт и/или упаковка отличаются тем, что на этикетке, листке и/или упаковочном вкладыше излагается, что производное 3,7-диазабицикло[3,3,1]нонана может быть введено в соответствии со схемой введения, в которой жидкая фармацевтическая композиция, включающая первое терапевтически эффективное количество упомянутого производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, являющееся достаточным для лечения и/или профилактики антиаритмических состояний у пациентов, вводится в течение первого периода времени примерно 10±2 мин, предпочтительно примерно 10±1 мин, наиболее предпочтительно примерно 10±0,5 мин, и второе терапевтически эффективное количество упомянутого производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, являющееся достаточным для продолжения лечения и/или профилактики, вводится в течение второго периода времени примерно 20±5 мин, предпочтительно примерно 20±3 мин, наиболее предпочтительно примерно 20±1 мин. Предпочтительно фармацевтический продукт и/или упаковка в соответствии с вариантом воплощения по изобретению содержат в качестве лекарственного средства терапевтически эффективное количество, по меньшей мере, одного производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, как определено выше, в жидкой фармацевтической композиции.
В еще дополнительном варианте воплощения изобретение относится к способу лечения и/или профилактики. Следовательно, изобретение включает способ лечения и/или профилактики антиаритмических состояний у пациентов, предпочтительно при конверсии недавнего начала фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм (NSR) человека, где жидкая фармацевтическая композиция, включающая терапевтически эффективное количество, по меньшей мере, одного производного 3,7-диазабицикло[3,3,1]нонана или его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, вводится упомянутому пациенту путем ступенчатого, полностью прерывистого и/или необязательно только частично непрерывного введения, предпочтительно для двухступенчатого введения двух вводимых непрерывно фаз. В частности, в данном способе лечения и/или профилактики по изобретению жидкая фармацевтическая композиция, включающая упомянутое терапевтически эффективное количество производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, вводится путем инфузии, предпочтительно ступенчатым инфузионным введением, причем каждый этап необязательно является частично непрерывным инфузионным введением, предпочтительно для двухступенчатого введения двух вводимых непрерывно фаз. Предпочтительный способ лечения и/или профилактики по изобретению отличается тем, что жидкая фармацевтическая композиция, включающая первое терапевтически эффективное количество упомянутого производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, являющееся достаточным для лечения и/или профилактики антиаритмических состояний у пациентов, вводится в течение первого периода времени примерно 10±2 мин, предпочтительно примерно 10±1 мин, наиболее предпочтительно примерно 10±0,5 мин, и второе терапевтически эффективное количество упомянутого производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, являющееся достаточным для продолжения лечения и/или профилактики, вводится в течение второго периода времени примерно 20±5 мин, предпочтительно примерно 20±3 мин, наиболее предпочтительно примерно 20±1 мин. В данном способе лечения и/или профилактики по изобретению вводится предпочтительно терапевтически эффективное количество, по меньшей мере, одного производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, как определено подробно выше.
В соответствии с наиболее предпочтительными вариантами воплощения по настоящему изобретения варианты воплощения, например, жидкие фармацевтические композиции пригодны для введения в виде двухступенчатого инфузионного режима, где в течение первого периода времени примерно 10±2 мин, предпочтительно примерно 10±1 мин, наиболее предпочтительно примерно 10±0,5 мин, вводится первое терапевтически эффективное количество упомянутого производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, являющееся достаточным для лечения и/или профилактики антиаритмического состояния у пациента, и затем впоследствии для продолжения лечения и/или профилактики второе терапевтически эффективное количество упомянутого производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, являющееся достаточным для продолжения лечения и/или профилактики, вводится в течение второго периода времени примерно 20±5 мин, предпочтительно примерно 20±3 мин, наиболее предпочтительно примерно 20±1 мин. Для данных периодов времени наиболее рекомендуемые дозы для двух этапов или фаз будут приведены в примерах ниже несколько подробнее. Однако ясно, что квалифицированный специалист, если нужно, может модифицировать до некоторой степени данную схему дозирования. Обычно общее количество производного 3,7-диазабицикло[3,3,1]нонана, предпочтительно тедисамила или одной из его солей, основанное на количестве основного соединения, может изменяться от примерно 0,16 мг/кг до примерно 0,64 мг/кг. Примеры специфических количеств, которые должны быть введены в предпочтительном режиме двухступенчатой инфузии, внутри данного диапазона могут доходить до 0,16 мг/кг, 0,24 мг/кг, 0,32 мг/кг, 0,48 мг/кг или 0,64 мг/кг. Примерно половина (например, 50±5 мас.%) от общего количества (100 мас.%) вводится в первый период времени, например, 10±2 мин, и примерно вторая половина (например, остающиеся 50±5 мас.% до 100 мас.%) вводится в течение второго периода времени, например, приблизительно 20±5 мин. В специфическом примере по данному изобретению использовали 0,32 мг/кг тедисамила-основания, вводя путем инфузии половину дозы в течение 10 мин и половину дозы в течение 20 мин.
Как правило, настоящее изобретение применимо к пациентам любого возраста и/или обоих полов. Однако в специфическом варианте воплощения изобретения находки по настоящему изобретению особенно полезны для лечения и/или профилактики антиаритмических состояний у пациентов мужского пола, предпочтительно при конверсии недавнего начала фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм (NSR) у пациентов мужского пола. Следовательно, в данном особом аспекте изобретение относится также к способу лечения и/или профилактики антиаритмических состояний у пациентов мужского пола, предпочтительно при конверсии недавнего проявления фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм (NSR) у пациентов мужского пола, где жидкая фармацевтическая композиция, включающая терапевтически эффективное количество, по меньшей мере, одного производного 3,7-диазабицикло[3,3,1]нонана, его физиологически приемлемой кислотно-аддитивной соли и/или сольвата, и/или депо-формы, вводится упомянутым пациентам мужского пола ступенчатым, полностью прерывистым и/или необязательно только частично непрерывным путем введения, но наиболее предпочтительно, когда назначается в виде двухступенчатого введения двух непрерывно вводимых фаз. В данном контексте изобретение включает также жидкие фармацевтические композиции, которые полезны также для ступенчатого, для полностью прерывистого и/или необязательно для только частично непрерывного введения, но наиболее предпочтительно полезно для назначения в виде двухступенчатого введения двух непрерывно вводимых фаз производных 3,7-диазабицикло[3,3,1]нонана, например, тедисамила и его кислотно-аддитивных солей пациенту мужского пола. Дополнительный аспект данного варианта воплощения по изобретению, относящийся к лечению пациентов мужского пола, направлен на фармацевтический продукт и/или упаковку, содержащую в качестве лекарственного средства в жидкой фармацевтической композиции терапевтически эффективное количество по меньшей одного производного 3,7-диазабицикло[3,3,1]нонана, по меньшей мере, его физиологически приемлемой соли и/или сольвата, и/или депо-формы, как определено дополнительно выше по изобретению, и этикетку, листок и/или упаковочный вкладыш, где указано, что упомянутое производное 3,7-диазабицикло[3,3,1]нонана может быть введено пациенту мужского пола ступенчато, полностью прерывисто и/или необязательно только частично непрерывно, наиболее предпочтительно в виде двухэтапного введения двух непрерывно вводимых фаз. Подробности, описанные в контексте вышеупомянутых общих вариантов воплощения по изобретению, полностью применимы также к данному специфическому варианту воплощения изобретения, связанному с лечением и/или профилактикой антиаритмических состояний у пациентов мужского пола.
Превосходный антиаритмический эффект соединений формулы I у человека может быть продемонстрирован с помощью фармакокинетической/фармакодинамической (ФК/ФД) модели и подтверждается данными клинического исследования, которые доказывают неожиданную увеличенную полезность и эффективность производных 3,7-диазабицикло[3,3,1]нонана, например, тедисамила и его кислотно-аддитивных солей, при лечении и/или профилактике антиаритмических эффектов у человека, предпочтительно при конверсии недавнего начала фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм (NSR) у пациентов при введении в виде жидкой фармацевтической композиции по схеме ступенчатого, полностью прерывистого и/или необязательно только частично непрерывного введения по настоящему изобретению.
Описание структуры и результатов клинического исследования
Создание двухэтапного инфузионного режима для быстрой конверсии недавнего начала предсердной фибрилляции/трепетания в нормальный синусовый ритм с использованием ФК/ФД модели
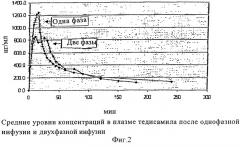
Предпосылки: тедисамил (ТЕДИ) является новым антиаритмическим агентом класса III, блокирующим при развитии различные выходящие токи калия, такие как IKur, Ito, IKr, IKs и IKTP, для быстрой конверсии недавнего начала фибрилляции предсердий (Afib) или трепетания предсердий (Aflu) в нормальный синусовый ритм (NSR). Внутривенные дозы ТЕДИ-основания до 0,24 мг/кг, инфузированные в течение 10 мин, не производят никакой конверсии у пациентов с Afib/Aflu. Был разработан двухэтапный инфузионный режим с использованием ФК/ФД модели, чтобы увеличить концентрацию/воздействие препарата в участке действия. ФК/ФД модель была основана на данных изучения однократной инфузии. Трехкомпартментная ФК модель и результат компартментной модели с линейной связью дали самое лучшее совпадение. Модель для ФД эффекта была простой линейной моделью. Результаты моделирования были оценены в двойном слепом, контролируемом плацебо, рандомизированном, состоящим из двух периодов, перекрестном исследовании на 18 здоровых субъектах мужского пола, в котором использовали двухэтапный инфузионный режим с 0,32 мг/кг ТЕДИ-основания, инфузируя половину дозы в течение 10 мин и половину дозы в течение 20 мин.
Цель: задачами исследования были оценка безопасности и переносимости ТЕДИ, корреляция между концентрациями ТЕДИ в плазме, а также QT, QTc и скоростью сердечных сокращений и сравнение этих результатов с данными стимуляции.
Способы и результаты: ТЕДИ был безопасен и хорошо переносим. Ожидаемое ФД действие, т.е. удлинение интервалов QT и QTc и отчетливое снижение скорости сердечных сокращений, наблюдали в течение 2 ч. ФК и ФД результаты были в близком совпадении со стимуляциями, основанными на ФК/ФД модели однократной инфузии: оценки стимуляции, основанные на однократной инфузии, находились в пределах 95% доверительного интервала вблизи прогнозируемого выборочного среднего значения исследования.
Заключение: двухэтапный инфузионный режим является благоприятным при введении производных 3,7-диазабицикло[3,3,1]нонана, например тедисамила и его кислотно-аддитивных солей, для лечения и/или профилактики антиаритмических эффектов, предпочтительно для конверсии недавнего проявления фибрилляции предсердий (Afib) или трепетания предсердий в нормальный синусовый ритм (NSR) при введении в виде жидкой фармацевтической композиции по схеме ступенчатого, полностью прерывистого и/или необязательно только частично непрерывного введения, таким образом увеличивая время воздействия на физиологическом участке эффекта.
Следующая выписка из отчета о клинических испытаниях представляет дополнительные подробности приведенной в примерах двухэтапной инфузионной методики
Двойное слепое, контолируемое плацебо, рандомизированное, с однократной внутривенной дозой, состоящее из двух периодов перекрестное исследование для оценки безопасности, переносимости, фармакодинамики и фармакокиетики в ходе и после двухэтапной инфузии тедисамила у здоровых субъектов мужского пола было проведено со следующим препаратом и дозами: дигидрохлорид тедисамила (0,4 мг/кг массы тела), инфузированный в течение 30 мин.
Цели
1. Оценить безопасность и переносимость тедисамила у здоровых субъектов мужского пола в ходе и после схемы двухэтапной инфузии (0,4 мг/кг массы тела, инфузированные в течение 30 мин, с половиной дозы, инфузированной в течение 10 мин, и половиной дозы, инфузированной в течение остающихся 20 мин).
2. Исследовать корреляцию между концентрациями тедисамила в плазме, фармакодинамическими переменными QT, QTc и сердечным ритмом, вычисленными на основе RR-интервала, используя ФК/ФД модель, и сравнить эти результаты с результатами, полученными от предыдущего стимуляционного исследования.
Методология
Это было одноцентровое, двойное слепое, контролируемое плацебо, рандомизированное, с однократной внутривенной дозой, состоящее из двух периодов перекрестное исследование. Субъекты были рандомизированно распределены по последовательности лечения или тедисамил-плацебо, или плацебо-тедисамил. Число пациентов (планируемых, отобранных, рандомизированных и анализированных): планированных - 18, отобранных - 27, рандомизированных - 18, анализированных - 18 в ФК/ФД анализах и анализах безопасности.
Диагноз и основной критерий для включения
Субъекты включались в исследование, если только они были здоровыми мужчинами, их возраст был в диапазоне 18-40 лет (оба включаемы), индекс их массы тела (ИМТ) был между 18 кг/м2 и 28 кг/м2. Исследуемый продукт, доза и тип введения: дигидрохлорид тедисамила; концентрация 2 мг/мл; доза 0,4 мг/кг массы тела, инфузированные в течение 30 мин, при половине дозы, инфузированной в течение 10 мин, и половине дозы, инфузированной в течение остающихся 20 мин. Путь введения внутривенный.
Продолжительность лечения
Один день на период, при котором проводится инфузия в течение общей продолжительности времени 30 мин. Оба введения препарата были разделены периодом промывания в одну неделю.
Критерии оценки
Эффективность/фармакодинамика
Электрокардиограммы (ЭКГ) с 12 отведениями были записаны в нескольких точках во времени, чтобы исследовать фармакодинамические эффекты тедисамила (воздействия на QT и QTc) в ходе и после инфузии. Максимальное значение и максимальное увеличение были получены для QT и QTc, и минимальное значение и максимальное понижение были получены для сердечного ритма. Были также вычислены площадь под кривой [AUC(0-24)], максимум для скорректированных с помощью плацебо QTc и QT и AUC(0-24) и минимум для скорректированного с помощью плацебо сердечного ритма.
Безопасность
Отборочные оценки включали исследование физического состояния, ЭКГ, скрининг на ВИЧ/гепатит, измерения кровяного давления и скорости сердечных сокращений, скрининг на препарат в моче, пробу на алкоголь в выдыхаемом воздухе и историю болезни. Последующие оценки включали исследование физического состояния, ЭКГ, измерения кровяного давления, скорости сердечных сокращений и вопросы о побочных эффектах и сопутствующей лекарственной терапии. В ходе сопутствующего введения тедисамила регистрировали кровяное давление, скорость сердечных сокращений и ЭКГ. Побочные эффекты и сопутствующую лекарственную терапию контролировали на протяжении всего исследования.
Фармакокинетика
Образцы крови для определения концентрации тедисамила в плазме брали в различные временные точки в ходе и после внутривенного введения препарата в оба периода испытаний. Следующие фармакокинетические параметры были определены: AUC(0-inf), AUC(0-t), максимальная концентрация Смакс, время максимальной концентрации в плазме Tмакс, время полувыведения t1/2, CL (клиренс), MRT (среднее время нахождения), и многие из данных, полученных в точках, учитывали при определении конечного времени полувыведения.
Статистические методики
Фармакодинамика
Данные, полученные от субъектов, которые завершили оба периода исследования, считались действительными для фармакодинамического/фармакокинетического анализа.
Описательную статистику ЭКГ проводили для интервалов QT, QTc, RR, PR, QRS и для скорости сердечных сокращений с учетом лечения (тедисамил, плацебо и “тедисамил-плацебо”) и временной точки. Индивидуальные и средние (средние арифметические значения±стандартное отклонение (SD)) профили времени для интервалов ЭКГ и сердечного ритма были графически представлены для обоих видов лечения.
Полученные параметры, т.е. максимальное значение и максимальное увеличение для QTc и QT, и максимальное понижение скорости сердечных сокращений были подвергнуты отдельным анализам (ко)вариантности (ковариантность только для максимальных и минимальных значений), включая объект, лечение, последовательность и период в качестве групповых эффектов (и индивидуальное значение предварительной дозы в качестве коварианта). Точечные оценки и 95% доверительные интервалы были созданы для различия “тедисамил-плацебо” с использованием остаточной вариантности. Модельные предположения были проверены путем визуального контроля оставшихся графиков. Дополнительно описательные статистические данные были рассчитаны для параметров, полученных от лечения, и для различия “тедисамил-плацебо”.
Описат