Агонисты м1 мускариновых рецепторов для противоболевой терапии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неврологии, и может быть использовано для лечения нейропатической боли. Изобретение заключается в том, что для лечения нейропатической боли вводят соединение, которое селективно активирует мускариновые рецепторы подтипа М(1), но при этом не облегчает острую боль. Использование изобретения позволяет лечить нейропатическую боль, не ослабляя способности воспринимать обычные раздражители. 9 з.п. ф-лы, 3 ил., 2 табл.
Реферат
Настоящее изобретение относится к нейропатической боли. В частности, настоящее изобретение относится к лечению нейропатической боли путем селективного взаимодействия с подтипами мускариновых рецепторов.
У многих больных повреждение сенсорных нервов сопровождается болью различной интенсивности. Восприятие может варьировать от умеренного увеличения тактильной или температурной чувствительности до мучительной боли. Такой вид боли назван нейропатической болью, так как считается, что она вызвана функциональным нарушением нервной системы или изменением структуры нервной системы. Нейропатическая боль чрезвычайно трудно поддается лечению, обычно является хронической, и не отвечает на стандартные анальгетические вмешательства.
Приблизительно 1,5% населения США может страдать от нейропатической боли того или иного вида. Эта группа оказывается шире, если в нее включают больных с различными формами боли в спине неврогенного происхождения. Таким образом, нейропатическая боль может быть связана с повреждениями нерва, вызванными травмой, с такими заболеваниями, как диабет, опоясывающий лишай, синдром раздраженной кишки, рак последней стадии, или химическим повреждением (например, неблагоприятным последствием лекарственной терапии, включая антивирусные препараты).
Важно отметить, что препараты, эффективные при лечении воспалительной и острой боли (такие как опиаты и нестероидные противовоспалительные средства), обычно не эффективны при лечении нейропатической боли). Наоборот, соединения, которые облегчают нейропатическую боль, могут быть не эффективны для лечения острой боли (например, гапапентин, трициклические антидепрессанты). Предлагаемая в настоящее время терапия нейропатической боли явно не разработана для этого вида боли и не удивительно, что эти препараты не имеют высокой эффективности и при этом воздействуют не на всех пациентов. Таким образом, существует актуальная потребность в более эффективном и более толерантном лечении нейропатической боли.
Существует один класс молекул, перспективный для терапии нейропатической боли, - это молекулы, которые прямо или опосредованно взаимодействуют с мускариновыми рецепторами. Например, блокада активности ацетилхолинэстеразы (ACHE-I) повышает уровень ацетилхолина, предотвращая его расщепление, что, в свою очередь, приводит к одновременной активации всех холинергических рецепторов.
Препараты, которые у человека ингибируют активность холинэстеразы, являются эффективными анальгетиками. Например, ACHE-I физостигмин вызывает кратко действующую аналгезию у хирургических больных при послеоперационном применении. Спинальное введение другого химически родственного препарата ACHE-I неостигмина уменьшает острую послеоперационную боль, хроническую нейропатическую боль и потенцирует болеутоляющую активность опиатов при их спинальном применении. Чтобы добиться антиноцицептивной и аллодинической реакции ингибиторов холинэстеразы, из различных холинергических рецепторов были предложены как мускариновые, так и никотиновые рецепторы, Однако антиаллодинические эффекты физостигмина блокировались антагонистами мускариновых рецепторов, но не антагонистами никотиновых рецепторов. Предполагается, что эффекты холинэстеразного ингибирования этой формы боли достигается путем активации мускариновых, а не никотиновых рецепторов.
В различных моделях острой боли на животных прямое действие агонистов мускариновых рецепторов является антиноцицептивным (Bartolini и другие, 1992; Brodie и Proudfit, 1984; Capone et al., 1999; Hartvig et al., 1989; Pedigo и et al., 1975; Przewlocka et al., 1999; Shannon et al., 1997; Sheardown et al., 1997). Эти эффекты могут быть блокированы мускариновыми антагонистами (Bartolini et al., 1992; Hwang et al., 1999; Naguib и Yaksh, 1997; Sheardown et al. 1997). Эти данные далее подтверждают роль активации мускариновых рецепторов в регуляции состояния острой боли.
Некоторые исследования изучали роль активации мускариновых рецепторов при хронической или нейропатической боли. В этих исследованиях прямое и непрямое повышение холинергического тонуса демонстрировало облегчение тактильной аллодинии после спинального введения у крыс моделей нейропатической боли с лигированным спинным мозгом, и эти эффекты были обратимы применением мускариновых антагонистов (Hwang et al., 1999; и Lee et al., 2002). Таким образом, прямая или косвенная активация мускариновых рецепторов проявляла и высокую анальгетическую активность и облегчала нейропатическую боль. Мускариновые агонисты и ACHE-I вследствие их склонности вызывать множество побочных эффектов при применении у людей клинически не нашли широкого применения. Нежелательные побочные эффекты включают повышенное слюноотделение и потоотделение, увеличение моторики желудочно-кишечного тракта и брадикардию, а также другие побочные эффекты. Эти побочные эффекты связаны с повсеместной экспрессией в организме семейства мускариновых рецепторов.
Открытие в середине 1980-х годов 5 генетически уникальных мускариновых рецепторов М(1)-M(5) с их дифференцированным распределением в организме позволило задуматься о разработке молекул, которые селективно взаимодействуют только с одним из этих подтипов рецепторов, а не с другими. Предполагалось, что разработка селективных молекул даст возможность модуляции, например, мускариновых рецепторов, регулирующих функции центральной нервной системы без одновременного активирования мускариновых рецепторов, регулирующих кардиальные, желудочно-кишечные или секреторные функции. Несмотря на огромные усилия, не было разработано никаких препаратов с такой ожидаемой селективностью, что обусловлено главным образом структурным сходством важных центров активации у этих 5 подтипов рецепторов.
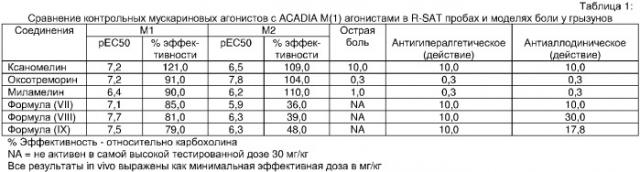
Также не известно, какой из 5 подтипов мускариновых рецепторов вызывает эффекты мускариновых соединений при различных болевых состояниях. В действительности возможно, что в регулирование боли может быть вовлечена активация более чем одного подтипа мускаринового рецептора или что активация различных подтипов мускариновых рецепторов может вызывать различные виды боли. Например, М(2) рецепторы в высокой степени выражены в ганглии дорсального корешка в малых и средних нейронах, в дорсальном роге спинного мозга и таламуса, и предполагается, что активация М(2) рецепторов может участвовать в модуляции трансдукции токсичных стимулов от периферии через спинной мозг к головному мозгу. Эта гипотеза подтвердилась тем, что удаление М(2) рецепторов у мышей уменьшает высокую антиноцицептивную активность мускариновых агонистов. К тому же, основываясь на удалении других подтипов мускариновых рецепторов у мышей, только М(2) и, возможно, М(4) рецепторы по причине их меньшей распространенности проявляют высокую анальгетическую активность мускариновых агонистов. В других случаях были получены подобные выводы: "Эти данные обеспечивают однозначные доказательства, что мускариновая аналгезия опосредована комбинацией исключительно М(2) и М(4) мускариновых рецепторов как на спинальном, так и супраспинальном уровнях" (Duttaroy A, et al., 2002). Тем не менее, другие исследователи в дальнейшем отметили: «Однако активность М(1) подтипа рецептора не является необходимой для антиноцицептивного действия» (Sheardown, et al., 1997).
Несмотря на эти данные, терапевтическая применимость соединения, действующего непосредственно на М(2) рецепторы, ограничена. Это обусловлено тем, что М(2) рецепторы также очень распространены в сердце и желудочно-кишечном тракте. Предполагается, что желудочно-кишечные расстройства и побочные эффекты мускариновых рецепторов со стороны сердечно-сосудистой системы также опосредованы этими рецепторами. Аналогично это предположение было подтверждено на мышах с удалением М(2) рецепторов. Таким образом, средства, которые прямо или опосредованно активируют М(2) мускариновые рецепторы, не могли бы быть полезны для лечения даже острой боли вследствие нежелательных и потенциально опасных побочных эффектов.
Подобное научное руководство не применимо для нейропатической боли. Точный подтип мускаринового рецептора, связанного с активностью прямых и косвенных мускариновых агонистов при нейропатической боли, достоверно не известен. В медицине существует насущная потребность определить подтип(ы) мускариновых рецепторов, вовлеченных в облегчение нейропатической боли, и разработать препараты, селективно активирующие эти рецепторы.
Способ лечения нейропатической боли, раскрытый в настоящем изобретении, включает идентификацию субъекта, нуждающегося в таком лечении, и предоставление субъекту эффективного количества, по меньшей мере, одного соединения, которое селективно активирует М(1) подтип рецепторов, посредством чего частично снимаются один или более симптомов нейропатической боли. В некоторых вариантах осуществления изобретения у субъекта проявляется гипералгезия. В некоторых вариантах осуществления изобретения у субъекта проявляется аллодиния. В некоторых вариантах осуществления изобретения нейропатическая боль связана с диабетом, вирусной инфекцией, синдромом раздраженной кишки, ампутацией, раком или химическим повреждением. В некоторых вариантах осуществления изобретения соединение, селективно активирующее М(1) подтип рецептора, не облегчает острую боль. В некоторых вариантах осуществления изобретения соединение выбирается из группы, состоящей из соединений Формул VII, VIII и IX:
Изобретение также относится к способу идентификации соединения, частично снимающего гипералгезию или аллодинию у субъекта, который включает предоставление субъекту, по меньшей мере, одного тестированного в отношении мускариновых рецепторов соединения и определение того, облегчает ли, по меньшей мере, одно тестированное соединение гипералгезию или аллодинию у субъекта. В некоторых вариантах осуществления изобретения, по меньшей мере, одно тестированное соединение является селективным для М(1) или М(4), но не для М(2) или М(3) рецепторов. В некоторых вариантах осуществления изобретения, по меньшей мере, одно тестированное соединение является селективным для М(1) рецептора. В некоторых вариантах осуществления изобретения гипералгезией является тепловая гипералгезия. В некоторых вариантах осуществления изобретения аллодинией является тактильная аллодиния.
Изобретение относится к фармацевтической композиции, содержащей эффективное количество, по меньшей мере, одного соединения, которое селективно активирует рецепторы подтипа М(1) в количестве, эффективном для снижения одного или более симптомов нейропатической боли. В некоторых вариантах осуществления изобретения соединения выбирают из группы, состоящей из соединений Формул VII, VIII и IX.
Краткое описание чертежей
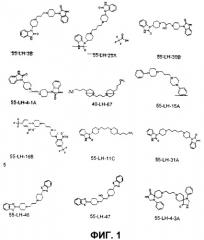
Фиг.1 показывает химические структуры примеров соединений Формулы (VI).
Фиг.2 показывает эффект лечения соединением Формулы IX на тактильную чувствительность после частичного лигирования седалищного нерва.
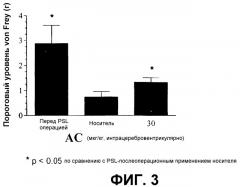
Фиг.3 показывает эффект введения соединения Формулы IX интрасеребровентикулярно на тактильную чувствительность после частичного лигирования седалищного нерва.
Подробное описание предпочтительного варианта осуществления
Разработаны соединения с беспрецедентной селективностью для М(1) рецепторов относительно других подтипов мускариновых рецепторов (Spalding ТА, Trotter C, Skjaerbaek N, Messier TL, Currier EA, Burstein ES, Li D, Hacksell U, Brann MR. Discovery of an ectopic activation site on the M(1) muscarinic receptor. Mol. Pharmacol, 61(6): 1297-302, 2002; U.S. Appl. No. 10/262,517 (publication number 20030100545), entitled, "Benzimidazolidinone Derivatives as Muscarinic Agents"; U.S. Patent No. 6,627,645, entitled, "Muscarinic Agonists"; U.S. Patent No. 6,528,529, entitled, "Compounds with Activity on Muscarinic Receptors"; U.S. Appl. No. 10/338,937 (publication number 20030144285), entitled, "Compounds with Activity on Muscarinic Receptors"; U.S. Appl. No. 10/329,455 (publication number 20030176418), entitled, "Tetrahydroisoquinoline Analogues as Muscarinic Agonists"; and U.S. Provisional No. 60/432,692, entitled, "Piperidinyl Dimers as Muscarinic Agents".
Обнаружено, что соединения с относительной селективностью для М(1) мускариновых рецепторов были очень эффективны в облегчении тепловой гипералгезии и тактильной аллодинии на моделях нейропатической боли при системном применении у грызунов. Поскольку эти соединения также не активируют другие подтипы мускариновых рецепторов, эти М(1) агонисты не вызывают, как предшествующие неселективные агонисты, нежелательных и несовместимых с жизнью действий. Поэтому М(1) селективные агонисты являются особенно привлекательными в качестве препаратов для лечения хронической нейропатической боли. Напротив, в отличие от неселективных мускариновых агонистов, которые взаимодействуют с М(2) и всеми другими подтипами мускариновых рецепторов, эти М(1) селективные агонисты не эффективны для уменьшения острой боли. Таким образом, на грызунах показано, что М(1) селективные агонисты имеют особенно привлекательный профиль. Они блокируют нейропатическую боль, но не меняют реакцию на другие формы боли. При длительном применении эти средства должны позволить пациентам обычным образом реагировать на острую боль, в то же время блокируя хроническую нейропатическую боль.
Используемый в описании термин "селективный" определен как свойство соединения, при этом количество соединения достаточно, чтобы вызывать желательную реакцию специфического типа, подтипа, класса или подкласса рецепторов с значительно меньшим или существенно малым или отсутствием всякого эффекта на активность других типов рецепторов. Например, селективное соединение может иметь, по меньшей мере, 10-кратный эффект на активность желательного рецептора, чем на другие типы рецепторов. В некоторых случаях селективное соединение может иметь, по меньшей мере, 20-кратный эффект на активность желательного рецептора, чем на другие типы рецепторов, или, по меньшей мере, 50-кратный эффект, или, по меньшей мере, 100-кратный эффект, или, по меньшей мере, 1000-кратный эффект, или, по крайней мере, 10000-кратным большим эффектом, или по, меньшей мере, 100000-кратный эффект, или более чем 100000-кратный эффект.
Участок действия М(1) агонистов на нейропатическую боль требует объяснения. Тем не менее, показано, что уменьшающее нейропатическую боль действие М(1) селективных агонистов блокируется мускариновым антагонистом скополамина гидрохлоридом, проникающим в центральную нервную систему, но не блокируется мускариновым антагонистом метилскополамина гидрохлоридом, обладающим главным образом периферическим действием. Предполагается, что уменьшающее нейропатическую боль действие М(1) селективных агонистов осуществляется через воздействие на центральную нервную систему. К тому же, эти М(1) селективные агонисты не эффективны в облегчении нейропатической боли при спинальном применении, но эффективно облегчают эту форму боли при интрацеребровентрикулярном применении. Предполагается, что активация уменьшающего нейропатическую боль действия М(1) рецептора осуществляется супраспинально и спинальная локализация действия не обязательна.
Соединения, которые взаимодействуют с М(1) подтипом рецептора, обладают прежде недооцененной аналгетической активностью и являются эффективными при лечении нейропатической боли. Эти наблюдения имеют практическое применение, которые поддерживают использование М(1) агонистов для лечения нейропатической боли, вызванной травмой и такими заболеваниями, как диабет, опоясывающий лишай, синдром раздраженной кишки, рак последней стадии, или химическим повреждением (например, неблагоприятным последствием лекарственной терапии, включая антивирусные препараты).
Таким образом, в некоторых вариантах осуществления настоящего изобретения нейропатическая боль в организме лечится путем введения объекту фармакологически активной дозы соединения, которое взаимодействует с М(1) подтипом рецепторов, с целью регуляции боли, не вызывая нежелательных и ограничивающих ее полезность побочных эффектов.
В некоторых вариантах осуществления изобретения соединения в соответствии с настоящим изобретением селективно взаимодействуют с М(1) подтипами рецепторов.
В некоторых вариантах осуществления изобретения соединения в соответствии с настоящим изобретением описаны в U.S. Patent Application No. 10/262,517 (publication number 20030100545) и имеют структуру Формулы (I)
в которой X выбран из от группы, состоящей из C, O, N и S;
Z выбран из от группы, состоящей из CH и N;
Y выбран из от группы, состоящей из =O, =N и =S или их таутомеров, таких как Y-алкилированные таутомеры;
SPU представляет единицу - спейсер, обеспечивающую расстояние d между Z и N, в котором -SPU- представляет бирадикал, выбранный из группы, состоящей из -(CR6R7)n-A- и -C3-8-циклоалкил-, в котором n находится в диапазоне от 1 до 5, такого типа, как 1, 2, 3, 4, или 5, и А отсутствует или произвольно замещен на -C3-8-циклоалкил-;
N вместе с R1 и R2 образуют гетероциклическое кольцо, в котором гетероциклическое кольцо выбрано из группы, состоящей из пергидроазоцина, пергидроазепина, пиперидина, пирролидина, азетидина, азиридина и 8-азабицикло[3,2,1]октана, и в котором гетероциклическое кольцо замещено одним или более заместителями R4, выбранными из группы, состоящей из гидрокси, галогена, С1-8-алкила, C3-8-циклоалкила, C1-8-алкокси, C1-8-алкилкарбонила, C1-8-алкилидена, C2-8-алкенила, C2-8-алкинила, C1-6-алкилоксиимино и C1-6-алкилоксиамино, каждый из которых может быть необязательно замещен заместителем R5 и в котором, по меньшей мере, одним из упомянутых заместителей R4 является R4′, выбранный из группы, состоящей из С1-8-алкила, C3-8-циклоалкила, C1-8-алкокси, C1-8-алкилкарбонила, C1-8-алкилидена, C1-8-алкилоксиимино и C1-8-алкилоксиамино, каждый из которых может быть необязательно замещен заместителем R5;
R5 выбран из группы, состоящей из водорода, галогена, гидрокси, С1-8-алкила, C1-8-алкокси, C3-8-циклоалкила, C3-8-гетероциклила, C1-8-алкилкарбонила, C1-8-алкилидена, C2-8-алкенила и C2-8-алкинила;
Rx может отсутствовать или выбираться из группы, состоящей из водорода, необязательно замещенного С1-8-алкила, необязательно замещенного C3-8-циклоалкила, необязательно замещенного C2-8-алкенила, необязательно замещенного C2-8-алкинила, необязательно замещенного арила, необязательно замещенного гетероарила CH2N(R5)(R5), CH2-OR5, CH2-SR5, CH2-O-C(=O)R5, CH2-O-C(=S)R5;
R3 может присутствовать 0-4 раза и выбираться из группы, состоящей из галогена, гидрокси, необязательно замещенного С1-8-алкила, С1-8-алкокси, необязательно замещенного C1-8-алкилидена, необязательно замещенного C2-8-алкенила, необязательно замещенного C2-8-алкинила, необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного C3-8-циклоалкила, необязательно замещенного C3-8-гетероциклила и необязательно замещенного C1-8-алкилкарбонила; и
каждый R6 и каждый R7 независимо выбирается из группы, состоящей из водорода, галогена, гидрокси, необязательно замещенного С1-8-алкила, С1-8-алкокси, необязательно замещенного C1-8-алкилидена, необязательно замещенного C2-8-алкенила, необязательно замещенного C2-8-алкинила, необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного C3-8-циклоалкила, необязательно замещенного C3-8-гетероциклила, и необязательно замещенного C1-8-алкилкарбонила.
В некоторых вариантах осуществления изобретения соединения, использующиеся в настоящем изобретении, описаны в U.S. Patent No. 6627645 и имеют структуру Формулы (II):
в которой Z1 представляет CR1 или N, Z2 представляет CR2 или N, Z3 представляет CR3 или N и Z4 представляет CR4 или N, где не больше чем два из Z1, Z2, Z3 и Z4 являются N;
W1 представляет O, S или NR5, один из W2 и W3 представляет N или CR6, а другой из W2 и W3 представляет CG; W1 является NG, W2 представляет CR5 или N, и W3 представляет CR6 или N; или W1 и W3 представляет N и W2 представляет NG;
G имеет формулу (III):
Y представляет O, S, CHOH, -NHC(O)-, -C(O)NH-, -C(O)-, OC(O)-, -(O)СО-, -NR7-, -CH=N- или отсутствует;
р = 1, 2, 3, 4 или 5;
Z представляет CR8R9 или отсутствует;
каждое t = 1, 2 или 3;
каждое R1, R2, R3 и R4 независимо является Н, амино, гидроксилом, галогеном или прямой или разветвленной цепью С1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гетероалкил, C1-6галогеналкил, -CN, -CF3-OR11, -COR11, -NO2, -SR11, -NHC(O)R1, -C(O)NR12R13, -NR12R3, -NR11C(O)NR12R13, -SO2NR12R13, -OC(O)R11, -O(CH2)qNR12R13 или -(CH2)qNR12R13, где q - целое число от 2 до 6, или R1 и R2 вместе образуют -NH-N=N- или R3 и R4 вместе образуют -NH-N=N-;
каждое R5, R6 и R7, независимо, является Н, С1-6алкилом; формилом; C3-6циклоалкилом; C5-6арилом, необязательно замещенным галогеном или С1-6алкилом; или C5-6гетероарилом, необязательно замещенным галогеном или С1-6алкилом; каждое R8 и R9, независимо, является Н или прямой или разветвленной цепью С1-8алкила;
R10 представляет прямую или разветвленную цепь С1-8алкила; C2-8алкенил, C2-8алкинил, C1-8алкилиден, C1-8алкокси, C1-8гетероалкил, C1-8аминоалкил, C1-8галогеналкил, C1-8алкоксикарбонил, C1-8гидроксиалкокси, C1-8гидроксиалкил, -SH, C1-8алкилтио, -O-CH2-C5-6арил, -C(O)-C5-6арил, замещенный С1-3алкилом или галогеном, C5-6арил, C5-6циклоалкил, C5-6гетероарил, C5-6гетероциклоалкил, -NR12R13, -C(O)NR12R13, -NR11C(O)NR12R13, -CR11R12R13, -OC(O)R11, -(O)(CH2)SNRI2R13 или -(CH2)SNR12R13, где s является целым числом от 2 до 8;
R10' является Н, прямой или разветвленной цепью С1-8алкила, C2-8алкенилом, C2-8алкинилом, C1-8алкилиденом, C1-8алкокси, C1-8гетероалкилом, C1-8аминоалкилом, C1-8галогеналкилом, C1-8алкоксикарбонилом, C1-8гидроксиалкокси, C1-8гидроксиалкилом или C1-8алкилтио; каждый R11, независимо, является Н, прямой или разветвленной цепью С1-8алкила, C2-8алкенилом, C2-8алкинилом, C2-8гетероалкилом, C2-8аминоалкилом, C2-8 галогеналкилом, C1-8алкоксикарбонилом, C2-8гидроксиалкилом, -C(O)-C5-6арилом, замещенным C1-3алкилом, или галогеном, C5-6арилом, C5-6гетероарилом, C5-6циклоалкилом, C5-6гетероциклоалкилом, -C(O)NR12R13, -CR5R12R13, -(CH2)tNR12R13, где t является целым числом от 2 до 8; и
каждый R12 и R13, независимо, являются Н, С1-6алкилом; C3-6циклоалкилом; C5-6арилом, необязательно замещенным галогеном или С1-6алкилом; или C5-6гетероарилом, необязательно замещенным галогеном или С1-6алкилом; или R12 и R13 вместе образуют циклическую структуру; или фармацевтически приемлемой солью, сложным эфиром или его пролекарством.
В некоторых вариантах осуществления изобретения соединения, используемые в настоящем изобретении, описаны в US Patent No. 6528529 и имеют структуру Формулы (IV):
в которой Х1, X2, X3, X4 и X5 выбраны из C, N и O;
k является 0 или 1;
t является 0, 1 или 2;
R1 представляет прямую или разветвленную цепь С1-8алкила, C2-8алкенил, C2-8алкинил, C1-8алкилиден, C1-8алкокси, C1-8гетероалкил, C1-8аминоалкил, C1-8галогеналкил, C1-8алкоксикарбонил, C1-8гидроксиалкокси, C1-8гидроксиалкил, -SH, C1-8алкилтио, -O-CH2-C5-6арил, -C(O)-C5-6арил, замещенный С1-3алкилом или галогеном; C5-6арил или C5-6циклоалкил необязательно содержащий 1 или более гетероатомов, выбранных из N, S и O; -C(O)NR3R4, -NR3R4, -NR3C(O)NR4R5, -CR3R4, -OC(O)R3, -(O)(CH2)SNR3R4 или -(CH2)SNR3R4;
где R3, R4 и R5 являются одинаковыми или различными, каждый независимо выбирается из Н, С1-6алкила; C5-6арила, необязательно содержащим 1 или более гетероатомов, выбранных из N, O и S, и необязательно замещенным галогеном или С1-6алкилом; C3-6циклоалкила; или R3 и R4 вместе с атомом N, если он присутствует, образуют циклическую кольцевую структуру, содержащую 5-6 атомов, выбранных из C, N, S и O; и
s является целым числом от 0 до 8;
А представляет C5-12арил или C5-7циклоалкил, каждый из которых необязательно содержит 1 или более гетероатомов, выбранных из N, S и O;
R2 представляет Н, амино, гидроксил, галоген или прямую или разветвленную цепь С1-6алкила, C2-6алкенил, C2-6алкинил, C1-6алкокси, C1-6гетероалкил, C1-6аминоалкил, C1-6галогеналкил, C1-6алкилтио, C1-6алкилкарбонил, -CN, -CF3, -OR3, -COR3, NO2, -NHR3, -NHC(O)R3, -C(O)NR3R4, -NR3R4, -NR3C(O)NR4R5, -OC(O)R3, -C(O)R3R4, -O(CH2)qNR3, -CNR3R4 или -(CH2)qNR3R4;
где q = целое число от 1 до 6;
n=0, 1, 2, 3 или 4, группы R2, при n>1, являются одинаковыми или различными;
р=0 или целое число от 1 до 5;
Y представляет O, S, CHOH, -NHC(O)-, -C(O)NH-, -C(O)-, -OC(O)-, NR7 или -CH=N-, и
R7 представляет Н или С1-4алкил; или отсутствует; и
Z представляет CR8R9, в котором R8 и R9 независимо выбраны из Н, и прямой или разветвленной цепи С1-8алкила; или фармацевтически приемлемой соли, сложного эфира или его пролекарства.
В некоторых вариантах осуществления изобретения соединения, используемые в настоящем изобретении, описаны в US Patent Application No. 10/329455 (publication number 20030176418) и имеют структуру Формулы (V):
в которой R1 представляет монорадикал, выбранный из группы, состоящей из необязательно замещенного С1-6алкила, необязательно замещенного C2-6-алкилидена, необязательно замещенного C2-6-алкенила, необязательно замещенного C2-6-алкинила, необязательно замещенного O-С1-6алкила, необязательно замещенного O-C2-6-алкенила, необязательно замещенного O-C2-6-алкинила; необязательно замещенного S-С1-6алкила, необязательно замещенного S-C2-6-алкенила, необязательно замещенного S-C2-6-алкинила;
m=0, 1 или 2;
C3-C4 представляет CH2-CH или CH=C, или C4 представляет CH, и C3 отсутствует;
R2 и R3 независимо выбран из группы, состоящей из водорода, необязательно замещенного С1-6алкила, необязательно замещенного O-С1-6алкила, галогена, гидрокси или выбраны так, что R2 и R3 вместе образуют кольцевую систему;
каждый R4 и R5 независимо выбран из группы, состоящей из водорода, галогена, гидрокси, необязательно замещенного С1-6алкила, необязательно замещенного O-С1-6алкила, необязательно замещенного арил-С1-6алкила, и необязательно замещенного арилгетероалкила;
L1 и L2 представляет бирадикалы, независимо выбранные из группы, состоящей из -C(R6)=C(R7), -C(R6)=N-, -N=C(R6)-, -S-, -NH- и -O-; причем только один из L1 и L2 может быть выбран из группы, состоящей из -S-, -NH- и -O-;
Y выбран из группы, состоящей из O, S и H2;
X представляет бирадикал, выбранный из группы, состоящей из -C(R6)(R7)-C(R6)(R7)-, -C(R6)=C(R7)-, -O-C(R6)(R7)-, C(R6)(R7)-O-, -S-C(R6)(R7)-, -С(R6)(R7)-S-, -N(RN)-C(R6)(R7)-, -C(R6)(R7)-N(RN)-, -C(R6)(R7)-C(R6)(R7)-C(R6)(R7)-, -O-C(R6)(R7)-C(R6)(R7)-, S-C(R6)(R7)-C(R6)(R7)-, N(RN)-C(R6)(R7)-C(R6)(R7)-, -C(R6)(R7)-C(R6)(R7)-O, -C(R6)(R7)-C(R6)(R7)-S, -C(R6)(R7)-C(R6)(R7)-N(RN)-, -C(R6)(R7)-C(R6)=C(R7)- и -C(R6)=C(R7)-C(R6)(R7),
в котором R6 и R7 независимо выбираются из группы, состоящей из водорода, галогена, гидрокси, нитро, циано, NRNRN, N(RN)-C(O)N(RN), необязательно замещенного С1-6алкила, C2-6-алкенила, C2-6-алкинила, необязательно замещенного O-C1-6-алкила, необязательно замещенного O-арила, необязательно замещенного O-C2-6-алкенила, необязательно замещенного O-C2-6-алкинила,
в котором RN выбран из группы, состоящей из водорода, и необязательно замещенного C1-6-алкила.
В некоторых вариантах осуществления изобретения соединения настоящего изобретения описаны в US Provisional Application No. 60/432692, и имеют структуру Формулы (VI):
в которой Y представляет бирадикал (CR4R5)m-Z-C(R4R5)n;
в котором сумма m+n составляет от 1 до 7;
Z выбран из группы, состоящей из C(R4R5), C(O), O, N(R6), S, O-C(O), N(R6)C(O), C(O)-O и P; и
R4 и R5 независимо выбраны из группы, состоящей из водорода, галогена, гидрокси, нитро, NR6N6', необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного C3-8-циклоалкила, необязательно замещенного гетероциклила, необязательно замещенного C1-6-алкила, необязательно замещенного C1-6-алкокси, необязательно замещенного фенокси, необязательно замещенного C2-8-алкенила и необязательно замещенного C2-8-алкинила; и
в которой R1 и R2 независимо выбраны из группы, состоящей из необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного C3-8-циклоалкила, необязательно замещенного гетероциклила, необязательно замещенного C1-6-алкила, необязательно замещенного C1-6-алкокси, необязательно замещенного C2-8-алкенила и необязательно замещенного C2-8-алкинила;
в которой R3 и R3' независимо выбраны из группы, состоящей из водорода, галогена, гидрокси, нитро, NR6N6', необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного C3-8-циклоалкила, необязательно замещенного гетероциклила, необязательно замещенного C1-6-алкила, необязательно замещенного C1-6-алкокси, необязательно замещенного C2-8-алкенила и необязательно замещенного C2-8-алкинила; и
R6 и R6' независимо выбраны из группы, состоящей из водорода, необязательно замещенного арила, необязательно замещенного гетероарила, необязательно замещенного C3-8-циклоалкила, необязательно замещенного гетероциклила, необязательно замещенного C1-6-алкила, необязательно замещенного C1-6-алкокси, необязательно замещенного C2-8-алкенила и необязательно замещенного C2-8-алкинила.
Химические структуры, показывающие определенные примеры соединений Формулы (VI), изображены на Фиг.1. Ниже представлены примеры, показывающие синтез этих соединений:
1,2-бис(4-(2-оксобензимидазолин-1-ил)пиперидино)этан (55LH-4-1A)
В пробирку помещали 4-(2-оксобензимидазолин-1-ил)пиперидин (0,27 г, 1,25 ммоль), 1-хлоро-2-йодоэтан (95 мг, 0,5 ммоль), K2CO3 (0,17 г, 1,25 ммоль) и этанол (2 мл) и смесь взбалтывали при 60°C в течение ночи. Добавляли воду и этилацетат, фильтровали и сушили с получением названного соединения в количестве 113 мг.
1Н ЯМР (ДМСО-d6) δ 1,59-1,66 (м, 4Н), 2,06-2,15 (м, 4Н), 2,27-2,40 (м, 4Н), 2,45 (арр с, 4Н), 2,99-3,06 (м, 4Н), 4,07-4,18 (м, 2Н), 6,92-7,00 (арр с, 6Н), 7,16-7,21 (м, 2Н); 13С ЯМР (ДМСО-d6) δ 29,4, 50,9, 53,9, 56,3, 109,3, 109,5, 121,1, 121,1, 129,0, 129,9, 154,4. LC-МС[M-H]+ 461,4.
1,4-бис(4-(2-оксобензимидазолин-1-ил)пиперидино)бутан трифторацетат (55-LH-25A)
В пробирку помещали 4-(2-оксобензимидазолин-1-ил)пиперидин (1,1 г, 5,0 ммоль), 4-бромо-1-бутанол (0,92 мг, 6,0 ммоль), K2CO3 (0,86 г, 6,25 ммоль) и этанол (3 мл) и смесь взбалтывали при 60°C в течение девяти дней. Добавляли воду и этилацетат, органический слой высушивали (Na2SO4), фильтровали и концентрировали. Остаток очищали на хроматографической колонке [(SiO2, 5% NH4OH в MeOH/EtOAc (1:9)] с получением 0,22 мг 4-(4-(2-оксобензимидазолин-1-ил)пиперидино)бутанола (55-LH-10), который использовали на следующем этапе без дальнейшего определения характеристик. LC-MC[M-H]+290,1.
Смесь (55-LH-10) (0,22 г, 0,78 ммоль), диметилсульфоксида (DMSO) (66 мкл, 0,93 ммоль) и дихлорметана (1 мл) охлаждали до -78°C и перемешивали в течение 0,5 часа. Добавляли оксалихлорид (73 мкл, 0,85 ммоль) и смесь выдерживали дополнительные 0,5 часа при -78°C. Добавляли триэтиламин (0,54 мл, 3,9 ммоль) и реакционную смесь доводили до комнатной температуры. Добавляли воду и дихлорметан, органический слой отделяли и промывали насыщенным солевым раствором, высушивали (Na2SO4), фильтровали и выпаривали. Полученный альдегид растворяли в MeOH (2,5 мл) и добавляли 4-(2-оксобензимидазолин-1-ил)пиперидин (0,17 г, 0,78 ммоль) с последующим добавлением HOAc до достижения pH 4-5. Добавляли свежеприготовленный раствор NaCNBH3 (54 мг, 0,85 ммоль) в MeOH (1 мл), и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду и этилацетат, органический слой высушивали (Na2SO4), фильтровали и концентрировали. Остаток растворяли в водном HCl (1N) и очищали препаративной ВЭЖХ [Luna колонка (21,2×250 мм, 15 мкм C18(2), 0,1% TFA (трифторуксусная кислота) в H2O/0,1% TFA в CH3CN/H2O (8:2) (9:1 градиент к 0:100)]. Очищенное соединение выпадало из воды в виде трифторацетатной соли (24 мг).
1Н ЯМР (CD3OD) δ 1,86-1,96 (м, 4Н), 2,06-2,14 (м, 4Н), 2,79-2,93 (м, 4Н), 3,09-3,32 (м, 8Н), 3,73-3,82 (м, 4Н), 4,55-4,65 (м, 2Н), 7,05-7,15 (м, 6Н), 7,28-7,33 (м, 2Н); LC-МС[M-H]+ 489,2.
5-(4-(2-Оксобензимидазолин-1-ил)пиперидино)пентанол (55-LH-27A)
Соединение 55-LH-27 приготавливали согласно процедуре, используемой для приготовления 55-LH-10 с использованием 5-бромо-1-пентанола (1,0 г, 6,0 ммоль). После 10 дней при 60°C добавляли воду, продукт фильтровали с получением 0,79 г названного соединения.
1Н ЯМР (CD3OD) δ 1,35-1,50 (м, 2Н), 1,55-1,65 (м, 4Н), 1,70-1,85 (м, 2Н), 2,10-2,25 (м, 2Н), 2,40-2,60 (м, 4Н), 3,05-3,15 (м, 2Н), 3,50-3,60 (м, 2Н), 4,25-4,40 (м, 1Н), 7,05-7,15 (м, 3Н), 7,35-7,45 (м, 1Н); 13С ЯМР (CD3OD) δ 23,8, 26,5, 28,4, 32,3, 50,7, 53,1, 58,4, 61,6, 109,4, 109,6, 121,0, 121,3, 128,5, 129,1, 155,1; LC-МС[M-H]+ 304,3.
1,5-бис(4-(2-оксобензимидазолин-1-ил)пиперидино)пентан (55-LH-31A)
Соединение (55-LH-31A) приготавливали согласно процедуре, используемой для приготовления 55-LH-25А с использованием 55-LH-27А (0,30 г, 1,0 ммоль). Остаток очищали на препаративной ВЭЖХ [Luna колонка (21,2×250 мм, 15 мкм C18(2), 0,1% TFA в H2O/0,1% TFA в CH3CN/H2O (8:2) 9:1 градиент к 0:100)]. Испаряли растворитель, и остаток растворяли в воде и дихлорметане. Добавляли гидроокись аммония до pH 10 и высушивали органический слой (Na2SO4), фильтровали и концентрировали. Остаток растворяли в MeOH и добавляли трифторуксусную кислоту (5 мкл). Трифторацетат очищали на препаративной ВЭЖХ [Luna колонка (21,2×250 мм, 15 мкм C18(2), 0,1% TFA в H2O/0,1% TFA в CH3CN/H2O (8:2) (9:1 градиент к 0:100)]. Растворитель испаряли и к водному раствору добавляли NH4OH до pH 10. Продукт фильтровали и высушивали с получением 47 мг названного соединения.
1Н ЯМР (CD3OD) δ 1,37-1,46 (м, 2Н), 1,59-1,68 (м, 4Н), 1,74-1,82 (м, 4Н), 2,16-2,25 (м, 4Н), 2,44-2,60 (м, 8Н), 3,12-3,20 (м, 4Н), 4,28-4,38 (м, 2Н), 7,02-7,08 (м, 6Н), 7,36-7,41 (м, 2Н); 13С ЯМР (CD3OD) δ 25,6, 26,6, 28,4, 50,7, 53,1, 58,3, 109,4, 109,6, 121,0, 121,3, 128,5, 129,1, 155,1; LC-МС[M-H]+ 503,1.
1,3-бис(4-(2-оксобензимидазолин-1-ил)пиперидино)пропан (55-LH-3B)
В пробирку помещали 4-(2-оксобензимидазолин-1-ил)пиперидин (1,09 г, 5 ммоль), 1-хлоро-3-йодопропан (250 мкл, 2 ммоль), K2CO3 (0,69 г, 5 ммоль) и этанол (10 мл) и взбалтывали при 60°C в течение шести дней. Добавляли воду, этилацетат и MeOH. Органический слой испаряли и остаток очищали на хроматографической колонке [(SiO2, 5% NH4OH в MeOH/этилацетате (1:9)] и затем путем препаративной ВЭЖХ [Luna колонка (21,2×250 мм, 15 мкм C18(2), 0,1% TFA в H2O/0,1% TFA в CH3CN/H2O (8:2) (9:1 градиент к 0:100)]. Растворитель испаряли и к водному раствору добавляли NH4OH до pH 10. Продукт отфильтровывали, промывали водой и высуш