Композиции, обладающие функцией снижения жировой ткани тела, и продукты питания и напитки, содержащие такие композиции
Иллюстрации
Показать всеИзобретение относится к медицине. Описана композиция манноолигосахаридов, которая эффективна для обеспечения эффекта снижения жировой ткани тела и для снижения массы тела. Композицию манноолигосахаридов обеспечивают гидролизом продукта маннана. Манноолигосахарид включает от около 1 до около 10 моносахаридов с, по меньшей мере, около 60 массовых процентов моносахаридов представляет собой манноза. 3 н. и 28 з.п. ф-лы, 5 ил., 9 табл.
Реферат
Настоящее изобретение относится к композициям манноолигосахаридов и продуктам питания и напиткам, содержащим манноолигосахариды. В частности, манноолигосахариды могут быть получены гидролизом продукта (материала) маннана и включены в продукты питания и напитки. Манноолигосахариды являются эффективными для снижения жировой ткани тела и особенно абдоминальной жировой ткани.
УРОВЕНЬ ТЕХНИКИ
В последние годы европеизированное питание, отсутствие физических упражнений и больший стресс привели к увеличению прибавки массы тела и ожирению. Избыточная масса тела и ожирение являются факторами риска заболеваний, таких как гипергликемия, гипертония и диабет. Были разработаны пищевые добавки для ограничения прибавки массы тела и лечения ожирения. Множество таких пищевых добавок являются натуральными продуктами или их получают из натуральных продуктов.
Кофейная промышленность является одним примером промышленности, которая обрабатывает и выпускает большое количество натуральных продуктов. Производители растворимого кофе и упакованного кофе производят большое количество использованных остатков кофе. Такие остатки преимущественно сжигают или уничтожают как промышленные отходы. Кофейные зерна и полученные кофейные остатки содержат нерастворимый в воде β-маннан. Манноолигосахариды (MOS) из гидролизированного маннана кофе являются потребляемыми олигосахаридами. В настоящем изобретении используют маннан для получения композиций, обладающих эффектами уменьшения жировой ткани.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Обеспечивают композицию манноолигосахарида, которая эффективна для получения эффекта снижения жировой ткани тела. Композиция манноолигосахарида может быть добавлена к композициям пищевых продуктов, особенно напитков, и потребляться перорально. Введение манноолигосахаридов является эффективным для снижения общей жировой ткани тела, по оценке процента жировой ткани, на, по меньшей мере, 4%, предпочтительно от около 4% до около 8%, абдоминальной жировой ткани на, по меньшей мере, около 10%, предпочтительно от около 10 до около 15%, и потери массы тела.
Обеспечивают композицию манноолигосахаридов, которая включает от около 1 до около 10 моносахаридов. По меньшей мере, около 60 массовых процентов моносахаридов представляет собой манноза, предпочтительно, по меньшей мере, 70 массовых процентов моносахаридов представляет собой манноза и наиболее предпочтительно, по меньшей мере, 80 массовых процентов моносахаридов представляет собой манноза. Манноолигосахариды также могут включать один или более моносахаридов, таких как глюкоза, галактоза, фруктоза и их смеси. Композицию манноолигосахаридов можно включать в пищевые продукты, напитки, корма, лекарственные препараты и косметические средства. Композицию манноолигосахаридов обеспечивают в виде гидролизата, который образуется гидролизом продукта маннана. Продукт маннан получают из источников, которые включают сырые кофейные зерна, жареные кофейные зерна, использованные остатки кофе, кокосовую муку, кокосовые хлопья, кокосовый орех, пальму Huacra, ямс, конжека, лилии, нарциссы, солодку, камедь плодов рожкового дерева, гуаровую камедь и их смеси. В важном аспекте, источник продукта маннана получают из кофейных материалов и особенно из использованных остатков кофе.
Гидролизат, содержащий манноолигосахариды, может быть получен с использованием способов гидролиза, таких как кислотный гидролиз, термический гидролиз, ферментативный гидролиз, гидролиз микробной ферментацией и комбинацией таких способов. Термический гидролиз можно проводить при температуре от около 200°С до около 220°С, предпочтительно около 210°С. Гидролизаты могут быть обесцвечены, дезодорированы и/или концентрированы посредством контакта с активированным углем, адсорбирующей смолой, ионообменной смолой, ионообменными мембранами и их комбинациями.
В другом аспекте обеспечивают композицию продуктов питания, которая включает манноолигосахарид, как описано. В таком аспекте композиция пищевых продуктов включает, по меньшей мере, около 1 грамма манноолигосахарида на 100 граммов композиции продукта питания. Манноолигосахариды могут быть включены во множество твердых пищевых продуктов и/или напитков. В важном аспекте манноолигосахариды включают в кофе.
Также обеспечивают способ для получения композиций манноолигосахаридов. Способ включает гидролиз продукта маннана в количестве, эффективном для получения гидролизата, содержащего манноолигосахариды, где каждый манноолигосахарид имеет от около 1 до около 10 моносахаридов с, по меньшей мере, 60 массовых процентов моносахарида маннозы, предпочтительно около 70 массовых процентов моносахарида маннозы и наиболее предпочтительно около 80 массовых процентов моносахарида маннозы. Продукт маннан может быть получен из сырых кофейных зерен, жареных кофейных зерен, использованных остатков кофе, кокосовой муки, кокосовых хлопьев, кокосовых орехов, пальмы Huacra, ямса, конжека, лилии, нарцисса, солодки, смолы плодов рожкового дерева, гуаровой камеди и их смесей. Предпочтительным источником продукта маннана являются использованные остатки кофе. Гидролизат, содержащий манноолигосахариды, получают с использованием способов гидролиза, таких как кислотный гидролиз, термический гидролиз, ферментативный гидролиз, гидролиз микробной ферментацией и их смеси. Предпочтительный способ гидролиза включает термический гидролиз. Полученный гидролизат может быть дезодорирован, обесцвечен и/или концентрирован с использованием активированного угля, адсорбирующих смол, ионообменных смол, ионообменных мембран и их комбинаций. Полученный гидролизат может быть использован в виде водной композиции или может быть высушен или лиофилизирован.
В другом важном аспекте обеспечивают способ для уменьшения процента жировой ткани и абдоминальной жировой ткани. Способ включает введение композиции манноолигосахарида в количестве, эффективном для снижения общего процента жировой ткани тела, по меньшей мере, на около 4%, предпочтительно от около 4% до около 8% и процента жировой ткани тела в абдоминальной области на, по меньшей мере, около 10%, предпочтительно от около 10% до около 15%. Манноолигосахарид может вводиться перорально со скоростью от около 1 до 10 граммов в сутки, предпочтительно от около 2 до 8 грамм в сутки и более предпочтительно от около 3 до 6 грамм в сутки в виде части пищевой композиции, такой как, например, напиток, такой как кофе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
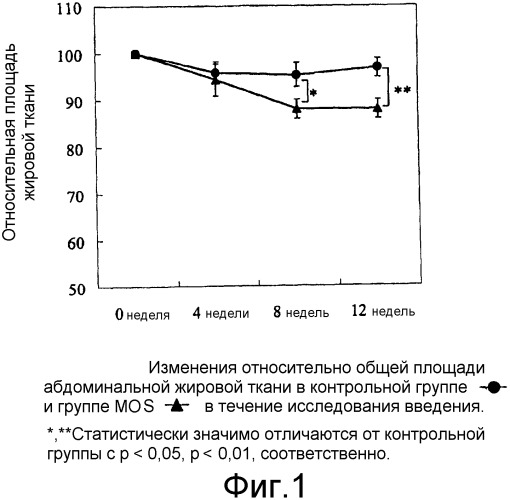
Фиг.1 иллюстрирует изменения относительной площади общей абдоминальной жировой ткани, рассчитанной на фотографиях КТ сканирования в контрольной группе и группе MOS.
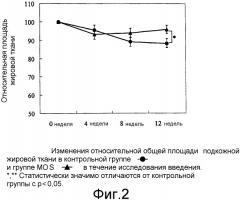
Фиг.2 иллюстрирует изменения относительной площади подкожной абдоминальной жировой ткани на фотографиях КТ сканирования в контрольной группе и группе MOS.
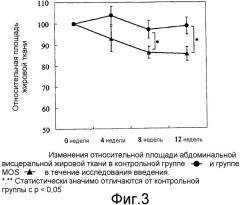
Фиг.3 иллюстрирует изменения относительной площади абдоминальной висцеральной жировой ткани в контрольной группе и группе MOS.
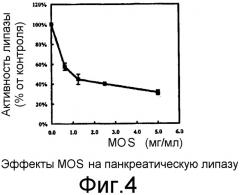
На Фиг.4 показан эффект MOS на панкреатическую липазу.
Фиг.5 иллюстрирует эффект MOS на уровень человеческих триглицеридов в плазме после перорального приема питания с высоким содержанием жира.
ПОДРОБНОЕ ОПИСАНИЕ
Обеспечивают композиции, которые дают эффекты снижения жировой ткани и которые могут рассматриваться как обладающие физиологическими функциями в уменьшении ожирения. Композиции представляют собой олигосахариды, которые преимущественно включают единицы маннозы. Такие олигосахариды на основании маннозы или манноолигосахариды являются неканцерогенными и низкокалорийными; они селективно утилизируются микрофлорой кишечника, снижают уровень липидов сыворотки и обеспечивают поглощение минералов.
Определения
Обеспечивают манноолигосахариды, которые являются олигосахаридами. Как используется в настоящем описании, «олигосахариды» относятся к полимерам моносахаридов, которые имеют степень полимеризации (DP) по меньшей мере, один, предпочтительно, DP от около 1 до около 10, более предпочтительно DP от около 2 до около 9 и более предпочтительно DP от около 2 до около 6. Манноолигосахарид, имеющий DP 1, является технически моносахаридом, но называется олигосахаридом, так как смеси олигосахаридов могут включать несколько единиц моносахаридов. Манноолигосахариды часто будут включать множество олигосахаридов с различной степенью полимеризации.
Продукт маннан
Как используется в настоящем описании, «маннан» относится к полисахаридам, которые включают моносахаридные остатки маннозы. Остатки маннозы могут быть в форме D-маннозы, галактоманнана, глюкоманнана и их смесей. Полисахариды, которые включают маннозу, могут быть полностью образованы из моносахаридных остатков маннозы или могут быть комбинацией моносахаридных остатков маннозы и других моносахаридов, таких как, например, галактоза, глюкоза и фруктоза.
Манноолигосахариды могут быть получены гидролизом маннана. Источники маннана включают сырые кофейные зерна, жареные кофейные зерна, использованные остатки кофе, кокосовую муку, кокосовые хлопья, кокосовый орех, пальму Huacra, ямс, конжек, лилию, нарцисс, солодку, смолу плодов рожкового дерева, гуаровую камедь и их смеси. Кокосовая мука и кокосовые хлопья могут быть получены из кокосового ореха. Растение пальма Huacra South African Arecacease (Palmae), маннан ямса и маннан Китайского ямса - все обеспечивают источник продукта маннана.
В важном аспекте жареные и измельченные кофейные зерна и использованные остатки кофе, которые остаются после варки кофе, являются предпочтительным источником маннана. Могут быть использованы любые типы кофейных зерен из любого источника. Примеры кофе, который может быть использован, включают Арабику, Робусту, Ливерию и подобные. Может быть использован отдельный тип кофе или смеси различных типов кофе. Также могут быть использованы кофейные зерна низшего качества или размера, включая имеющие минимальное или не имеющие вообще коммерческого значения. В другом важном аспекте маннан может быть получен из остатков экстракции кофе, полученных после экстракционной обработки жареного и измельченного кофе обычными способами для получения жидкого кофе или растворимого кофе.
Гидролиз продукта маннана
Гидролиз продукта маннана может проводиться с использованием способов гидролиза, которые могут включать кислотный гидролиз, термический гидролиз, ферментативный гидролиз, гидролиз микробной ферментацией и их смеси. Способы гидролиза с использованием кислоты и/или высокой температуры описаны в патентной заявке Японии № Sho 61-96947 и Hei 02-200147, которые включены в настоящее описание в виде ссылки. Кроме того, способы кислотного гидролиза описаны в патенте США № 4508745 и способы гидролиза высокой температурой описаны в ЕР 0363529, оба из которых включены в настоящее описание в виде ссылки.
Использованные остатки кофе могут быть гидролизованы в реакционном сосуде с или без кислоты и с или без давления. Гидролиз также может проводиться в любом другом реакционном сосуде для такой обработки, таком как, например, реактор с пульсирующим потоком. Гидролиз эффективен для гидролиза маннана, который может иметь DP 10-40 или выше до олигосахаридов, имеющих DP 1-10.
Ферментативный гидролиз может проводиться суспендированием продукта маннана в водной среде и добавлением соответствующих коммерчески доступных ферментов, таких как, например, целлюлаза и гемицеллюлаза. Ферментативный гидролиз может проводиться с использованием стандартных условий, известных обычному специалисту в области техники.
Микробная ферментация также может быть использована для гидролиза продукта маннана. Продукт маннана может быть ферментирован микроорганизмами, которые продуцируют ферменты, способные гидролизовать маннан. Могут быть использованы микроорганизмы, которые продуцируют ферменты, такие как целлюлаза и гемицеллюлаза. Одним примером соответствующего микроорганизма является Basidomycota.
Полученные гидролизаты продукта маннана могут быть использованы как есть или могут быть дополнительно очищены активированным углем, адсорбирующей смолой, ионообменной смолой, ионообменными мембранами и их комбинациями. Обесцвечивание и/или дезодорирование гидролизатов могут быть осуществлены контактом гидролизата с активированным углем или любым другим материалом смолы поглощающего типа. Обессоливание и нейтрализация могут быть проведены с использованием ионообменных смол и/или ионообменных мембран. Также могут быть использованы комбинации таких способов. Последующая очистка может проводиться при более высоком уровне дозировки или когда гидролизат должен использоваться в определенном типе продуктов питания или напитков.
Клинические испытания
В испытаниях, проводимых с препаратами MOS, масса тела и окружность талии в группах MOS имели тенденцию к уменьшению через 12 недель по сравнению со временем начала. В среднем снижение массы тела варьировалась от около 0,5 до около 1,0 кг и окружность талии снижалась на от около 1,5 до около 3,0 см. Процент жировой ткани тела по DEXA снижался от около 4% до около 8% в группах MOS через 12 недель по сравнению с временем начала и значимо отличался от группы плацебо в конце периода наблюдения. Площадь общей абдоминальной жировой ткани и площадь висцеральной жировой ткани по КТ-сканированию значимо снижались в группах MOS по сравнению с группой плацебо через 12 недель со снижением процента жировой ткани от около 10% до около 15% от начала исследования. Характеристика оценки КТ-сканирования жировой ткани на относительной основе, кроме того, продемонстрировала существенные изменения в абдоминальной области. Результаты показали, что кофейный напиток, содержащий MOS, снижал проценты жировой ткани тела и абдоминальной жировой ткани у людей, что с течением времени может быть отражено в снижении массы тела.
При отсутствии намерения быть связанным какой-либо теорией снижение абдоминальной жировой ткани может происходить из-за одной или более следующих причин: (1) пропионовая кислота, которая является кишечным продуктом ферментации MOS, может подавлять синтез жирных кислоты в печени, (2) MOS может ингибировать поглощение липидов в тонком кишечнике, вызывающее накопление жировой ткани в организме, для метаболизирования и (3) может увеличивать экскрецию жировой ткани посредством объема испражнений, таким образом уменьшая абдоминальную жировую ткань.
ПРИМЕРЫ
ПРИМЕР 1: Клинические исследования MOS - Исследование 1
1. Препарат MOS
Использованные остатки кофе гидролизовали в реакционном сосуде при температуре 220°С. Гидролизованный продукт обесцвечивали порошком активированного угля (Umehachi; Taihei Chemicals, Osaka) и обессоливали катионообменной смолой (SKIB; Mitsubishi Chemicals, Tokyo) и анионообменной смолой (WA30; Mitsubishi Chemicals). Моносахариды удаляли с использованием хроматографии с активированным углем со ступенчатым градиентом воды и 10,0% (об/об) этанола. Очищенный раствор концентрировали в ротационном испарителе и лиофилизировали. Смесь MOS (степень полимеризации (dp) 2:21,2%, dp3:22,2%, dp4: 21,2%, dp5:16,2% и dp6 или более: 19,2%) использовали для клинических исследований.
2. Тестируемые напитки
Композиция кофейных напитков была следующая.
| Таблица 1 | ||
| г/100 мл | Контрольный кофе | Кофе MOS |
| Твердое вещество кофе | 1,1 | 1,1 |
| Искусственный подсластитель | 0,017 | 0,017 |
| MOS | - | 1,0 |
| Твердое вещество кукурузного сиропа | 1,0 | - |
Кофейный напиток упакован в 900 мл флаконы из РЕТ (полиэтилентерэфталата). Тестируемый напиток содержал 1 г MOS в 100 мл. Каждый пациент получал 300 мл тестируемого кофейного напитка (содержащего 3,0 г MOS) в сутки. Твердое вещество кукурузного сиропа добавляли в контрольный кофейный напиток в качестве плацебо вместо MOS. Тестируемые кофейные напитки получали имеющими такой же уровень вещества кофе, так чтобы между ними не было различий в аромате. Оба напитка также получали для уравновешивания уровня кофеина, так как известно, что кофеин увеличивает расход энергии. Уровень кофеина составил 45,4 мг/100 мл в контрольном кофе и 46,8 мг/100 мл в тестируемом кофе соответственно.
3. Пациенты и расписание исследований
Настоящее исследование имеет дизайн плацебо-контролируемого, двойного слепого исследования. Добровольцев подвергали медицинскому и физикальному обследованию. Получали образец крови натощак для анализа липидов сыворотки.
Были выбраны тридцать добровольцев (мужчины 15, женщины 15). Они принадлежали к категории лиц с ожирением 1 (25 кг/м2 < ИМТ < 30 кг/м2) в соответствии с классификацией ожирения Японского Общества по Изучению Ожирения и к категории с гиперхолестеринемией (уровень общего холестерина сыворотки > 180 мг/100 мл). Их делил на 2 группы по ИМТ и уровню общего холестерина сыворотки врач, не связанный с этим исследованием.
После однонедельного периода наблюдения пациентам давали кофейный напиток в течение 12 недель. Они посещали клинику в первый день, через 4, 8 и 12 недель. На каждом визите в клинику их подвергали медицинскому и физикальному обследованию. Собирали образцы крови и мочи натощак и оценивали площадь абдоминальной жировой ткани с использованием компьютерного томографического сканирования (КТ-сканирования).
Пациенты отмеряли 300 мл кофейного напитка (MOS или плацебо) мерной чашкой и пили его каждый день без добавления молока или сливок. Время потребления не ограничено. Пациентов инструктировали, что на всем протяжении исследования они не должны каким-либо образом менять обычное питание. Кроме того, их ограничивали от потребления пищевых продуктов и лекарственных препаратов, которые влияют на уровень липидов крови. При каждом визите в клинику от них требовали не есть и не пить ничего кроме воды с 9.00 вечера до завершения обследования.
4. Запись дневников питания
Пациентам давали шкалу веса, одноразовую камеру и шагомер. Пациентов просили записывать все приемы пищи, включая перекусы между приемами пищи, вес каждого блюда, фотографировать каждую еду и подсчитывать каждый день количество пройденных шагов в течение 3 дней перед визитом в клинику. Потребление питательных веществ рассчитывали по записям приемов пищи и фотографиям с использованием Microsoft Excel Add-in “Excel Eiyou-kun ver. 3.0” (Kenpakusya; Tokyo, Japan). Добровольцы также ежедневно записывали потребление алкоголя.
5. Физикальное обследование
Проводили физикальное обследование с записью роста, веса, окружности бедер и талии и толщины подкожной жировой ткани. Окружность бедер и талии измеряли на выдохе и в положении стоя в соответствии со способом Японского Общества по Изучению Ожирения (Tokunaga et al., Int.J. Obesity, 7, 437-445(1983)). Толщину подкожной жировой ткани измеряли на плече и под лопаткой с использованием циркуля. Индекс массы Тела (ИМТ) рассчитывали в соответствии со следующим уравнением: ИМТ (кг/м2) = [масса тела (кг)]/[рост (м]2.
6. Исследование площади абдоминальной жировой ткани
Определение площади абдоминальной жировой ткани посредством КТ-сканирования проводили с использованием метода Tokunaga (Int.J. Obesity, 7, 437-445 (1983)). Все КТ-исследования проводили с использованием CT-W450 (Hitachi Medico Inc., Japan). Рентгеновские фотографии делали с использованием напряжения трубки 120 кВ, тока трубки 90 мА; уровня окна 0; и ширины окна 1000. Общую площадь жировой ткани, площадь подкожной жировой ткани и площадь висцеральной жировой ткани определяли по КТ-фотографиям с использованием средства оценки висцеральной жировой ткани программного обеспечения «fat Scan ver.2» (N2 System Inc., Japan).
7. Анализ крови
Анализ крови в этом исследовании включал лейкоциты, эритроциты, гемоглобин, MCV, MCH, MCHC и тромбоциты. Общий белок, соотношение A/G, альбумин, общий билирубин, АсТ (GOT), АлТ (GPT), ЩФ, ЛДГ, γ-ГТ, общий холестерин, холестерин ЛПВП, холестерин ЛПНП, триглицериды, мочевую кислоту, азот мочевины, креатинин, Na, K, Cl, Ca, IP, Mg, сахар крови натощак, общие липиды, неэстерифицированные жирные кислоты, пероксиды липидов, HbA1c и инсулин измеряли с использованием биохимического исследования крови.
8. Статистический анализ
Результаты анализа представлены в виде средних значений со стандартными ошибками. Сравнение средних значений между каждыми группами анализировали с использованием парного t-критерия, когда различия данных соответствовали нормальному распределению, и анализировали с использованием критерия предписанных рангов Вилкоксона, когда различия данных не соответствовали нормальному распределению. Колебания площади жировой ткани с течение периода исследования представлены в виде относительного значения по сравнению с данными на 0 неделе. Различия средних значений между двумя группами подвергали дисперсионному анализу и затем при расчете с использованием или t критерия Стьюдента или t-критерия Велча. Значения р < 0,05 оценивали как достоверные.
9. Питание в течение периода исследования
Статистический анализ проводили у 29 пациентов, которые были поделены на две группы: одна группа из 15 пациентов, которым давали контрольный напиток (далее называемая «контрольная группа»); и другая группа из 14 пациентов, которым давали напиток, который содержал MOS (далее называемая «группа исследования»). Один пациент был исключен из группы исследования из-за его чрезвычайно нерегулярного режима питания во время периода исследования. Записи введения показывали, что степень потребления составила 99,9% для контрольной группы и 99,7% для группы исследования, демонстрируя отсутствие достоверных различий между двумя группами. Не было отмечено существенного потребления алкоголя или лекарственных препаратов в течение периода исследования. Результаты изучения питания выявили, что существовала небольшая достоверная разница в питании в течение периода исследования для обеих групп. Среднее потребление энергии в сутки ± стандартная ошибка составило 1997±77 ккал/сутки для контрольной группы и 2066±72 ккал/сутки для группы исследования. Уровень физической нагрузки, что показано шагомерами, не показал существенных изменений в обеих группах в течение периода исследования.
10. Побочные эффекты
В физическом состоянии пациентов не наблюдали побочных эффектов, связанных с введением тестируемого напитка в любой момент в течение периода исследования. Консультации врачей не выявили субъективных/объективных симптомов или нарушенных показателей из-за введения напитков в течение периода исследования.
11. Физикальные оценки
| Таблица 2Характеристика пациентов перед потреблением тестируемого напитка | |||||
| Группа | всего | Мужчины | Женщины | ||
| Кол-во пациентов | Контроль | 15 | 7 | 8 | |
| MOS | 14 | 7 | 7 | ||
| Возраст | лет | Контроль | 55,7 ± 2,8 | 53,1 ± 14,1 | 57,9 ± 7,2 |
| MOS | 49,6 ± 2,9 | 46,0 ± 11,5 | 53,1 ± 9,8 | ||
| Рост | см | Контроль | 157,2 ± 2,1 | 163,2 ± 5,8 | 151,9 ± 5,7 |
| MOS | 160,3 ± 2,3 | 167,5 ± 1,8 | 153,2 ± 5,8 | ||
| Вес | кг | Контроль | 66,9 ± 1,8 | 71,8 ± 6,3 | 62,5 ± 4,8 |
| MOS | 69,2 ± 2,0 | 74,5 ± 3,9 | 63,9 ± 6,5 | ||
| ИМТ | Кг/м2 | Контроль | 27,0 ± 0,2 | 26,9 ± 0,8 | 27,1 ± 1,0 |
| MOS | 26,9 ± 0,4 | 26,6 ± 1,4 | 27,1 ± 1,4 | ||
| Температура тела | єС | Контроль | 36,2 ± 0,1 | 36,3 ± 0,3 | 36,1 ± 0,5 |
| MOS | 36,0 ± 0,1 | 36,1 ± 0,4 | 35,8 ± 0,4 | ||
| талия | см | Контроль | 86,3 ± 1,2 | 89,1 ± 2,6 | 83,8 ± 4,7 |
| MOS | 86,5 ± 1,5 | 88,6 ± 4,2 | 84,4 ± 6,1 | ||
| Бедра | см | Контроль | 96,8 ± 1,0 | 96,1 ± 3,3 | 97,4 ± 4,2 |
| MOS | 97,8 ± 0,9 | 97,3 ± 2,3 | 98,2 ± 4,1 | ||
| Толщина подкожной жировой ткани на плече | см | Контроль | 1,8 ± 0,1 | 1,4 ± 0,4 | 2,1 ± 0,3 |
| MOS | 1,7 ± 0,1 | 1,4 ± 0,1 | 2,0 ± 0,2 | ||
| Толщина подкожной жировой ткани под лопаткой | см | Контроль | 2,3 ± 0,2 | 2,7 ± 1,1 | 2,0 ± 0,3 |
| MOS | 2,3 ± 0,1 | 2,3 ± 0,3 | 2,3 ± 0,3 | ||
| САДа | Мм рт ст | Контроль | 127,5 ± 4,4 | 128,1 ± 15,6 | 127,0 ± 19,4 |
| MOS | 131,8 ± 3,3 | 132,9 ± 11,8 | 130,7 ± 13,6 | ||
| САДb | Мм рт ст | Контроль | 79,9 ± 2,3 | 81,6 ± 9,7 | 78,4 ± 8,6 |
| MOS | 82,4 ± 2,3 | 84,3 ± 8,6 | 80,4 ± 9,9 | ||
| пульс | Уд/мин | Контроль | 69,3 ± 2,2 | 67,1 ± 6,9 | 71,3 ± 9,8 |
| MOS | 67,8 ± 1,6 | 67,7 ± 6,6 | 67,9 ± 5,6 | ||
| Значения представлены в виде средних и стандартных ошибок.а -систолическое артериальное давлениеb - диастолическое артериальное давление |
Не было подтверждено значительных различий между контрольной группой и группой исследования. Изменения в физических показателях в течение периода исследования указаны ниже.
| Таблица 3Изменения показателей физического обследования в течение периода введения | |||||
| 0 недель | 4 недели | 8 недель | 12 недель | ||
| Вес (кг) | Контроль | 66,9 ± 1,8 | 66,3 ± 1,8 | 66,5 ± 1,9 | 66,3 ± 1,9 |
| MOS | 69,2 ± 2,0 | 68,8 ± 1,9 | 68,6 ± 2,0 | 68,7 ± 2,0 | |
| ИМТ (кг/м2) | Контроль | 27,0 ± 0,2 | 26,8 ± 0,3 | 26,9 ± 0,3 | 26,8 ± 0,3 |
| MOS | 26,9 ± 0,4 | 26,7 ± 0,3 | 26,6 ± 0,4 | 26,7 ± 0,3 | |
| Талия (см) | Контроль | 86,3 ± 1,2 | 85,6 ± 1,3* | 85,1 ± 1,2** | 85,2 ± 1,4* |
| MOS | 86,5 ± 1,5 | 86,0 ± 1,4 | 85,1 ± 1,6 | 84,8 ± 1,5* | |
| Бедра (см) | Контроль | 96,8 ± 1,0 | 96,4 ± 1,0* | 96,5 ± 1,0 | 96,2 ± 1,1 |
| MOS | 97,8 ± 0,9 | 97,6 ± 0,9 | 96,4 ± 1,2 | 96,1 ± 1,2 | |
| Толщина подкожной жировой ткани на плече (см) | Контроль | 1,8 ± 0,1 | 1,8 ± 0,1 | 1,8 ± 0,1 | 1,8 ± 0,1 |
| MOS | 1,7 ± 0,1 | 1,7 ± 0,1 | 1,8 ± 0,1 | 1,7 ± 0,1 | |
| Толщина подкожной жировой ткани под лопаткой (см) | Контроль | 2,3 ± 0,2 | 2,4 ± 0,2 | 2,4 ± 0,2 | 2,3 ± 0,2 |
| MOS | 2,3 ± 0,1 | 2,3 ± 0,1 | 2,3 ± 0,1 | 2,2 ± 0,1* | |
| Значения представлены в виде среднего и стандартных ошибок.*, ** значительно отличаются от перед применением на 0 неделе с р < 0,05, p < 0,01 соответственно. |
Не наблюдали статистически значимых различий по весу, ИМТ или подкожной жировой ткани в средней части разгибательной стороне плеча для каждой группы. Уменьшение окружности талии для обеих групп было статистически значимо при сравнении с до применения напитков, однако не было получено статистически значимых различий между двумя группами. Толщина подкожной жировой ткани около тыла под лопаткой для исследуемой группы достоверно снижалась (p < 0,05) на 12-й неделе по сравнению с началом применения, но не было статистически значимых различий между двумя группами. Различия между двумя группами были подтверждены как минимальные и недостоверные.
12. Площадь абдоминальной жировой ткани по КТ сканированию
Один пациент из контрольной группы и один пациент из исследуемой группы были исключены из анализа поперечного среза липидов, так как идеальное изображение КТ-сканирования не могло быть получено из-за большого размера талии пациента. Статистический анализ проводили у 27 пациентов, 14 из контрольной группы и 13 из исследуемой группы. Изменения площади абдоминальной жировой ткани в течение периода исследования указаны в Таблице 4.
| Таблица 4Изменения площади абдоминальной жировой ткани в течение введения | ||||||
| 0 неделя | 4 недели | 8 недель | 12 недель | Значение р повторных изменений ANOVA (период исследования) | ||
| Общая площадь жировой ткани (см2) | Контроль | 274,5 ± 11 | 263 ± 12,5 | 261 ± 11,6 | 265,5 ± 11,1 | 0,00003 |
| Δ (от 0Н) | -11,3 ± 7,1 | -13,8 ± 6,8 | -8,9 ± 6,1 | |||
| MOS | 281,5 ± 19,1 | 266,3 ± 19,8 | 251,0 ± 21,6** | 248,9 ± 19,2** | ||
| Δ (от 0Н) | -15,2 ± 7,7 | -30,5 ± 4,4 | -32,6 ± 5,4 ↑↑ | |||
| Площадь подкожной жировой ткани (см2) | Контроль | 181,6 ± 12,3 | 169,8 ± 13,0 | 171,4 ± 12,5* | 174,6 ± 13,1 | 0,00024 |
| Δ (от 0Н) | -11,7 ± 5,7 | -10,1 ± 4,3 | -7,0 ± 6,0 | |||
| MOS | 173,4 ± 15,1 | 166,1 ± 15,1 | 156,7 ± 15,7** | 154,5 ± 14,8** | ||
| Δ (от 0Н) | -7,3 ± 4,4 | -16,8 ± 3,7 | -18,9 ± 3,3 | |||
| Площадь висцеральной жировой ткани (см2) | Контроль | 92,9 ± 8,4 | 93,1 ± 6,6 | 89,2 ± 8,3 | 91,0 ± 9,7 | 0,01928 |
| Δ (от 0Н) | 0,4 ± 4,4 | -3,7 ± 4 | -9,0 ± 6,1 | |||
| MOS | 108 ± 11 | 100 ± 10,8 | 94,4 ± 11,3** | 94,4 ± 11,9** | ||
| Δ (от 0Н) | -7,9 ± 5,2 | -13,7 ± 2,9 | -13,7 ± 3,9↑ | |||
| Значения представлены в виде среднего и стандартных ошибок.*, ** значительно отличаются от перед применением на 0 неделе с р < 0,05, p < 0,01 соответственно.↑, ↑↑ значительно отличаются от контрольной группы с р < 0,05, p < 0,01 соответственно. |
Не было обнаружено значительных различий между группами в отношении общей площади жировой ткани, площади подкожной жировой ткани и площади висцеральной жировой ткани в начале введения (0 неделя). В течение периода исследования анализа площади жировой ткани площадь подкожной жировой ткани контрольной группы достоверно снижалась на 8 неделе (р < 0,05) по сравнению с началом введения. В исследуемой группе значительное снижение (p < 0,01) обнаружили через 8 и 12 недель в отношении общей площади жировой ткани, площади подкожной жировой ткани и площади висцеральной жировой ткани. Снижение от перед потреблением на 0 неделе в группе MOS было больше, чем в контрольной группе. В группе исследования явно были показаны значительно более низкие значения для общей площади жировой ткани на 8 неделе (р < 0,05) и 12 неделе (p < 0,01) по сравнению с контрольной группой (Фиг.1). В группе исследования также показано значительное снижение площади подкожной жировой ткани и площади висцеральной жировой ткани на 12 неделе (р < 0,05 для обоих) по сравнению с контрольной группой (Фиг.2 и 3).
13. Результаты исследований крови
Два пациента из группы исследования были исключены из анализа крови, так как они позавтракали и пили прохладительные напитки после 9.00 вечера на 12 визите в клинику. Изменения значений исследований крови в течение периода исследования указаны в таблице 5, и изменения значений биохимического исследования крови указаны в таблице 6.
| Таблица 5Результаты исследования крови в течение периода введения | |||||||
| Нормальный диапазон | единицы | Группа | 0неделя | 4 недели | 8 недель | 12 недель | |
| лейкоциты | 3500-9700 | /мкл | Контроль | 6553 ± 1015 | 6544 ± 1156 | 6313 ± 1483 | 6303±1279 |
| MOS | 6748 ± 1721 | 6490 ± 1608 | 6415 ± 1658 | 6872±1279 | |||
| эритроциты | М438-577Ж376-516 | × 104/мкл | Контроль | 464,9 ± 40,5 | 468,5 ± 42,6 | 457,1± 40,4* | 460,9±38,6 |
| MOS | 486,6± 32,3 | 487,4 ± 31,1 | 475,1±34,1* | 475,3±38,6** | |||
| гемоглобин | М13,6-18,3Ж11,2-15,2 | г/100 мл | Контроль | 14,17 ± 1,52 | 14,29 ± 1,65 | 14,00 ± 1,48 | 14,12±1,45 |
| MOS | 14,92 ± 0,95 | 14,82 ± 0,90 | 14,70 ± 0,96* | 14,58±1,45** | |||
| гематокрит | М40,4-51,9 Ж34,3-45,2 | % | Контроль | 44,29 ± 4,39 | 44,61 ± 4,69 | 43,31 ± 4,60** | 43,59±4,15* |
| MOS | 45,94 ± 2,92 | 46,31 ± 2,55 | 45,19 ± 2,68 | 44,81 ± 4,15* | |||
| MCV | М83-101Ж80-101 | Fl | Контроль | 95,3 ± 3,7 | 95,2 ± 3,0 | 94,7 ± 3,9 | 94,6 ±3,3 |
| MOS | 94,4 ± 3,5 | 95,0 ± 3,4 | 95,2 ± 2,6 | 94,4 ±3,3 | |||
| MCH | М28,2-34,7Ж26,4-34,3 | Пг | Контроль | 30,47 ± 1,37 | 30,46 ± 1,31 | 30,61 ± 1,28 | 30,62 ± 1,19 |
| MOS | 30,69 ± 0,84 | 30,45 ± 0,96 | 30,95 ± 0,74 | 30,67 ± 1,19 | |||
| MCHC | М31,8-36,4Ж31,3-36,1 | % | Контроль | 32,01 ± 1,47 | 32,02 ± 0,71 | 32,35 ± 0,51 | 32,38 ± 0,79 |
| MOS | 32,50 ± 0,91 | 32,01 ± 1,01 | 32,53 ± 0,58 | 32,54 ± 0,79 | |||
| Тромбоциты | 14,0-37,9 | Х104/мкл | Контроль | 24,32 ± 4,43 | 25,09 ± 5,41 | 23,32 ± 3,99 | 24,53 ± 4,87 |
| MOS | 23,02 ± 4,85 | 23,85 ± 4,54 | 22,58 ± 4,82 | 23,56 ± 4,87 | |||
| Значения представлены в виде среднего и стандартных ошибок.*, ** значительно отличаются от перед применением на 0 неделе с р < 0,05, p < 0,01 соответственно. |
| Таблица 6Результаты биохимического исследования крови в течение периода исследования | |||||||
| Нормальный диапазон | единицы | Группа | 0 неделя | 4 недели | 8недель | 12недель | |
| Общий белок | 6,5-8,2 | г/100 мл | Контроль | 7,48±0,09 | 7,46±0,33 | 7,33 ± 0,35** | 7,34 ± 0,28** |
| MOS | 7,53±0,09 | 7,51±0,19 | 7,53 ± 0,26 | 7,40 ± 0,28 | |||
| А/Г соотношение | 1,30-2,00 | - | Контроль | 1,45±0,19 | 1,43±0,16 | 1,45 ± 0,16 | 1,49 ± 0,16 |
| MOS | 1,51±0,18 | 1,44±0,15 | 1,45 ± 0,17 | 1,48 ± 0,16 | |||
| Альбумин | 3,7-5,5 | г/100 мл | Контроль | 4,41±0,24 | 4,38±0,24 | 4,33 ± 0,22* | 4,37 ± 0,14 |
| MOS | 4,50± 0,19 | 4,42± 0,24 | 4,44 ± 0,29 | 4,41 ± 0,14* | |||
| Общий билирубин | 0,2-1,0 | Мг/100 мл | Контроль | 0,79± 0,22 | 0,71± 0,21 | 0,74 ± 0,24 | 0,79 ± 0,25 |
| MOS | 0,72± 0,20 | 0,67± 0,18 | 0,74 ± 0,22 | 0,81 ± 0,25 | |||
| АсТ (GOT) | 10-40 | МЕ/л | Контроль | 25,9± 9,9 | 25,0± 9,2 | 25,0 ± 8,2 | 24,6±7,0 |
| MOS | 22,8±10,2 | 20,4 ± 7,0 | 22,5 ± 7,6 | 23,3 ± 7,0 | |||
| АлТ (GPT) | 5-45 | МЕ/л | Контроль | 28,1±16,7 | 28,1±19,0 | 25,5 ± 11,4 | 28,1 ± 11,7 |
| MOS | 28,3±17,8 | 25,2±9,7 | 25,8 ± 13,2 | 28,0 ± 11,7 | |||
| ЩФ | 104-338 | МЕ/л | Контроль | 238,7±64,4 | 245,9±75,6 | 228,4 ± 65,3 | 228,5 ± 64,2 |
| MOS | 214,3±55,5 | 223,3±52,8 | 209,2 ± 52,6 | 208,1 ± 64,2 | |||
| ЛДГ | 120-245 | МЕ/л | Контроль | 205,5±25,5 | 210,3±29,0 | 215,1± 25,4** | 202,2 ± 23,8 |
| MOS | 206,3±50,7 | 201,6±41,2 | 210,6 ± 43,6 | 196,6 ± 23,8* | |||
| γ-ГТП | М16-73 | МЕ/л | Контроль | 37,2±27,1 | 39,9±28,9 | 35,6 ± 23,2 | 41,9 ± 30,6 |
| (Ж8-32) | MOS | 38,7±21,7 | 36,2±20,2 | 32,1 ± 15,1* | 39,0 ± 30,6 | ||
| О-холестерин | 150-219 | Мг/100 мл | Контроль | 236,9±28,2 | 235,3±22,8 | 233,9 ± 30,2 | 243,5 ± 26,6 |
| MOS | 223,2±30,3 | 233,3±32,7 | 219,4 ± 30,6 | 224,5 ± 26,6 | |||
| ЛПВП | М40-80 | Мг/100 мл | Контроль | 52,8± 11,7 | 52,5± 13,2 | 52,5 ± 12,7 | 51,3 ± 13,7 |
| Ж40-90 | MOS | 56,6 ± 13,3 | 55,0 ± 13,6 | 56,1 ± 13,1 | 54,7 ± 13,7 | ||
| ЛПНП | 70-139 | Мг/100 мл | Контроль | 163,1 ± 30,3 | 151,3 ± 26,5 | 157,4 ± 28,5 | 156,8 ± 23,0 |
| MOS | 151,3 ± 26,0 | 152,2 ± 23,8 | 146,4 ± 28,7 | 141,8 ± 23,0* | |||
| триглицериды | 50-149 | Мг/100 мл | Контроль | 127,5 ± 56,6 | 153,0 ± 100,3 | 146,8 ± 70,0 | 142,3 ± 84,9 |
| MOS | 105,9 ± 52,5 | 139,0 ± 77,5 | 119,3 ± 52,2 | 113,2 ± 84,9 |
В начале введения (0 неделя) не было обнаружено значительных различий между двумя группами по любому из пунктов при исследовании крови и биохимическом исследовании крови. Для изучаемых показателей, связанных с липидами сыворотки человека, результаты исследования крови и биохимического исследования крови группы исследования показали существенное снижение холестерина ЛПНП от начала введения до 12 недель (р < 0,05). Хотя не было обнаружено достоверных различий между двумя группами, в группе исследования имелась тенденция к более низким значениям для концентрации общего холестерина (р < 0,054) и холестерина ЛПНП (р < 0,062) на 12 неделе по сравнению с контрольной группой. Хотя по сравнению с началом введения было несколько статистически значимых различий по показателям, иным, чем связанные с липидами сыворотки человека, такие различия находились в стандартном диапазоне.
ПРИМЕР 2: Эффект жидкого кофе, содержащего манноолигосахариды
Далее анализировали данные тестируемых пациентов в Примере 1, которые имели ИМТ > 26,4 (2 мужчин и 5 женщин). После потребления жидкого кофе, содержащего MOS, масса тела, соотношение жировой ткани тела и ИМТ снижались достоверно, как показано в таблице. Следовательно, жидкий кофе, содержащий MOS (3г/300 мл), показал наличие эффектов снижения ж