Производные имидазо-пиридина, обладающие сродством к рецептору меланокортина
Иллюстрации
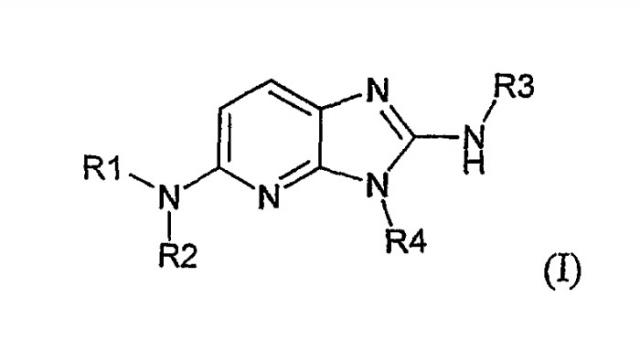
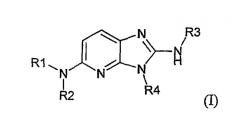
Показать всеОписываются новые производные имидазо-пиридина общей формулы I
в рацемической, энантиомерной форме или в виде любой комбинации этих форм и их фармацевтически приемлемые соли. Значения радикалов R1-R4 приведены в описании. Данные соединения обладают сродством к рецептору меланокортина, что позволяет их использовать при получении лекарственных средств для лечения нарушений, связанных с массой тела, расстройств психики, боли, нарушений половой активности. Описывается также фармацевтическая композиция, содержащая новые соединения, и способ их получения. 4 н. и 1 з.п. ф-лы, 1 табл.
Реферат
Объектом настоящего изобретения являются новые производные имидазо-пиридина. Эти продукты обладают высоким сродством к некоторым подтипам рецепторов меланокортинов, в частности к рецепторам МС4. Они представляют особый интерес для лечения патологических состояний и заболеваний, в которых участвует один или несколько рецепторов меланокортинов. Изобретение также относится к фармацевтическим композициям, содержащим указанные продукты, и к их применению для получения лекарственного средства.
Меланокортины представляют собой группу пептидов, происходящих от одного предшественника, проопиомеланокортина (РОМС), и структурно близких друг к другу: адренокортикотропного гормона (АСТН), гормона, стимулирующего α-меланоциты (α-MSH), β- MSH и γ-MSH (Eipper B.A. et Mains R.E., Endocr. Rev. 1980, 1, 1-27). Меланокортины осуществляют большое число физиологических функций. Они стимулируют синтез стероидов в коре надпочечников и синтез эумеланина в меланоцитах. Они регулируют усвоение питательных веществ, энергетический метаболизм, половую функцию, регенерацию нейронов, кровяное давление и частоту сердечных сокращений, а также восприятие боли, познавательную функцию, внимание и память. Меланокортины также обладают противовоспалительными и жаропонижающими свойствами и регулируют секрецию многих эндокринных или экзокринных желез, таких как сальные, слезные, молочные железы, предстательная железа и поджелудочная железа (Wikberg S.E. et al. Pharmacol. Res. 2000, 42, 393-420; Abdel-Malek Z.A., Cell. Mol. Life. Sci. 2001, 58, 434-441).
Действие меланокортинов опосредовано семейством особых мембранных рецепторов, имеющих семь трансмембранных доменов и связанных с белками G. На сегодняшний день клонировано и охарактеризовано пять подтипов рецепторов, названных МС1-МС5. Эти рецепторы различаются распределением в тканях и сродством к различным меланокортинам, причем рецепторы МС2 распознают только АСТН. Стимуляция рецепторов меланокортинов активирует аденилатциклазу и продукцию циклического АМФ. Хотя специфическая функциональная роль каждого из этих рецепторов выяснена не до конца, лечение патологических расстройств или заболеваний может быть связано со сродством к некоторым подтипам рецепторов. Так, активация рецепторов МС1 связана с лечением воспалений, тогда как их блокировка связана с лечением рака кожи. Лечение нарушений питания связано с рецепторами МС3 и МС4, лечение ожирения - за счет агонистов и лечение кахексии и анорексии - за счет антагонистов. Другими показаниями, связанными с активацией рецепторов МС3 и МС4 являются нарушения половой активности, невропатические боли, тревожные состояния, депрессия и наркомания. Активация рецепторов МС5 связана с лечением угрей и дерматозов.
Усилия исследователей направлены, таким образом, на поиск непептидных низкомолекулярных соединений, обладающих биодоступностью при пероральном введении, которые являлись бы мощными агонистами или антагонистами рецепторов меланокортина.
Заявитель обнаружил, что новые соединения общей формулы (I), приведенной ниже, обладают высоким сродством к рецепторам меланокортинов. Они действуют преимущественно на рецепторы МС4. Указанные соединения, являющиеся агонистами или антагонистами рецепторов меланокортинов, могут быть использованы для лечения патологических состояний или заболеваний обмена веществ, нервной системы или дерматологических, в которых участвуют один или несколько рецепторов меланокортинов, таких как, например, воспалительные состояния, нарушения энергетического гомеостаза, усвоения пищи, нарушения массы тела (ожирение, кахексия, анорексия), расстройства половой активности (нарушения эрекции), боль, в частности невропатическая боль. Можно также назвать психические расстройства (тревожные состояния, депрессия), наркоманию, кожные заболевания (угри, дерматозы, рак кожи, меланомы). Эти соединения также могут быть использованы для стимуляции регенерации нервов.
Таким образом, объектом изобретения являются соединения общей формулы(I)
в рацемической, энантиомерной форме или в виде любой комбинации этих форм, в которой:
R1 и R2 обозначают, независимо, атом водорода; (C1-C8)алкил, который может быть замещен гидроксилом; (C2-C6)алкенил; бициклоалкил; или радикал формулы -(CH2)n-Х1 или -X-(CH2)n'-X'1;
X обозначает -C(O)- или -C(S)-NH-;
X1 обозначает (C1-C6)алкоксил, (C3-C7)циклоалкил, адамантил, гетероциклоалкил, арил или гетероарил,
причем (C3-C7)циклоалкил, гетероциклоалкил, арил и гетероарил могут быть замещены одним или несколькими одинаковыми или разными заместителями, выбранными из -(CH2)n1-V1-Y1, галогена, нитрогруппы и цианогруппы;
V1 обозначает -O-, -S- или ковалентную связь;
Y1 обозначает (C1-C6)алкил, который может быть замещен одним или несколькими одинаковыми или разными галогенами, или арил;
n и n' обозначают целое число от 0 до 6 и n1 - целое число от 0 до 2 (при условии, что когда n равно 0, тогда X1 не обозначает радикал алкоксил);
X'1 обозначает атом водорода, (C1-C6)алкил, который может быть замещен одним или несколькими одинаковыми или разными галогенами, (C3-C7)циклоалкил; или арил, который может быть замещен одним или несколькими одинаковыми или разными заместителями, выбранными из галогена, нитрогруппы, цианогруппы, (C1-C6)алкилкарбонила, (C1-C6)алкила, который может быть замещен одним или несколькими одинаковыми или разными галогенами, и (C1-C6)алкоксила, который может быть замещен одним или несколькими одинаковыми или разными галогенами;
или R1 и R2 образуют вместе с атомом азота, с которым они связаны, гетеробициклоалкил или гетероциклоалкил, которые могут быть замещены одним или несколькими одинаковыми или разными заместителями, выбранными из гидроксила, (C1-C6)алкила, который может быть замещен гидроксилом, (C1-C6)алкоксикарбонила, -(CH2)n"-A, -C(O)-NV1'Y1' и гетероциклоалкила; или R1 и R2 вместе образуют радикал формулы:
V1' и Y1'обозначают, независимо, атом водорода или (C1-C6)алкил;
A обозначает арил, который может быть замещен одним или несколькими одинаковыми или разными заместителями, выбранными из галогена, нитрогруппы, цианогруппы, (C1-C6)алкила, который может быть замещен одним или несколькими одинаковыми или разными галогенами, и (C1-C6)алкоксила, который может быть замещен одним или несколькими одинаковыми или разными галогенами;
n" обозначает целое число от 0 до 2;
R3 обозначает -Z3, -C(RZ3)(R'Z3)-Z3, -C(RZ3)(R'Z3)-(CH2)p-Z3 или -C(O)-Z'3;
RZ3 и R'Z3 обозначают, независимо, атом водорода или (C1-C6)алкил;
Z3 обозначает Z3a, Z3b, Z3c, Z3d, или Z3e;
Z3a обозначает (C1-C6)алкил или (C2-C6)алкенил;
Z3b обозначает (C1-C6)алкоксил, (C1-C6)алкилтио, (C1-C6)алкиламино или ди((C1-C6)алкил)амино;
Z3c обозначает арил или гетероарил;
причем арил и гетероарил могут быть замещены одним или несколькими одинаковыми или разными заместителями, выбранными из галогена, цианогруппы, нитрогруппы, азидной группы, окси-радикала или -(CH2)p'-V3-Y3;
V3 обозначает -O-, -S-, -C(O)-, -C(O)-O-, -O(CO)-, -SO2-, -SO2NH-, -NR'3-SO2-, -NR'3-, -NR'3-C(O)-, -C(O)-NR'3-, -NH-C(O)-NR'3- или ковалентную связь;
Y3 обозначает атом водорода или (C1-C6)алкил, который может быть замещен одним или несколькими одинаковыми или разными галогенами; арил, который может быть замещен одним или несколькими одинаковыми или разными заместителями, выбранными из галогена, нитрогруппы, (C1-C6)алкила и (C1-C6)алкоксила; или арил-(C1-C6)-алкил, который может быть замещен одним или несколькими одинаковыми или разными заместителями, выбранными из галогена, нитрогруппы, (C1-C6)алкила и (C1-C6)алкоксила;
Z3d обозначает (C1-C6)алкоксикарбонил, аминокарбонил, (C1-C6)алкиламинокарбонил, ди((C1-C6)алкил)аминокарбонил;
Z3e обозначает (C1-C6)алкил-C(O)-NH-, (C3-C7)циклоалкил, гетероциклоалкил или радикал формулы
причем (C3-C7)циклоалкил и гетероциклоалкил могут быть замещены одним или несколькими окси-радикалами или одинаковыми или разными (C1-C6)алкилами,
Z'3 обозначает арил, который может быть замещен одним или несколькими одинаковыми или разными заместителями, выбранными из галогена, нитрогруппы и -(CH2)p"-V'3-Y'3;
V'3 обозначает -O-, -C(O)-, -C(O)-O-, -C(O)-NR'3-, -NR'3-C(O)-, -NH-C(O)-NR'3 или ковалентную связь;
Y'3 обозначает атом водорода или (C1-C6)алкил, который может быть замещен одним или несколькими одинаковыми или разными галогенами;
R'3 обозначает атом водорода, (C1-C6)алкил или (C1-C6)алкоксил;
p, p' и p" обозначают, независимо, целое число от 0 до 6;
R4 обозначает радикал формулы -(CH2)s-R'4;
R'4 обозначает гетероциклоалкил, содержащий по меньшей мере один атом азота и который может быть замещен (C1-C6)алкилом или аралкилом; гетероарил, содержащий по меньшей мере один атом азота и который может быть замещен (C1-C6)алкилом; или радикал формулы -NW4W'4;
W4 обозначает атом водорода или (C1-C8)алкил;
W'4 обозначает радикал формулы -(CH2)s'-Z4;
Z4 обозначает атом водорода, (C1-C8)алкил; (C2-C6)алкенил; (C3-C7)циклоалкил, который может быть замещен одним или несколькими одинаковыми или разными (C1-C6)алкильными заместителями; циклогексен; гетероарил; арил, который может быть замещен одним или несколькими одинаковыми или разными радикалами, выбранными из -(CH2)s"-V4-Y4, галогена и нитрогруппы;
V4 обозначает -O-, -S-, -NH-C(O)-, -NV4'- или ковалентную связь;
Y4 обозначает атом водорода или (C1-C6)алкил, который может быть замещен одним или несколькими одинаковыми или разными галогенами;
V4' обозначает атом водорода или (C1-C6)алкил;
s" обозначает целое число от 0 до 4;
или Z4 обозначает радикал формулы
s и s' обозначают, независимо, целое число от 0 до 6;
или фармацевтически приемлемая соль этого соединения.
В приведенных выше определениях выражение «галоген» обозначает фтор, хлор, бром или иод, предпочтительно хлор, фтор или бром. Выражение «алкил» (если не уточняется) предпочтительно обозначает алкил, содержащий от 1 до 6 атомов углерода, прямой или разветвленный, такой как метил, этил, пропил, изопропил, бутил, изобутил, втор.-бутил и трет.-бутил, пентил или амил, изопентил, неопентил, 2,2-диметил-пропил, гексил, изогексил или 1,2,2-триметил-пропил. Термин (C1-C8)алкил обозначает алкил, содержащий от 1 до 8 атомов углерода, прямой или разветвленный, такой как определенные выше, а также гептил, октил, 1,1,2,2-тетраметилпропил, 1,1,3,3-тетраметил-бутил. Под выражением «алкил, замещенный гидроксилом» следует понимать любую прямую или разветвленную алкильную цепь, содержащую гидроксил, расположенный по длине цепи; так, в случае цепи, содержащей 3 атома углерода и гидроксильный радикал, в качестве примера можно привести HO-(CH2)3-, CH3-CH(ОН)-CH2- и CH3-CH2-CH(OH)-.
Под алкенилом, если не уточняется, понимают прямой или разветвленный алкил, содержащий от 1 до 6 атомов углерода и по меньшей мере одну ненасыщенную (двойную) связь, такой как, например, винил, аллил, пропенил, бутенил или пентенил.
Термин «алкоксил» обозначает радикалы, в которых алкил является таким, как определено выше, такие как, например, метокси, этокси, пропилокси или изопропилокси, а прямой, вторичный или третичный бутокси, пентилокси. Термин «алкоксикарбонил» обозначает предпочтительно радикалы, в которых алкоксил является таким, как определено выше, например метоксикарбонил, этоксикарбонил.
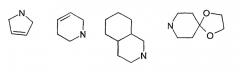
Термин «(C3-C7)циклоалкил» обозначает насыщенную углеродную моноциклическую систему, содержащую от 3 до 7 атомов углерода, предпочтительно циклопропильный, циклобутильный, циклопентильный, циклогексильный или циклогептильный циклы. Выражение «гетероциклоалкил» обозначает насыщенную моноциклическую или бициклическую конденсированную систему, содержащую от 2 до 9 атомов углерода и по меньшей мере один гетероатом. Этот радикал может содержать несколько одинаковых или разных гетероатомов. Предпочтительно гетероатомы выбирают из кислорода, серы или азота. В качестве примера гетероциклоалкила можно назвать циклы, содержащие по меньшей мере один атом азота, такие как пирролидин, имидазолидин, пиразолидин, изотиазолидин, тиазолидин, изоксазолидин, оксазолидин, пиперидин, пиперазин, азепан (азациклогептан), азациклооктан, диазепан, морфолин, декагидроизохинолин (или декагидрохинолин), а также циклы, не содержащие азот, такие как тетрагидрофуран или тетрагидротиофен. В качестве иллюстрации циклоалкила или гетероциклоалкила, замещенных окси-радикалом, можно назвать, например, пирролидинон и имидазолидинон.
Термин «бициклоалкил» обозначает неконденсированную насыщенную бициклическую углеводородную систему, содержащую от 5 до 9 атомов углерода, такую как бициклогептан, например бицикло[2,2,1]гептан, или бицикло-октан, например бицикло[2,2,2]октан или бицикло [3,2,1]октан. Термин «гетеробициклоалкил» обозначает неконденсированную насыщенную бициклическую углеводородную систему, содержащую от 5 до 8 атомов углерода и по меньшей мере один гетероатом, выбранный из азота, кислорода или серы. В качестве примера гетеробициклоалкила можно назвать азабициклогептан и азабициклооктан, такие как 7-аза-бицикло[2,2,1]гептан, 2-аза-бицикло [2,2,2]октан или 6-аза-бицикло[3,2,1]октан.
Выражение «арил» обозначает ароматический радикал, состоящий из одного цикла или нескольких конденсированных циклов, например фенил, нафтил, флуоренил или антрил. Выражение «гетероарил» обозначает ароматический радикал, состоящий из одного цикла или нескольких конденсированных циклов, где по меньшей мере один цикл содержит один или несколько одинаковых или разных гетероатомов, выбранных из серы, азота или кислорода. В качестве примера гетероарила можно назвать радикалы, содержащие по меньшей мере один атом азота, такие как пирролил, имидазолил, пиразолил, изотиазолил, тиазолил, изоксазолил, оксазолил, триазолил, тиадиазолил, пиридил, пиразинил, пиримидил, хинолил, изохинолил, хиноксалинил, индолил, дигидроиндолил, бензоксадиазолил, карбазолил, феноксазинил, а также радикалы, не содержащие атомов азота, такие как тиенил, бензотиенил, фурил, бензофурил, дибензофурил, дигидробензофурил, дибензотиенил, тиоксантенил или пиранил. Термин «аралкил (арилалкил)» предпочтительно обозначает радикалы, в которых арил и алкил являются такими, как определено выше, например бензил или фенетил. В качестве иллюстрации арила или гетероарила, замещенных окси-радикалом, можно назвать, например, флуоренон, акридон, ксантенон, бензотиенил-дион, антрахинон, тиоксантен, бензокумарин.
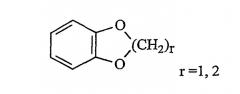
Также в настоящей заявке радикал (CH2)i (целое число i может обозначать n, n', n", n1, p, p', p", s, s' и s", как они определены выше) обозначает прямую или разветвленную углеводородную цепь, содержащую i атомов углерода. Так, радикал -(CH2)3- может обозначать -CH2-CH2-CH2-, но также -CH(CH3)-CH2-, -CH2-CH(CH3)- или - C(CH3)2-.
Также согласно настоящей заявке, когда какой-либо радикал имеет формулу -B-D-E, где D обозначает, например, -C(O)-NH-, это означает, что атом углерода в -C(O)-NH- связан с В, а атом азота - с E.
Предпочтительно изобретение относится к соединению формулы I, определенной выше, отличающемуся тем, что
R1 и R2 обозначают, независимо, атом водорода, (C1-C8) алкил, бициклоалкил или радикал формулы -(CH2)n-X1 или -X-(CH2)n'-X'1;
X обозначает -C(O)- или -C(S)-NH-;
X1 обозначает (C1-C6)алкоксил, (C3-C7)циклоалкил, который может быть замещен (C1-C6)алкилом, или гетероарил;
X'1 обозначает атом водорода, (C1-C6)алкил, который может быть замещен одним или несколькими одинаковыми или разными галогенами, (C3-C7)циклоалкил или арил, который может быть замещен (C1-C6)алкилкарбонилом;
или R1 и R2 образуют вместе с атомом азота, с которым они связаны, гетеробициклоалкил или гетероциклоалкил, который может быть замещен одним или несколькими одинаковыми или разными заместителями, выбранными из (C1-C6)алкила, (C1-C6)алкоксикарбонила и -(CH2)n''-A;
A обозначает арил, который может быть замещен одним или несколькими одинаковыми или разными заместителями, выбранными из галогена и (C1-C6)алкила;
n" обозначает целое число от 0 до 1;
R4 обозначает радикал формулы -(CH2)s-R'4;
R'4 обозначает гетероциклоалкил, содержащий по меньшей мере один атом азота и который может быть замещен (C1-C6)алкилом; или радикал формулы -NW4W'4;
W4 обозначает атом водорода или (C1-C8)алкил;
W'4 обозначает радикал формулы -(CH2)s'-Z4;
Z4 обозначает атом водорода, (C1-C8)алкил или арил, который может быть замещен одним или несколькими одинаковыми или разными радикалами, выбранными из -(CH2)s"-V4-Y4;
V4 обозначает -O-;
Y4 обозначает (C1-C6)алкил, который может быть замещен одним или несколькими одинаковыми или разными галогенами;
s" обозначает целое число от 0 до 4;
s и s' обозначают, независимо, целое число от 1 до 4;
или соль; или фармацевтически приемлемой соли этого соединения,
и, в частности, соединение I отвечает по меньшей мере одной из следующих характеристик:
циклоалкил выбран из циклопропила, циклобутила и циклогексила;
бициклоалкил представляет собой бицикло[2,2,1]гептан;
гетеробициклоалкил представляет собой 7-аза-бицикло [2,2,1]гептан;
арил представляет собой фенил;
гетероарил представляет собой фурил;
гетероциклоалкил выбран из пиперидина, морфолина и пиперазина; или является фармацевтически приемлемой солью этого соединения.
Также очень предпочтительно изобретение относится к соединению формулы I, как она определена выше, отличающемуся тем, что
R1 и R2 обозначают, независимо, атом водорода, (C1-C8)алкил или радикал формулы -(CH2)n-X1 или -X-(CH2)n'-X'1;
X обозначает -C(O)-;
X1 обозначает (C3-C7)циклоалкил;
X'1 обозначает атом водорода или (C3-C7)циклоалкил;
n обозначает 0 или 1; n' обозначает целое число от 0 до 5;
или R1 и R2 образуют вместе с атомом азота, с которым они связаны, гетероциклоалкил, который может быть замещен одним или несколькими одинаковыми или разными (C1-C6)алкильными заместителями;
и, в частности, (C3-C7)циклоалкил, обозначаемый X1 и X'1, выбирают из циклопропила, циклобутила и циклогексила; и гетероциклоалкил, который образуют вместе R1 и R2, представляет собой пиперидиновый цикл; или к фармацевтически приемлемой соли этого соединения.
Также очень предпочтительно изобретение относится к соединению формулы I, как она определена выше, отличающемуся тем, что
R4 обозначает радикал формулы -(CH2)s-R'4;
R'4 обозначает гетероциклоалкил, содержащий по меньшей мере один атом азота и который может быть замещен (C1-C6)алкилом; или радикал формулы -NW4W'4;
W4 обозначает атом водорода или (C1-C8)алкил;
W'4 обозначает радикал формулы -(CH2)s'-Z4;
Z4 обозначает атом водорода или (C1-C8)алкил;
s и s' обозначают, независимо, целое число от 2 до 4;
и, в частности, гетероциклоалкил, обозначаемый R'4, выбирают из пиперидина и морфолина; или к фармацевтически приемлемой соли этого соединения.
Также предпочтительно изобретение относится к соединению формулы I, как она определена выше, отличающемуся тем, что R3 обозначает -C(O)-Z'3;
Z'3 обозначает арил, который может быть замещен одним или несколькими одинаковыми или разными заместителями, выбранными из галогена и -(CH2)p''-V'3-Y'3;
V'3 обозначает -O- или ковалентную связь;
Y'3 обозначает атом водорода или (C1-C6)алкил, который может быть замещен одним или несколькими одинаковыми или разными галогенами;
p" обозначает целое число от 0 до 2; или к фармацевтически приемлемой соли этого соединения.
Также предпочтительно изобретение относится к соединению формулы I как она определена выше, отличающемуся тем, что R3 обозначает -Z3, -C(RZ3)(R'Z3)-Z3 или
-C(RZ3)(R'Z3)-(CH2)p-Z3; или к фармацевтически приемлемой соли этого соединения.
Также очень предпочтительно изобретение относится к соединению формулы I, как она определена выше, отличающемуся тем, что R3 обозначает -Z3 и Z3 обозначает Z3b, Z3c или Z3e; и предпочтительно Z3 обозначает Z3c и Z3c обозначает арил,
и, в частности, Z3c обозначает фенил, который может быть замещен одним или несколькими одинаковыми или разными заместителями, выбранными из галогена, нитрогруппы или -(CH2)p'-V3-Y3;
V3 обозначает -O-, -S-, -C(O)-, -C(O)-O-, -SO2NH-, -NR'3-C(O)-, -C(O)-NR'3- или ковалентную связь;
R'3 обозначает атом водорода;
Y3 обозначает атом водорода или (C1-C6)алкил, который может быть замещен одним или несколькими одинаковыми или разными галогенами;
и, в частности, Z3c обозначает фенил, замещенный одним или несколькими одинаковыми или разными заместителями формулы -(CH2)p'-V3-Y3;
V3 обозначает -C(O)-, -C(O)-O- или -C(O)-NR'3-;
R'3 обозначает атом водорода;
Y3 обозначает атом водорода или (C1-C6)алкил; или к фармацевтически приемлемой соли этого соединения.
Также очень предпочтительно изобретение относится к соединению формулы I, как она определена выше, отличающемуся тем, что R3 обозначает -C(RZ3)(R'Z3)-Z3 и Z3 обозначает Z3d или Z3e; или к фармацевтически приемлемой соли этого соединения.
Также очень предпочтительно изобретение относится к соединению формулы I, как она определена выше, отличающемуся тем, что R3 обозначает -C(RZ3)(R'Z3)-(CH2)p-Z3 и Z3 обозначает Z3с, Z3d или Z3e,
и, в частности, Z3 обозначает Z3d или Z3e;
Z3d обозначает (C1-C6)алкоксикарбонил или аминокарбонил;
Z3e обозначает (C1-C6)алкил-C(O)-NH-, гетероциклоалкил, который может быть замещен окси-радикалом, или радикал формулы
или к фармацевтически приемлемой соли этого соединения.
В настоящей заявке, символ ->* соответствует месту присоединения радикала. Если место присоединения на радикале не показано, это означает, что присоединение происходит по одному из свободных мест на этом радикале, по которому оно возможно.
В соответствии с определениями вариативных групп R1, R2, R3 и R4 соединения по изобретению могут быть получены в жидкой фазе согласно различным процедурам от А до Е, описанным ниже.
А. Получение согласно реакционной схеме A:
Как описано на схеме А, 2,6-дихлор-3-нитропиридин может быть обработан первичным амином в присутствии органического основания, такого как третичный амин, или неорганического основания, такого как карбонат калия или цезия, в апротонном неполярном растворителе, таком как толуол, при температуре, близкой к 20°C, в течение 3-18 часов с получением соединения (1). Хлорсодержащее производное (1) может вступать в реакцию с первичным или вторичным амином в присутствии органического основания, такого как третичный амин, или неорганического основания, такого как карбонат калия или цезия, в апротонном полярном растворителе, таком как ацетонитрил, диметилформамид или НМРА, при температуре 20-70°C в течение 2-18 часов с получением соединения (2). Нитрогруппу соединения (2) восстанавливают каталитическим гидрированием в присутствии 10% палладия на угле в инертном растворителе, таком как метанол, этанол, этилацетат, или в смеси этих растворителей при температуре 18-25°C в течение 2-8 часов с получением дианилина (3). Производное (3) затем обрабатывают изотиоцианатом в присутствии агента сочетания, на смоле в качестве носителя или без носителя, такого как диизопропилкарбодиимид или дициклогексилкарбодиимид, или N-циклогексилкарбодиимид-N-метилполистирольная смола, в инертном растворителе, таком как тетрагидрофуран, метиленхлорид или хлороформ, при температуре 20-70°C в течение 2-72 часов с получением производного (4). В альтернативном варианте производное (3) может быть обработано изотиоцианатом в инертном растворителе, таком как тетрагидрофуран, метиленхлорид, хлороформ или этанол, при температуре 20-80°C в течение 1-16 часов, после чего полученный тиокарбамид может быть обработана желтым оксидом ртути (II) в присутствии каталитического количества серы в полярном растворителе, таком как метанол или этанол, в течение 2-24 часов при температуре 20-80°C с получением (4).
Пример A1: гидрохлорид 4-{[3-(3-аминопропил)-5-(диизобутиламино)-3H-имидазо[4,5-b]пиридин-2-ил]амино}-N-метилбензамида
Стадия 1: трет.-бутил 3-[(6-хлор-3-нитропиридин-2-ил)амино]пропилкарбамат
К 2,6-дихлор-3-нитропиридину (8 г, 1 экв.) в растворе в толуоле (150 мл) последовательно добавляют карбонат калия (5,4 г, 1,2 экв.) и трет.-бутил-N(2-аминопропил)карбамат (6,8 г, 1 экв.). После 6 часов перемешивания при температуре, близкой к 20°C, смесь концентрируют при пониженном давлении при 40°C, затем добавляют воду (80 мл) и дихлорметан (200 мл). После декантации и экстракции объединенные органические фазы промывают рассолом, высушивают над Na2SO4, затем концентрируют при пониженном давлении при 40°C. В результате очистки полученного твердого вещества, осуществляемой путем флэш-хроматографии на силикагеле (элюент: гептан/этилацетат 7:3), получают целевое соединение в виде твердого вещества желтого цвета (11,4 г; выход 92%).
SM/CL: MM рассчитанная=330,7; m/z=331,1 (MH+)
ЯМР (1H, 400 МГц, ДМСО-d6): δ 1,36(с, 9H), 1,68(м, 2H), 2,99(дд, 2H), 3,51(дд, 2H), 6,76(д, 1H), 6,86(т, 1H), 8,41(д, 1H), 8,75(т, 1H).
Стадия 2: трет.-бутил 3-{[6-(диизобутиламино)-3-нитропиридин-2-ил]амино}пропилкарбамат
К раствору трет.-бутил 3-[(6-хлор-3-нитропиридин-2-ил)амино]пропилкарбамата (2 г, 1 экв.) в ацетонитриле (100 мл) последовательно добавляют карбонат калия (1,31 г, 1,5 экв.) и диизобутиламин (981 мг, 1,2 экв.). Смесь нагревают с обратным холодильником в течение 5 часов, затем охлаждают до комнатной температуры и концентрируют при пониженном давлении при 40°C. Остаток помещают в дихлорметан (200 мл) и воду (90 мл). После декантации и экстракции объединенные органические фазы промывают рассолом, высушивают над Na2SO4, затем концентрируют при пониженном давлении при 40°C. В результате очистки полученного остатка, осуществляемой путем флэш-хроматографии на силикагеле (элюент:гептан/этилацетат 7:3 - 1:1), получают целевое соединение в виде масла желтого цвета (2,46 г; выход 95%).
SM/CL: MM рассчитанная=437,6; m/z=438,3 (MH+)
ЯМР (1H, 400 МГц, ДМСО-d 6): δ 0,86(м, 12H), 1,36(с,9H), 1,68(м, 2H), 1,99(м,1H),2,15(м, 1H) 2,98(дд,2H), 3,35(м, 2H), 3,48(м, 4H) 6, 20(д, 1H), 6,85(т,1H), 8,01(д, 1H), 8,85(т, 1H).
Стадия 3: трет.-бутил 3-[5-(диизобутиламино)-2-({4-[(метиламино)карбонил]фенил}амино)-3H-имидазо[4,5-b]пиридин-3-ил]пропилкарбамат
В гемолизную пробирку, помещенную в автоклав, вводят трет.-бутил-3-{[6-(диизобутиламино)-3-нитропиридин-2-ил]амино}пропилкарбамат (63 мг) в растворе в смеси этилацетат/этанол 3:1 (1,5 мл), и 10% палладий на угле (7 мг). После 3 часов перемешивания в атмосфере водорода (3 бар) при температуре приблизительно 20°C смесь отфильтровывают через целит в гемолизную пробирку, содержащую раствор 4-изотиоцианато-N-метилбензамид (43 мг, 1,2 экв.) в тетрагидрофуране (1 мл). К полученному таким образом фильтрату добавляют N-циклогексилкарбодиимид-N-метил-полистирольную смолу (Novabiochem; загрузка 1,9 ммоль/г; 237 мг, 3 экв.). Смесь нагревают с обратным холодильником в течение 18 часов, охлаждают до комнатной температуры, затем фильтруют через стеклянный фильтр и концентрируют фильтрат при пониженном давлении при 40°C. В результате очистки остатка путем флэш-хроматографии на силикагеле (элюент: гептан/этилацетат от 1:1 до 100% этилацетата) получают целевое соединение (53 мг; выход 65%).
SM/CL: MM рассчитанная=551,7; m/z=552,3 (MH+)
ЯМР(1H, 400 МГц, ДМСО-d 6): δ 0,88(д, 12H), 1,36(с, 9H), 1,83(м,2H), 2,09(м, 2H), 2,76(д,3H), 2,98(м, 2H), 3,35(м, 4H), 4,15(т,2H), 6,34(д, 1H), 6,80(т, 1H), 7,51(д, 1H), 7,78(AB, 2H), 7,85(AB, 2H), 8,20(м, 1H), 8,97(с, 1H).
Стадия 4: гидрохлорид 4-{[3-(3-аминопропил)-5-(диизобутиламино)-3H-имидазо[4,5-b]пиридин-2-ил]амино}-N-метилбензамид
К раствору трет.-бутил 3-[5-(диизобутиламино)-2-({4-[(метиламино)карбонил]фенил}амино)-3H-имидазо[4,5-b]пиридин-3-ил]пропилкарбамата (51 мг) в этилацетате (0,5 мл) добавляют раствор соляной кислоты в простом эфире (1н., 2 мл). После 2 часов перемешивания при температуре, близкой к 20°C, смесь фильтруют и полученное твердое вещество промывают простым этиловым эфиром и высушивают (50 мг; выход 95%).
SM/CL: MM рассчитанная=451,6; m/z=452,3 (MH+)
ЯМР (1H, 400 МГц, ДМСО-d 6): δ 0,88(д, 12H), 2,10-2,19(м, 4H), 2,79 (д, 3H), 2,95(м, 2H), 3,35(м, 4H), 4,40(т, 2H), 6,55(д, 1H), 7,53(д, 1H), 7,64(м, 2H), 7,94(м, 5H), 8,45(м, 2H).
Пример A2: гидрохлорид 1-(4-{[5-(дибутиламино)-3-(3-пиперидин-1-илпропил)-3H-имидазо[4,5-b]пиридин-2-ил]амино}фенил)-этанона
Стадия 1: 6-хлор-3-нитро-N-(3-пиперидин-1-илпропил) пиридин-2-амин
К 2,6-дихлор-3-нитропиридин (500 мг, 1 экв.) в растворе в толуоле (10 мл) последовательно добавляют карбонат калия (540 мг, 1,5 экв.) и 3-пиперидино-пропиламин (420 мг, 1 экв.). После 2 часов перемешивания при температуре, близкой к 20°C, смесь концентрируют при пониженном давлении при 40°C, затем добавляют воду (20 мл) и дихлорметан (70 мл). После декантации и экстракции объединенные органические фазы промывают рассолом, высушивают над Na2SO4, затем концентрируют при пониженном давлении при 40°C. В результате очистки полученного твердого вещества, осуществляемой с помощью флэш-хроматографии на силикагеле (элюент:гептан/этилацетат 3:7 до 100% этилацетата), получают целевое соединение в виде твердого вещества желтого цвета (473 мг; 61% выход).
SM/CL: MM рассчитанная=298,8; m/z=299,1 (MH+)
ЯМР (1H,400 МГц, ДМСО-d 6): δ 1,37(м, 2H), 1,49(м, 4H), 1,74(м, 2H), 2,34(м, 6H) 3,55(м, 2H), 6,75(д,1H), 8,40(д, 1H), 8,96(т, 1H).
Стадия 2: N 6 ,N 6 -дибутил-3-нитро-N 2 -(3-пиперидин-1-илпропил)пиридин-2,6-диамин
К раствору 6-хлор-3-нитро-N-(3-пиперидин-1-илпропил)пиридин-2-амина (59 мг, 1 экв.) в ацетонитриле (3 мл) последовательно добавляют карбонат калия (54 мг, 2 экв.) и раствор дибутиламина (30 мг, 1,2 экв.) в ацетонитриле (2 мл). Смесь нагревают с обратным холодильником в течение 15 часов затем охлаждают до комнатной температуры и концентрируют при пониженном давлении при 40°C. Остаток помещают в дихлорметан (200 мл) и воду (90 мл). После декантации и экстракции объединенные органические фазы промывают рассолом, высушивают над Na2SO4 затем концентрируют при пониженном давлении при 40°C. В результате очистки полученного остатка, осуществляемой с помощью флэш-хроматографии на силикагеле (элюент:гептан/этилацетат 1:1 до 100% этилацетата), получают целевое соединение (73 мг; выход 95%).
SM/CL: MM рассчитанная=391,6; m/z=392,2 (MH+)
Стадия 3: гидрохлорид 1-(4-{[5-(дибутиламино)-3-(3-пиперидин-1-илпропил)-3H-имидазо[4,5-b]пиридин-2-ил]амино}фенил)этанон
В гемолизную пробирку, помещенную в автоклав, добавляют N 6 ,N 6-дибутил-3-нитро-N 2-(3-пиперидин-1-илпропил)пиридин-2,6-диамин (70 мг) в растворе в смеси этилацетат/метанол 3:1 (2 мл) и палладий на угле 10% (7 мг). После 3 часов перемешивания в атмосфере водорода (3 бар) при температуре приблизительно 20°C смесь фильтруют через целит в гемолизную пробирку, содержащую раствор 4-изотиоцианато-N-метилбензамид (43 мг, 1,2 экв.) в тетрагидрофуране (1 мл). К полученному таким образом фильтрату добавляют N-циклогексилкарбодиимид-N-метил-полистирольную смолу (Novabiochem; загрузка 1,9 ммоль/г; 284 мг, 3 экв.). Смесь нагревают с обратным холодильником в течение 18 часов, охлаждают до комнатной температуры, затем фильтруют через стеклянный фильтр и фильтрат концентрируют при пониженном давлении при 40°C. В результате очистки остатка, осуществляемой с помощью флэш-хроматографии на силикагеле (элюент: от 100% дихлорметана до дихлорметан/метанол 9:1), получают целевое соединение в виде основания. Соль соответствующего гидрохлорида образуют добавлением раствора 1н. соляной кислоты в простом этиловом эфире. Полученный осадок фильтруют и высушивают, получая целевое соединение (72 мг).
SM/CL: MM рассчитанная=504,7; m/z=505,2 (MH+)
ЯМР (lH, 400 МГц, ДМСО-d 6): δ 0,92(т, 6H), 1,34(м, 5H), 1,55(м, 4H), 1,77(м, 5H), 2,35(м, 2H), 2,59(с, 3H), 2,88(м, 2H), 3,18(м, 2H), 3,38(м, 2H), 3,49(м, 4H), 4,48(т, 2H), 6,60(м, 1H), 7,59(д, 1H), 7,70(д, 2H), 8,06(м, 2H), 10,62(s, 1H), 11,71(s, 1H).
Получение изотиоцианатов, не выпускаемых промышленно:
Первичный амин может быть превращен в изотиоцианат обработкой тиофосгеном в присутствии третичного основания, такого как триэтиламин, в апротонном растворителе, таком как дихлорметан или тетрагидрофуран, при температуре 0-20°C в течение 0,3-2 часов, или, в альтернативном варианте, обработкой дисульфидом углерода и циклогексилкарбодиимидом на носителе в виде смолы или без носителя в апротонном растворителе, таком как дихлорметан или тетрагидрофуран, при температуре 0-70°C в течение 0,3-15 часов.
Получение 4-изотиоцианато-N-метилбензамида :
К охлажденному до 0°C раствору 4-амино-N-метилбензамида (2 г, 1 экв.) и триэтиламина (5,6 мл, 3 экв.) в тетрагидрофуране (260 мл) по каплям добавляют тиофосген (1,13 мл, 1,1 экв.). Смесь перемешивают 30 мин при 0°C, затем удаляют холодную баню и продолжают перемешивание в течение еще 30 мин. В смесь добавляют воду (100 мл) и простой диэтиловый эфир (250 мл). После декантации и экстракции органические фазы объединяют, промывают рассолом, высушивают над Na2SO4, затем концентрируют при пониженном давлении при 40°C. Полученное твердое вещество перекристаллизуют в смеси дихлорметан/петролейный эфир (2,2 г; выход 86%).
ЯМР (1Н, 400 МГц, ДМСО-d 6): 2,77(д, 3Н), 7,51(АВ, 2Н), 7,88(АВ, 2Н), 8,52(м, 1Н).
Согласно процедуре, аналогичной той, которая была описана для N-(4-изотиоцианатофенил)ацетамида, могут быть получены следующие изотиоцианаты:
Получение N-(4-изотиоцианатофенил)-N'-метоксикарбамида :
К охлажденному до 0°C раствору трет.-бутил-4-аминофенилкарбамата (1,04 г) в безводном дихлорметане (100 мл) добавляют карбонилдиимидазол (CDI) (1,62 г, 2 экв.). Температуру смеси доводят до 20°C и перемешивают при этой температуре в течение 15 часов. К охлажденной до 0°C реакционной среде последовательно добавляют триэтиламин (7 мл, 10 экв.), затем гидрохлорид O-метилгидроксиламина (4,2 г, 10 экв.). После 3 часов перемешивания при температуре, близкой к 20°C, к смеси добавляют воду, насыщенную гидрокарбонатом натрия и хлороформом. После декантации и экстракции объединенные органические фазы промывают рассолом, высушивают над Na2SO4, затем концентрируют при пониженном давлении при 40°C, получая трет.-бутил-4-{[(метоксиамино)карбонил]амино}фенилкарбамат (1,33 г). Через суспензию этого производного в этилацетате пропускают ток газообразной соляной кислоты до полного завершения реакции. Полученный осадок фильтруют, затем промывают простым диэтиловым эфиром и высушивают, получая гидрохлорид N-(4-аминофенил)-N'-метоксикарбамида (1 г).
К охлажденному до 0°C раствору гидрохлорида N-(4-аминофенил)-N-метоксикарбамида (1 г) и триэтиламина (3,2 мл, 5 экв.) в тетрагидрофуране (90 мл) по каплям добавляют тиофосген (0,38 мл, 1,1 экв.). Смесь перемешивают 15 мин при 0°C, затем добавляют воду и простой диэтиловый эфир. После декантации и экстракции органические фазы объединяют, промывают рассолом, высушивают над Na2SO4, затем концентрируют при пониженном давлении при 40°C. В результате очистки, осуществляемой с помощью флэш-хроматографии на силикагеле (элюент:гептан/этилацетат от 7:3 до 3:7), получают целевое соединение (630 мг ; выход 62%).
ЯМР (1H, 400 МГц, ДМСО-d 6): δ 3,61(с, 3H), 7,34(AB, 2H), 7,67(AB, 2H), 9,11(с, 1H), 9,65(с, 1H).
Получение ацил-изотиоцианатов, не выпускаемых промышленно: