Способ анализа панкреатита и содержащих его композиций
Иллюстрации
Показать всеЗаявлен способ анализа образца белков, содержащего панкреатин и/или панкреатинподобную смесь пищеварительных ферментов, двухмерным электрофорезом в геле. Заявленное изобретение обеспечивает оптимизированный способ анализа панкреатина, прежде всего осажденного панкреатина или образцов мини-микросфер панкреатина, который можно использовать в фармацевтике. 2 н. и 11 з.п. ф-лы, 11 табл., 11 ил.
Реферат
В настоящем изобретении предлагается новый способ анализа идентичности и состава смесей белков и/или пептидов, а также стабильности образцов, содержащих физиологически приемлемые смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью, прежде всего смесей пищеварительных ферментов, таких как панкреатин, прежде всего в связи с получением препаратов медицинского назначения, включающих указанные ферменты, например осажденный панкреатин или мини-микросферы панкреатина.
Объектом изобретения является разработка нового аналитического способа, пригодного для анализа фармацевтических препаратов, включающих смеси пищеварительных ферментов, таких как панкреатин, прежде всего также в связи с получением препаратов медицинского назначения, включающих указанные смеси ферментов, например панкреатин или мини-микросферы панкреатина. Объектом изобретения прежде всего является пригодный и достоверный способ анализа, который можно использовать в фармацевтике для анализа и определения идентичности состава смесей белков и/или пептидов, а также стабильности образцов указанных пищеварительных ферментов. Кроме того, объектом изобретения является разработка указанного способа анализа, оптимизированного для анализа панкреатина, прежде всего осажденного панкреатина или образцов мини-микросфер панкреатина.
Согласно изобретению физиологически приемлемые смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью, такие как пригодные смеси ферментов микробиологического происхождения и/или прежде всего смеси пищеварительных ферментов животного происхождения, такие как предпочтительно панкреатин или панкреатинподобные смеси пищеварительных ферментов, анализируют способами анализа, которые в основном описаны в настоящей заявке.
Способ по настоящему изобретению можно использовать для анализа физиологически приемлемых смесей ферментов, обладающих липолитической, протеолитической и амилолитической активностью, животного или микробиологического происхождения. В качестве смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которые можно анализировать способом по изобретению, используют как ферменты только микробиологического происхождения, так и ферменты только животного происхождения, или смеси ферментов животного и микробиологического происхождения.
Таким образом, в одном варианте изобретения используется смесь ферментов исключительно микробиологического происхождения. Пригодными ферментами микробиологического происхождения являются прежде всего ферменты, продуцируемые прежде всего бактериями, т.е. штаммами Bacillus или Pseudomonas, или культурами грибов, такими как плесневые грибы, например штаммами Rhizopus и Aspergillus. Примеры таких физиологически приемлемых бактериальных ферментов и/или ферментов плесневых грибов описаны в уровне техники, например, в связи с их синтезом и применением для лечения нарушенного пищеварения. Липазы получают, например, из штаммов Bacillus или Pseudomonas, амилазы и липазы получают из плесневых грибов, например из штамма Rhizopus, а протеазы получают, например из штаммов Aspergillus.
В одном предпочтительном варианте изобретения описано применение смесей пищеварительных ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которые по своим свойствам аналогичны панкреатину. По настоящему изобретению предпочтительно используют смеси пищеварительных ферментов, содержащие панкреатин, прежде всего нативный панкреатин, и при необходимости в панкреатин или в смеси пищеварительных ферментов, содержащие панкреатин, можно добавлять один или более микробиологических ферментов, т.е. ферментов, синтезируемых микроорганизмами, из группы липаз, протеаз и амилаз. Наиболее предпочтительный способ по изобретению пригоден для анализа осажденного панкреатина или образцов мини-микросфер панкреатина.
Панкреатин представляет собой известную смесь ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которая выпускается под торговым названием Creon® в форме гранул, шариков или капсул, микросфер с энтеросолюбильным покрытием и используется в медицине для ферментзаместительной терапии, например, при недостаточности поджелудочной железы, пищеварительной недостаточности после операций на желудке, при заболеваниях печени и желчного пузыря, муковисцидозе и хроническом панкреатите. В общем случае панкреатин получают в виде смеси природных ферментов экстракцией поджелудочной железы свиньи, например, способом, описанным в заявках на выдачу патентов Германии DE 2512746 и DE 4203315, а затем перерабатывают в требуемую галеновую форму известным способом. Ферменты поджелудочной железы обычно вводят пероральным способом в форме твердых препаратов.
В другом варианте изобретения фармацевтические препараты, анализируемые способом по изобретению, содержат предпочтительно панкреатин или смеси пищеварительных ферментов, содержащие панкреатин. Указанные фармацевтические препараты, анализируемые способом по изобретению, могут содержать панкреатин или смеси пищеварительных ферментов, содержащие панкреатин, и в некоторых случаях указанные смеси наряду с панкреатином содержат один или более физиологически приемлемых ферментов из группы липаз, протеаз и амилаз из микроорганизмов. Микробные ферменты, используемые в этой добавке, включают прежде всего вышеуказанные синтезируемые бактериями ферменты, например штаммами Bacillus или Pseudomonas, или грибковыми культурами, такими как плесневые грибы, например штаммы Rhizopus или Aspergillus. Липазы, добавляемые в панкреатин и смеси ферментов, содержащих панкреатин, синтезируются, например, штаммами Bacillus или Pseudomonas, амилазы и липазы синтезируются плесневыми грибами, например штаммом Rhizopus, а протеазы, например, штаммом Aspergillus.
В настоящее время установлено, что для эффективного анализа физиологически приемлемых смесей ферментов, обладающих липолитической, протеолитической и амилолитической активностью, таких, как панкреатин или смеси ферментов, неживотного происхождения, которые можно получить из микробиологических и/или животных источников и которые описаны в ссылках, приведенных в настоящем изобретении, можно использовать способы по настоящему изобретению. В изобретении предлагается эффективный и надежный (воспроизводимый) способ, например, для анализа и определения идентичности и состава смесей белков и/или пептидов, а также стабильности композиций указанных пищеварительных ферментов или образцов, содержащих физиологически приемлемые смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью. Для специалиста в данной области техники представляется очевидным, что указанные параметры можно в определенной степени изменять при сохранении функциональных возможностей способа по настоящему изобретению; например можно изменить параметры, указанные при осуществлении способа в следующем описании, примерах, таблицах и рисунках, в пределах ±10%, прежде всего ±5%.
Таким образом, изобретение относится к способу анализа, предназначенному для изучения свойств и/или спецификации образцов белка, содержащих физиологически приемлемые смеси пищеварительных ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которые используются для получения фармацевтических препаратов, предназначенных для лечения нарушений и/или заболеваний, двухмерным электрофорезом в геле (2М ЭФ), причем указанный способ включает:
а) получение образца растворением смеси ферментов в композиции растворителей для электрофореза в геле, включающей специальный растворитель, пригодный для растворения белков, внутренний стандарт для количественного определения белков и агент, ингибирующий протеазы;
б) стадию изоэлектрического фокусирования для проведения электрофореза в первом направлении и применение градиента рН для разделения белковых фракций;
в) последующую стадию предварительной обработки, включающую пропитку геля буферным раствором;
г) перенос геля для разделения во втором направлении и проведение разделения в ДСН-ПААГ (в полиакриламидном геле в присутствии додецилсульфата натрия);
д) фиксирование и окрашивание гелей, полученных на стадии г); и
е) денситометрическую оценку флуоресцентным сканированием.
Метод двухмерного электрофореза в геле (2М ЭФ) прежде всего пригоден для анализа и определения идентичности и состава белков и/или пептидов, а также стабильности указанных композиций пищеварительных ферментов или образцов, содержащих физиологически приемлемые смеси ферментов, обладающих липолитической, протеолитической и амилолитической активностью, причем молекулярная масса фракций белков или пептидов составляет от приблизительно 8 кДа (килодальтон) и выше. Этот вариант изобретения прежде всего пригоден для анализа и определения идентичности и состава белков и/или пептидов, а также стабильности панкреатина и прежде всего осажденного панкреатина или мини-микросфер панкреатина. Параметры, используемые при реализации вариантов способа по настоящему изобретению, подробно описаны ниже в разделах "Идентификация пятен с использованием МС (MALDI-TOF)", "Анализ устойчивости осажденного панкреатина к действию стресс-факторов", "Методика идентификации и определение белкового состава образцов осажденного панкреатина с использованием 2М ЭФ", и в соответствующих таблицах и, кроме того, иллюстрируются на чертежах, приведенных в описании настоящего изобретения.
Для анализа образцов пищеварительных ферментов, например, панкреатина и прежде всего осажденного панкреатина или мини-микросфер панкреатина с молекулярной массой фракций белков или пептидов менее приблизительно 8 кДа используют вариант изобретения, включающий кроме того анализ методом аналитической ОФ-ЖХВР.
Объект изобретения, указанный выше, включает анализ смеси липаз, протеаз и амилаз микробиологического происхождения. Другой объект изобретения, описанный выше, относится к анализу панкреатина и/или панкреатинподобной смеси пищеварительных ферментов. Еще одним объектом изобретения является анализ образца панкреатина, который представляет собой осажденный панекреатин или мини-микросферы панкреатина.
Другим объектом изобретения является вышеуказанный способ анализа, при котором растворитель, используемый на стадии (а) для растворения образца, представляет собой буферный раствор для лизиса следующего состава: 7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН 3-10.
Еще одним объектом изобретения является вышеуказанный способ анализа, при котором внутренний стандарт для количественного анализа белков, используемый на стадии (а), представляет собой фосфорилазу В, предпочтительно фосфорилазу В кролика, или карбоангидразу, предпочтительно карбоангидразу КРС.
Кроме того, объектом изобретения является вышеуказанный способ анализа, при котором агент, ингибирующий протеазы, представляет собой набор ингибиторов Mini Complete и/или Pefabloc.
Еще одним объектом изобретения является вышеуказанный способ анализа, при котором растворитель, используемый на стадии (а) для растворения образца, означает растворитель Lp3, содержащий раствор 1,5 мг набора Mini Complete в 2 мл буферного раствора для лизиса следующего состава: 7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ, и 0,5% фармалит®, рН 3-10, и раствор 1 мг набора Pefabloc в 2 мл буферного раствора для лизиса, смешанные в соотношении 1:1 об./об.
Кроме того, изобретение относится к вышеуказанному способу анализа методом 2М ЭФ, причем указанный способ используется для изучения свойств и количественного анализа белковых и/или пептидных фракций с молекулярной массой более приблизительно 8 кДа.
Еще одним объектом изобретения является вышеуказанный способ анализа, который включает определение идентичности и/или белкового, и/или пептидного состава панкреатина, предпочтительно образца осажденного панкреатина или образца мини-микросфер панкреатина.
Еще одним объектом изобретения является вышеуказанный способ анализа, который кроме того включает идентификацию белковых и/или пептидных пятен с использованием МС (MALDI-TOF).
Другим объектом изобретения является вышеуказанный способ анализа, который используется для определения стабильности и устойчивости к действию стресс-факторов, идентичности и/или белкового, и/или пептидного состава панкреатина, предпочтительно образца осажденного панкреатина или образца мини-микросфер панкреатина, и примесей и/или продуктов деградации, причем указанный способ необязательно включает также количественный анализ указанных белков, пептидов, примесей и/или продуктов деградации.
Еще одним объектом изобретения является вышеуказанный способ анализа, причем указанный способ включает также изучение свойств и количественный анализ фракций низкомолекулярных белков и/или пептидов с молекулярной массой менее приблизительно 8 кДа методом ОФ-ЖХВР.
Другим объектом изобретения является также композиция растворителя, пригодная для характеризации и/или спецификации образцов физиологически приемлемых смесей ферментов, обладающих липолитической, протеолитической и амилолитической активностью, которые используются для получения фармацевтических препаратов, предназначенных для лечения нарушений и/или заболеваний, методом 2М ЭФ, включающая:
(а) растворитель, пригодный для проведения электрофореза в геле и разделения белков, т.е. буферный раствор для лизиса следующего состава: 7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН 3-10,
(б) внутренний стандарт для количественного анализа белка, и
(в) ингибитор протеаз.
Вариантом указанного растворителя является композиция, в которой растворитель для растворения образца означает растворитель Lp3, содержащий раствор 1,5 мг набора Mini Complete в 2 мл буферного раствора для лизиса следующего состава: 7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ и 0,5% фармалит®, рН 3-10, и раствор 1 мг набора Pefabloc в 2 мл буферного раствора для лизиса, смешанные в соотношении 1:1 об./об.
Термины и сокращения, используемые в описании заявки, имеют следующие значения:
| ммс | мини-микросферы (мини-микросферы панкреатина) |
| HCl | соляная кислота |
| API | активный фармацевтический ингредиент |
| NDA | новое применение лекарственного средства |
| FDA | Управление по контролю за продуктами и лекарственными средствами |
| МС (MALDI-TOF) | времяпролетная масс-спектрометрия с матричной лазерной десорбционной ионизацией |
| UTLIEF | изоэлектрофокусирование в сверхтонком слое |
| МС (ESI) | масс-спектрометрия с ионизацией электрораспылением |
Способы анализа по изобретению, прежде всего после утверждения в соответствующих организациях для фармацевтических и законодательных целей, предпочтительно предназначены для применения с целью характеризации и контроля за формированием осажденного панкреатина и могут также применяться для анализа мини-микросфер панкреатина с энтеросолюбильным покрытием (мини-микросферы панкреатина).
Например, спецификация продукта, подлежащего регистрации в качестве NDA для активного ингредиента в виде осажденного панкреатина и лекарственной формы ммс панкреатина с энтеросолюбильным покрытием включает такие показатели, как идентификация, степень чистоты, количественный анализ, устойчивость в желудочном соке и высвобождение ферментов. В уровне техники описана идентификация, основанная на анализе ферментативной активности, который используется для определения активности ферментов в API и в лекарственной форме. Показатель "чистота" включает также определение остаточного содержания растворителей (в API и ммс), жира (в API), воды (в API и ммс) и определение микрофлоры. С учетом современных требований FDA и перспектив на будущее, описанных в руководстве Q6B "Спецификации, методики испытаний и приемлемые критерии биотехнологических/биологических продуктов", представляется необходимым более подробное изучение свойств лекарственного средства и лекарственной формы, причем особое внимание следует обратить на идентификацию и количественный анализ различных классов ферментов, примесей и продуктов деградации этих ферментов. Результаты и методы характеризации можно выбирать в зависимости от назначения указанных продуктов.
Таким образом, для характеризации и спецификации указанных продуктов в настоящем изобретении предлагается двухмерный электрофорез в геле (2М ЭФ). Поскольку осажденный панкреатин представляет собой сложную смесь компонентов различных классов, предполагается, что 2М ЭФ обеспечивает наиболее эффективное и максимально селективное разделение пептидов и белков, т.е. различных классов ферментов, примесей и продуктов деградации белков. Кроме того, визуализация окрашенных гелей позволяет провести количественную оценку компонентов и сравнение белкового и/или пептидного состава образцов панкреатина, образцов осажденного панкреатина или микро-мини-сфер панкреатина. В настоящем изобретении установлено, что идентификацию наиболее ярких пятен можно проводить вырезанием пятен, триптическим гидролизом и последующим анализом методом MC (MALDI-TOF).
В общем случае, разделение методом 2М ЭФ по настоящему изобретению проводят сначала в первом направлении (стадия (б) изоэлектрическое фокусирование). Образцы панкреатина или ммс в водном буферном растворе предварительно обессоливают и наносят на гели, в которых формируется градиент рН от 3 до 10, что обеспечивает разделение широкого спектра соединений или возможных компонентов смеси. Фокусирование проводят на сухих иммобилиновых полосках. Примеры параметров для разделения в градиенте рН приводятся в таблице:
| Стадия 2М ЭФ (изоэлектрофокусирование) | Напряжение [В] до приблизительно | Время [ч] до приблизительно |
| 1 | 150 | 4, предпочтительно 1 |
| 2 | 300 | 4, предпочтительно 1 |
| 3 | 600 | 3, предпочтительно 1 |
| 4 | 1200 | 1 |
| 5 | 2400 | 1 |
| 6 | 3500 | 8, предпочтительно 7,25 |
Обычно разделение во втором направлении (стадия г, ДСН-ПААГ) по настоящему изобретению проводят в гелях, полученных в лаборатории (например, в гелях следующего состава: Т 13%, С 3%), например, в буферном растворе ДСН/глицин/трис, например, в условиях, приведенных в таблице:
| Стадия | Сила тока [мА], приблизительно | Напряжение [В] приблизительно |
| 1 | 80 | Макс.45 |
| 2 | 150 | Макс.200 |
| 3 | 10 | Для безопасности |
Обычно окрашивание проводят после фиксации, например, смесью этанол/уксусная кислота, с использованием флуоресцентного красителя и с последующим отмыванием красителя, например, этанолом/уксусной кислотой. Гель промывают водой и проводят денситометрическое сканирование. Затем гель окрашивают, например, коллоидным раствором кумаси голубого и проводят индентифицикацию методом MC (MALDI-TOF). Для этого пятна вырезают и проводят гидролиз трипсином. Пептиды элюируют из геля, например, смесью ацетонитрил/0,1% ТФУ, и раствор очищают на колонке С18 ZipTip. После совместной кристаллизации с 2,5-дигидроксибензойной кислотой экстракты переносят пипеткой на подложку мишени.
В качестве примера, иллюстрирующего возможность применения и эффективность способа по настоящему изобретению, проводили анализ трех партий каждого из трех образцов осажденного панкреатина (полученного различными способами из желез, доставленных из трех различных стран), включая панкреатин SPL 85. Один образец каждой партии наносили на гель, причем для одной партии каждого образца проводили анализ в трех повторах для проверки воспроизводимости стадии осаждения, получения образца и метода разделения. Затем проводили количественную оценку пятен и идентифицировали характерные пятна.
В качестве примера, иллюстрирующего возможность применения и эффективность способа по настоящему изобретению, проводили исследование стабильности препарата, при этом каждую партию сначала подвергали воздействию стресс-факторов (температуры, влажности, света), а затем регистрировали любое снижение активности, анализировали и определяли различие между исходным и конечным препаратом и при необходимости идентифицировали возможные продукты деградации.
Как показано выше, в случае образцов пищеварительных ферментов, например, панкреатина и прежде всего осажденного панкреатина или мини-микросфер панкреатина для анализа белков или пептидов с молекулярной массой менее приблизительно 8 кДа используют ОФ-ЖХВР, как указано в одном из вариантов изобретения. Параметры метода ОФ-ЖХВР, используемые в вариантах осуществления изобретения, описаны ниже в разделе "Использование ОФ-ЖХВР в сочетании с МС (MALDI-TOF) при анализе панкреатина".
В описании заявки приводятся иллюстрированные примерами разделы "Идентификация пятен с использованием MC (MALDI-TOF)", "Исследование устойчивости препаратов осажденного панкреатина к действию стресс-факторов", "Определение идентичности и белкового состава образцов осажденного панкреатина методом двухмерного электрофореза" и соответствующие таблицы.
ЖХВР представляет собой автоматизированный метод с высокой воспроизводимостью и селективностью, который находит широкое применение для проведения серийных анализов, в том числе белков. Метод обеспечивает количественную оценку, а идентификацию пиков можно проводить методом ЖХ-МС(ESI). Метод позволяет детектировать и идентифицировать пептиды с низкой молекулярной массой и другие низкомолекулярные соединения, и, следовательно, он дополняет, например, метод 2М ЭФ или ЭФ в ДСН-ПААГ. Следовательно, этот метод прежде всего можно использовать для получения двухмерных карт, для идентификации и количественного анализа различных классов ферментов, примесей и продуктов деградации.
Обычно ЖХВР проводят с использованием эффективных хроматографических систем, которые включают автосамплер G 1313А, четырехтактный насос G 1311А, УФ-детектор G 1314A, вакуумный дегазатор G 1322A, термостатированную колонку высокого давления G 1316A, контроллер 1100 G 1323A, LAN-интерфейс 35900Е и программное обеспечение ChemServer, или эквивалентную систему. Типичной колонкой для ЖХВР является, например, колонка MODULO O-CART QS UPTISPHERE 5 WRP (UP5WRP$15QS, фирма Interchim, 3,0×150 мм, неподвижная фаза RP 18, 5,0 мкм, материал: нержавеющая сталь), или эквивалентная ей колонка. В качестве неподвижной фазы предпочтительна фаза RP 18 (5,0 мкм), поскольку она позволяет использовать в качестве элюента воду (100%) и пригодна для разделения белков и пептидов. Другие примеры пригодных колонок включают, например, Polaris (5 мкм С18-А, 4,6х50 мм, кат. №А2000150Х046, фирма Varian B.V., Middelburg, Нидерланды) или, например, Cogent Bidentate (С (октил), 4 мкм, 300 Å, 4,6×150 мм, фирма MicroSolv Technology Corporation, Long Branch, NJ 07740, США).
Разделение методом ЖХВР обычно проводят в следующих условиях:
Режим хроматографии: градиент растворителя
Подвижная фаза: фаза А: вода/0,05% ТФУ(об./об.)
фаза Б: ацетонитрил/0,05% ТФУ (об./об.)
Форма градиента:
| Время [мин] | Фаза А (%) | Фаза Б (%) | |
| 0 | 100 | 0 | Линейный градиент |
| 75 | 10 | 90 | Линейный градиент |
| 75,1 | 100 | 0 | Изократический режим |
| 80 | 100 | 0 | Уравновешивание колонки |
| Скорость элюирования: | 1,0 мл/мин |
| Время анализа: | 75 мин |
| Температура: | 20±5,0°С |
| Объем образца: | 10 мкл |
Для анализа образцов используют УФ-детектор с длиной волны 214 нм.
Идентификация пятен с использованием MC (MALDI-TOF)
Другим объектом изобретения является способ анализа, включающий идентификацию пятен белков на двухмерной карте в геле, например, в образце осажденного панкреатина. Идентификация пятен с использованием MC (MALDI-TOF) более подробно описана в следующих разделах. Кроме того, ниже подробно описаны методики проведения двухмерного электрофореза в геле, а также анализ методом MC (MALDI-TOF). Для характеризации белков снимают отпечаток (пептидную масс-карту) с влажной электрофореграммы в геле, полученной двухмерным электрофорезом, в затем дополнительно проводят анализ методом MC(MALDI)/MC пятен, которые не удалось идентифицировать однозначно.
Получение пептидной масс-карты
Для получения пептидной масс-карты (PMF) соответствующие пятна вырезают из влажного геля вручную с использованием насадки на автоматическую пипетку диаметром 0,2 см. Затем каждое вырезанное пятно переносят в отдельную пробирку (0,5 мл). Окрашенные кумаси голубым частицы геля обесцвечивают по следующей методике: 1) добавляют 100 мкл 10 мМ раствора гидрокарбоната аммония и встряхивают в течение 5 мин, 2) добавляют 10 мМ раствор гидрокарбоната аммония, 50% ацетонитрил и встряхивают в течение 5 мин. Указанную обработку повторяют по меньшей мере трижды или до полного обесцвечивания геля. После последней промывки в каждую пробирку добавляют по 5 мкл ацетонитрила. После того, как пятна приобрели белый цвет в пробирки в зависимости от количества геля добавляют 2-6 мкл буферного раствора для гидролиза. Буферный раствор для гидролиза представляет собой 10 мМ раствор бикарбоната аммония, содержащий модифицированный трипсин КРС (фирма Roche Diagnostics, Базель, Швейцария) в количестве 0,01 мкг/мкл. Гидролиз проводят в течение ночи при 37°С.
После гидролиза супернатант удаляют, оставляя в пробирках частицы геля. При отсутствии супернатанта в пробирки добавляют по 5 мкл раствора для экстракции (1% ТФУ/50% ацетонитрил). Раствор в пробирках обрабатывают ультразвуком на бане в течение 10 мин и пробирки переносят в вакуумную центрифугу (спидвак) для удаления ацетонитрила. Затем образцы концентрируют и обессоливают на колонке С18 ZipTip (фирма Millipore, США) по методике фирмы-производителя. Образец (0,1 мкл) смешивают с 0,1 мкл матрицы DHBS (2,5-дигидроксибензойная кислота/2-гидрокси-5-метоксибензойная кислота, 9:1), помещают на подложку MC(MALDI) (фирма Applied Biosystems) и анализируют в MALDI масс-спектрометре (фирма Voyager STR, Applied Biosystems, Foster City, CA, США). Режим работы детектора предусматривает регистрацию ионов в диапазоне масс 600-4200 дальтон (Да). Низкомолекулярные ионы (<600 Да) не регистрируются из-за влияния матрицы.
Спектры PMF размечают и калибруют по двум пептидам с известной молекулярной массой (805,42 Да, 2163,05 Да), которые являются продуктами автолиза трипсина. Калибровочный спектр обычно получают с точностью менее 50 част./млн. Поиск в базе данных для спектров PMF проводят с использованием программы ProFound (фирма Genomic Solutions, США). Достоверные совпадения достигаются в том случае, если расхождение между первой и второй бальной оценкой по программе ProFound составляет по меньшей мере 10-4 и наиболее интенсивные массы в спектре отнесены к конкретному белку или если степень перекрывания последовательности является относительно высокой (>30%).
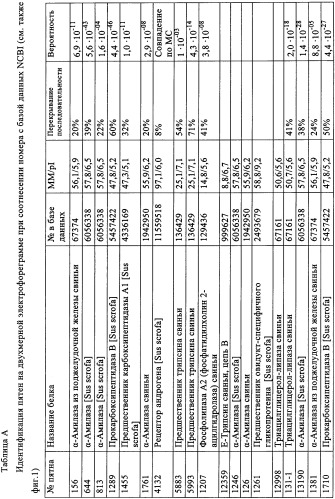
Результаты идентификации приводятся ниже в таблице А, а на фиг.1 приводится двухмерная электрофореграмма панкреатина с помеченными идентифицированными пятнами.
Кроме того, на фиг.2 иллюстрируется высокая воспроизводимость способа по настоящему изобретению. Три геля одного и того же образца осажденного панкреатина получали в разные дни, например, в течение четырех дней.
MC (MALDI)/MC
Отдельные пятна белков, которые не удалось идентифицировать однозначно методом PMF анализировали методом MC (MALDI)/MC с использованием анализатора Proteomics 4700 (фирма Applied Biosystems, Framingham, CA, США). Для этого отбирали пептиды, соответствующие пятнам определенной интенсивности, и фрагментировали для получения информации о последовательности. Полученный спектр фрагментов использовали для поиска в базе данных NCBI (http://www.ncbi.nih.gov/) (National Center for Biotechnology Information, National Library of Medicine, Building 38A, Bethesda, MD 20894, США) с использованием программы Mascot (фирма Matrixscience, London, UK). Значимыми считались спектры, превышающие определенный уровень бальной оценки по программе Mascot. В сомнительных случаях анализ проводили вручную.
В таблице А приводятся результаты, полученные анализом МС (MALDI)/MC.
Исследование стабильности осажденного панкреатина при действии стресс-факторов
Другим объектом изобретения является использованием метода 2М ЭФ для регистрации процессов деградации и/или регистрации стабильности образцов осажденного панкреатина. Исследование стабильности более подробно описано в следующем разделе, который относится к исследованию устойчивости осажденного панкреатина к действию стресс-факторов.
Еще одним объектом изобретения является изучение пригодности метода 2М ЭФ для (а) анализа стабильности осажденного панкреатина, (б) для локализации возможных продуктов деградации, образующихся при воздействии стресс-факторов, и (в) для идентификации пятен, указывающих на деградацию. Исследование выявило существенные изменения некоторых ранее идентифицированных пятен, которые сопоставимы в обоих исследованных образцах осажденного панкреатина. Следовательно, метод позволяет оценивать стабильность препарата.
Для оценки пригодности метода 2М ЭФ для характеризации осажденного панкреатина образцы препарата хранили при действии стресс-факторов и исследовали способами по настоящему изобретению. Аликвотные части указанных образцов анализировали методом 2М ЭФ для определения времени, необходимого для выявления результатов воздействия стресс-факторов и обнаружения пятен, ассоциированных с продуктами деградации панкреатина.
Испытание воздействия стресс-факторов проводили по методике "Идентификация и получение белковых карт методом 2М ЭФ", подробно описанной ниже.
Для испытания воздействия стресс-факторов использовали следующие образцы:
| Образец | Условия хранения | Продолжительность хранения (сут) |
| Панкреатин N | 40°/75% (вл.) | 0, 16, 32 |
| Панкреатин SPL 85 | 40°/75% (вл.) | 0, 15, 28 |
Осажденный панкреатин (20 г) помещали в чашки Петри и накрывали второй чашкой Петри. Образец хранили при 40°С и 75% относительной влажности. Образцы в количестве 100 мг отбирали в начале эксперимента и через 1, 2, 4, 8, 16 и 32 сут. Образцы, взятые через 0, 16 и 32 сут, анализировали методом 2М ЭФ. До проведения анализа все образцы хранили в замороженном виде, т.е. при температуре ниже -15°С, в отсутствие света и воздействия влажности.
Результаты приводятся в таблицах A-I и на фиг, 1-7, где показаны электрофореграммы, полученные при исследовании устойчивости образцов осажденного панкреатина при воздействии стресс-факторов. Далее приводится краткое описание каждой таблицы и фигуры.
Описание таблиц A-I
Таблица А: Идентификация пятен на двухмерной электрофореграмме при соотнесении номера с базой данных NCBI (см. также фиг.1).
Таблица В: Интенсивности пятен в образце панкреатина, партия 1 (t 0 и 16 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица С: Интенсивности пятен в образце панкреатина, партия 1 (t 0 и 16 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица D: Интенсивности пятен в образце панкреатина, партия 1 (t 32 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица Е: Интенсивности пятен в образце панкреатина, партия 1 (t 32 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица F: Интенсивности пятен в образце панкреатина, партия 2 (t 0 и 15 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица G: Интенсивности пятен в образце панкреатина, партия 2 (t 0 и 15 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица Н: Интенсивности пятен в образце панкреатина, партия 2 (t 32 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Таблица I: Интенсивности пятен в образце панкреатина, партия 2 (t 32 сут) с указанием среднего и стандартного отклонения и отнесения к t 0.
Описание чертежей 1-7
Фиг.1. Двухмерная электрофореграмма осажденного панкреатина с помеченными идентифицированными пятнами (см. также данные в таблицах J и К).
Фиг.2. Воспроизводимость метода 2М ЭФ на примере одного образца осажденного панкреатина; 3 геля получены в течение четырех дней (IPG 3-10NL, флуоресцентное окрашивание, внешний стандарт карбоангидраза, количество 320 нг).
Фиг.3. Двухмерная электрофореграмма панкреатина, партия 1, после испытания на устойчивость к действию стресс-факторам (краситель Sypro Ruby).
Фиг.4. Двухмерная электрофореграмма панкреатина, партия 2, после испытания на устойчивость к действию стресс-факторам (краситель Sypro Ruby).
Фиг.5. Усредненные гели (n3), рассчитанные для панкреатина, партия 1.
Фиг.6. Усредненные гели (n3), рассчитанные для панкреатина, партия 1.
Фиг.7. Двухмерная электрофореграмма осажденного панкреатина при добавлении двух внутренних белков-маркеров (фосфорилазы В и карбоангидразы), полученная, как описано в разделе "Идентификация и белковый состав".
Идентификация и определение белкового состава образцов осажденного панкреатина при анализе двухмерным электрофорезом в геле
Другим объектом изобретения является применение метода 2М ЭФ для идентификации и определения белкового состава образцов осажденного панкреатина. Более подробно методика описана ниже, причем при описании методики используются следующие сокращения:
CHAPS: 1-пропансульфонат 3-(3-холамидопропил)диметиламмония
ДТТ: дитиотреит
Трис: трис(гидроксиметил)аминометан
ПСА: персульфат аммония
TEMED: N,N,N',N'-тетраметилэтилендиамин
ДСН: додецилсульфат натрия
Описание метода 2М ЭФ
Метод 2М ЭФ в геле (O′Farrell P.H., J. Biol. Chem., 250, 4007-4021 (1975)) представляет собой метод разделения сложных смесей белков, в котором используется различие индивидуальных компонентов по электрофоретической подвижности, причем в первом направлении фракционирование производится изоэлектрофокусированием, т.е. за счет различия по зарядам (точнее по изоточкам pI), а во втором направлении в ДСН-ПААГ, т.е. по молекулярной массе (ММ).
В общем случае электрофорез проводится согласно Европейской фармакопее (Ph. Eur. 2.2.31) и этом контексте термин "вода" без указания квалификации означает дважды перегнанную или деионизованную воду или воду эквивалентного качества.
Материалы и реагенты:
Ацетонитрил, например, фирмы Merck, кат. №1033530220
Раствор акриламида, например, фирмы Serva, кат. №10688.02
Агароза, например, фирмы VWR International, кат. №1.16802.0025
Персульфат аммония, например, фирмы Serva, кат. №13375.01
Бромфеноловый синий, например, фирмы VWR International, кат. №1.08122.0005
2-Бутанол, например, фирмы VWR International, кат.№8.22263.1000
CHAPS, например, фирмы Roth, кат. №1479.2
ДТТ, 1,4-дитиотреит, например, фирмы Roth, кат. №6908.2
Бумага для электродов, например, фирмы Amersham Biosciences, кат. №80-1106-19.
Полоски бумаги для электродов, например, фирмы Amersham Biosciences, кат. №18-1004-40
Этанол, например, фирмы VWR International, кат. №ТС212-9025
Уксусная кислота, например, фирмы Roth, кат. №3738.2
Сухие иммобилиновые полоски, рН 3-10NL, например, фирмы Amersham
Biosciences, кат. №17-1235-01
Глицерин, например, фирмы Serva, кат. №23176
Глицин, например, фирмы Roth, кат. №3908.3
Мочевина, например, фирмы Roche Diagnostics, кат. №1685902
Иодацетамид, например, фирмы Sigma, кат. №1-6125
Фармалит ТМ 3-10, фирма Amersham Biosciences, кат. №17-0456-01
Смесь стандартных белков 4, фирма Serva, кат. №39208.01
Смесь стандартных белков 5, фирма Serva, кат. №39209.01
Концентрат красителя Roti-Blue®, кат. №А152.1
Конические насадки, например, фирмы Amersham Biosciences, кат.B№1e-1004-35
ДСН: додецилсульфат натрия, например, фирмы Serva, кат. №20763.02
Силиконовое масло, например, фирмы Serva, кат. №35132
TEMED, например, фирмы Bio-Rad, кат. №161-0800
Тиомочевина, например, фирмы Fluka, кат. №88810
Трис, для электродного буферного раствора, например, фирмы Roth, кат. №4855.2
Трис, для рабочих растворов, например, фирмы Bio-Rad, кат. №161-0719.
При проведении анализа используются следующие растворы:
(1) буферный раствор для лизиса:
7 М мочевина, 2 М тиомочевина, 4% (мас./об.) CHAPS, 1% (мас./об.) ДТТ, 0,5% фармалит®, рН 3-10;
(2) растворитель Lp3 (для образцов):
раствор 1,5 мг набора Mini Complete в 2 мл буферного ра