Применение производных пиридин-2-ил-метиламина для получения лекарственного средства, предназначенного для лечения симптомов хронической боли невропатического или психогенного происхождения
Иллюстрации
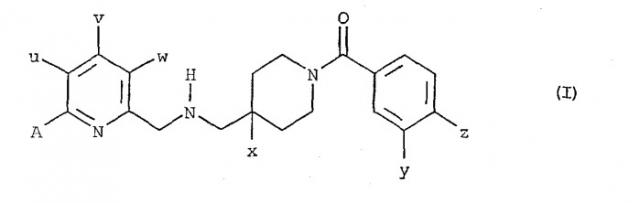
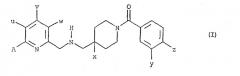
Показать всеНастоящее изобретение относится к химико-фармацевтической промышленности и касается применения соединения формулы (I) и его терапевтически приемлемых солей, в которой, в частности, u обозначает метил, v и w обозначают атом водорода, х обозначает атом фтора, у обозначает атом хлора, z обозначает атом фтора, А обозначает атом водорода или аминометильную группу, а также его солей присоединения с фармацевтически приемлемыми неорганическими или органическими кислотами для получения лекарственного средства, предназначенного для лечения симптомов хронической боли невропатического или психогенного происхождения. Соединение обладает высокой эффективностью для лечения невропатической хронической боли и высокой продолжительностью действия. 2 з.п. ф-лы, 8 ил.
Реферат
Настоящее изобретение относится к применению производных пиридин-2-ил-метиламина для получения лекарственного средства, предназначенного для терапевтического лечения симптомов хронической боли невропатического или психогенного происхождения.
В международной заявке на патент WO 98/22459 заявителем были описаны соединения, отвечающие общей формуле (I):
Соединения (I) отличаются сродством и селективностью на уровне рецепторов подтипа 5-НТ1А, а также способностью провоцировать особый элемент серотонинэргического синдрома (т.е. сокращение нижней губы) у крысы после перорального введения. В этом отношении соединения (I) заявлены в качестве лекарственных средств, потенциально пригодных для лечения депрессии и боли.
Предметом настоящего изобретения является усовершенствование существующих методик и курсов обезболивания, осуществляемое посредством соединений формулы (I). Заявленное усовершенствование открывает новые терапевтические перспективы в профилактике и/или лечении симптомов хронической боли, для которых в настоящее время не существует удовлетворительных терапевтических решений.
В целом различают три типа хронических болей, классифицируемых в соответствии с задействованным механизмом, а именно боли, возникающие вследствие избыточных вредоносных воздействий, невропатические (или нейрогенные, или дезафферентационные) боли и психогенные боли. Некоторые боли, тем не менее, имеют характеристики, являющиеся общими для нескольких типов болей.
Выражение «хроническая боль», используемое в рамках настоящей заявки на патент, объединяет болевые синдромы, развитие которых длится более трех месяцев, но интенсивность которых может варьировать по ходу времени.
В рамках настоящего изобретения боль определяют как ненормальное, неприятное или даже труднопереносимое чувственное или эмоциональное восприятие, которое воспринимается и интегрируется в самом верхнем отделе коры головного мозга, что придает ему его эмоциональный и аффективный оттенок.
В рамках настоящего изобретения выражение «невропатическая боль» относится к группе болей, имеющих причиной одно или более повреждений и/или дисфункций центральной или периферической нервной системы.
В рамках настоящего изобретения выражение «психогенная боль» в целом обозначает боли, не имеющие видимой патологической причины. Они представляют собой боли, не имеющие истинной анатомической основы, т.е. возникающие без объективных повреждений; они, таким образом, являются по существу психологическими или психическими. Они также могут представлять собой, например, так называемые «фантомные» боли, т.е. боль изначально органического происхождения, но сохраняющуюся после исчезновения первоначального повреждения (память о боли) или настоящие болевые галлюцинации (боль, ощущаемую в ампутированной части тела), или органическую боль, при которой не обнаруживается какого-либо повреждения. Этот тип болей может проявляться в разных участках тела и иметь очень разнообразные формы и интенсивность проявления.
Настоящее изобретение направлено, таким образом, на лечение симптомов блуждающей боли, т.е. часто меняющей локализацию.
Настоящее изобретение также направлено на лечение других болей, таких как heavy pain, т.е. боль, сопровождающаяся ощущением тяжести, острая кинжальная боль, т.е. сопоставимая с болью, вызванной ударом кинжала, глухая боль, т.е. легкая, но продолжительная, ноющая боль, т.е. сопровождающаяся ощущением растяжения, сверлящая боль, т.е. интенсивная, глубокая, которую пациент воспринимает, как причиняемую острым предметом, введенным в часть тела больного.
Под анальгезирующими лекарственными средствами понимают лекарственные средства, облегчающие или устраняющие боль без потери чувствительности или сознания.
Таким образом, настоящее изобретение направлено на лечение симптомов, соответствующих болям, возникающим не вследствие избыточного вредоносного воздействия, а невропатическим или психогенным болям, которые не играют физиологической роли, например, в форме сигнала, а представляют собой настоящее патологическое явление.
Настоящее изобретение относится, таким образом, к получению лекарственного средства, предназначенного для профилактики и/или лечения симптомов хронической боли невропатического или психогенного происхождения.
Лекарственные средства, используемые в клинической практике для лечения хронических болей, относятся к трем различным фармакологическим семействам, заглавными представителями которых являются: морфин, аспирин и парацетамол. Морфин воздействует на центральную нервную систему и остается эталонным анальгетиком центрального действия. Аспирин воздействует на периферическую нервную систему непосредственно на место возникновения боли. Парацетамол действует как аспирин, но, по-видимому, обладает и центральным действием. Лекарственные средства, принадлежащие к этим разным семействам, эффективны в отношении болей, возникающих вследствие избыточного вредоносного воздействия, но малоэффективны или неэффективны в отношении других типов боли (т.е. невропатических болей и психогенных болей). Поэтому для облегчения некоторых невропатических болей слабой или умеренной интенсивности на практике прибегают к антидепрессантам, главным образом, относящимся к классу трициклических соединений (например, амитриптилину, имипрамину и т.п.). Другие вспомогательные лекарственные средства, такие как анксиолитические препараты, противосудорожные препараты (например, габапентин, карбамазепин), блокаторы натриевых каналов (лидокаин, мекилетин) или глюкокортикоиды, также назначаются в комбинации с соединениями морфинового ряда и/или неморфиновыми анальгетиками. Помимо относительно ограниченной эффективности существующих лекарственных средств, их долговременное применение сопровождается нежелательными побочными эффектами. В качестве примера можно назвать проблемы переносимости и зависимости, связанные с использованием главных препаратов морфинового ряда (например, морфина, петидина и т.п.); токсичности для пищеварительной системы (например, в случае аспирина и салициловых производных); гипотонии, заторможенности и увеличения массы тела (трициклические антидепрессанты) и т.д.
Наряду с лекарственными средствами, используемыми в клинической практике, целый ряд соединений, обладающих различными механизмами действия, находятся на различных стадиях исследований в качестве анальгетиков. Можно упомянуть, например, агонисты 5-НТ1А (например, WO 98/22459); ингибиторы обратного захвата серотонина (Е-5296); смешанные ингибиторы обратного захвата серотонина и адреналина (венлафаксин); холинэргические агонисты (леветирацетам); антагонисты NMDA (мемантин; CNS-5161); антагонисты глутамата (топирамат); модуляторы никотиновых рецепторов (АВТ-594); антагонисты ССК (коликад, девакад); производные капсаицина (DA-5018, BL-1832), каннабиноиды (СТ-3); антагонисты ноцицептина (JTC-801) и т.д. Эти соединения, по большей части, заявлены в качестве действующих начал для симптоматического лечения невропатических болей.
В итоге можно сказать:
- что существующие методы лечения хронических болей основаны главным образом на лечении причины (например, противовоспалительными средствами) и, таким образом, являются малоэффективными или неэффективными в отношении невропатических или психогенных болей;
- что терапевтические подходы к проблеме невропатических или психогенных болей (например, антидепрессанты, соединения морфинового ряда) в лучшем случае облегчают симптомы, но не оказывают какого-либо лечебного эффекта; кроме того, их применение ограничено их побочными эффектами;
- что новые подходы могли бы предложить более широкий спектр действия по сравнению с традиционными агентами в том, что касается симптоматического лечения хронических болей, но ни один из них не предусматривает наличие эффекта, который хоть каким-то образом можно было бы отнести к лечебному эффекту.
В настоящей заявке предлагается усовершенствование видов/методик лечения синдромов хронической боли невропатического и психогенного происхождения, в котором терапия очень нуждается. Преимущества этой усовершенствованной методики, составляющей объект заявки, заключается:
- в том, что анальгезия, обеспечиваемая при помощи агониста 5-НТ1А формулы (I), выходит за рамки обычного симптоматического лечения хронических болей невропатического или психогенного происхождения;
- в том, что анальгезия, обеспечиваемая при помощи агониста 5-НТ1А формулы (I), снижает на длительное время или даже навсегда уровень интенсивности боли, воспринимаемой в контексте невропатических или психогенных болей;
- в том, что активность соединений формулы (I) может быть приравнена к лечебному действию в отношении хронических болей невропатического или психогенного происхождения; на сегодняшний день не было сообщений о действии такого типа в отношении какого-либо другого агента, обладающего анальгезирующими свойствами, в том числе и в отношении агонистов 5-НТ1А.
В плане симптоматического лечения синдромов боли некоторые соединения формулы (I) демонстрируют мощную анальгезирующую активность на моделях животных, моделирующих невропатические боли. Действительно, уже установлено, что их анальгезирующая активность в целом превосходит анальгезирующую активность эталонных анальгетиков. Однако в ходе исследования анальгезирующей активности соединений (I) при хроническом и субхроническом введении авторы выявили неожиданные свойства, которые могут оказаться значимыми в отношении терапевтического применения в лечении хронических болей.
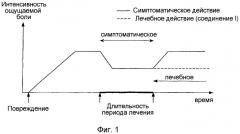
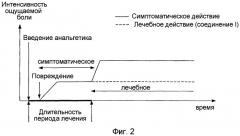
Действительно, все анальгетики, вне зависимости от их действия, имеют сходный, типичный профиль активности in vivo, который можно квалифицировать как симптоматический, как показано на фиг.1 и 2 в приложении. Однако в дополнение к классической фазе симптоматической анальгезии соединения (I) имеют фазу так называемой лечебной анальгезии, о которой никогда ранее не сообщалось применительно к другим анальгезирующим агентам или методикам. Природа этой особой фазы анальгезии детально рассматривается далее.
На практике различают две различающиеся в хронологическом отношении схемы лечения:
а) анальгетически активный агент вводят в течение фазы хронической боли;
b) введение анальгетически активного агента предшествует появлению хронической боли.
а) анальгетически активный агент вводят в течение фазы хронической боли
Так, у животных, у которых развилась хроническая боль (гипералгия или аллодиния), интенсивность которой достигла порога максимальной амплитуды, как показано на фиг.1, хроническое введение анальгетически активного агента приводит к существенному и, по существу, дозозависимому снижению интенсивности болевых симптомов (т.е. симптоматической анальгезии). Интенсивность болевых симптомов может быть объективно оценена путем измерения различных поведенческих и/или физиологических параметров, сознательных или бессознательных. Анальгезирующий эффект поддерживается при условии достаточности циркулирующих уровней анальгетика для осуществления анальгезирующего действия. В случае прерывания лечения интенсивность боли возрастает и имеет тенденцию к возврату на уровень, близкий к первоначальному (т.е. к болевому порогу до начала лечения). Интенсивность боли может также возрастать уже в ходе фазы лечения, если развивается устойчивость к анальгетику (например, в случае лечения главными представителями морфинового ряда).
В случае хронического введения некоторых соединений (I) наблюдают также, в ходе фазы лечения, типичное дозозависимое снижение интенсивности болевых симптомов (т.е. классическую симптоматическую анальгезию). Однако, в противоположность другим анальгетикам, не наблюдается тенденции к возврату интенсивности боли к первоначальному уровню в случае прерывания лечения, как показано на фиг.1 в приложении. Так, неожиданным образом оказалось, что анальгезия не только сохраняется несмотря на остановку лечения, но остается на устойчивом уровне той же амплитуды, как и в конце лечения. Это наблюдаемое явление представляет интерес тем более потому, что соединение (I) не остается в организме животных в ходе фазы анальгезии, наступающей по завершении лечения, и потому, что оно не оказывает какого-либо действия на источник хронической боли (например, повреждение, воспаление и т.п.). Учитывая эти обстоятельства, можно квалифицировать действие соединений (I) как лечебное. Механизмы, задействованные в этом особом действии соединений формулы (I) после активации рецепторов 5-НТ1А, на сегодняшний день остаются неизвестны.
b) введение анальгетически активного агента предшествует возникновению хронической боли
Типичный профиль анальгетической активности активного соединения в случае, когда хроническое лечение начинают перед индукцией боли у животного (как показано на фиг.2 в приложении), показывает, что интенсивность боли после повреждения достигает порога, амплитуда которого ниже амплитуды порога, достигаемого в отсутствие лечения (т.е. классический симптоматический анальгезирующий эффект). Эта фаза симптоматической анальгезии систематически исчезает при прерывании лечения (как показано на фиг.2 в приложении).
В случае хронического введения некоторых соединений (I), когда лечение начинают до индукции боли, также наблюдают фазу симптоматической анальгезии, характерную для анальгетиков. Однако, как и в случае а), анальгезия, обеспечиваемая соединениями (I), сохраняется и остается на стабильном уровне, несмотря на прерывание лечения (как показано на фиг.2). В течение этой особой фазы анальгезии соединение (I) не присутствует в организме животных и не производит какого-либо действия на источник хронической боли. Лечение при помощи соединения (I), осуществляемое до появления хронической боли, имеет, таким образом, тенденцию к предотвращению или к сильному ограничению ее последующего развития. Этот особый аспект активности соединений (I) представляет потенциальный интерес для профилактики постоперационных болей. Он также может быть полезен при некоторых нарушениях нервной системы, при которых возникновение повреждения от возникновения боли отделяет более или менее значительный промежуток времени (например, при повреждениях спинного мозга, фантомных болях в конечностях).
Единый и неожиданный профиль развития анальгезирующей активности соединений (I), в частности, за счет их лечебного действия, вне зависимости от схемы лечения (т.е. до или после развития боли), представляет собой существенное усовершенствование существующего уровня техники.
Соединения по изобретению потенциально позволяют, таким образом, ответить на нужды терапии в области лечения хронических болей невропатического и/или психогенного происхождения, в котором существующие лекарственные средства оказываются малоэффективными или неэффективными или оказываются ограниченно пригодными в силу своих побочных эффектов.
Соединения (I) в своей основной форме представлены общей формулой (I):
в которой:
u обозначает атом водорода или метил, при условии, что, когда u обозначает метил, v и w обозначают атом водорода;
v обозначает атом водорода, атом хлора или метил, при условии, что, когда v обозначает метил, u и w обозначают атом водорода;
w обозначает атом водорода, атом фтора или метил, при условии, что, когда w обозначает метил, u и v обозначают атом водорода;
х обозначает атом водорода или атом фтора;
y обозначает атом хлора или метил;
z обозначает атом водорода, атом фтора или атом хлора, или метил;
А обозначает:
- атом водорода или атом фтора, или атом хлора;
- C1-C5-алкил, т.е. насыщенный алифатический углеводородный остаток с прямой или разветвленной цепью, содержащий от 1 до 5 атомов углерода, такой как метил, этил, пропил, бутил, пентил, изопропил, 1-метилэтил, 1-метилпропил, 1-метилбутил, 2-метилпропил, 2-метилбутил или 3-метилбутил, 1-этилпропил, 2-этилпропил;
- фторалкил, такой как монофторметил (-CH2F) или дифторметил, (-CHF2) или трифторметил (-CF3), или 1-фтор-1-этил (-CHFCH3), или 1,1-дифтор-1-этил (-CF2CH3);
- циклопропил или циклобутил, или циклопентил;
- 5-членная ароматическая гетероциклическая группа, замещенная или незамещенная, содержащая 1, 2, 3 или 4 гетероатома, выбранных из азота, кислорода и серы, при условии, что гетероцикл А содержит не более одного атома кислорода и/или серы.
- Ароматические гетероциклы предпочтительно представляют собой:
фуран-2-ил (О.CH:CH.CH:C-) или
фуран-3-ил (CH:CH.O.CH:C-), или
1H-пиррол-2-ил (NH.CH:CH.CH:C-), или
1H-пиррол-3-ил (CH:CH.NH.CH:C-), или
1-метил-пиррол-2-ил (N(CH3).CH:CH.CH:C-), или
1-метил-пиррол-3-ил (CH:CH.N(CH3).CH:C-), или
тиофен-2-ил (S.CH:CH.CH:C-), или
тиофен-3-ил (CH:CH.S.CH:C-), или
пиразол-1-ил (N:CH.CH:CH.N-), или
1H-пиразол-3-ил (CH:CH.NH.N:C-), или
1H-пиразол-4-ил (CH:N.NH.CH:C-), или
1-метилпиразол-3-ил (CH:CH.N(CH3).N:C-), или
имидазол-1-ил (CH:N.CH:CH.N-), или
1H-имидазол-2-ил (NH.CH:CH.N:C-), или
1H-имидазол-4-ил, (N:CH.NH.CH:C-) или
оксазол-2-ил (О.CH:CH.N:C-), или
оксазол-4-ил (N:CH.О.CH:C-), или
оксазол-5-ил (О.CH:N.CH:C-), или
изоксазол-5-ил (O.N:CH.CH:C-), или
изоксазол-4-ил (CH:N.O.CH:C-), или
изоксазол-3-ил (CH:CH.O.N:C-), или
тиазол-2-ил (S.CH:CH.N:C-), или
тиазол-4-ил (N:CH.S.CH:C-), или
тиазол-5-ил (S.CH:N.CH:C-), или
изотиазол-5-ил (S.N:CH.CH:C-), или
изотиазол-4-ил (CH:N.S.CH:C-), или
изотиазол-3-ил (CH:CH.S.N:C-), или
[1,2,4]триазол-1-ил (CH:N.CH:N.N-), или
1H-[1,2,4]триазол-3-ил (N:CH.NH.N:C-), или
[1,2,4]оксадиазол-3-ил (N:CH.O.N:C-), или
[1,2,4]оксадиазол-5-ил (O.N:CH.N:C-), или
5-метил[1,2,4]оксадиазол-3-ил N:C(CH3).O.N:C-), или
1H-тетразол-5-ил (NH.N:N.N:C-);
- алкоксигруппу (R1O-) или алкилтиогруппу (R1S-), в которой R1 обозначает:
- C1-C5-алкил такой, как определено выше,
- монофторметил или трифторметил,
- циклопропил или циклобутил, или циклопентил;
- аминогруппу типа II
в которой R2 и R3, одинаковые или разные, обозначают водород или C1-C5-алкил такой, как определено выше, или циклопропил или трифторметил;
- насыщенную циклическую аминогруппу типа III
в которой n может принимать целые значения 1 или 2;
- алкоксикарбонильную, предпочтительно, метоксикарбонильную (CH3OCO-) или этоксикарбонильную (CH3CH2OCO-) группу.
Изобретение также распространяется на соли присоединения соединений вышеуказанной формулы (I) с неорганическими или органическими фармацевтически приемлемыми кислотами.
Настоящее изобретение более конкретно относится к применению соединений формулы (I), выбранных из:
(3,4-дихлорфенил)-(4-{[(6-пиразол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-{[(6-пиразол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(4-хлор-3-метилфенил)-(4-{[(6-пиразол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлорфенил)-(4-{[(6-пиразол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(4-{[(6-пиразол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)-м-толилметанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-пиразол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-имидазол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-[1,2,4]триазол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-пиррол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-метиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-метиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-диметиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-{[(6-диметиламино-пиридин-2-илметил)амино]метил}-4-фторпиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[{6-диметиламино-пиридин-2-илметил)амино]метил}-4-фторпиперидин-1-ил)метанона,
(3,4-дихлорфенил)-[4-({[6-(этилметиламино)-пиридин-2-илметил]амино}метил)-4-фторпиперидин-1-ил]метанона,
(3,4-дихлорфенил)-[4-({[6-(метилпропиламино)-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
(4-{[(6-азетидин-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)-(3,4-дихлорфенил)метанона,
(4-{[(6-азетидин-1-ил-пиридин-2-илметил)амино]метил}-4-фторпиперидин-1-ил)-(3,4-дихлорфенил)метанона,
(4-{[(6-циклопентил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)-(3,4-дихлорфенил)метанона,
(4-{[(6-хлор-пиридин-2-илметил)амино]метил}пиперидин-1-ил)-(3,4-дихлорфенил)метанона,
(3,4-дихлорфенил)-[4-({[6-(1H-пиразол-3-ил)-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
(3,4-дихлорфенил)-[4-фтор-4-({[6-(1H-пиразол-3-ил)-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
(3,4-дихлорфенил)-[4-фтор-4-({[6-(1-метилпиразол-3-ил)-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
(3,4-дихлорфенил)-[4-({[6-(1H-имидазол-2-ил)-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
(3,4-дихлорфенил)-(4-{[(6-тиазол-2-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-тиазол-2-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-[4-({[6-(1H-пиррол-2-ил)-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
(3,4-дихлорфенил)-(4-{[(6-тиофен-2-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-тиофен-2-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-фуран-2-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-фуран-2-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(6-фуран-2-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-оксазол-5-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-оксазол-5-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-фуран-3-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-[4-({[6-(5-метил[1,2,4]оксадиазол-3-ил)-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
(3,4-дихлорфенил)-(4-{[(6-метил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-изопропил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-циклопропил-пиридин-2-илметил)амино]метил}-4-фторпиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-фторметил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-дифторметил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-дифторметил-пиридин-2-илметил)амино]метил}-4-фторпиперидин-1-ил}метанона,
(3,4-дихлорфенил)-[4-фтор-4-({[6-(1-фторэтил)-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
сложного метилового эфира 6-({[1-(3,4-дихлорбензоил)-пиперидин-4-илметил]амино}метил)пиридин-2-карбоновой кислоты,
сложного этилового эфира 6-({[1-(3,4-дихлорбензоил)-пиперидин-4-илметил]амино}метил)пиридин-2-карбоновой кислоты,
(3,4-дихлорфенил)-(4-{[(6-метокси-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-метокси-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4{[(6-изопропилокси-пиридин-2-илметил)амино)метил}пиперидин-1-ил)метанона,
(4-{[(6-циклопентилокси-пиридин-2-илметил)амино]метил}пиперидин-1-ил)-(3,4-дихлорфенил)метанона,
(3,4-дихлорфенил)-(4-{[(6-метилсульфанил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-{[(6-фтор-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(6-фтор-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-{[(3-фтор-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(4-{[(4-хлор-пиридин-2-илметил)амино]метил}пиперидин-1-ил)-(3,4-дихлорфенил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(5-метил-6-фуран-2-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-[4-фтор-4-({[5-метил-6-(1H-пиразол-3-ил)-2-ил-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(5-метил-6-метиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(4-{[(6-азетидин-1-ил-пиридин-2-илметил)амино]метил}-4-фторпиперидин-1-ил)-(3-хлор-4-фторфенил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(6-оксазол-5-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(6-этиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(6-метиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-метилфенил)-(4-фтор-4-{[(6-диметиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(5-метил-6-диметиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-[4-фтор-4-({[6-(1H-пиразол-3-ил)-пиридин-2-илметил]амино}метил)пиперидин-1-ил]метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(3-метил-6-диметиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(6-пиразол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3,4-дихлорфенил)-(4-фтор-4-{[(5-метил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(5-метил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(6-диэтиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторметил)-(4-фтор-4-{[(5-метил-6-хлор-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(4-метил-6-диметиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлор-4-фторфенил)-(4-фтор-4-{[(5-метил-6-пиразол-1-ил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона,
(3-хлорфенил)-(4-фтор-4-{[(6-диметиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанона.
В рамках настоящего изобретения предпочтительными соединениями формулы (I) являются:
(3-хлор-4-фторфенил)-(4-фтор-{[(5-метил-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанон,
т.е. A = H, u = CH3, v и w = H, X = F, y = Cl и z = F, и
(3-хлор-4-фторфенил)-(4-фтор-{[(5-метил-6-метиламино-пиридин-2-илметил)амино]метил}пиперидин-1-ил)метанон,
т.е. A = NHCH3, u = CH3, v и w = H, X = F, y = Cl и z = F,
а также их соли присоединения с неорганическими или органическими фармацевтически приемлемыми кислотами. Эти соединения в дальнейшем обозначают, соответственно, как соединения (Ia) и (Ib).
Получение соединений (Ia) и (Ib), а также их аналитические характеристики приведены в заявке WO 02/064585.
Изобретение также распространяется на фармацевтические композиции, содержащие в качестве действующего начала по меньшей мере одно из производных общей формулы (I) или одну из их солей или гидратов их солей в комбинации с одним или несколькими инертными носителями или другими фармацевтически приемлемыми носителями.
Фармацевтические композиции согласно изобретению могут представлять собой, например, композиции, вводимые пероральным, назальным, подъязычным, ректальным, чрескожным или парентеральным путем. В качестве примера композиций, вводимых пероральным путем, можно назвать таблетки, желатиновые капсулы, гранулы, порошки и оральные растворы или суспензии. Примеры фармацевтических композиций, содержащих продукты формулы (I), приведены в заявке WO 98/22459.
Эффективная доза соединения по изобретению варьирует в зависимости от многих параметров, таких как, например, выбранный путь введения, масса тела, возраст, пол, стадия развития патологии и индивидуальная чувствительность лица, которому назначают лечение. Таким образом, оптимальная дозировка должна определяться на основании актуальных параметров специалистом в данной области.
Среди невропатических и психогенных хронических болей, потенциально чувствительных к действию соединений формулы (I), можно, в частности, назвать, в качестве иллюстративных примеров, боли, связанные с периферическими или центральными невропатиями, вызванными повреждениями нервов травматической (например, нарушение мозгового кровообращения), метаболической (например, диабет), инфекционной (например, ВИЧ, опоясывающий лишай, герпес), токсической (например, мышьяк, свинец), инвазивной (раковая боль) или врожденной природы; фантомные боли конечностей; цефалгии; невоспалительные боли суставов (например, артроз); фибромиалгии; спинальные боли; послеоперационные боли; другими источниками невропатических болей являются рассеянные склерозы, хронические боли. Боль диагностируют как хроническую, если пациент жалуется на то, что страдает ей в течение периода, превышающего 6 месяцев. Среди хронических болей можно назвать, в качестве иллюстративного и не ограничительного примера, помимо болей, связанных с фибромиалгиями, боли, происходящие от волокнистых тканей, мышц, сухожилий, связок и других областей, абдоминальные боли, диареи (в частности, в случае синдрома воспаленного кишечника) и хронические боли в спине.
Настоящее изобретение направлено, в частности, на лечение синдрома фибромиалгии, который представляет собой хронический синдром, характеризующийся ощущением боли или жжения с тугоподвижностью по утрам, затрагивающим, главным образом, волокнистые, суставные и околосуставные ткани, и ощущением глубокой усталости. Здесь следует напомнить, что фибромиалгия проявляется в совокупности симптомов, среди которых наиболее часто наблюдается невосстанавливающий сон, головные боли, нарушения пищеварения, депрессивное состояние, мышечные спазмы, боли в лице, онемения и т.д.
Изобретение также направлено на лечение некоторых симптомов синдрома хронической усталости, характеризующегося состоянием изнеможения или усталости, проявляющимся, в частности, в виде спазмов и/или в мышечных болей.
Исследование фармакологических свойств соединений (I)
Измерение анальгезирующей активности продуктов (Ia) и (Ib) позволяет выявить:
- эффективность соединений формулы (I) на моделях животных, моделирующих невропатические боли;
- единый профиль их анальгезирующей активности;
и, таким образом, проиллюстрировать усовершенствования, вносимые в методики/схемы анальгезии и которые составляют объект настоящего изобретения.
В качестве примера описана анальгезирующая активность продуктов (Ia) и (Ib), выявленная в тестах на периферической и центральной невропатии. Эти примеры никоим образом не ограничивают рамки изобретения.
Пример лечебного аспекта анальгезирующего эффекта, вызываемого соединениями (I)
1-й вариант: лечение с использованием соединения (Ia) после развития хронической боли
Тест на центральной невропатии осуществляли на крысе согласно методике, аналогичной описанной Hao и Xu в Pain 1996, 66, 279-286. Тестируемый продукт вводят с постоянным уровнем с помощью осмотического насоса (Alzet, модель 2ML2) в течение 14 дней. Насосы имплантируют через 28 дней после повреждения спинного мозга, затем удаляют по завершении лечения. В этой модели было установлено, что через 28 дней после нанесения повреждения животное находится в фазе хронической гиперчувствительности, которая длится несколько месяцев. В этом опыте измеряют гиперчувствительность животных с повреждением, которые получают лечение с использованием либо соединения (Ia), либо солевого раствора. Болевой порог объективируют путем персистирующей вокализации животного в ответ на стимуляцию с возрастающей интенсивностью чувствительной области при помощи волосков фон Фрея. Таким образом, анальгезия тем эффективнее, чем выше амплитуда порога вокализации. Фумарат соединения (Ia) вводили в количестве 0,63 мг/крыса/сутки. Насосы, имплантированные животным контрольной группы с повреждениями, высвобождают раствор 0,9% NaCl (солевой)/крыса/сутки.
Тестирование чувствительности к стимуляции при помощи волосков фон Фрея осуществляли через 3 дня после имплантации осмотического насоса и продолжали регулярно в течение 28 дней. Дозы соответствуют массе соединения в несолевой форме.
Эффекты, полученные с помощью соединения (Ia), в сравнении с эффектами у контрольных животных с повреждениями, получающих солевой раствор, представлены на фиг.3 в приложении. В этой модели антидепрессанты, противовоспалительные средства, а также соединения морфинового ряда являются неактивными.
Результаты
У животных с повреждениями, которым назначен солевой раствор, стимуляция, вызывающая вокализацию, имеет очень низкую интенсивность, и это наблюдается на всем протяжении эксперимента (т.е. в течение 28 дней после нанесения повреждений). Таким образом, у животных с повреждениями развилась хроническая гиперчувствительность. Животные, получающие лечение соединением (Ia), выдерживают стимуляцию, имеющую более высокую интенсивность по сравнению с контрольными животными при любом измерении в течение всего периода лечения. Это положение дел в отношении анальгезии становится статистически достоверным начиная с 10-го дня лечения. Соединение (Ia) проявляет, таким образом, симптоматическую анальгезирующую активность. После прерывания лечения (т.е. начиная с 15-го дня на фиг.3 в приложении) анальгезирующий эффект сохраняется и остается на том же уровне, который был достигнут к концу периода лечения, что выявляется при каждом измерении в течение оставшегося периода проведения опыта (т.е. 14 дней после извлечения насоса).
Соединение (Ia) проявляет, таким образом, также лечебную анальгезирующую активность.
Результаты этого эксперимента показывают, что лечение при помощи соединений I продуцирует:
- фазу симптоматической анальгезии;
- фазу лечебной анальгезии.
2-й вариант: лечение с использованием соединения (Ia) и (Ib), когда боль еще не развилась
Тест на периферической невропатии осуществляли на крысе согласно методике, аналогичной описанной Vos в J. Neurosci. 1994, 14, 2708-2723. Тестируемый продукт вводят с постоянным уровнем (0,12 мл/сутки) с помощью осмотического насоса (Alzet, модель 2ML2) в течение 14 дней. Насосы имплантируют за 24 часа до нанесения повреждения (односторонняя лигатура инфраорбитального нерва), затем удаляют по завершении лечения. Имплантацию насосов осуществляют подкожно через трансверсальный надрез, выполненный в коже спинной поверхности крысы. Оценку интенсивности ощущаемой боли объективируют, исходя из серии поведенческих признаков, наблюдаемых в ответ на механическую стимуляцию поврежденной области при помощи волосков фон Фрея. Стимуляции осуществляют в порядке возрастающей интенсивности. Интенсивность ощущаемой боли оценивают на основании следующих критериев: 0, отсутствие ответа со стороны животного; 1, детекция (т.е. крыса поворачивает голову в сторону объекта, используемого для стимуляции); 2, отступление (т.е. крыса отводит голову или совершает движение для уклонения от объекта, используемого для стимуляции); 3, бегство или нападение (т.е. крыса избегает контакта с объектом с помощью движения корпуса или решительно нападает на объект, используемый для стимуляции); 4, потирание поверхности (т.е. крыса трется в месте стимуляции, для учета должно наблюдаться по меньшей мере три повторные серии потираний). Уровень ответа со стороны животных, не имеющих повреждений, соответствует 0 или 1.
Фумарат соединения (Ia) вводят в количестве 0,63 мг/крыса/сутки; гликолят соединения (Ib) - 0,16 мг/крыса/сутки; гидрохлорид морфина - 5 мг/крыса/сутки и баклофен - 1,06 мг/крыса/сутки. Все соединения вводят в виде раствора в дистиллированной воде. Насосы, имплантированные контрольным животным, высвобождают раствор 0,9% NaCl (солевой)/крыса/сутки; дозы соответствуют массе соединений в несолевой форме.
Эффекты, полученные с помощью соединений (Ia), (Ib) и продуктами, выбранными для сравнения, представлены на фиг.4-8 в приложении. На фиг.4-7 показаны анальгезирующие эффекты различных продуктов, оцениваемые в дни 4, 6, 8, 11, 13 лечения и 1-й день после извлечения насоса (день 15). На фиг.8 показаны анальгезирующие эффекты различных продуктов, измеренные в день 21, т.е. через 6 дней после завершения лечения. В этой модели было предварительно установлено, что антидепрессанты являются неактивными, тогда как баклофен является наиболее активным агентом.
Результаты для каждого животного пока