Ra антигенные пептиды
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Настоящее изобретение относится к новым антигенным пептидам класса II главного комплекса гистосовместимости, которые связаны с молекулой МНС класса II. Данное изобретение позволяет расширить арсенал технических средств, используемых в ранней диагностике ревматоидного артрита. 1 з.п. ф-лы, 5 ил., 4 табл.
Реферат
Настоящее изобретение относится к новым природно-процессируемым RA антигенным пептидам, которые являются предположительными маркерами эрозивного и неэрозивного RA. Указанные антигенные пептиды представлены HLA-DR молекулами класса II основного комплекса гистосовместимости человека. Кроме того, настоящее изобретение относится к антигенным полипептидам, связанным с молекулами класса II основного комплекса гистосовместимости, а также к антителам, реагирующим с указанными антигенными пептидами, нуклеиновым кислотам, кодирующим указанные антигенные пептиды, конструкциям нуклеиновых кислот и клеткам-хозяевам для экспрессии указанных антигенных пептидов. Антигенные пептиды, заявленные в соответствии с настоящим изобретением, а также полипептиды, из которых их получают, могут быть использованы в качестве маркеров для диагностики RA и в качестве терапевтических агентов в составе анти-RA вакцин.
Ревматоидный артрит (RA, от англ. Rheumatoid Arthritis), обычно обозначаемый термином хронический полиартрит, представляет собой системное аутоиммунное заболевание, которое является одной из самых тяжелых форм воспалительного поражения суставов (Feldmann, M. et al., Cell 85 (1996) 307-310; Dedhia, H.V. & DiBartolomeo, A., Critical care clinics 18 (2002) 841-854). В типичных случаях RA вызывает суставную боль, приводит к деформации и выраженной ригидности суставов. Данное заболевание может манифестировать и не с суставного синдрома, особенно у пациентов, позитивных по аутоантителу, обозначаемому как "ревматоидный фактор" (RF, от англ. Rheumatoid Factor) (Mageed, R.A., in: van Venrooij, W.J. & Maini, R.N. eds., Manual из biological markers of disease, Kluwer Academic Publishers (1996) 1-18). RA чаще встречается у представителей белой европеоидной расы, при этом на предрасположенность к RA влияют генетические факторы и факторы окружающей среды. Указанные факторы оказывают существенное влияние на возникновение и прогрессирование этого аутоиммунного заболевания. Приблизительно 4% общей популяции имеют повышенную генетическую предрасположенность к RA, из которых у 20% (приблизительно 1% общей популяции) в результате воздействия неизвестных ненаследственных факторов развивается RA. Кроме того, было показано, что RA значительно чаще встречается у женщин; так, риск заболеть у женщин в три раза выше, чем у мужчин, что свидетельствует о том, что половые гормоны также могут быть вовлечены в патогенез.
На начальных стадиях RA прогрессирует медленно. Наиболее часто встречающимися ранними симптомами являются потливость ладоней, утренняя скованность в суставах пальцев и симметричное поражение суставов воспалительного характера. Кроме того, могут появляться ревматоидные узелки, что является признаком поражения внесуставных тканей. Упрощенная схема патогенеза RA может быть представлена следующим образом: иммунная система продуцирует антитела к здоровым тканям. Указанные антитела атакуют суставной хрящ, что приводит к воспалению сустава и, на более поздних стадиях, к его разрушению. Это разрушение стимулирует иммунную систему, которая начинает продуцировать еще больше аутоантител. Кроме того, происходит образование цитокинов, таких как фактор некроза опухолей альфа (TNF-α) и интерлейкин-1 (IL-1), которые дополнительно усиливают воспалительную реакцию (Houssiau, F.A., Clin Rheumatol 14 Suppi 2 (1995) 10-13). В ответ на инфильтрацию иммунными клетками, такими как макрофаги и Т-клетки, начинается отек синовиальной оболочки. Указанные клетки активно участвуют в механизме клеточной гибели и поддерживают воспаление в суставе (Fox, D.A., Arthritis Rheum 40 (1997) 598-609; Choy, E.H. & Panayi, G.S., N Engi J Med 344 (2001) 907-916). Все эти процессы формируют порочный круг, включающий образование аутоантител, воспаление и разрушение сустава.
В типичных случаях RA протекает хронически, у 85-90% всех пациентов наблюдается медленное прогрессирование заболевания. Злокачественные формы заболевания, приводящие к полной потере функции суставов вплоть до инвалидности, встречаются в 10-15% случаев. При таких формах RA у пациентов отмечается постоянное воспаление суставов и наличие ревматоидных узелков. Такие пациенты страдают от мучительной хронической боли, а постоянное воспаление приводит к выраженной ригидности суставов пальцев рук и необратимым деформациям и вывихам суставов.
Диагностика
Появляется все больше доказательств того, что терапевтическое воздействие на ранних стадиях заболевания может предотвратить разрушение суставов (Egmose, С.et al., J Rheumatol 22 (1995) 2208-2213; Van der Heide, A. et al., Ann Intern Med 124 (1996) 699-707). С тех пор как лечение модифицирующими заболевание антиревматическими лекарственными средствами (DMARDs, от англ. Disease-Modifying Antirheumatic Drugs) стало считаться оправданным и удалось достичь удовлетворительных соотношений риск/преимущество и цена/эффективность, стало обязательным сразу после начала заболевания проводить дифференциальную диагностику RA и других форм артрита (Kirwan, J.R. & Quilty, В., Clin Exp Rheumatol 15 (1997) 15-25). Диагноз устанавливается на основании четких критериев, выявленных из анамнеза заболевания, клинического обследования и лабораторных данных. Американская Ассоциация Ревматизма опубликовала список критериев, которые позволяют собрать объективные доказательства в пользу RA (Amett, F.C., et al., Arthritis Rheum 31 (1987) 315-324). Однако до настоящего времени не существует ни одного теста, специфичного для RA. Для постановки диагноза RA используются некоторые биологические и биохимические маркеры, например С-реактивный белок (CRP, от англ. C-reactive Protein), скорость оседания эритроцитов (СОЭ), антинуклеарные антитела (ANA, от англ. Antinuclear Antibody) и RF. Однако указанные маркеры не являются специфичными, поскольку они могут появляться и при других воспалительных или аутоиммунных заболеваниях. В частности, RF представляет собой аутоантитело, которое присутствует в сыворотке приблизительно у 50% больных RA. С тех пор как было доказано, что RF может выявляться в сыворотке и при других воспалительных заболеваниях, таких как синдром Шегрена, эндокардит или хронический гепатит, RF перестал использоваться как диагностический маркер RA. Перечисленные выше биологические и биохимические маркеры сами по себе имеют диагностическое значение и, кроме того, могут использоваться для определения степени активности заболевания и прогноза, а также для лечения и классификации пациентов с RA (Nakamura, R.M., J Clin Lab Anal 14 (2000) 305-313).
Недавно был разработан набор критериев диагностики RA, который включает клинические и биохимические показатели, позволяющие на ранних стадиях заболевания провести дифференциальную диагностику между самоограничивающимся RA, персистирующим эрозивным RA и персистирующим неэрозивным RA (Visser, H. et al., Arthritis Rheum 46 (2002) 357-365). Самоограничивающаяся форма RA характеризуется естественной ремиссией: при осмотре пациентов не отмечается признаков артрита в течение определенного периода времени. Эрозивный артрит устанавливают на основании наличия эрозивных изменений на рентгенограммах кисти и/или стопы. В частности, применение антител, которые распознают циклические цитруллинированные пептиды, может оказаться эффективным, а также позволяет предположить важную роль цитруллинированных антигенов в патогенезе эрозивного RA (Schellekens, G.A. et al., J Clin Invest 101 (1998) 273-281; Vincent, С.et al., J Rheumatol 25 (1998) 838-846). Ранняя диагностика эрозивного RA позволяет как можно раньше начать применение DMARDs, что будет способствовать своевременному контролю за патологическим процессом и улучшению исходов заболевания (Symmons, D.P.M. et al., J Rheumatol 25 (1998) 1072-1077; Anderson, J.J. et al., Arthritis Rheum 43 (2000) 22-29). Аналогично, ранняя диагностика самоограничивающейся формы RA и неэрозивного RA позволяет предотвратить ненужную медикаментозную терапию потенциально токсичными лекарственными препаратами (Fries, J.F. et al., Arthritis Rheum 36 (1993)297-306).
Терапия
Целью противовоспалительной терапии является облегчение болевого синдрома для того, чтобы улучшить повседневную активность пациентов. В настоящее время полностью вылечить RA невозможно, но с помощью современных методов лечения можно замедлить прогрессирование заболевания или даже остановить его развитие. Вследствие индивидуальных различий каждому конкретному пациенту требуется своя индивидуально подобранная терапия, и, как упоминалось выше, желательно поставить диагноз как можно раньше. Терапия RA является комплексной и заключается в пожизненном применении лекарственных средств, а также физиотерапии и лучевой терапии. Основными терапевтическими агентами для лечения RA являются DMARDs (например, метотрексат, сульфалазин, гидроксихлорохин, лефлуномид, азатиоприн), кортизон, нестероидные противовоспалительные средства (НПВС) или моноклональные антитела к провоспалительным цитокинам TNF-α, IL-1β или их рецепторам (http://rheuma-online.de). Указанные лекарственные агенты имеют общий механизм действия, который заключается в уменьшении воспалительной реакции путем подавления иммунной системы. Основными недостатками являются их низкая специфичность по отношению к RA, побочные эффекты и неспособность воздействовать на основную причину развития RA.
Аутоиммунизация
Аутоиммунизация запускается тогда, когда инициируется специфический адаптивный иммунный ответ, направленный против собственных антигенов (аутоантигенов) и проявляющийся на начальном этапе образованием автономных Т или В клеток. Естественным результатом адаптивного иммунного ответа, направленного против чужеродного антигена, является элиминация указанного антигена из организма. В том случае, когда адаптивный иммунный ответ развивается на собственный антиген, указанный антиген в большинстве случаев не полностью элиминируется из организма и поддерживает постоянный иммунный ответ. Как следствие, эффекторные механизмы иммунной защиты приводят к хроническим воспалительным процессам в тканях. Механизмы повреждения тканей при аутоиммунных заболеваниях по существу не отличаются от механизмов, которые работают при иммунной защите организма и при развитии реакций гиперчувствительности. И хотя в настоящее время не очень понятно, что является триггерным фактором для аутоиммунизации, недавно были обобщены факторы, которые, по всей видимости, вносят свой вклад в развитие аутоиммунных заболеваний и "отбор" мишеней для аутоантигенов (Marrack, P. et al., Nat Med 7 (2001) 899-905).
Аутоиммунные заболевания контролируются свойствами определенных генов каждого индивидуального фактора или фактора внешней среды. Гены хозяина определяют предрасположенность к аутоиммунизации по крайней мере на трех уровнях. Во-первых, некоторые гены влияют на общую реактивность иммунной системы и, следовательно, могут предопределять развитие у индивидуума определенных аутоиммунных заболеваний или даже развитие нескольких заболеваний разных типов. Во-вторых, такая измененная иммунореактивность приводит к образованию определенных аутоантигенов, которые регулируются генами, влияющими на распознавание антигенных пептидов Т-клетками. В-третьих, другие гены определяют способность тканей-мишеней регулировать иммунную атаку, в частности, оказывая влияние на активность эффекторных клеток иммунной системы, которые инициируют иммунную агрессию. Последние два набора генов определяют, какие антигены будут являться мишенями для аутоантител и, следовательно, какие органы будут подвергаться атаке и повреждаться.
Кроме того, сигналы окружающей среды влияют на развитие аутоиммунизации на тех же трех уровнях, оказывая воздействие на общую реактивность иммунной системы, антиген-специфичность и состояние потенциальных тканей-мишеней. И, наконец, существует перекрестное взаимодействие факторов окружающей среды и генетических факторов.
Основной комплекс гистосовместимости (МНС, от англ. Main Histocompatibility Complex)
Популяционные исследования, генотипирование и современные достижения молекулярной биологии показали, что носительство определенных генов, кодирующих белки основного комплекса гистосовместимости (МНС), является высоким риском развития RA (Stastny, P., Tissue Antigens 4 (1974) 571-579; Wordsworth, P. et al., PNAS 86 (1989) 10049-10053; Wordsworth, P.&Bell, J., Springer Semin Immunopathol 14 (1992) 59-78). В частности, носительство определенных аллелей HLA класса II, таких как HLA-DRB1*0101, *0401, *0404 и *0405, некоторыми этническими группами повышает восприимчивость к RA (Reveille, J., Curr Opin Rheumatol 10 (1998) 187-200). Так, более чем у 90% RF-позитивных пациентов выявляется носительство одного из указанных предрасполагающих аллелей. HLA молекулы класса II представляют собой МНС-поверхностные белки, которые связывают антигенные пептиды внутри клетки и экспонируют их на поверхности антиген-презентирующих клеток для взаимодействия с рецепторами CD4+Т-лимфоцитов, что инициирует клеточный иммунный ответ (Banchereau, J.& Stemman, R.M., Nature 392 (1998) 245-252). RA-ассоциация определенных HLA молекул класса II и наличие большого количества активированных CD4+Т-клеток, по-видимому, является схемой, запускающей развитие заболевания, при которой ассоциированные с заболеванием HLA-DR молекулы экспонируют связанные с заболеванием (например, синовиальные) аутоантигены и вызывают стимуляцию и размножение синовиальных Т-клеток, которые в дальнейшем поддерживают воспалительный процесс (Striebich, С.С.et al., J Immunol 161 (1998) 4428-4436).
HLA-DR (коротко: DR) белки класса II МНС представляют собой гетеродимеры, состоящие из мономорфных α-цепей и чрезвычайно полиморфных β-цепей, которые связывают белковые антигены в пептидсвязывающем желобке. Указанный желобок обычно имеет четыре основных кармана для связывания боковых цепей в соответствующих положениях 1, 4, 6 и 9 пептида (Stem, L.J. et al., Nature 368 (1994) 215-221). Аллельные варианты HLA молекул класса II обладают различной способностью связывать антигенные пептиды. Это объясняет тот факт, что индивидуумы, отличающиеся по HLA аллелям, имеют различный набор антигенных пептидов, что обусловливает различия в интенсивности иммунного ответа (Messaoudi, I. et al., Science 298 (2002) 1797-1800).
Пептиды, которые связываются МНС молекулами класса II, обычно длиннее и более гетерогенные по размеру (11-25 аминокислот), чем пептиды, которые связываются МНС молекулами класса I (8-10 аминокислот). Это различие обусловлено тем, что пептидсвязывающий желобок белков класса II является открытым и, в то время как пептиды удерживаются в центре желобка, их концы могут распространяться за его пределы различным образом (Jones, E.Y., Curr Opin Immunol 9 (1997) 75-79). В итоге молекулы класса II обычно связывают набор перекрывающихся пептидов, которые имеют общую центральную последовательность, называемую "Т-клеточный эпитоп", но различаются по длине.
Более чем десять лет назад было обнаружено, что DRβ цепи, кодируемые RA-ассоциированными DRB1 аллелями, несмотря на их полиморфизм, все имеют общий отрезок идентичных или почти идентичных аминокислот в положениях 67-74, известный как "перекрестный эпитоп" (Gregersen, Р.К. et al., Arthritis Rheum 30 (1987) 1205-1213). До того времени, как было установлено, что иммунитет к аутоантигенам является центральным звеном в патогенезе RA, существовало предположение о том, что перекрестный эпитоп может участвовать в патологическом связывании соответствующих DR молекул с помощью по крайней мере двух механизмов: во-первых, путем отбора релевантных аутоантигенных пептидов для экспонирования, и, во-вторых путем отбора подходящих аутореактивных специфичных Т-клеток во время онтогенеза. Трехмерная пространственная структура DR молекул также подтверждает, что перекрестный эпитоп располагается в центре α-спирали, фланкируя пептидосвязывающий желобок с одной стороны (Stem, L.J. et al., Nature 368 (1994) 215-221). Следовательно, перекрестный эпитоп стратегически расположен таким образом, что он может взаимодействовать как со связанным пептидом, так и с Т-клеточным рецептором.
Однако одним из неразрешенных вопросов ревматологии является вопрос о том, какие артритогенные антигены и эпитопы в организме человека являются триггерными и запускают развитие RA. Хотя в настоящее время были идентифицированы аутоантитела различной специфичности в сыворотке и синовиальной жидкости пациентов, до сих пор неясно, действительно ли антитела, которые высвобождаются при разрушении хряща, запускают патологический процесс или же их высвобождение просто является следствием воспаления (Corrigall, V.M. & Panayi G.S., Crit Rev Immunol 22 (2002) 281-293). Кроме того, очень трудно установить патогенетические механизмы, при которых антиген присутствует в организме, включая суставы, но патологический процесс при этом направлен главным образом или исключительно на суставы.
Аутоантигены
При исследовании сыворотки или, реже, Т-клеток, выделенных от больных с хроническим RA, удалось определить большое число возможных RA аутоантигенов. Одним из точно установленных суставоспецифичных антигенов, который, предположительно, относится к DR молекулам, является коллаген типа II (CII), основной белок суставного хряща. Антитела к CII в высоких концентрациях обнаруживают в сыворотке и суставной жидкости пациентов с RA, хотя до сих пор не ясно, являются ли указанные анти-CII-антитела патогенными при RA (Banerjee, S. et al., Clin Exp Rheumatol 6 (373-380). Snowden et al. показали, что периферические Т-клетки крови, выделенные из организма пациентов с RA, начинают пролиферировать в присутствии CII и наиболее интенсивно у пациентов с анти-CII-антителами. Однако указанный ответ наблюдался только у 50% пациентов (Snowden, N. et al., Rheumatology 40 (1997) 1210-1218). На моделях мышей иммунизация CII индуцировала развитие артрита у мышей, экспрессирующих аллели DRB 1*0401 и *0101 МНС класса II (Rosloniec, E.F., et al., J Exp Med 185 (1997) 1113-1122; Rosloniec, E.F. et al., J Immunol 160 (1998) 2573-2578). Иммунодоминатный эпитоп в обоих *0401 и *0101 аллелях трансгенных мышей был направлен по отношению к пептидам с остатками 261-273 CII человека (Fugger, L. et al., Ew J Immunol 26 (1996) 928-933). Аналогичный эпитоп CII демонстрировал способность стимулировать Т-клеточный ответ у пациентов с RA, в особенности на ранних стадиях болезни. Т-клетки синовиальной жидкости обладали наибольшей реактивностью (Kirn, H.Y. et al., Arthritis Rheum 42 (1999) 2085-2093).
Хотя были обнаружены другие хрящевые белки, которые потенциально могут представлять собой RA антигены, ОР4-связывающие эпитопы были обнаружены только у хрящевого гликопротеина 39 человека (HCgp39). Указанный белок секретируется синовиальными клетками и суставными хондроцитами и его количество в плазме и суставной жидкости увеличивается во время воспаления (Vos, К. et al., Ann Rheum Dis 59 (2000) 544-548). Как и в случае с CII, введение HCgp39 индуцирует развитие артрита у мышей. Также у пациентов с RA определяли иммунный ответ Т-клеток периферической крови на введение HCgp39 (Verheijden, G.F. et al., Arthritis Rheum 40 (1997) 1115-1125). Доминантный эпитоп, который распознают Т-клетки у пациентов-носителей DR4, находится между остатками 263-275 и идентичен иммунодоминантному эпитопу, обнаруживаемому у DRB 1*0401-трансгенных мышей после иммунизации нативным HCgp39 (Соре, А.Р. et al., Arthritis Rheum 42 (1999) 1497-1507). Хотя иммунный ответ на этот белок и не является специфичным для этого заболевания, он коррелирует с активностью заболевания у пациентов с RA (Baeten, D. et al., Arthritis Rheum 43 (2000) 1233-1243). Антитела к HCgp39, однако, определяются в сыворотке пациентов с воспалительными заболеваниями, такими как воспалительные заболевания кишечника и системная красная волчанка (СКВ), хотя и в меньших концентрациях, чем при RA.
При попытке выявить антиген-специфичные Т-клетки у больных RA, для определения синовиальных CD4+Т-клеток, реагирующих с CII или HCgp39 у DR4+пациентов, использовали растворимые пептидные DR4 тетрамерные комплексы (Kotzin, B.L. et al., PNAS 97 (2000) 291-296). CII-DR4 комплекс специфично связывается с CII-реактивными Т-клеточными гибридомами, но не с определяемой фракцией синовиальных CD4+клеток. Практически аналогичные результаты были получены с HCgp39-DR4 комплексом, что позволило сделать предположение о том, что основные олигоклональные популяции CD4+Т-клеток, присутствующие в суставах при RA, не являются специфичными для доминантного CII и HCgp39 доминант, описанных выше.
В целом, несмотря на наличие некоторых существенных признаков ассоциации CII и HCgp39 с патогенезом RA, доказательств того, что они являются основными антигенами при RA, недостаточно. Прямых доказательств того, что CII или HCgp39 белки презентируются рестриктированными по МНС класса II антиген-представляющими клетками с последующей стимуляцией и активацией синовиальных CD4+Т-клеток, явно недостаточно. Кроме того, большой проблемой при использовании модельных животных является то, что их восприимчивость к RA до конца неизвестна, поскольку CII-индуцированный артрит у иммунизированных крыс или мышей по многим параметрам отличается от RA.
Природно-процессируемые пептиды, ассоциированные с МНС класса II
Альтернативный подход для идентификации RA-специфичных аутоантител и Т-клеток заключается в применении анализа последовательностей природно-процессируемых пептидных антигенов, которые связываются с молекулами МНС класса II. При помощи моноклональных антител молекулы МНС класса II, определяющие предрасположенность к RA, могут быть выделены из соответствующих клеток. RA-ассоциированные пептидные антигены могут быть элюированы кислотами из очищенных HLA молекул класса II. Смесь небольших белков может быть разделена с помощью HPLC, а белковые последовательности могут быть определены с помощью секвенирования по Эдману или масс-спектрометрии. Поскольку способы очистки белков и методики секвенирования имеют свои ограничения, до настоящего времени удалось только выделить белковые последовательности из молекул МНС, изолированных из культивированных В-клеточных линий или большого объема ткани, и осуществить анализ лишь некоторых белков, присутствующих в большом количестве (Kropsher et al., J. Exp.Med. 175 (1992) 1799-1803; Chicz, R.M. et al., J Exp Med 178 (1993) 27-47). Создание высокоразрешающих микрокапиллярных колонок для HPLC и более чувствительных масс-спектрометров позволило осуществлять более эффективный анализ МНС-связанных белков (Dongre, A.R. et al., Eur J Immunol 31 (2001) 1485-1494; Engelhard, V.H. et al., Mol Immunol 39 (2002) 127-137).
В настоящем изобретении для исследования пептидного антигенного набора HLA-DR4 молекул, выделенных из аутологичных дендритных клеток (DCs, от англ. Dendritic Cells), которые предварительно обрабатывали сывороткой или синовиальной жидкостью пациентов с RA, использовали методику выделения модифицированных пептидов и их секвенирования. Основным достоинством этой современной методики является использование DCs человека, которые участвуют в RA-ассоциированном процессинге антигенов и их презентации, а не моделей трансгенных животных или искусственных В-клеточных линий.
DCs в большом количестве присутствуют в синовиальной жидкости и тканях при RA и происходят из циркулирующих незрелых предшественников (Thomas, R. et al., J Immunol 152 (1994) 2613-2623). Они являются наиболее активными антиген-представляющими клетками, которые экспрессируют большое количество МНС молекул и разнообразные вспомогательные молекулы (Mellman, I. et al., Trends Cell Biol 8 (1998) 231-237). Последние исследования в этой области показали, что ex vivo дифференцирующиеся DCs человека и макрофаги, которые фенотипически аналогичны антиген-представляющим клеткам синовиальной жидкости из пораженных RA суставов, обладают способностью генерировать и презентировать иммунодоминантные эпитопы из СИ и HCgp39 (Tsark, B.C. et al., J Immunol 169 (2002) 6625-6633). DC обладает способностью праймировать CD4+хелперные Т-клетки и эффективно активировать цитотоксические CD8+Т-клетки (Ridge, Т. et al., Nature 393 (1998) 474-478). Следовательно, пептиды, связывающиеся с МНС молекулами класса II и презентируемые DCs, играют первостепенную роль в патогенезе заболеваний, при которых в иммунный ответ вовлекаются Т-клетки.
Кроме того, проблема, связанная с отсутствием достаточного количества информации, касающейся RA антигенных пептидов, ассоциированных с МНС класса II, может быть решена путем получения новых природно-процессируемых RA антигенных пептидов, ассоциированных с МНС класса II, и полипептидов, из которых можно получать указанные антигенные пептиды, и их использования в качестве маркеров RA.
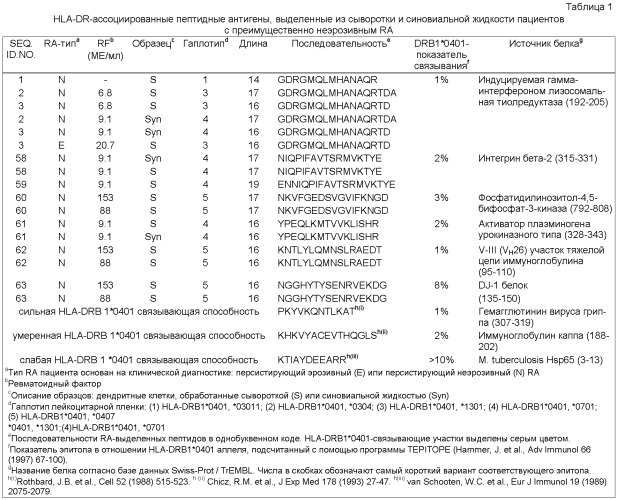
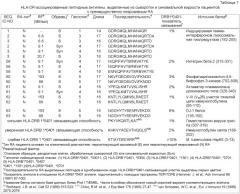
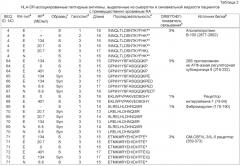
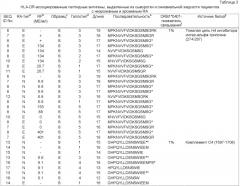
Настоящее изобретение относится к новым природно-процессируемым антигенным пептидам, которые являются предположительными маркерами эрозивного и неэрозивного RA. Указанные антигенные пептиды представлены HLA-DR молекулами МНС класса II, полученными из дендритных клеток, которые обрабатывают сывороткой или синовиальной жидкостью пациентов с установленным диагнозом эрозивного или неэрозивного RA. Антигенные пептиды МНС класса II, заявленные в соответствии с настоящим изобретением, включают: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка, выбранную из группы, включающей SEQ ID NOs. 49-57 и SEQ ID NOs. 103-122, или (б) по крайней мере аминокислотную последовательность пептидсвязывающего участка, выбранную из группы, включающей SEQ ID NOs. 49-57 и SEQ ID NOs. 103-122, с дополнительными N-и С-концевыми фланкирующими последовательностями соответствующей последовательности, выбранной из группы, включающей SEQ ID NOs. 1-39 или SEQ ID NOs. 58-102; причем заявленную последовательность получают из индуцируемой γ-интерфероном лизосомальной тиолредуктазы, интегрина бета-2, фосфатидилинозитол-4,5-бифосфат-3-киназы; активатора плазминогена урокиназного типа, участка V-III тяжелой цепи иммуноглобулина (Ун2б), белка DJ-1, аполипопротеина В-100, 26S протеасомной не АТФ-азной регуляторной субъединицы 8, рецептора интерлейкина 1, фибромодулина, GM-CSF/IL-3/IL-5 рецептора, сортирующего нексина 3, тяжелой цепи Н4 ингибитора интер-α-трипсина, комплемента С4, комплемента C3 (α-цепь), комплемента C3 (β-цепь), протеина 3, подобного обогащенному глутаминовой кислотой связывающему SH3-домен протеину, индуцируемого интерлейкином-4 протеина 1, гемопексина, Hsc70-интерактивного протеина, константной цепи (Ii), отвечающего на протеин 2 рецептора ретиноевой кислоты, фибронектина, катепсина В, трипептидил-пептидазы II, легумаина, рецептора фактора активации тромбоцитов, поли-альфа-2,8-сиалилтрансферазы и ras-родственного пептида Rab-11B. Настоящее изобретение также относится к указанным антигенным пептидам и белкам, из которых их получают, и их использованию в качестве маркеров эрозивного и неэрозивного RA. Кроме того, настоящее изобретение относится к указанным антигенным пептидам, связанным с молекулами МНС класса II, антителам, реагирующим с указанными антигенными пептидами, нуклеиновым кислотам, кодирующим указанные антигенные пептиды, и конструкциям нуклеиновых кислот, клеткам-хозяевам и способам экспрессии указанных антигенных пептидов. Также настоящее изобретение относится к способам выделения и идентификации RA антигенных пептидов.
Фиг.1: Схематическое изображение анализа тканевых образцов, опосредованного дендритными клетками (DC-опосредованный анализ). Дендритные клетки (DCs), наиболее специализированные антиген-представляющие клетки (APCs, от англ. Antigen-Presenting Cells), обрабатывают средой, содержащей антиген (например, синовиальной жидкостью), при оптимальных условиях для захвата и процессинга антигена. В качестве контроля используют DCs, культивируемые при тех же условиях, но в отсутствие антигенов синовиальной жидкости. После созревания DCs нагруженные антигеном молекулы МНС класса II очищают и соответствующие антигенные пептиды, ассоциированные с МНС класса II, выделяют и идентифицируют.
Фиг.2А: Хроматограмма основного пика (ION-TRAP MS) антигенных пептидов, ассоциированных с МНС класса II, которые были выделены из дендритных клеток, предварительно обработанных сывороткой больного RA. Пептиды непосредственно элюируют с RP-C18-HPLC колонки в масс-спектрометр с ионной ловушкой для немедленной MS/MS идентификации. Числа обозначают время удержания (наибольшие величины) и молекулярную массу (наименьшие величины) наиболее явных белковых пиков в смеси в соответствующее время.
Фиг.2 Б: ION-TRAP MS спектр антигенных пептидов за время удержания, составляющее 65.4 мин. Отмеченный пик дополнительно фрагментируют и согласовывают с двухзарядной ионной формой пептида из ингибитора интеральфа-трипсина ITIH4 (см. Таблицу 3).
Фиг.2В: ION TRAP MS/MS спектр двухзарядного пептидного иона при m/z, составляющем 977.1. Фрагментируемые массы вместе с массой родительского иона анализируют относительно невыборочной базы данных человека с использованием алгоритма SEQUEST. Найденная последовательность MPKNVVFVIDKSGSMSGR (однобуквенный код) соответствует доминантному эпитопу ITIH4 (271-288) ингибитора интер-альфа-трипсина. Положения заданных серий N-концевых и С-концевых Y-ионов маркированы.
Фиг.3: Суммарные данные по дифференциальной связывающей активности тестируемых вероятных RA антигенов относительно связывания с аллелем HLA-DRB1*0401. Предполагаемый HLA-DRB1* 0401-связывающий участок помещен в серую рамку. Как меру аффинности, определяют концентрацию пептида, необходимую для снижения связывания заданного количества биотинилированного НА (307-319) пептида при 50% (1С5о) при конкурентом связывании. Реципрокная величина (1/1С5о) коррелирует с аффинностью пептида. В качестве репортерной молекулы в исследовании используют НА (307-319) пептид, гемагглютинин вируса гриппа (Rothbard, J.B. et al., Cell 52 (1988) 515-523).
Антигенные пептиды, заявленные в соответствии с настоящим изобретением, представляют собой пептиды, ассоциированные и представляемые молекулами МНС, в связи с чем они обладают способностью активировать или повышать чувствительность Т-клеток. Антигенные пептиды, представляемые молекулами МНС класса II, таким образом, являются антигенными пептидами, ассоциированными с молекулами МНС класса II, или антигенными пептидами МНС класса II; при этом антигенные пептиды, представляемые молекулами МНС класса I, являются антигенными пептидами, ассоциированными с молекулами МНС класса I, или антигенными пептидами МНС класса I.
Пептиды, получаемые из белков, закодированных в геноме организма или АРС, обозначают как "аутопептиды". Предполагается, что основная функция аутопептидов, представляемых DCs в периферических органах лимфатической системы, заключается в обеспечении толерантности Т-клеток к аутопептидам. Толерантность подразумевает несостоятельность иммунного ответа на антиген; в том случае, когда такой антиген образуется в тканях самого организма, толерантность обозначают как аутотолерантность.
Антигены, получаемые из собственного организма, называют "аутоантигенами". Адаптивный иммунный ответ, направленный против аутоантигенов, называют аутоиммунным ответом. Аналогично, адаптивный иммунитет, специфичный по отношению к аутоантигенам, называют аутоиммунитетом. Термин аутореактивность объединяет иммунные ответы, направленные против аутоантигенов. RA, предположительно, обусловлен аутоиммунным ответом, в который вовлекаются аутореактивные Т-клетки и/или аутореактивные антитела. К иммунногенным пептидам относятся (без ограничений указанными) антигенные пептиды, способные вызывать или стимулировать клеточный или гуморальный иммунный ответ. Указанные пептиды также могут реагировать с антителами.
Пептиды, получаемые из белков, закодированных в геноме бактерий, вирусов или других чужеродных возбудителей, и отличающиеся от аутопептидов, называют "чужеродными антигенами" или "чужеродными" пептидами. Они обладают способностью вызывать Т-клеточный ответ, направленный против чужеродных белков, из которых они были получены.
RA антигенные пептиды представляют собой аутопептиды, которые выполняют роль аутоантигенов и, как следствие заболевания, ошибочно запускают аутореактивность к собственным тканям организма.
Настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка, выбранную из группы, включающей SEQ ID NOs. 49-57 или SEQ ID NOs. 103-122, или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка, выбранную из группы, включающей SEQ ID NOs. 49-57 или SEQ ID NOs. 103-122, с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующей последовательности, выбранной из группы, включающей SEQ ID NOs. 1-39 или SEQ ID NOs. 58-102. Предпочтительно антигенные пептиды МНС класса II имеют в длину менее 26 аминокислот, более предпочтительно их длина составляет от 11 до 25 аминокислот. Еще более предпочтительно, чтобы длина антигенных пептидов, заявленных в соответствии с настоящим изобретением, составляла от 11 до 19 аминокислот. Наиболее предпочтительно, чтобы в состав антигенного пептида, заявленного в соответствии с настоящим изобретением, входил пептидсвязывающий участок, включающий четыре "якорные" аминокислоты.
Настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 49 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 49 с дополнительными С- и N-концевыми фланкирующими последовательностями соответствующей последовательности, выбранной из группы, включающей SEQ ID NOs. 1-3.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 103 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 103 с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующих последовательностей SEQ ID NOs. 58 и 59.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 104 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 104 с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующей последовательности SEQ ID NOs. 60.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 105 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 105 с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующей последовательности SEQ ID NOs. 61.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 106 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 106 с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующей последовательности SEQ ID NOs. 62.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 107 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 107 с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующей последовательности SEQ ID NOs. 63.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 50 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 50 с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующей последовательности SEQ ID NOs. 5.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 108 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 108 с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующих последовательностей SEQ ID NOs. 64-67.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 109 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 109 с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующей последовательности SEQ ID NOs. 68.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 110 или б) по крайней мере аминокислотную последовательность пептидсвязывающего участка SEQ ID NO. 110 с дополнительными N- и С-концевыми фланкирующими последовательностями соответствующих последовательностей SEQ ID NOs. 69 и 70.
Кроме того, настоящее изобретение относится к антигенным пептидам МНС класса II, включающим: а) по крайней мере аминокислотную последовательность пептидсвязывающего уч