Оптимизированная экспрессия l1 hpv45 в дрожжах
Иллюстрации
Показать всеИзобретение относится к области вирусологии и медицины. Представлена синтетическая ДНК-молекула, кодирующая белок L1 HPV45. При этом ДНК-молекула была кодон-оптимизирована для высокоуровневой экспрессии белка в дрожжевой клетке. Данные синтетические молекулы можно использовать для получения вирусоподобных частиц (VLP) HPV45 и для получения вакцин и фармацевтических композиций, содержащих VLP-частицы HPV45. Вакцины обеспечивают эффективную иммунопрофилактику заражения вирусом папилломы благодаря нейтрализующим антителам и клеточно-опосредованному иммунитету. Изобретение может быть использовано в медицине. 5 н. и 4 з.п. ф-лы, 6 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится, главным образом, к лечению человека, зараженного вирусом папилломы (HPV). В частности, настоящее изобретение относится к синтетическим полинуклеотидам, кодирующим белок L1 HPV45, а также к рекомбинантным векторам и хозяевам, включающим указанные полинуклеотиды. Настоящее изобретение относится также к вирусоподобным частицам (VLP) HPV45, причем данные частицы образуются путем экспрессии рекомбинантных белков L1 или L1+L2 вируса HPV45 в дрожжевых клетках, и к их использованию в вакцинах и в фармацевтических композициях для профилактики и лечения больных HPV.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Существует свыше 80 типов вируса папилломы человека (HPV), многие из которых ассоциированы с большим числом биологических фенотипов, начиная с развивающихся доброкачественных бородавок до злокачественных карцином (смотрите обзор McMurray и соавт., Int. J. Exp. Pathol. 82(1): 15-33 (2001)). HPV6 и HPV11 представляют собой типы вируса папиллом, чаще всего ассоциированные с доброкачественными бородавками и/или с незлокачественной кондиломой слизистых половых или дыхательных органов. HPV16 и HPV18 представляют собой типы папиллом повышенного риска, часто ассоциированные с in situ-карциномами и с инвазивными карциномами шейки матки, влагалища, наружных женских половых органов и анального канала. Свыше 90% заболеваний рака шейки матки связаны с заражением вирусами HPV16, HPV18 или менее распространенными канцерогенными типами HPV31, -33, -45, -52 и -58 (Schiffman и соавт., J. Natl. Cancer Inst. 85(12): 958-64 (1993)). Наблюдение о том, что ДНК HPV детектируется более чем у 90% больных раком шейки матки, является веским эпидемиологическим свидетельством того, что многие типы HPV вызывают карциному шейки матки (смотрите Bosch и соавт., J. Natl. Cancer Inst. 87(11): 796-802 (1995)).
Вирусы папилломы представляют собой небольшие (50-60 нм), безоболочечные, икосаэдрические ДНК-вирусы, которые кодируются восемью ранними и двумя поздними генами. Открытые рамки считывания (ORF) вирусных геномов обозначают E1-E7, а также L1 и L2, где "E" означает ранний, а "L" означает поздний. L1 и L2 кодируют белки капсида вируса, а E-гены связаны с такими функциями, как репликация вируса и клеточная трансформация.
Белок L1 представляет собой главный белок капсида и обладает молекулярной массой 55-60 кДа. Белок L2 представляет собой минорный белок капсида. Иммунологические данные дают основание полагать, что бтльшая часть белка L2 находится в вирусном капсиде внутри белка L1. И белок L1, и белок L2 разных вирусов папилломы являются высококонсервативными.
Экспрессия белка L1 или сочетания белков L1 и L2 в дрожжах, в клетках насекомых, клетках млекопитающих или бактериальных клетках приводит к самосборке вирусоподобных частиц (VLP) (смотрите обзор Schiller and Roden, в Papillomavirus Reviews: Current Research on Papillomaviruses; Lacey, ed. Leeds, Великобритания: Leeds Medical Information, pp. 101-12 (1996)). VLP-частицы морфологически сходны с аутотентичными вирионами и при введении животному способны индуцировать высокие титры нейтрализующих антител. Поскольку VLP-частицы не содержат потенциально онкогенного вирусного генома, они представляют собой безопасную альтернативу использования живого вируса для создания HPV-вакцины (смотрите обзор Schiller and Hidesheim, J. Clin. Virol. 19: 67-74 (2000)). По этой причине гены L1 и L2 были идентифицированы в качестве иммунологических мишеней при создании профилактической и терапевтической вакцин для HPV-инфекции и заболевания.
Созданию и организации поточного производства HPV-вакцины препятствовали трудности, связанные с получением высокого уровня экспрессии экзогенных генов в успешно трансформированных организмах-хозяевах, лимитирующих продукцию очищенного белка. Поэтому, несмотря на идентификацию нуклеотидных последовательностей дикого [немутантного] типа, кодирующих белки HPV L1, таких как HPV45 L1-белок, было бы весьма желательно создать легко возобновляемый источник неочищенного HPV L1-белка, который использует HPV45 L1-кодирующие нуклеотидные последовательности, оптимизированные для экспрессии в предполагаемой клетке-хозяине. Кроме того, было бы целесообразно получать большие количества VLP-частиц HPV45 L1, обладающих свойствами нативных белков вызывать иммунитет для использования в разработке вакцин.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩЕСТВА ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям и к способам активизации или усиления иммунитета к белковым продуктам, экспрессируемым генами L1 HPV45, которые ассоциированы с раком шейки матки. В частности, настоящее изобретение обеспечивает полинуклеотиды, кодирующие белок L1 HPV45, причем данные полинуклеотиды были кодон-оптимизированы для высокоуровневой экспрессии в дрожжевой клетке. Настоящее изобретение обеспечивает также вирусоподобные частицы (VLP) HPV45, где указанные VLP-частицы получают путем экспрессии рекомбинантных L1 или L1+L2 HPV45 в дрожжевых клетках, а также раскрыто использование VLP-частиц HPV45 в фармацевтических композициях и в вакцинах для профилактики и/или лечения больных HPV-ассоциированной злокачественной опухолью.
Настоящее изобретение относится к синтетическим ДНК-молекулам, кодирующим белок L1 HPV45. Кодоны данных синтетических молекул сконструированы таким образом, чтобы использовать данные кодоны предпочтительно в дрожжевой клетке. Указанные синтетические молекулы можно использовать в качестве источника белка L1 HPV45, который может подвергаться самосборке в VLP-частицы. Указанные VLP-частицы можно использовать для создания вакцины на основе VLP.
Пример осуществления настоящего изобретения включает в себя синтетическую молекулу нуклеиновой кислоты, которая кодирует белок L1 HPV45, представленный в SEQ ID NO:2, причем указанная молекула нуклеиновой кислоты содержит последовательность нуклеотидов, представленную в SEQ ID NO:1.
Также обеспечиваются рекомбинантные векторы и рекомбинантные клетки-хозяева, как прокариотические, так и эукариотические, которые содержат молекулы нуклеиновой кислоты, раскрытые в данном описании.
Настоящее изобретение относится также к способу экспрессии белка L1 HPV45 в рекомбинантной клетке-хозяине, предусматривающему: (а) внедрение вектора, содержащего нуклеиновую кислоту, кодирующую белок L1 HPV45, в дрожжевую клетку-хозяина; и (b) культивирование дрожжевой клетки-хозяина в условиях, которые делают возможным экспрессию указанного белка L1 HPV45.
Далее, настоящее изобретение относится к способу экспрессии белка L1 HPV45 в рекомбинантной клетке-хозяине, включающему в себя: (а) внедрение вектора, содержащего нуклеиновую кислоту, кодирующую белок L1 HPV45, в дрожжевую клетку-хозяина; где молекула нуклеиновой кислоты является кодон-оптимизированной для оптимальной экспрессии в дрожжевой хозяйской клетке-хозяине; (b) культивирование данной дрожжевой клетки-хозяина в условиях, которые делают возможной экспрессию указанного белка L1 HPV45.
В предпочтительных вариантах осуществления настоящего изобретения нуклеиновая кислота содержит последовательность нуклеотидов, представленную в виде SEQ ID NO:1 (R-последовательность L1 типа 45).
Настоящее изобретение относится также к вирусоподобным частицам (VLP) HPV, которые продуцируются в дрожжевых клетках, к способам получения VLP-частиц HPV45, и к способам использования VLP-частиц HPV45.
В предпочтительном варианте осуществления настоящего изобретения дрожжи выбраны из группы, состоящей из Saccharomyces cerevisiae, Hansenula polymorpha, Pichia pastoris, Kluyveromyces fragilis, Kluyveromyces lactis и Schizosaccharomyces pombe.
Другой аспект настоящего изобретения составляет VLP-частицу HPV45, где VLP-частицу получают в результате рекомбинантной экспрессии L1 HPV45 или L1+L2 HPV45 в дрожжевой клетке.
Еще один аспект настоящего изобретения составляет VLP-частица HPV45, которая содержит белок L1 HPV45, кодируемый кодон-оптимизированным L1-геном HPV45. В примере осуществления данного аспекта настоящего изобретения кодон-оптимизированный L1-ген HPV45 включает в себя последовательность нуклеотидов, представленную SEQ ID NO:1.
Настоящее изобретение обеспечивает также способ индукции у животного иммунного ответа, предусматривающий введение данному животному вирусоподобных частиц HPV45. В предпочтительном варианте осуществления настоящего изобретения VLP-частицы HPV45 производят с помощью кодон-оптимизированного гена.
Еще один аспект настоящего изобретения составляет способ профилактики или лечения рака шейки матки, вызванного HPV, включающий в себя введение млекопитающему вакцины, содержащей VLP-частицы HPV45. В предпочтительном варианте осуществления данного аспекта настоящего изобретения
VLP-частицы HPV45 получают в дрожжах.
Настоящее изобретение относится также к вакцине, включающей вирусоподобные частицы (VLP) HPV45.
В альтернативном варианте осуществления данного аспекта настоящего изобретения вакцина дополнительно содержит VLP-частицы, по меньшей мере, одного дополнительного типа HPV. По меньшей мере, один дополнительный тип HPV может представлять собой любой интересующий тип HPV, включая любой тип HPV, описанный в данной области техники, либо тип HPV, который можно было бы идентифицировать впоследствии. В предпочтительном варианте осуществления настоящего изобретения тип HPV представляет собой тип, который ассоциируется с таким клиническим фенотипом как бородавки, или рак шейки матки. Еще в одном предпочтительном варианте осуществления настоящего изобретения, по меньшей мере, один тип HPV выбран из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV51, HPV52, HPV55, HPV56, HPV58, HPV59, и HPV68.
Настоящее изобретение относится также к фармацевтическим композициям, содержащим вирусоподобные частицы HPV45. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим VPL-частицы HPV45, а также VLP-частицы одного из дополнительных типов HPV. В предпочтительном варианте осуществления настоящего изобретения, по меньшей мере, один дополнительный тип HPV выбран из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV51, HPV52, HPV55, HPV56, HPV58, HPV59 и HPV68.
Используемые в данном описании и в прилагаемой формуле изобретения формы единственного числа включают ссылку на множественное число, за исключением особо оговоренных случаев.
В данном описании и в прилагаемой формуле изобретения применяют нижеследующие определения и сокращения.
Термин "промотор" относится к сайту узнавания в цепи ДНК, с которым связывается РНК-полимераза. Промотор образует с РНК-полимеразой инициирующий комплекс, который инициирует и направляет транскрипционную активность. Данный комплекс можно модифицировать с помощью активирующих последовательностей, именуемых "энхансерами", или "вышележащими активирующими последовательностями", либо с помощью ингибирующих последовательностей, именуемых "сайленсерами".
Термин "вектор" относится к тем средством, с помощью которых ДНК-фрагменты могут быть введены в организм хозяина или в ткань хозяина. Существуют разнообразные типы векторов, включая плазмиды, вирусы (в том числе аденовирусы), бактериофаги и космиды.
Определение "последовательность L1 дикого типа 45" относится к ДНК-последовательности L1 HPV45, раскрытой здесь в виде SEQ ID NO:3 (45 L1 wt). Несмотря на то что ДНК-последовательность L1 дикого типа HPV 45 была описана раньше, в препаратах ДНК клинических изолятов нередко обнаруживают незначительные изменения этой последовательности. Поэтому типичная ДНК-последовательность L1 дикого типа 45 выделена из клинических образцов, показывающих содержание ДНК HPV45 (смотрите ПРИМЕР 1). Эту последовательность L1 дикого типа 45 используют в качестве стандартной последовательности для сравнения раскрытых здесь кодон-оптимизированных последовательностей L1 45 (смотрите ФИГУРУ 1).
Обозначение "HPV 45 L1 R" или "45 L1 R" относится к раскрытой здесь типичной синтетической нуклеотидной последовательности L1 HPV45 (SEQ ID NO:1), причем данная последовательность была реконструирована таким образом, чтобы она включала кодоны, которые предпочтительны для высокоуровневой экспрессии в дрожжевой клетке.
Термин "эффективное количество" подразумевает введение достаточного количества вакцинной композиции для получения адекватного уровня соответствующего полипептида, вызывающего иммунную реакцию. Специалисту в данной области техники очевидно, что данный уровень может варьироваться.
"Консервативная аминокислотная замена" относится к замене одного аминокислотного остатка другим, химически сходным аминокислотным остатком. Примеры таких консервативных замен включают: замену одного гидрофобного остатка (изолейцин, лейцин, валин, или метионин) другим; замену одного полярного остатка другим полярным остатком с таким же зарядом (например, аргинин на лизин; глутаминовая кислота на аспарагиновую кислоту).
Термин "млекопитающее" относится к любому млекопитающему, включая человека.
"VLP-частица" или "VLP-частицы" подразумевает вирусоподобную частицу или вирусоподобные частицы.
Термин "синтетический" означает, что ген L1 HPV45 создан так, что он содержит последовательность нуклеотидов, которая отличается от последовательности нуклеотидов, представленной в указанном естественно встречаемом гене L1 дикого типа HPV45 (45 L1 wt, SEQ ID NO:3). Как указано выше, синтетические молекулы, приведенные здесь, включают последовательность нуклеотидов, содержащую кодоны, которые предпочтительны для экспрессии в дрожжевых клетках. Синтетические молекулы, приведенные здесь, кодируют ту же аминокислотную последовательность, что и аминокислотная последовательность гена L1 дикого [немутантного] типа HPV45 (SEQ ID NO:2).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГУРЕ 1 представлено выравнивание ДНК последовательностей, показывающая нуклеотиды, которые были изменены в синтетическом гене L1 HPV45 настоящего изобретения (SEQ ID NO:1, представленная в виде "45 L1 R") (смотрите ПРИМЕР 2). Стандартная последовательность представляет собой последовательность L1 дикого [немутантного] типа 45 (SEQ ID NO:3, представленная в виде "45 L1 wt"; смотрите ПРИМЕР 1). Измененные нуклеотиды указаны в их соответствующем местоположении. Количество нуклеотидов дано в скобках. Идентичные нуклеотиды в реконструированной последовательности L1 45 изображены с помощью точек.
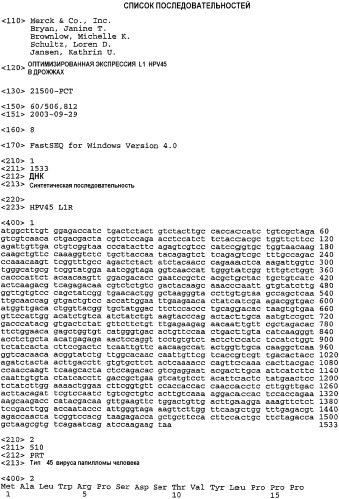
На ФИГУРЕ 2 представлены реконструированная синтетическая нуклеотидная последовательность L1 HPV45 и соответствующая однокодоновая аминокислотная последовательность. Количество нуклеотидов указано слева.
На ФИГУРЕ 3 представлены результаты Нозерн-блотт-зондирования, специфичного для РНК L1 HPV45 в очень жестких условиях (смотрите ПРИМЕР 4). Дорожка (1) содержит 5 мкг РНК R L1 HPV45, а дорожка (2) содержит 10 мкг РНК R L1 HPV45. На полученном блотте виден единственный полноразмерный РНК-транскрипт. Стрелка слева указывает предсказанное положение полноразмерного L1-транскрипта HPV45.
На ФИГУРЕ 4 показан Вестерн-блотт L1 дикого типа 45 и трех R-изолятов L1 HPV45. Содержимое дорожек: 45 L1 wt (дорожка 1), 45 L1 R#4 (дорожка 2), 45 L1 R#7 (дорожка 3), 45 L1 R#11 (дорожка 4), контроль L1 HPV16 (дорожка 5). Дрожжевой экстракт, содержащий пятнадцать микрограмм тотального белка, вносят на каждую дорожку 10%-го SDS-ПААГ. Для специфической идентификации L1-белка HPV45 используют поликлональную антисыворотку козы против химерного белка L1 TrpE HPV45. Стрелка слева указывает положение 55 кДа-белка.
На ФИГУРЕ 5 частично представлены данные двух экспериментов ИФА в нг VLP/мкг общего белка (смотрите ПРИМЕР 7). Показано сравнение между wt L1 45 и R L1 45 двух отдельных клонов. Экспрессия реконструированной VLP L1 HPV45 оказывается примерно в 2 раза выше, чем L1 wt 45.
На ФИГУРЕ 6 представлен типичный образец VLP-частиц HPV45, составленный из белковых молекул R L1 HPV45, описанных здесь, которые визуализируют с помощью просвечивающей электронной микроскопии (смотрите ПРИМЕР 8). Подчеркнутое соответствует приблизительно 10 нм.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Большинство карцином шейки матки связано с инфицированием специфическими онкогенными типами вируса папилломы человека (HPV). Настоящее изобретение относится к композициям и к способам получения или усиления иммунитета по отношению к белковым продуктам, экспрессируемым генами онкогенных типов HPV.
В частности, настоящее изобретение обеспечивает полинуклеотиды, кодирующие белок L1 HPV45, который подвержен самосборке в вирусоподобные частицы (VLP) HPV45, а также раскрыто использование указанных полинуклеотидов и VLP-частиц в фармацевтических композициях и в вакцинах для профилактики и/или лечения HPV-ассоциированной злокачественной опухоли.
Сообщается о нуклеотидной последовательности L1 дикого типа HPV45 (Инвентарный № в Genbank NC_001590; смотрите также Delius and Hofmann, Curr. Top. Microbiol. Immunol. 186:13-31 (1994)). Настоящее изобретение обеспечивает синтетические молекулы ДНК, кодирующие белок L1 HPV45. Синтетические молекулы настоящего изобретения включают в себя последовательность кодонов, в которой, по меньшей мере, часть кодонов была изменена для их использования в высокоуровневой экспрессии преимущественно в дрожжевых клетках. Данные синтетические молекулы можно использовать в виде кодирующей последовательности для экспрессии белка L1 HPV45, который может подвергаться самосборке в VLP-частицы. Указанные VLP-частицы можно использовать в вакцине, основанной на VLP, для создания эффективной иммунопрофилактики инфицирования вирусом папилломы с помощью нейтрализующих антител и клеточноопосредованного иммунитета.
Экспрессия VLP-частиц HPV45 в дрожжевых клетках дает преимущества, заключающиеся в рентабельности и легкой адаптации при масштабном выращивании в ферментерах. Вместе с тем, многие белки L1 HPV, в том числе и L1 HPV45, экспрессируются в дрожжевых клетках на уровне, который ниже желательного для масштабного коммерческого производства.
В соответствии с этим настоящее изобретение относится к последовательностям гена L1 HPV45, которые "оптимизируют" для достижения высокоуровневой экспрессии в среде дрожжевых клеток.
Кодоновый "триплет" из четырех возможных нуклеотидных оснований может существовать более чем в 60 вариантных формах. Поскольку данные кодоны содержат информацию лишь для 20 разных аминокислот (а также для инициации транскрипции и терминации), некоторые аминокислоты могут кодироваться более чем одним кодоном, и это явление известно как вырожденность генетического кода. По не вполне понятным причинам альтернативные кодоны неодинаково представлены в эндогенных ДНК разных типов клеток. Очень похоже, что существует изменчивая естественная иерархия, или "предпочтение", для некоторых кодонов в некоторых типах клеток. В качестве примера, аминокислота лейцин задается любым из шести ДНК-кодонов, включая CTA, CTC, CTG, CTT, TTA и TTG. Всесторонний анализ частот использованных кодонов у микроорганизмов показал, что эндогенная ДНК E. coli обычно содержит специфичный для лейцина CTG-кодон, тогда как ДНК дрожжей и слизевиков чаще всего включают специфичный для лейцина TTA-кодон. С учетом данной иерархии обычно полагают, что вероятность получения с помощью E. coli высокоуровневой экспрессии богатого лейцином полипептида до некоторой степени зависит от определенной частоты использования данного кодона. Например, возможно, что богатый TTA-кодонами ген будет недостаточно экспрессироваться в E. coli, а богатый CTG-кодонами ген будет, по-видимому, высокоэкспрессируемым в данном хозяине. Сходным образом, предпочтительным кодоном для экспрессии богатого лейцином полипептида в дрожжевых хозяйских клетках предполагается TTA.
Значение феномена кодонового предпочтения в технике рекомбинантных ДНК очевидно, и это явление может служить объяснением многих прежних неудач в достижении высокоуровневой экспрессии экзогенных генов у успешно трансформированных организмов-хозяев - менее "предпочтительный" кодон может быть повторно представлен во встроенном гене, и механизм экспрессии может действовать неэффективно. Наличие данного феномена означает, что синтетические гены, предназначенные для включения предпочтительных кодонов в предполагаемые клетки-хозяева, предусматривает придание оптимального вида чужеродному генетическому материалу для экспрессии рекомбинантного белка на практике. Следовательно, один из аспектов настоящего изобретения заключается в том, что ген L1 HPV45 является кодон-оптимизированным для высокоуровневой экспрессии в любой дрожжевой клетке. В предпочтительном варианте осуществления настоящего изобретения выясняется, что использование альтернативных кодонов, кодирующих одну и ту же белковую последовательность, может исключить ограничения по экспрессии L1-белков HPV45 в дрожжевых клетках.
В соответствии с настоящим изобретением сегменты гена L1 HPV45 конвертируют в последовательности, обладающие идентичными транслируемыми последовательностями, но с использованием альтернативного кодона, как это описано у Sharp и Cowe (Synonymous Codon Usage in Saccharomyces cerevisiae. Yeast 7:657-678 (1991)), который включен здесь в качестве ссылки. Данная методика, как правило, состоит из идентифицикации кодонов в последовательности дикого [немутантного] типа, которые, в общем, не связаны с высокоэкспрессируемыми дрожжевыми генами, а также с их замещением на оптимальные кодоны для высокой экспрессии в дрожжевых клетках. Затем полученную новую генную последовательность проверяют на наличие нежелательных последовательностей, образованных в результате данных кодоновых замен (например, "ATTTA"-последовательностей, случайно созданных интронных сплайс-сайтов узнавания, нежелательных сайтов фермента рестрикции, высокого содержания GC, наличия сигналов терминации транскрипции, которые узнаются дрожжами, и т.д., и т.п.). Нежелательные последовательности элиминируют путем замены существующих кодонов другими, кодирующими ту же аминокислоту. Затем сегменты синтетического гена тестируют на улучшенную экспрессию.
Вышеописанные способы используют для создания сегментов синтетического гена L1 HPV45, с получением гена, содержащего кодоны, оптимизированные для высокоуровневой экспрессии в клеточной дрожжевой среде. Хотя вышеприведенная методика предполагает краткое изложение нашего метода по созданию кодон-оптимизированных генов для их использования в HPV-вакцинах, специалистам в данной области техники очевидно, что подобную вакцину для эффективной или повышенной экспрессии генов можно создать путем незначительных изменений данной методики или путем незначительных вариаций данной последовательности.
В соответствии с этим настоящее изобретение относится к синтетическому полинуклеотиду, включающему в себя последовательность нуклеотидов, кодирующую L1-белок HPV45, либо биологически активный фрагмент или мутантную форму L1-белка HPV45, полинуклеотидную последовательность, включающую кодоны, оптимизированные для экспрессии в дрожжевых клетках-хозяевах. Указанные мутантные формы белка L1 HPV45 включают, но не ограничиваются: замены консервативных аминокислот, аминоконцевые усечения, карбоксиконцевые усечения, делеции или добавки. Любой такой биологически активный фрагмент и/или мутант будет кодировать либо белок, либо белковый фрагмент, который, по меньшей мере, существенно имитирует иммунологические свойства белка L1 HPV45, представленнного в SEQ ID NO:2. Синтетические полинуклеотиды настоящего изобретения кодируют молекулы мРНК, которые экспрессируют функциональный белок L1 HPV45, пригодный для создания терапевтической или профилактической HPV-вакцины.
Один из аспектов настоящего изобретения представляет собой кодон-оптимизированную молекулу нуклеиновой кислоты, кодирующей белок L1 HPV45 и представленной SEQ ID NO:2, причем указанная молекула нуклеиновой кислоты содержит последовательность нуклеотидов, представленных SEQ ID NO:1.
Настоящее изобретение относится также к рекомбинантным векторам и к рекомбинантным клеткам-хозяевам, как прокариотическим, так и эукариотическим, которые содержат молекулы нуклеиновых кислот, раскрытые в данном описании.
Синтетическую ДНК HPV45 или ее фрагменты, сконструированные с помощью описанных здесь способов, можно рекомбинантно экспрессировать путем молекулярного клонирования в экспрессионный вектор, содержащий подходящий промотор и другие соответствующие элементы регуляции транскрипций, и затем перенести в прокариотические или эукариотические клетки-хозяева для создания рекомбинантного L1 HPV45. Методы такой обработки полностью описаны у Sambrook и соавт. (Molecular Cloning: A Laboratory Manual; Cold Spring Harbor, New York (1989); Current Protocols in Molecular Biology, Ausubel и соавт., Green Pub. Associates and Wiley-Interscience, New York (1988); Yeast Genetics: A Laboratory Course Manual, Rose и соавт., Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, (1990)), которые, тем самым, полностью включены здесь путем ссылки.
Таким образом, настоящее изобретение относится к способу экспрессии белка L1 HPV45 в рекомбинантной клетке-хозяине, включающему в себя: (а) введение вектора, содержащего нуклеиновую кислоту, кодирующую белок L1 HPV45, в дрожжевую клетку-хозяина; и (b) культивирование данной дрожжевой клетки-хозяина в условиях, которые делают возможной экспрессию указанного белка L1 HPV45.
Настоящее изобретение относится также к способу экспрессии белка L1 HPV45 в рекомбинантной клетке-хозяине, включающему в себя: (а) введение вектора, содержащего нуклеиновую кислоту, кодирующую белок L1 HPV45, в дрожжевую клетку-хозяина; причем указанная молекула нуклеиновой кислоты является кодон-оптимизированной для оптимальной экспрессии в данной дрожжевой клетке-хозяине; и (b) культивирование указанной дрожжевой клетки-хозяина в условиях, которые делают возможной экспрессию указанного белка L1 HPV45.
Настоящее изобретение относится также к способу экспрессии белка L1 HPV45 в рекомбинантной клетке-хозяине, включающему в себя: (а) введение вектора, содержащего нуклеиновую кислоту, представленную SEQ ID NO:1, в дрожжевую клетку-хозяина; и (b) культивирование данной дрожжевой клетки-хозяина в условиях, которые делают возможной экспрессию указанного белка L1 HPV45.
Синтетические гены настоящего изобретения могут быть собраны в экспрессионную кассету, которая включает в себя последовательности, предназначенные для обеспечения эффективной экспрессии белка L1 HPV45 в соответствующей клетке-хозяине. Кассета предпочтительно содержит синтетический ген с присоединенным к нему транскрипционными и трансляционными регуляторными последовательностями функционально связанными с ним, такими как промоторные последовательности, а также последовательности терминации. В предпочтительном варианте осуществления настоящего изобретения данный промотор представляет собой промотор GAL1 S. cerevisiae, хотя специалистам в данной области техники известно, что можно использовать любой из ряда других известных дрожжевых промоторов, таких как GAL10, GAL7, ADH1, TDH1 или PGK-промоторы, либо иных промоторов эукариотических генов. Предпочтительным терминатором транскрипции является терминатор ADH1, хотя можно использовать и другие известные терминаторы транскрипции. Особенно предпочтительным является сочетание промотора GAL1 и терминатора ADH1.
Другой аспект настоящего изобретения касается вирусоподобной частицы (VLP) HPV45, получаемой с помощью рекомбинантной экспрессии в дрожжевой клетке генов L1 или L1+L2 HPV45, способов получения VLP-частиц HPV45, а также способов использования VLP-частиц HPV45. VLP-частицы могут образовываться путем самосборки в том случае, если L1, главный белок капсида вирусов папилломы человека и животных, экспрессируется в дрожжевых клетках, клетках насекомого, клетках млекопитающего или в бактериальных клетках (смотрите обзор Schiller and Roden, в Papillomavirus Reviews: Current Research on Papillomaviruses; Lacey, ed. Leeds, Великобритания: Leeds Medical Information, pp.101-12 (1996)). Морфологически неразличимые VLP-частицы можно также получить путем экспрессии сочетания капсидных белков L1 и L2. VLP-частицы L1 состоят из 72 пентамеров с икосаэдрической структурой T=7 (Baker и соавт., Biophys. J. 60(6):1445-56 (1991)).
VLP-частицы морфологически сходны с аутентичными вирионами, и при введении животному способны индуцировать высокие титры нейтрализующих антител. Иммунизация кроликов (Breitburd и соавт., J. Virol. 69(6):3959-63 (1995)) и собак (Surich и соавт., Proc. Natl. Acad. Sci. USA 92(25):11553-57 (1995)) с VLP-частицами показала индуцирование нейтрализующих антител и защиту от экспериментального заражения вирусом папилломы. Но, поскольку VLP-частицы не содержат потенциально онкогенного вирусного генома и могут подвергаться самосборке при экспрессии одного гена, они представляют безопасную альтернативу использования живого вируса для создания HPV-вакцины (смотрите обзор Schiller and Hidesheim, J. Clin. Virol. 19:67-74 (2000)).
Marais и соавт. (J. Med. Virol. 60:331 (2000)) описывают VLP-частицы HPV45, которые были получены в клетках насекомых с гена L1 HPV45, экспрессируемого из бакуловируса. Экспрессия VLP-частиц в клетках насекомых не имеет преимущества при создании вакцины из-за высокой стоимости. Кроме того, зачастую трудно наладить масштабную экспрессию генов L1 HPV45 в культуре клеток насекомых с получением больших объемов, необходимых для создания коммерческого продукта. Получение VLP-частиц HPV45 в дрожжевых клетках ранее не было описано. Экспрессия VLP-частиц HPV в дрожжевых клетках дает преимущества в рентабельности и легко применима для масштабированного выращивания клеток в ферментерах. Помимо этого, дрожжевой геном можно легко изменить, что обеспечивает селекцию рекомбинантов, получение дрожжей с усиленным ростом и экспрессионным потенциалом.
Таким образом, настоящее изобретение относится к вирусоподобным частицам, включающим рекомбинантный белок L1 или рекомбинантные белки L1+L2 HPV45, где данный рекомбинантный белок экспрессируется в дрожжевой клетке.
В предпочтительном варианте осуществления настоящего изобретения VLP-частицы HPV45 получают путем экспрессии L1 HPV45 или L1+L2 HPV45 в дрожжах, выбранных из группы, состоящей из: Saccharomyces cerevisiae, Hansenula polymorpha, Pichia pastoris, Kluyveromyces fragilis, Kluyveromyces lactis и Schizosaccharomyces pombe.
Следующий аспект настоящего изобретения касается VLP HPV45, которые включают в себя белок L1 HPV45, производимый путем экспрессии кодон-оптимизированного гена L1 HPV45. В предпочтительном варианте осуществления данного аспекта настоящего изобретения кодон-оптимизированный ген L1 HPV45 включает в себя последовательность нуклеотидов, представленную SEQ ID NO:1.
Еще один аспект настоящего изобретения представляет собой способ получения VLP-частиц HPV45, включающий в себя: (а) трансформацию дрожжей с помощью рекомбинантной ДНК-молекулы, кодирующей белок L1 HPV45 или белки L1+L2 HPV45; (b) культивирование трансформированных таким образом дрожжей в условиях, которые делают возможными экспрессию рекомбинантной ДНК-молекулы для получения рекомбинантного белка HPV45; и (с) вытделение рекомбинантного белка HPV45 и получение VLP-частиц HPV45.
В предпочтительном варианте осуществления данного аспекта настоящего изобретения соответствующие дрожжи трансформируют кодон-оптимизированным геном L1 HPV45 для получения VLP-частиц HPV45. В наиболее предпочтительном варианте осуществления настоящего изобретения кодон-оптимизированный ген L1 HPV45 включает в себя последовательность нуклеотидов, представленную SEQ ID NO:1.
Настоящее изобретение обеспечивает также способ индукции у животного иммунной реакции, предусматривающий введение данному животному вирусоподобных частиц HPV45. В предпочтительном варианте осуществления настоящего изобретения данные VLP-частицы HPV45 получают с помощью кодон-оптимизированного гена.
Еще один аспект настоящего изобретения касается способа профилактики заболевания или лечения пациента с HPV-ассоциированным раком шейки матки, включающего в себя введение млекопитающему вакцины, содержащей VLP-частицы HPV45. В предпочтительном варианте осуществления данного аспекта настоящего изобретения VLP-частицы HPV45 получают в дрожжах.
Настоящее изобретение относится также к вакцине, содержащей вирусоподобные частицы (VLP) HPV45.
В альтернативном варианте осуществления данного аспекта настоящего изобретения указанная вакцина дополнительно включает VLP-частицы, по меньшей мере, одного дополнительного HPV-типа. В предпочтительном варианте осуществления настоящего изобретения, по меньшей мере, один указанный дополнительный HPV-тип выбран из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV51, HPV52, HPV55, HPV56, HPV58, HPV59 и HPV68.
В предпочтительном варианте осуществления данного аспекта настоящего изобретения указанная вакцина дополнительно содержит VLP-частицы HPV16.
В другом предпочтительном варианте осуществления настоящего изобретения указанная вакцина дополнительно содержит VLP-частицы HPV16 и VLP-частицы HPB18.
Еще в одном предпочтительном варианте осуществления настоящего изобретения указанная вакцина дополнительно содержит VLP-частицы HPV6, VLP-частицы HPV11, VLP-частицы HPV16 и VLP-частицы HPV18.
Настоящее изобретение относится также к фармацевтическим композициям, включающим в себя вирусоподобные частицы HPV45. Кроме того, настоящее изобретение относится к фармацевтическим композициям, включающим в себя VLP-частицы HPV45 и VLP-частицы, по меньшей мере, одного дополнительно HPV-типа. В предпочтительном варианте осуществления настоящего изобретения, по меньшей мере, один дополнительный HPV-тип выбран из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV51, HPV52, HPV55, HPV56, HPV58, HPV59 и HPV68.
Вакцинные композиции настоящего изобретения могут использоваться поодиночке в соответствующих дозах, установленных при рутинном тестировании для того, чтобы получить оптимальное подавление HPV45-инфекции, а также минимизировать любую потенциальную токсичность. Кроме того, может быть желательно также совместное или последовательное введение иных агентов.
Количество вирусоподобных частиц, которое вводят в вакцину для реципиента, зависит от иммуногенности экспрессируемого генного продукта. В большинстве случаев в мышечную ткань непосредственно вводят иммунологически или профилактически эффективную дозу около 10-100 мкг, и предпочтительно прямо в мышечную ткань вводят около 20-60 мкг VLP-частиц. Предполагаются также подкожная инъекция, внутрикожное введение, чрескожное воздействие и иные способы введения, такие как внутрибрюшинное, внутривенное или путем ингаляции. Предполагается также создание активных прививок. Преимуществом является также парентеральное введение, такое как внутривенное, внутримышечное, подкожное или иные способы введения с адъювантами, такими как квасцы или адъювант фосфат алюминия Merck, одновременно или с последующим парентеральным введением вакцины настоящего изобретения.
Все указанные здесь публикации включены в качестве ссылки с целью описания и раскрытия методов и материалов, которые могут быть использованы в связи с настоящим изобретением. Ничего из того, что здесь рассмотрено в качестве допущения, не дает права настоящему изобретению датировать такое раскрытие задним числом на основании предшествующего изобретения.
Описав предпочтительные варианты осуществления настоящего изобретения со ссылкой на прилагаемые чертежи, следует иметь в виду, что настоящее изобретение не ограничивается определенными вариантами его осуществления, и что специалистом в данной области техники могут быть осуществлены различные изменения и модификации, не выходящие за рамки объема или существа настоящего изобретения, которые определены в прилагаемой формуле изобретения.
Нижеследующие примеры иллюстрируют, но не ограничивают настоящее изобретение.
ПРИМЕР 1
Определение типичной L1-последовательности HPV45.
L1-последовательность HPV45 описана раньше (№ по каталогу в Genbank NC_001590; смотрите Delius and Hofmann Curr. Top. Microbiol. Immunol. 186:13-31 (1994)). Вместе с тем, нередко в полученных клинических изолятах среди молекул ДНК обнаруживают небольшие вариации последовательности. Для определения типичной последовательности L1 дикого типа HPV45 выделяли ДНК из четырех клинических образцов, в которых ранее показано наличие ДНК HPV45. Последовательности L1 HPV45 амплифицировали в полимеразной цепной реакции (ПЦР) с использованием ДНК Taq-полимеразы и следующих праймеров: F L1 HPV45 5'-CCACCACCACCTATATAGGTATTC-3' (SEQ ID NO:4) и B L1 HPV45 5'-CAAACATACATATATGTGCTAACA-3' (SEQ ID NO:5). Полученные амплифицированные продукты разделяли с помощью электрофореза в агарозных гелях и визуализировали путем окрашивания бромистым этидием. Из геля вырезали полосы L1 размером около 1500 п.н. и ДНК выделяли с использованием набора QUA для быстрого выделения очисткой продуктов ПЦР (Qiagen, Hilden, Германия). Затем выделенную ДНК лигировали с TA-клонирующим вектором (Invitrogen Corp., Carlsbad, CA), трансформировали E. coli с помощью данной лигирующей смеси, высевали на LB-ага