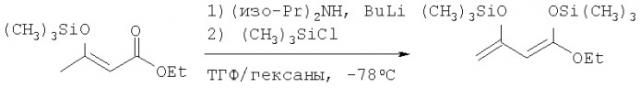Способ получения органических соединений
Иллюстрации
Показать всеНастоящее изобретение относится к новому способу получения соединения, отвечающего следующей формуле (S1):
включающий реакцию конденсации дисилилоксидиена, отвечающего формуле (II)
с альдегидом, отвечающего следующей формуле (Q1):
в присутствии катализатора на основе титана (IV) формулы (IV)
в инертном растворителе с получением 5(S)гидрокси-3-кетоэфира, отвечающего формуле (S1), в которой
R1 - необязательно замещенный алкил, циклоалкил или аралкил, a R2, R3, R4, R5, R6 и R7 независимо обозначают атом водорода или галогена, гидроксил, необязательно замещенный алкил, циклоалкил, арил, аралкил, гетероциклил, гетероаралкил, необязательно замещенный алкокси, арилокси, аралкокси, гетероциклоокси или гетероаралкокси; R8 обозначает (низш.)алкил; бинафтильный остаток характеризуется S-конфигурацией; R и R' независимо обозначают (низш.)алкил, где реакцию осуществляют при температуре между 10 и 60°С, более предпочтительно между 15 и 55°С.
Изобретение также относится к способу получения сложного 3(R),5(S)дигидроксиэфира, формулы (V1), к способам получения кальциевой соли, отвечающей формуле (W1), а также к способу получения соли щелочного металла, отвечающей формуле (X1). Технический результат - новый способ получения соединений формул (S1), (V1), (W1), (X1).
5 н. и 22 з.п. ф-лы, 2 табл.
Реферат
В одном варианте выполнения изобретения предлагается энантиоселективный способ получения соединений, отвечающих следующим формулам (S1), (S2) или (S3):
в которых
R1 независимо обозначает незамещенный или замещенный алкил, циклоалкил или аралкил, а
R2, R3, R4, R5, R6 и R7 независимо обозначают атом водорода или галогена, гидроксил, необязательно замещенный алкил, циклоалкил, арил, аралкил, гетероциклил, гетероаралкил, необязательно замещенный алкокси, арилокси, аралкокси, гетероциклоокси или гетероаралкокси.
Ниже перечислены определения различных понятий, использованных для описания соединений по настоящему изобретению. Эти определения применимы к использованным понятиям во всем описании, за исключением конкретных случаев, в которых они ограничены либо индивидуально, либо как часть более широкой группы.
Понятие "необязательно замещенный алкил" относится к незамещенным или замещенным прямоцепочечным или разветвленным углеводородным группам, содержащим от 1 до 20 углеродных атомов, предпочтительно от 1 до 7 углеродных атомов. Примеры незамещенных алкильных групп включают метил, этил, пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил, изогексил, гептил, 4,4-диметилпентил, октил и т.п. Замещенные алкильные группы включают, хотя ими их список не ограничен, алкильные группы, замещенные одним или несколькими из следующих групп: гало, гидроксил, циклоалкил, алкокси, алкенил, алкинил, алкилтио, алкилтионо, сульфонил, нитро, циано, алкоксикарбонил, арил, аралкокси, гетероциклил, включая индолил, имидазолил, фурил, тиенил, тиазолил, пирролидил, пиридил, пиримидил, пиперидил, морфолинил и т.п.
Понятие "низший алкил, соответственно (низш.)алкил" относится к тем алкильным группам, как они представлены выше, которые содержат от 1 до 7 углеродных атомов, предпочтительно от 1 до 4 углеродных атомов.
Понятие "атом галогена" или "гало" относится к атомам фтора, хлора, брома и иода.
Понятие "алкенил" относится к любой из вышеприведенных алкильных групп, содержащих по меньшей мере два углеродных атома и дополнительно содержащих по месту присоединения по меньшей мере одну углерод-углеродную двойную связь. Предпочтительны группы, содержащие от 2 до 4 углеродных атомов.
Понятие "алкинил" относится к любой из вышеприведенных алкильных групп, содержащих по меньшей мере два углеродных атома и дополнительно содержащих по месту присоединения по меньшей мере одну углерод-углеродную тройную связь. Предпочтительны группы, содержащие от 2 до 4 углеродных атомов.
Понятие "циклоалкил" относится к необязательно замещенным моноциклическим, бициклическим или трициклическим углеводородным группам, содержащим от 3 до 12 углеродных атомов, каждая из которых может быть замещена одним или несколькими заместителями, такими как алкил, гало, оксо-, гидроксил, алкокси, алкилтио, нитро, циано, алкоксикарбонил, сульфонил, гетероциклил и т.п.
Примеры моноциклических углеводородных групп включают, хотя ими их список не ограничен, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил и т.п.
Примеры бициклических углеводородных групп включают борнил, индолил, гексагидроиндолил, тетрагидронафтил, декагидронафтил, бицикло[2,1,1]гексил, бицикло[2,2,1]гептил, бицикло[2,2,1]гептенил, 6,6-диметилбицикло[3,1,1]гептил, 2,6,6-триметилбицикло[3,1,1]гептил, бицикло [2,2,2] октил и т.п.
Примеры трициклических углеводородных групп включают адамантил и т.п.
Понятие "алкокси" относится к алкил-O-.
Понятие "алкилтио" относится к алкил-S-.
Понятие "алкилтионо" относится к алкил-S(О)-.
Понятие "триалкилсилил" относится к (алкил)3Si-.
Понятие "триалкилсилилокси" относится к (алкил)3SiO-.
Понятие "алкилсульфонил" относится к алкил-S(O)2-.
Понятие "сульфонил" относится к алкилсульфонилу, арилсульфонилу, гетероарилсульфонилу, аралкилсульфонилу, гетероаралкилсульфонилу и т.п.
Понятие "арил" относится к моноциклическим или бициклическим ароматическим углеводородным группам, содержащим в кольцевом фрагменте от 6 до 12 углеродных атомов, таким как фенильная, нафтильная, тетрагидронафтильная и бифенильная (дифенильная) группы, каждая из которых может быть необязательно замещенной 1-4 заместителями, такими как алкил, гало, гидроксил, алкокси, ацил, тиол, алкилтио, нитро, циано, сульфонил, гетероциклил и т.п.
Понятие "моноциклический арил" относится к необязательно замещенному фенилу, такому как упомянутый в качестве примера арила.
Понятие "аралкил" относится к арильной группе, присоединенной непосредственно через алкильную группу, к такой как бензил.
Понятие "аралкилтио" относится к аралкил-S-.
Понятие "аралкокси" относится к арильной группе, присоединенной непосредственно через алкоксигруппу.
Понятие "арилсульфонил" относится к арил-S(O)2-.
Понятие "арилтио" относится к арил-S-.
Понятие "гетероциклил" или "гетероцикло-" относится к необязательно замещенной, полностью насыщенной или ненасыщенной, ароматической или неароматической циклической группе, которая, например, представляет собой 4-7-членную моноциклическую, 7-12-членную бициклическую или 10-15-членную трициклическую кольцевую систему, у которой имеется по меньшей мере один гетероатом в по меньшей мере одном содержащем углеродные атомы кольце. Каждое кольцо гетероциклической группы, содержащей гетероатом, может обладать 1, 2 или 3 гетероатомами, выбранными из атомов азота, атомов кислорода и атомов серы, где азотные и серные гетероатомы могут также быть необязательно окисленными. Гетероциклическая группа может быть присоединенной через гетероатом или углеродный атом.
Понятие "гетероарил" относится к ароматическому гетероциклу, например к моноциклическому или бициклическому арилу, такому как пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, фурил, тиенил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, бензотиазолил, бензоксазолил, бензотиенил, хинолинил, изохинолинил, бензимидазолил, бензофурил и т.п., необязательно замещенному, например, (низш.)алкилом, (низш.)алкокси или гало.
Понятие "гетероарилсульфонил" относится к гетероарил-S(O)2-.
Понятие "гетероаралкил" относится к гетероарильной группе, присоединенной через алкильную группу.
Соответственно, соединения, отвечающие формулам (S1), (S2) или (S3), могут быть получены вначале реакцией конденсации дисилилоксидиена, отвечающего формуле (II)
в которой
R1 независимо обозначает незамещенный или замещенный алкил, циклоалкил или аралкил, а
R и R' каждый обозначает (низш.)алкил, предпочтительно этил или метил, и
R и R' могут быть одинаковыми или разными,
с альдегидом, отвечающим следующим формулам (Q1), (Q2) или (Q3):
в которых R2, R3, R4, R5, R6 и R7 имеют такие же значения, как указанные для формул (S1), (S2) или (S3), в присутствии катализатора на основе титана (IV), отвечающего формуле (IV)
в которой R8 обозначает (низш.)алкил, а бинафтильный остаток характеризуется S-конфигурацией в инертном растворителе с получением соединений, отвечающих формулам (S1), (S2) или (S3), с высокими химическим выходом и энантиомерной чистотой.
В вышеописанной реакции альдольной конденсации молярное соотношение между дисилилоксидиеном формулы (II) и альдегидом, отвечающим формулам (Q1), (Q2) или (Q3), первоначально содержащимися в реакционной смеси, находится в интервале от 1:1 до 6:1, предпочтительно от 1:1 до 4:1, а более предпочтительно от 1,5:1 до 3:1.
Дисилилоксидиен формулы (II) может быть получен реакцией ацетоацетата, отвечающего формуле (VI)
в которой R1 независимо обозначает незамещенный или замещенный алкил, циклоалкил или аралкил; с силилирующим агентом, таким как
три((низш.)алкил)силилхлорид и
три((низш.)алкил)силилтрифторметансульфонат, предпочтительно
триметилсилилхлорид или триэтилсилилхлорид, в присутствии основания, такого как триэтиламин, диизопропилэтиламин и N-метилморфолин, предпочтительно триэтиламин, в органическом растворителе, таком как пентан, гексан, гептан, тетрагидрофуран, диэтиловый эфир и дихлорметан, предпочтительно гексан, при температуре в интервале от примерно -25 до примерно 30°С с получением силиленового простого эфира формулы (VII)
в которой
R1 независимо обозначает незамещенный или замещенный алкил, циклоалкил или аралкил, а
R обозначает (низш.)алкил.
Затем силиленовый эфир формулы (VII) может быть обработан основанием, таким как диизопропиламид лития или бис(триметилсилил)амид лития, натрия или калия, предпочтительно диизопропиламид лития, с последующим добавлением силилирующего агента, такого как три((низш.)алкил)силилхлорид и три((низш.)алкил)силилтрифторметансульфонат, предпочтительно триметилсилилхлорид или триэтилсилилхлорид, в инертном растворителе, таком как диэтиловый эфир и тетрагидрофуран, предпочтительно тетрагидрофуран, при температуре в интервале от примерно -40 до примерно -100°С с получением дисилилоксидиена формулы (II).
Диизопропиламид лития может быть получен in situ из диизопропиламина и н-бутиллития в условиях, хорошо известных в данной области техники, или так, как проиллюстрировано в примерах, приведенных в настоящем описании.
Молярное соотношение между катализатором на основе титана (IV) формулы (IV) и альдегидом формулы (II), первоначально содержащимися во время вышеописанной реакции альдольной конденсации, находится в интервале от 0,01:1 до 0,15:1, предпочтительно от 0,04:1 до 0,1:1.
Катализатор на основе титана (IV) формулы (IV) может быть приготовлен in situ реакцией Ti(OR8)4, где R8 обозначает (низш.)алкил, предпочтительно изопропил, с (S)-2,2'-бинафтолом формулы (VIII)
(S)-2,2'-бинафтол формулы (VIII) технически доступен, например на фирме Karlshamns под товарным знаком BINOL, а тетраалкоксиды титана (IV), предпочтительно тетраизопропоксид титана (IV), могут быть необязательно получены in situ из тетрахлорида титана и алкоксида натрия или лития, предпочтительно изопропоксида натрия или лития.
Вышеописанную реакцию альдольной конденсации можно проводить в полярном апротонном растворителе, таком как тетрагидрофуран, диэтиловый эфир и диметоксиэтан, предпочтительно тетрагидрофуран. Может быть также использовано сочетание растворителей. Реакционная температура может находиться в интервале от примерно 0 до примерно 70°С, предпочтительно от примерно 10 до примерно 60°С, а более предпочтительно от примерно 15 до примерно 55°С. Эту реакцию проводят в течение периода времени от примерно 1 ч до примерно 72 ч, предпочтительно от примерно 2 ч до примерно 24 ч.
Соединения, отвечающие формулам (S1), (S2) или (S3), для повышения энантиомерной чистоты можно, что необязательно, очищать с помощью физического или химического средства. Примеры такого средства для обогащения включают, хотя ими их список не ограничен, кристаллизацию и хиральную препаративную хроматографию, такую как жидкостная хроматография под высоким давлением (ЖХВД).
В другом варианте выполнения изобретения предлагается стереоселективный способ получения сложных син-3(R),5(S)дигидроксиэфиров восстановлением соединений формул (S1), (S2) или (S3). Сложные син-3(R),5(S)дигидроксиэфиры отвечают следующим формулам (V1), (V2) или (V3):
в которых
R1 независимо обозначает незамещенный или замещенный алкил, циклоалкил или аралкил, а
R2, R3, R4, R5, R6 и R7 независимо обозначают атом водорода или галогена,
гидроксил, необязательно замещенный алкил, циклоалкил, арил, аралкил,
гетероциклил, гетероаралкил, необязательно замещенный алкокси,
арилокси, аралкокси, гетероциклоокси или гетероаралкокси.
Стереоселективное восстановление соединений, отвечающих формулам (S1), (S2) или (S3), можно осуществлять в присутствии ди((низш.)алкил)метоксиборана, такого как диэтилметоксиборан и дибутилметоксиборан, предпочтительно диэтилметоксиборан, в полярном растворителе, таком как тетрагидрофуран и низший спирт, например метанол или этанол, или смесь этих растворителей, предпочтительно смесь тетрагидрофурана и метанола. Восстановитель, используемый на вышеупомянутой стадии восстановления, может быть выбран из группы гидридных реагентов, таких как боргидриды натрия и лития. В предпочтительном варианте восстановителем является боргидрид натрия. Реакцию можно проводить при температуре в интервале от примерно -20 до примерно -100°С, предпочтительно от примерно -50 до примерно -80°С.
В другом варианте выполнения изобретения предлагаются способы получения кальциевых солей, отвечающих следующим формулам (W1), (W2) или (W3):
в которых R2, R3, R4, R5, R6 и R7 независимо обозначают атом водорода или галогена, гидроксил, необязательно замещенный алкил, циклоалкил, арил, аралкил, гетероциклил, гетероаралкил, необязательно замещенный алкокси, арилокси, аралкокси, гетероциклоокси или гетероаралкокси.
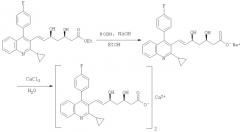
Кальциевые соли формул (W1), (W2) или (W3) могут быть получены вначале гидролизом соединений формул (V1), (V2) или (V3) в присутствии водного основания с получением соответствующих солей щелочных металлов, отвечающих следующим формулам (X1), (Х2) или (Х3):
в которых R2, R3, R4, R5, R6 и R7 независимо обозначают атом водорода или галогена, гидроксил, необязательно замещенный алкил, циклоалкил, арил, аралкил, гетероциклил, гетероаралкил, необязательно замещенный алкокси, арилокси, аралкокси, гетероциклоокси или гетероаралкокси; а М обозначает натрий, литий или калий, предпочтительно натрий.
Вышеупомянутую стадию гидролиза можно осуществлять в органическом растворителе, таком как низший спирт, предпочтительно этанол, а основания, используемые во время указанного гидролиза, в предпочтительном варианте выбирают из водного гидроксида калия, водного гидроксида лития и водного гидроксида натрия. В более предпочтительном варианте основанием служит гидроксид натрия. В предпочтительном варианте гидролиз проводят при температуре в интервале от примерно -10 до примерно 30°С, предпочтительно от примерно 0 до примерно 25°С.
Затем соли щелочных металлов, отвечающих формулам (X1), (Х2) или (Х3), могут быть превращены в соответствующие кальциевые соли формулам (W1), (W2) или (W3) реакцией водного раствора соли щелочного металла формулам (X1), (Х2) или (Х3) с водным раствором приемлемого источника кальция при температуре окружающей среды, предпочтительно при комнатной температуре. Приемлемые источники кальция включают, хотя ими их список не ограничен, хлорид кальция, оксид кальция и гидроксид кальция.
По другому варианту кальциевые соли формулам (W1), (W2) или (W3) могут быть получены вначале циклизацией соединений формулы (V1), (V2) или (V3) в присутствии кислоты и апротонного смешивающегося с водой растворителя с получением соответствующего лактона, отвечающего следующим формулам (Y1), (Y2) или (Y3):
и его кислотно-аддитивных солей;
где R2, R3, R4, R5, R6 и R7 независимо обозначают атом водорода или галогена, гидроксил, необязательно замещенный алкил, циклоалкил, арил, аралкил, гетероциклил, гетероаралкил, необязательно замещенный алкокси, арилокси, аралкокси, гетероциклоокси или гетероаралкокси.
Вышеупомянутую циклизацию можно проводить в присутствии кислоты, такой как трифторуксусная кислота или сильная минеральная кислота, предпочтительно концентрированная соляная кислота, в апротонном смешивающемся с водой растворителе, таком как тетрагидрофуран и ацетонитрил, предпочтительно ацетонитрил, при температуре в интервале от 0 до 25°С. Лактоны формул (Y1), (Y2) или (Y3) и их кислотно-аддитивные соли, предпочтительно их гидрохлоридные соли, могут включать небольшие количества непрореагировавшего исходного материала формул (V1), (V2) или (V3) и соответствующую кислоту, отвечающую следующим формулам (Z1), (Z2) или (Z3):
и ее кислотно-аддитивные соли, предпочтительно ее гидрохлоридные соли; где R2, R3, R4, R5, R6 и R7 независимо обозначают атом водорода или галогена, гидроксил, необязательно замещенный алкил, циклоалкил, арил, аралкил, гетероциклил, гетероаралкил, необязательно замещенный алкокси, арилокси, аралкокси, гетероциклоокси или гетероаралкокси.
Далее лактоны формул (Y1), (Y2) или (Y3), их загрязняющие примеси и их кислотно-аддитивные соли можно превращать в соответствующие кальциевые соли формул (W1), (W2) или (W3) аналогично тому, как это изложено выше в настоящем описании для соединений формул (V1), (V2) или (V3) или их модификаций.
В одном варианте выполнения изобретения кальциевая соль представляет собой кальцийпитавастатин.
Способы, представленные в настоящем описании выше, осуществляют в инертной атмосфере, предпочтительно в азотной атмосфере. Объем изобретения включает применение молекулярного сита во время получения соединений по изобретению, преимущественно на стадии реакции конденсации дисилилоксидиена с альдегидом формул (Q1), (Q2) или (Q3) в присутствии катализатора на основе титана (IV). Перед использованием молекулярного сита к этому молекулярному ситу можно, что необязательно, добавлять воды. В одном варианте предпочтительное содержание воды в молекулярном сите составляет от примерно 1 до примерно 15 мас.%, более предпочтительно от примерно 2,6 до примерно 10 мас.%, в пересчете на общую массу катализатора на основе титана (IV).
Типы реактора, применяемого для получения соединений по изобретению, включают реакторы периодического, непрерывного и полунепрерывного действия. Объем изобретения включает получение соединений в реакторе с внешней рециркуляцией, которая позволяет: (I) проводить предварительную обработку или последующую обработку in-situ твердых молекулярных сит, (II) по завершении реакции удалять молекулярные сита фильтрованием и (III) легко повторно использовать молекулярные сита, предоставляя возможность проведения циклического процесса.
Содержащиеся в исходных соединениях и промежуточных продуктах, которые превращают в соединения по изобретению в соответствии с изложенным в настоящем описании, функциональные группы, такие как амино-, тиоловая, карбоксильная и гидроксильная группы, необязательно защищают обычными защитными группами, которые общепризнаны в препаративной органической химии. Защитные амино-, тиоловая, карбоксильная и гидроксильная группы представляют собой те группы, которые в мягких условиях можно превращать в свободные амино-, тиоловую, карбоксильную и гидроксильную группы без разрушения молекулярного каркаса или протекания других нежелательных побочных процессов.
Целью введения защитных групп является защита функциональных групп от нежелательных реакций с реакционными компонентами в условиях, используемых для проведения целевого химического превращения. Необходимость и выбор защитных групп для конкретной реакции специалистам в данной области техники известны и зависят от природы той функциональной группы, которая должна быть защищена (гидроксильная группа, аминогруппа и т.д.), строения и стабильности молекулы, частью которой является заместитель, и реакционных условий. Хорошо известные защитные группы, которые удовлетворяют этим условиям, и их введение и удаление описаны, например, в работах McOmie "Protective Groups in Organic Chemistry", Plenum Press, Лондон, Нью-Йорк (1973), и Greene "Protective Groups in Organic Synthesis", Wiley, Нью-Йорк (1991).
Соединения по изобретению могут быть получены с высокой энантиомерной чистотой, причем для достижения этого отсутствует потребность в разделении. Используемое в настоящем описании понятие "высокая энантиомерная чистота" или "энантиоселективность" означает по меньшей мере 70%-ную оптическую чистоту, предпочтительно по меньшей мере 80%-ную оптическую чистоту, наиболее предпочтительно по меньшей мере 97%-ную оптическую чистоту.
Соединения по изобретению особенно эффективны при лечении или профилактике атеросклероза. В одном варианте выполнения изобретения эти соединения ингибируют фермент 3-гидрокси-3-метилглутарил кофермент А (HMG-CoA) редуктазу, который идентифицирован как фермент, лимитирующий скорость в процессе биосинтеза холестерина.
Следующие примеры предназначены для иллюстрации сущности изобретения, поэтому их не следует рассматривать как ограничивающие его объем. Температуры приведены в градусах Цельсия. Во всех случаях, если не указано иное, все процессы выпаривания проводят под пониженным давлением, предпочтительно в пределах примерно 15 и 100 мм рт.ст. (т.е. от 20 до 133 мбар). Строение конечных продуктов, промежуточных продуктов и исходных материалов подтверждают по стандартным методам анализов, например микроанализом, по температуре плавления (tпл) и спектроскопическими характеристиками, в частности МС, ИК и ЯМР. Использованы те аббревиатуры, которые обычны в данной области техники.
Пример 1
Получение этилового эфира 3-триметилсиланилоксибут-2-еновой кислоты
Раствор 31,9 мл (0,25 моля) этилацетоацетата при комнатной температуре перемешивают в гексане (350 мл). Добавляют триэтиламина (42 мл, 0,30 моля) с последующим добавлением по каплям триметилсилилхлорида (35 мл, 0,276 моля), поддерживая температуру массы с помощью водяной бани (примерно 18°С) ниже 25°С. Густую белую суспензию перемешивают при комнатной температуре в течение ночи. Далее добавляют 200 мл гексана и смесь перемешивают на ледяной бане в течение 1 ч. Смесь фильтруют и твердые частицы промывают 50 мл холодного гексана. Выпариванием объединенных фильтрата и промывных жидкостей в виде бесцветного слегка мутного масла получают 46 г этилового эфира 3-триметилсиланилоксибут-2-еновой кислоты. Этот материал используют без дальнейшей очистки на следующей стадии.
Пример 2
Получение 1-этокси-1,3-бис-триметилсиланилоксибута-1,3-диена
В азотной атмосфере 600 мл безводного тетрагидрофурана и 38 мл диизопропиламина (0,271 моля) охлаждают до -5°С. Добавляют 121 мл 2,5 М н-бутиллития (в гексане), одновременно поддерживая температуру массы на уровне -3±3°С. Затем смесь на ацетоновой бане с сухим льдом охлаждают до -78°С. Добавляют 45,2 г (0,22 моля) соединения примера 1, этилового эфира 3-триметилсиланилоксибут-2-еновой кислоты, поддерживая температуру массы ниже -70°С. После перемешивания в течение 25 мин добавляют 44 мл триметилсилилхлорида (0,347 моля), одновременно поддерживая температуру массы ниже -70°С. Затем смеси дают нагреться до комнатной температуры. После выпаривания растворителей остаток перемешивают в 250 мл гексана, охлаждают с помощью ледяной бани и перемешивают в течение 1 ч с последующим фильтрованием для удаления твердых частиц. Фильтрат выпаривают с получением в виде желтого масла 64,7 г 1-этокси-1,3-бистриметилсиланилоксибута-1,3-диена, который используют без дальнейшей очистки на следующей стадии. Этот материал защищают от влаги и хранят в морозильной камере (-35°С).
Пример 3
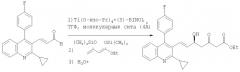
Получение этилового эфира (Е)-(5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты
Метод 1
В сухую 500-миллилитровую колбу в азотной атмосфере загружают 25,4 г (Е)-3-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]пропеналя, полученного в соответствии со способом, описанным в работе "Synthesis and Biological Evaluations of Quinoline-based HMG-CoA Reductase Inhibitors", Bioorganic Med. Chem., том 9, сс.2727-2743 (2001), 0,080 моля, 0,91 г продукта (5)-BINOL (4 мольных %) и 5 г молекулярных сит (4Å, активированный порошок). Добавляют 200 мл безводного тетрагидрофурана и смесь перемешивают в течение 40 мин, затем по каплям добавляют 0,95 мл (4 мольных%) изопропоксида титана (IV). Смесь сразу же становится темно-красной. После перемешивания в течение 30 мин при комнатной температуре в течение 10 мин по каплям добавляют 39,2 г (примерно 44 мл, 0,143 моля) соединения примера 2, 1-этокси-1,3-бистриметилсиланилоксибута-1,3-диена. Для поддержания температуры массы ниже 25°С колбу содержат на водяной бане с температурой 18°С. Смесь перемешивают при комнатной температуре и за исчезновением (E)-3-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]пропеналя следят с помощью ТСХ (33% этилацетата/гексан, Rf альдегида: 0,65). В зависимости от количества используемого катализатора продолжительность реакции варьируют в пределах от 1 до 72 ч. После завершения реакции добавляют 50 мл воды и смесь охлаждают на ледяной бане, после чего добавляют 10 мл трифторуксусной кислоты/воды в объемном соотношении 1:1. Смеси дают нагреться до комнатной температуры в течение примерно 30 мин. По прошествии этого времени десилилирование завершается, о чем судят с помощью ТСХ (при исчезновении силилоксиальдольного аддукта Rf: 0,75, при появлении десилилированного продукта Rf: 0,22). Смесь загружают в колбу с быстро вращающейся мешалкой, содержащую 400 мл этилацетата и 100 мл насыщенного водного бикарбонат натрия. После перемешивания в течение 5 мин смесь фильтруют для удаления молекулярных сит. Органический слой отделяют и промывают рассолом, сушат над безводным сульфатом натрия и фильтруют. После удаления растворителя выпариванием с целью вызвать выпадение осадка в полученный продукт в виде масла в течение 45 мин добавляют примерно 150 мл гексана. Смесь перемешивают на ледяной бане в течение дополнительных 45 мин. Осажденные твердые частицы собирают фильтрованием под вакуумом, промывают холодным гексаном и сушат в течение ночи под вакуумом при 35°С с получением 33,8 г (94%-ный выход) этилового эфира (E)-(5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты 97,4%-ной оптической чистоты (ЖХВД: Chiralpak AD; элюент: гексан/изо-PrHO 94/6; скорость потока 1 мл/мин.; УФ при 254 нм).
Метод 2
В азотной атмосфере в сухую 1000-миллилитровую колбу загружают 1,44 г продукта (S)-BINOL, 14,8 г порошка молекулярных сит 4Å (предварительно выдержанного в течение по меньшей мере 24 ч в обычной конвекционной сушилке при 110°С) и 210 мл безводного тетрагидрофурана. Смесь перемешивают при 20±2°С в течение примерно 15 мин, затем по каплям добавляют 1,49 мл изопропоксида титана (IV) и темно-красную смесь нагревают до 50±1°С и перемешивают в течение 30 мин, затем вновь охлаждают до 20±2°С. В виде твердого вещества добавляют 32,0 г (2E)-3-{2-циклопропил-4-(4-фторфенил)хинолин-3-ил}-2-пропеналя и смесь перемешивают в течение 10 мин. Затем пятью порциями добавляют 64,6 г (примерно 71 мл) соединения примера 2, 1-этокси-1,3-бистриметилсиланилоксибута-1,3-диена, причем каждую порцию добавляют в течение примерно 5 мин (слабоэкзотермическая реакция) и перед добавлением следующей порции ожидают в течение 30 мин. Температуру массы поддерживают на уровне 20±2°С. За исчезновением альдегида следят с помощью ТСХ (гексан/EtOAc в объемном соотношении 2:1, Rf альдегида 0,65). Когда реакция завершается, смесь охлаждают с помощью ледяной бани и добавляют 40 мл водной трифторуксусной кислоты объемной концентрации 20%. Смесь нагревают до комнатной температуры. Спустя 30 мин десилилирование с помощью ТСХ оценивают как полное (при исчезновении силилоксиальдольного аддукта Rf 0,75, при появлении десилилированного продукта Rf 0,22). Смесь охлаждают с помощью ледяной бани и добавляют 80 г 25%-ной по объему водной фосфорной кислоты (экзотермическая реакция), одновременно поддерживая температуру массы ниже 25°С. Смесь перемешивают в течение 3 ч, затем слои разделяют. Водный слой экстрагируют 210 мл трет-бутилметилового эфира, а органические слои объединяют и промывают 4 порциями по 150 мл 10%-ного водного хлорида натрия. Растворители удаляют выпариванием в роторном растворителе, а полученный продукт в виде масла растворяют в 150 мл н-бутанола и выпаривают под пониженным давлением. Этот процесс повторяют с использованием дополнительных 150 мл н-бутанола с выделением этилового эфира (Е)-(5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты 99,3%-ной оптической чистоты (ЖХВД: Chiralpak AD; элюент: гексан/изо-PrHO 94/6; скорость потока 1 мл/мин; УФ при 254 нм). Этот продукт можно использовать на следующей стадии без дальнейшей очистки.
Существует возможность готовить порошок молекулярных сит 4Å при других температурах, а также добавлять соответствующее количество воды в ТГФ раствор продукта (S)-BINOL и молекулярных сит (МС) с целью доведения содержания воды до целевого интервала. Влияние на оптическую чистоту этих факторов, а также соотношения между МС и продуктом (S)-BINOL продемонстрировано в следующей таблице:
| Приготовление МС | Массовое соотношение МС/продукт (S)-BINOL | Оптическая чистота, % |
| Выдержка в печи при 110°С в течение >24 ч | 2,6 | 89,4 |
| Приобретенное техническое активированное МС | 4,2 | 95,8 |
| Приготовление МС | Массовое соотношение МС/продукт (S)-BINOL | Оптическая чистота, % |
| Выдержка в печи при 140°С в течение >24 ч | 4,2 | 97,6 |
| Выдержка в печи при 110°С в течение >24 ч | 4,2 | 98,4 |
| Выдержка в печи при 65°С в течение >24 ч | 4,2 | 98,4 |
| Выдержка в печи при 110°С в течение >24 ч | 4,8 | 98,7 |
| Выдержка в печи при 110°С в течение >24 ч | 10 | 99,0-99,6 |
| МС, высушенное до содержания воды 6,1 мас.% при 125°С в сухом N2 | 10 | 96,4 |
| МС, высушенное до содержания воды 8,9 мас.% при 125°С в сухом N2 | 10 | 98,5 |
| МС с содержанием Н2О 6,1 мас.% и добавленной Н2О в количестве 6,1 мас.% | 10 | 98,9 |
Метод 3
В аргоновой атмосфере в сухую 350-миллилитровую колбу загружают 0,92 г продукта (S)-BINOL (5 мольных %), 9,24 г относительно сухих молекулярных сит (активированный порошок с размерами пор 4Å; содержание воды 1,0%) и 130 мл водного тетрагидрофурана, содержащего 462 мкл воды. Эту смесь перемешивают при температуре от 20 до 25°С в течение 1 ч, затем по каплям добавляют 0,96 мл изопропоксида титана (IV) (5 мольных %) и темно-красную смесь нагревают до 50±1°С и перемешивают в течение 30 мин, затем вновь охлаждают до 20±2°С. В виде твердого вещества добавляют 20 г (2Е)-3-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-2-пропеналя (0,063 моля) и смесь перемешивают в течение 10 мин. Далее семью порциями добавляют 56,56 г (примерно 62 мл, 0,206 моля) соединения примера 2, 1-этокси-1,3-бистриметилсиланилоксибута-1,3-диена, причем каждую порцию добавляют в течение примерно 5 мин (слабоэкзотермическая реакция) и перед добавлением следующей порции ожидают в течение 30 мин. Температуру массы поддерживают на уровне 20±2°С. За исчезновением альдегида следят с помощью ТСХ (гексан/EtOAc в объемном соотношении 2:1, Rf альдегида 0,65). Когда реакция завершается, смесь охлаждают на ледяной бане и в течение 10 мин добавляют 150 г 25%-ной водной фосфорной кислоты (экзотермическая реакция), одновременно поддерживая температуру массы ниже 25°С. Смесь перемешивают в течение 1 ч при температуре от 20 до 25°С. Десилилирование с помощью ТСХ оценивают как полное (при исчезновении силилоксиальдольного аддукта Rf 0,75, при появлении десилилированного продукта Rf 0,22). После этого слои разделяют. Органический слой экстрагируют 87 г 25%-ной водной фосфорной кислоты. Объединенные водные слои экстрагируют 2 порциями по 130 мл трет-бутилметилового эфира и органические слои объединяют и промывают 4 порциями по 76 мл 10%-ного водного хлорида натрия. Растворители выпаривают под пониженным давлением, полученный продукт в виде масла растворяют в 100 мл н-бутанола и раствор выпаривают вновь под пониженным давлением. Этот процесс повторяют с использованием дополнительных 100 мл н-бутанола с получением 49,4 г маслянистого остатка. К этому веществу в виде масла добавляют 247 г гептановой фракции, смесь нагревают до 45°С±1°С и перемешивают в течение 1 ч. После охлаждения до температуры от 0 до 5°С смесь перемешивают при этой температуре в течение еще одного часа. Осажденные твердые частицы собирают фильтрованием под вакуумом, промывают 2 порциями по 30 мл гептановой фракции и сушат в течение ночи под вакуумом при 60°С с получением 26,3 г (89%-ный выход) этилового эфира (Е)-(5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты 99,7%-ной оптической чистоты (ЖХВД: Chiralpak AD-H; элюент: н-гексан/этанол 90/10; скорость потока 1,0 мл/мин; Т 30°С; УФ определение при 244 нм) и 95,7%-ной химической чистоты (ЖХВД: YMC-Pack ODS-AQ; элюент: 0,01 М водный раствор аммонийацетата/ацетонитрила 45/55; скорость потока 0,7 мл/мин; Т 60°С; УФ определение при 245 нм).
Пример 4
Получение этилового эфира (Е)-(3R,5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3,5-дигидроксигепт-6-еновой кислоты
В сухую 1-литровую колбу на ацетоновой бане с сухим льдом в азотной атмосфере добавляют 4,16 г боргидрида натрия (0,11 моля) и 300 мл тетрагидрофурана. После того как температура содержимого становится ниже -70°С, смесь перемешивают в течение примерно 30 мин. В течение примерно 10 мин по каплям добавляют 10,8 мл диэтилметоксиборана (0,082 моля). Смесь перемешивают в течение 15 мин, затем по каплям в течение примерно 30 мин добавляют раствор 30 г соединения примера 3, этилового эфира (E)-(5S)-7-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-5-гидрокси-3-оксогепт-6-еновой кислоты (метод 1, 0,067 моля), в 60 мл тетрагидрофурана и 100 мл метанола, поддерживая температуру содержимого ниже -70°С. Спустя 30 мин смесь нагревают до комнатной температуры и добавляют в колбу с быстро вращающейся мешалкой, содержащую 200 мл насыщенного водного бикарбоната натрия и 400 мл этилацетата. После перемешивания слои разделяют. Органический раствор концентрируют и остаток растворяют в 400 мл этилацетата, в который медленно добавляют 70 мл водного пероксида водорода концентрацией 30 мас.%, используя охлаждающую баню для поддержания температуры содержимого ниже 25°С. После перемешивания в течение 1 ч при комнатной температуре перемешивание прерывают и слои разделяют. Органический слой промывают 150 мл насыщенного раствора сульфита натрия, после чего 150 мл рассола, в который добавляют 15 мл насыщенного водного бикарбонат натрия. После выпаривания растворителей из органического слоя полученный продукт в виде масла перегоняют с толуолом, а затем с гептаном с получением сырого вещества в виде масла 97,2%-ной оптической чистоты (ЖХВД: Chiralpak AD; элюент: гексан/изо-PrHO 94/6; скорость потока 1 мл/мин; УФ при 254 нм). Это вещество в виде масла при 45°С растворяют в 330 мл циклогексана/метил-трет-бутилового эфира в объемном соотношении 90:10. Охлаждение до комнатной температуры и перемешивани