Нейтрализующие антитела против gdf-8 и их применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано в медицине. В данном изобретении получены новые антитела и фрагменты антител человека, которые специфически связываются с GDF-8 и ингибируют его активность in vitro и/или in vivo. На основании данного изобретения создана фармацевтическая композиция, которая может быть использована для диагностики, профилактики или лечения дегенеративных нарушений мышцы или кости или нарушений метаболизма инсулина. Данное изобретение расширяет ассортимент арсенала технических средств, используемых при лечении заболеваний, связанных с мышечной, костной тканью или метаболизмом инсулина. 11 н. и 30 з.п. ф-лы, 12 ил., 3 табл.
Реферат
По данной заявке испрашивается приоритет по предварительной заявке на выдачу патента Соединенных Штатов Америки №60/419964, поданной 22 октября 2002 года, которая полностью включена в настоящее описание в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Область техники относится к антителам против фактора-8 роста и дифференцировки (GDF-8), в частности антителам человека и фрагментам антител, в частности к антителам и фрагментам антител, которые ингибируют активность GDF-8 in vitro и/или in vivo. Эта область дополнительно относится к диагностике, профилактике или лечению дегенеративных нарушений мышцы или кости или нарушений метаболизма инсулина.
УРОВЕНЬ ТЕХНИКИ
Фактор-8 роста и дифференцировки (GDF-8), также известный как миостатин, является секретируемым белком и является членом надсемейства трансформирующего фактора роста бета (TGF-β) структурно родственных факторов роста, каждый из которых имеет физиологически важные регулирующие рост и морфогенетические свойства (Kingsley et al. (1994) Genes Dev., 8:133-146; Hoodless et al. (1998 Curr. Topics Microbiol. Immunol., 228:235-272). Подобно TGF-β, GDF-8 человека синтезируется в виде белка-предшественника размером 375 аминокислот. Этот белок-предшественник GDF-8 образует гомодимер. Во время процессинга аминоконцевой пропептид отщепляется при Arg-266. Этот отщепленный пропептид, известный как «ассоциированный с латентностью пептид» (LAP), может оставаться нековалентно связанным с гомодимером, инактивируя посредством этого этот комплекс (Miyazono et al. (1988) J.Biol. Chem., 263:6407-6415; Wakefield et al. (1988) J.Biol. Chem., 263:7646-7654; Brown et al. (1990 Growth Factors, 3:35-43 и Thies et al. (2001) Growth Factors, 18: 251-259). Комплекс зрелого GDF-8 с пропептидом обычно называют «малым латентным комплексом» (Gentry et al. (1990) Biochemistry, 29:6851-6857; Derynck et al. (1995) Nature, 316:701-705 и Massague (1990) Ann. Rev. Cell Biol., 12:597-641). Известно, что другие белки также связывают зрелый GDF-8 и ингибируют его биологическую активность. Такие ингибиторные белки включают в себя фоллистатин и фоллистатин-родственные белки (Gamer et al. (1999) Dev. Biol., 208:222-232).
Сопоставление расшифрованных аминокислотных последовательностей из различных видов демонстрирует, что GDF-8 является высококонсервативным в ходе эволюции (McPherron et al. (1997) Proc. Natl. Acad. Sci. USA, 94:12457-12461). Действительно, последовательности GDF-8 человека, мыши, крысы, свиньи и курицы являются на 100% идентичными в С-концевом районе, тогда как в случае павиана, коровы и овцы они различаются только 3 аминокислотами. GDF-8 зубастого карася является наиболее дивергентным; однако он идентичен на 88% GDF-8 человека.
Высокая степень сохранения предполагает, что GDF-8 имеет важную функцию. GDF-8 экспрессируется в высокой степени в развивающейся и зрелой скелетной мышце, и было обнаружено, что он участвует в регуляции критических биологических процессов в мышце и в остеогенезе. Например, трансгенные мыши с выключенным GDF-8 характеризуются ярко выраженной гипертрофией и гиперплазией скелетных мышц (McPherron et al. (1997) Nature, 387:83-90) и измененной структурой кортикального слоя костей (Hamrick et al. (2000) Bone, 27(3):343-349). Сходные увеличения массы скелетных мышц обнаруживаются в природно встречающихся мутациях GDF-8 у крупного рогатого скота (Ashmore et al. (1974) Growth, 38:501-507; Swatland et al. (1994) J.Anim. Sci., 38:752-757; McPherron et al. (1997) Proc. Natl. Acad. Sci. USA, 94:12457-12461 и Kambadur et al. (1997) Genome Res., 7:910-915). Исследования показали, что мышечное истощение, ассоциированное с ВИЧ-инфекцией, сопровождается увеличением экспрессии GDF-8 (Gonzalez-Cadavid et al., (1998) Proc. Natl. Acad. Sci. USA, 95:14938-14943). Предполагалось также, что GDF-8 участвует в продуцировании специфических для мышц ферментов (например, креатинкиназы) и пролиферации миобластных клеток (WO 00/43781). Считается, что кроме его регулирующих рост и морфогенетических свойств GDF-8 участвует также в ряде других физиологических процессов, в том числе гомеостазе глюкозы в развитии диабета типа 2, нарушенной толерантности к глюкозе, метаболических синдромах (например, синдроме Х), инсулинорезистентности, вызываемой травмой, такой как ожоги или нарушение азотного баланса, и нарушениях жировой ткани (например, ожирении) (Kim et al. (2001) BBRC, 281:902-906).
Ряд нарушений у человека и животных ассоциированы с функционально нарушенной мышечной тканью, например мышечная дистрофия (в том числе мышечная дистрофия Дюшенна), боковой амиотрофический склероз, мышечная атрофия, атрофия органов, хрупкость, хроническая обструктивная болезнь легких, саркопения, кахексия и синдромы мышечного истощения, вызываемые другими заболеваниями и состояниями. До настоящего времени очень мало надежных или эффективных способов терапии было разработано для лечения этих нарушений.
Имеется ряд состояний, ассоциированных с разрежением кости, которые включают в себя остеопороз и остеоартрит, в частности, у пожилых и/или постклимактерических женщин. Кроме того, метаболические костные заболевания и нарушения включают в себя низкую костную массу вследствие продолжительной глюкокортикоидной терапии, преждевременную недостаточность половых желез, супрессию андрогенов, недостаточность витамина D, вторичный гиперпаратиреоз, нарушения питания и нервно-психическую анорексию. Доступные в настоящее время терапии для этих состояний действуют посредством ингибирования резорбции кости. Желательной альтернативой этим терапиям была бы терапия, которая стимулирует новообразование кости.
Таким образом, существует потребность в разработке новых способов лечения, которые способствуют общему увеличению мышечной массы и/или прочности и/или плотности костей, в частности, человека.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одними объектами данного изобретения являются безопасные и эффективные способы лечения ассоциированных с мышцами и/или костями нарушений.
Другими объектами данного изобретения являются способы увеличения мышечной массы и/или прочности и/или плотности костей у позвоночных животных.
Еще одними объектами данного изобретения являются ингибиторы GDF-8, которые являются безопасными и эффективными in vivo.
Другими объектами данного изобретения являются антитела человека и их фрагменты, которые связывают GDF-8 с высокой специфичностью и аффинностью.
Таким образом, раскрыты способы лечения дегенеративных нарушений мышц и кости. Эти способы применимы также для увеличения мышечной массы и плотности костей у здоровых животных. Обеспечены также новые анти-GDF-8-антитела человека, названные Myo29, Myo28 и Myo22, и произведенные из них антитела и антигенсвязывающие фрагменты. Антитела данного изобретения имеют ряд полезных свойств. Во-первых, эти антитела способны связывать зрелый GDF-8 с высокой аффинностью. Во-вторых, описанные антитела ингибируют активность GDF-8 in vitro и in vivo, как показано, например, ингибированием связывания ActRIIB и анализами с использованием репортерных генов. В-третьих, описанные антитела могут ингибировать активность GDF-8, ассоциированную с отрицательной регуляцией массы скелетных мышц и плотности костей.
Некоторые варианты осуществления данного изобретения содержат VH- и/или VL-домен Fv-фрагмента Myo29, Myo28 или Myo22. Дополнительные варианты осуществления содержат один или несколько определяющих комплементарность районов (CDR) любого из этих VH- и/или VL-доменов Myo29, Myo28 или Myo22.
Другие аспекты обеспечивают композиции, содержащие антитела данного изобретения или их антигенсвязывающие фрагменты, и их применение в способах ингибирования или нейтрализации GDF-8, в том числе способах лечения человека или животных. Антитела данного изобретения могут быть использованы для лечения или предупреждения состояний, при которых желательным является увеличение мышечной ткани или плотности костей. Например, описанные здесь антитела могут быть использованы в способах лечения для восстановления поврежденной мышцы, например, миокарда, диафрагмы и т.д. Примеры заболеваний и нарушений включают в себя мышечные и нервно-мышечные нарушения, такие как мышечная дистрофия (в том числе мышечная дистрофия Дюшенна); боковой амиотрофический склероз; мышечную атрофию; атрофию органов; хрупкость; синдром канала запястья; хроническую обструктивную болезнь легких; саркопению, кахексию и другие синдромы мышечного истощения; нарушения жировой ткани (например, ожирение); диабет типа 2; нарушенную толерантность к глюкозе; метаболические синдромы (например, синдром Х); инсулинорезистентность, индуцированную травмой, такой как ожоги или нарушения азотного баланса; и костные дегенеративные заболевания (например, остеоартрит и остеопороз).
Кроме того, описанные в настоящее время антитела могут быть использованы в качестве диагностического инструмента для количественного или качественного детектирования GDF-8 или его фрагментов в биологическом образце. Детектированное присутствие или количество GDF-8 может коррелировать с одним или несколькими медицинскими состояниями, перечисленными выше.
Другой аспект относится к выделенной нуклеиновой кислоте, которая содержит последовательность, кодирующую VH- или VL-домен из Fv-фрагмента Myo29, Myo28 или Myo22. Описана также выделенная нуклеиновая кислота, которая содержит последовательность, кодирующую по меньшей мере один CDR из любого из описанных в настоящее время VH- и VL-доменов. Другой аспект относится к клеткам-хозяевам, содержащим такую нуклеиновую кислоту.
Еще один аспект относится к способу получения новых VH- и VL-доменов и/или функциональных антител, содержащих все домены или часть таких доменов, произведенных из VH- или VL-доменов Myo29, Myo28 или Myo22.
Дополнительные цели данного изобретения будут изложены частично в следующем далее описании, а частично будут очевидными из данного описания, или могут быть определены при применении данного изобретения на практике. Различные цели, аспекты и преимущества данного изобретения будут поняты и достигнуты с использованием элементов и комбинаций, конкретно указанных в прилагаемой формуле изобретения.
Следует понимать, что как предыдущее общее описание, так и последующее подробное описание носят только примерный и разъясняющий характер и не ограничивают данное изобретение, которое заявлено в формуле изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
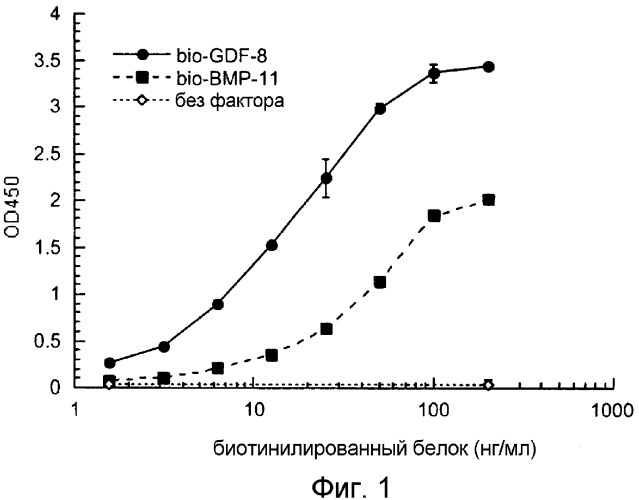
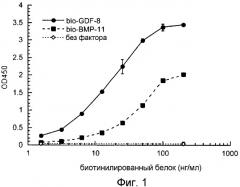
На фиг.1 показано, что биотинилированные GDF-8 и ВМР-11 связывают рецептор ActRIIB с ED50 15 нг/мл и 40 нг/мл, соответственно.
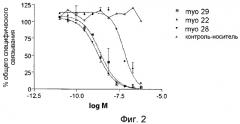
На фиг.2 показано ингибирование связывания GDF-8 с рецептором ActRIIB scFv-фрагментами данного изобретения. Как показано, IC50 для scFv Myo29, Myo28 и Myo22 равны 2,4 нМ, 1,7 нМ и 60 нМ, соответственно.
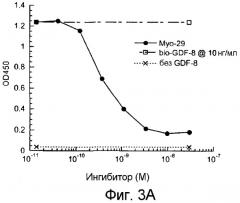
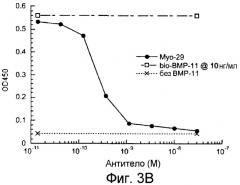
На фиг.3А и 3В показано, что предынкубация Myo29 с биотинилированным GDF-8 или ВМР-11 при 10 нг/мл ингибирует связывание GDF-8 или ВМР-11 с ActRIIB в анализе связывания ActRIIB с IC50 0,2-0,4 нМ.
На фиг.4В и 4С показаны результаты анализов с использованием репортерного гена pGL3(CAGA)12, в которых испытывали Myo29. Фигура 4А демонстрирует условия базовой линии (фона), т.е. индукцию активности репортерного гена GDF-8, ВМР-11 и активином. Фиг.4В и 4С показывают, что Myo29 уменьшает активность GDF-8 зависимым от дозы образом с IC50 15-30 нг/мл и ингибирует биологическую активность ВМР-11 в той же самой степени. Фиг.4D иллюстрирует, что Myo29 не влияет на активность активина в этом анализе.
На фиг.5 показаны результаты картирования эпитопа для Myo22, Myo28 и Myo29. Эпитоп Myo29 был картирован от аминокислоты 72 до аминокислоты 88 зрелого GDF-8; для Myo22, от аминокислоты 1 до аминокислоты 44; для Myo28, от аминокислоты 1 до аминокислоты 98.
На фиг.6 показаны результаты анализа замен эпитопа Myo29. По-видимому, остатки Lys-78, Pro-81 и Asn-83 в зрелом GDF-8 являются важными для связывания Myo29 с GDF-8.
На фиг.7 показаны результаты эксперимента по иммунопреципитации, выполняемого с Myo29 и Myo28. Кондиционированную среду от клеток СНО, экспрессирующих GDF-8, которые были радиоактивно помечены 35S-метионином/цистеином, подвергали иммунопреципитации с использованием Myo29 или Myo28. Затем иммунопреципитаты анализировали электрофорезом в ДСН-ПААГ при восстанавливающих условиях. Полосы на геле идентифицировали как зрелый GDF-8, пропептид GDF-8 и непроцессированный GDF-8.
На фиг.8 показаны результаты фармакокинетического исследования, в котором мыши С57В6/SCID получали дозу 1 мг/кг в виде единственного внутривенного (IV) или внутрибрюшинного (IP) введения Myo29. Myo29 показывает пролонгированный конечный полупериод существования около одной недели и низкий клиренс приблизительно 1 мл/час/кг. Фракция, абсорбированная после IP-инъекции, составляет приблизительно 77%.
На фиг.9 показаны сравнения массы четырехглавых мышц бедра у самцов мышей СВ17 SCID, получавших один раз в неделю различные дозы Myo29 (60, 10 и 1 мг/кг) или носитель (ЗФР). Лечение Myo29 при уровнях доз 10 и 60 мг/кг в течение четырех недель приводит к статистически значимому увеличению мышечной массы 19% и 23%, соответственно.
На фиг.10А и 10В показана масса икроножной и четырехглавой мышц у самок мышей СВ17 SCID, получавших один раз в неделю различные дозы Myo29 (10, 5, 2,5 и 1 мг/кг) или ЗФР в течение четырех недель. Мышечная масса увеличивается на 10-20% в мышах, получавших Myo29, в сравнении с контролем-носителем.
На фиг.11А и 11В показана соответственно масса икроножной и четырехглавой мышц у самок мышей СВ17 SCID, получавших один раз в неделю различные дозы Myo29 (10, 5, 2,5 и 1 мг/кг) или ЗФР в течение двенадцати недель. Мыши, получавшие Myo29, показывают увеличения мышечной массы в диапазоне 12-28%.
На фиг.12 показана мышечная сила передней конечности, измеренная измерителем силы хватания, у самок мышей СВ17 SCID, получавших один раз в неделю Myo29 (10 и 5 мг/кг) или ЗФР в течение двенадцати недель. Сила передней конечности увеличивалась на 17% и 23% у мышей, получавших Myo29 при 5 мг/кг и 10 мг/кг, соответственно.
ПОДРОБНОЕ ОПИСАНИЕ
I. Определения
Термин «антитело» в данном контексте относится к иммуноглобулину или его части и включает в себя любой полипептид, содержащий антигенсвязывающий сайт, независимо от источника, вида происхождения, способа получения и характеристик. В качестве неограничивающего примера, термин «антитело» включает в себя антитела человека, орангутанга, мыши, крысы, козы, овцы и курицы. Этот термин включает в себя, но не ограничивается ими, поликлональные, моноклональные, моноспецифические, полиспецифические, неспецифические, гуманизированные, одноцепочечные, химерные, синтетические, рекомбинантные, гибридные, мутированные и CDR-трансплантированные антитела. Для целей данного изобретения этот термин включает в себя также, если нет других указаний, фрагменты антител, такие как Fab, F(ab')2, Fv, scFv, Fd, dAB и другие фрагменты антител, которые сохраняют антигенсвязывающую функцию.
Антитела могут быть получены, например, посредством традиционных гибридомных способов (Kohler and Milstein (1975) Nature, 256:495-499), методами рекомбинантных ДНК (патент США №4816567) или способами фагового дисплея с использованием библиотек антител (Clackson et al. (1991) Nature, 352:624-628; Marks et al. (1991) J.Mol. Biol., 222:581-597). В отношении других способов получения антител см. Antibodies: A Laboratory Manual, eds. Harlow et al., Cold Spring Harbor Laboratory, 1988.
Термин «антигенсвязывающий домен» относится к части молекулы антитела, которая содержит зону, специфически связывающуюся с частью антигена или со всем антигеном, или комплементарной части антигена или всему антигену. Если антиген является большим, антитело может связывать только конкретную часть этого антигена. «Эпитоп» или «антигенная детерминанта» является частью молекулы антигена, которая является ответственной за специфические взаимодействия с антигенсвязывающим доменом антитела. Антигенсвязывающий домен может быть обеспечен одним или несколькими вариабельными доменами антитела (например, так называемым Fd-фрагментом антитела, состоящим из VH-домена). Антигенсвязывающий домен содержит вариабельную область легкой цепи (VL) и вариабельную область тяжелой цепи (VH).
Термин «репертуар» относится к генетически различному набору нуклеотидов, например ДНК-последовательностей, происходящих полностью или частично из последовательностей, которые кодируют экспрессируемые иммуноглобулины. Эти последовательности генерируются реаранжировкой in vivo, например, V-, D- и J-сегментов для Н-цепей и, например, V- и J-сегмента для L-цепей. Альтернативно, эти последовательности могут быть генерированы из клеточной линии стимуляцией in vitro, в ответ на которую может происходить реаранжировка. Альтернативно, часть этих последовательностей или все эти последовательности могут быть получены объединением неаранжированных V-сегментов с D- и J-сегментами, посредством нуклеотидного синтеза, неспецифического мутагенеза и других способов, как описано в Патенте США №5565332.
Термин «специфическое взаимодействие” или “специфически связывается” или т.п. обозначает, что две молекулы образуют комплекс, который является относительно стабильным при физиологических условиях. Этот термин может быть также применим когда, например, антигенсвязывающий домен является специфическим в отношении конкретного эпитопа, который несут ряд антигенов, и в этом случае данное антитело несет антигенсвязывающий домен, который может быть способен связываться с различными антигенами, несущими этот эпитоп. Таким образом, антитело может специфически связывать, например, ВМР-11 и GDF-8, пока оно связывается с эпитопом, который несут оба эти фактора.
Специфическое связывание характеризуется высокой аффинностью и низкой - умеренной производительностью. Неспецифическое связывание обычно имеет низкую аффинность с умеренной - высокой производительностью. Обычно связывание считается специфическим, когда константа аффинности Ка выше, чем 106 М-1 или предпочтительно выше, чем 108 М-1. Если необходимо, неспецифическое связывание может быть уменьшено по существу без влияния на специфическое связывание варьированием условий связывания. Такие условия известны в данной области и специалист с квалификацией в данной области с использованием рутинных способов может выбрать подходящие условия. Эти условия обычно определяют в виде концентрации антител, ионной силы раствора, температуры, времени, позволяющего связывание, концентрации неродственных молекул (например, сывороточного альбумина, казеина молока) и т.д. Примеры условий представлены в примерах 4, 7 и 10.
Фраза “по существу, как представленные” означает, что релевантные CDR, VH- или VL-домен будут или идентичными, или в высокой степени сходными с указанными районами, последовательность которых представлена здесь. Например, такие замены включают в себя 1 или 2 из любых 5 аминокислот в последовательности CDR (Н1, Н2, Н3, L1, L2 или L3).
Термин “надсемейство TGF-β” относится к семейству структурно родственных факторов роста. Это семейство родственных факторов роста хорошо известно в данной области (Kingsley et al. (1994) Genes Dev., 8: 133-146; Hoodless et al. (1998) Curr. Topics Microbiol. Immunol., 228: 235-72). Надсемейство TGF-β включает в себя костные морфогенетические белки (ВМР), активин, ингибин, ингибирующее вещество Мюллера, полученный из глии нейротрофический фактор и все время растущий ряд факторов роста и дифференцировки (GDF), таких как GDF-8 (миостатин). Многие из таких белков являются структурно и/или функционально родственными GDF-8. Например, ВМР-11 человека, также известный как GDF-11, на 90% идентичен GDF-8 по аминокислотной последовательности (Gamer et al. (1999) Dev. Biol. 208, 222-232; Nakshima et al. (1999) Mech. Dev. 80:185-189).
Термин «GDF-8» относится к специфическому фактору-8 роста и дифференцировки и, где это удобно, к факторам, которые структурно или функционально родственны GDF-8, например, ВМР-11 и другим факторам роста, принадлежащим к надсемейству TGF-β. Этот термин относится в полноразмерной непроцессированной форме-предшественнику GDF-8, а также к формам зрелого белка и пропептида, возникающим в результате посттрансляционного расщепления. Этот термин относится также к любым фрагментам и вариантам GDF-8, которые сохраняют по меньшей мере некоторые биологические активности, ассоциированные со зрелым GDF-8, как обсуждается здесь, в том числе последовательностям, которые могут быть модифицированы. Аминокислотная последовательность зрелого GDF-8 человека представлена в SEQ ID NO:49. Данное изобретение относится к GDF-8 из всех видов позвоночных, в том числе, но не только, человека, коровы, курицы, мыши, крысы, свиньи, овцы, индейки, павиана и рыбы (в отношении информации о последовательности см., например, McPherron et al. (1997) Proc. Natl. Acad. Sci. USA, 94:12457-12461).
Термин «зрелый GDF-8» относится к белку, который отщеплен от карбоксиконцевого домена белка-предшественника GDF-8. Зрелый GDF-8 может присутствовать в виде мономера, гомодимера или в виде латентного комплекса GDF-8. В зависимости от условий зрелый GDF-8 может устанавливать равновесие между любыми или всеми из этих различных форм. В его биологически активной форме зрелый GDF-8 называют также «активным GDF-8».
Термин «пропептид GDF-8» относится к полипептиду, который отщеплен от аминоконцевого домена белка-предшественника GDF-8. Пропептид GDF-8 способен связываться с пропептидсвязывающим доменом на зрелом GDF-8.
Термин “латентный комплекс GDF-8” относится к комплексу белков, образованных между зрелым гомодимером GDF-8 и пропептидом GDF-8. Считается, что два пропептида GDF-8 связываются с двумя молекулами зрелого GDF-8 в гомодимере с образованием неактивного тетрамерного комплекса. Латентный комплекс может включать в себя другие ингибиторы GDF вместо одного или более пропептидов GDF-8 или наряду с одним или более пропептидами GDF-8.
Термин “активность GDF-8” относится к одной или нескольким физиологически регулирующим рост или морфогенетическим активностям, ассоциированным с активным белком GDF-8. Например, активный GDF-8 является отрицательным регулятором массы склетных мышц. Активный GDF-8 может также модулировать продуцирование специфических для мышц ферментов (например, креатинкиназы), стимулировать пролиферацию миобластов и модулировать дифференцировку пре-адипоцитов в адипоциты. Примеры процедур для измерения активности GDF-8 in vivo и in vitro приведены в примерах 2, 3, 6 и 13.
Термин “ингибитор GDF-8” включает в себя любой агент, способный ингибировать активность, экспрессию, процессинг или секрецию GDF-8. Такие ингибиторы включают в себя белки, антитела, пептиды, пептидомиметики, рибозимы, антисмысловые олигонуклеотиды, двухцепочечные РНК и другие малые молекулы, которые специфически ингибируют GDF-8. Говорят, что такие ингибиторы “ингибируют”, “нейтрализуют” или “уменьшают” биологическую активность GDF-8.
Термины “нейтрализуют”, “нейтрализующий”, “ингибиторный” и близкие им слова относятся к уменьшению активности GDF-8 ингибитором GDF-8 относительно активности GDF-8 в отсутствие того же самого ингибитора. Уменьшение активности составляет предпочтительно приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более.
Термин “лечение” используется здесь взаимозаменяемо с термином “терапевтический способ” и относится как к терапевтическому лечению, так и к профилактическим/превентивным мероприятиям. Те, кто нуждается в лечении, могут включать в себя индивидуумов, уже имеющих конкретное медицинское нарушение, а также индивидуумов, которые могут в конечном счете приобрести это нарушение (т.е. индивидуумов, нуждающихся в превентивных мероприятиях).
Термин “выделенный” относится к молекуле, которая по существу не содержит ее природного окружения. Например, выделенный белок по существу не содержит клеточного материала или других белков из клеточного или тканевого источника, из которого он получен. Этот термин относится к препаратам, в которых выделенный белок является достаточно чистым для введения в качестве терапевтической композиции или по меньшей мере на 70 мас.%-80 мас.% чистым, более предпочтительно по меньшей мере на 80 мас.%-90 мас.% чистым, еще более предпочтительно на 90-95 мас.% чистым; и, наиболее предпочтительно по меньшей мере на 95 мас.%, 96 мас.%, 97 мас.%, 98 мас.%, 99 мас.% или 100 мас.% чистым.
Термин “млекопитающее” относится к любому животному, классифицируемому как млекопитающее, в том числе людям, домашним и сельскохозяйственным животным, животным зоопарка, спортивным животным или комнатным животным, таким как собаки, лошади, кошки, овцы, свиньи, коровы и т.д.
Термин “эффективная доза” или “эффективное количество” относится к количеству соединения, которое приводит к ослаблению симптомов у пациента или желаемому биологическому результату (например, увеличенной массе скелетных мышц и/или плотности костей). Такое количество должно быть достаточным для уменьшения активности GDF-8, связанной с отрицательной регуляцией массы скелетных мышц и плотности кости. Это эффективное количество может быть определено, как описано в последующих разделах.
II. Антитела против GDF-8 и антигенсвязывающие фрагменты
А. Антитела Myo29, Myo28 или Myo22 человека
Данное изобретение относится к новым антителам против GDF-8 и их антигенсвязывающие фрагменты. Неограничивающие иллюстративные варианты таких антител названы Myo29, Myo28 или Myo22. Эти примеры вариантов данного изобретения обеспечены в форме IgG1-антител человека.
Антитела данного изобретения обладают уникальными и полезными свойствами. Во-первых, эти антитела способны связывать с высокой аффинностью зрелый GDF-8. Во-вторых, антитела данного изобретения могут ингибировать активность GDF-8 in vitro и in vivo, как показано, например, ингибированием связывания ActRIIB и анализами с использованием репортерных генов. Антитела данного изобретения способны также специфически связывать и/или ингибировать активность ВМР-11, как показано, например, ингибированием связывания ActRIIB и анализами с использованием репортерных генов. В третьих, описанные антитела могут ингибировать активность GDF-8, ассоциированную с отрицательной регуляцией массы скелетных мышц и плотности костей.
В примерном варианте осуществления описанные в настоящее время антитела способны специфически связывать как GDF-8, так и ВМР-11. Предполагается, что эти антитела могут также взаимодействовать с другими белками, например с белками, принадлежащими к надсемейству TGF-β, такими как ингибирующее вещество Мюллера, полученный из глии нейротрофический фактор или факторы роста и дифференцировки, другие, чем GDF-8. В некоторых вариантах осуществления Myo29 взаимодействует с белком, который содержит последовательность, идентичную аминокислотам 72-88 SEQ ID NO:49. В дополнительных вариантах осуществления Myo29 связывается с белком, содержащим последовательность Lys-Xaa1-Xaa2-Pro-Xaa3-Asn (SEQ ID NO:54), где Xaa1, Xaa2 и Xaa3, каждый, обозначают любую аминокислоту. В дополнительных вариантах осуществления удовлетворяется по меньшей мере одно из следующих условий: (1) Хаа1 = Met, (2) Xaa2 = Ser и (3) Xaa3 = Ile; в каждом случае независимо один от другого. В других вариантах осуществления Myo22 узнает эпитоп в первых 44 N-концевых аминокислотах в последовательности зрелого GDF-8 (аминокислоты 1 - 44 SEQ ID NO:49).
Специалисту с квалификацией в данной области будет понятно, что антитела данного изобретения могут быть использованы для обнаружения, измерения и ингибирования белков, которые отличаются от белков, указанных выше. В общем, антитела данного изобретения могут быть использованы с любым белком, который содержит последовательность, которая является по меньшей мере на приблизительно 70%, 80%, 90%, 95% или более идентичной любой последовательности из по меньшей мере 100, 80, 60, 40 или 20 смежных аминокислот в последовательности зрелой формы GDF-8, представленной SEQ ID NO:49. Неограничивающие примеры таких белков включают в себя последовательности GDF-8, полученные из разных видов, которые описаны в данном описании. Процентную идентичность определяют стандартными алгоритмами сопоставлений, такими как, например, Basic Local Alignment Tool (BLAST), описанный в Altschul et al. (1990) J. Vol. Biol., 215:403-410, алгоритм Needleman et al. (1970) J.Mol. Biol., 48:444-453 или алгоритм Meyers et al. (1988) Comput. Appl. Biosci., 4:11-17.
В. Вариабельные домены
Интактные антитела, также известные как иммуноглобулины, являются обычно тетрамерными гликозилированными белками, состоящими из двух легких (L) цепей массой приблизительно 25 кДа каждая и двух тяжелых (Н) цепей массой приблизительно 50 кДа каждая. Два типа легкой цепи, названные λ и κ, обнаружены в антителах. В зависимости от аминокислотной последовательности константного домена тяжелых цепей, иммуноглобулины могут быть отнесены к пяти основным классам: A, D, E, G и М, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны в данной области. В отношении структуры антител см. Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, eds. Harlow et al., 1988. Вкратце, каждая легкая цепь состоит из N-концевого вариабельного (V) домена (VL) и константного (С) домена (CL). Каждая тяжелая цепь состоит из N-концевого V-домена, трех или четырех С-доменов и шарнирного участка. СН-домен, наиболее проксимальный относительно VH, назван СН1. VH- и VL-домен состоят из четырех районов относительно консервативной последовательности, назваемых каркасными районами (FR1, FR2, FR3 и FR4), которые образуют каркас для трех районов гипервариабельной последовательности (определяющих комплементарность районов, CDR). CDR содержат большинство остатков, ответственных за специфические взаимодействия с антигеном. CDR называют CDR1, CDR2 и CDR3. Таким образом, CDR-компоненты на тяжелой цепи называют Н1, Н2 и Н3, тогда как CDR на легкой цепи называют L1, L2 и L3. CDR3 является самым важным участком молекулярного разнообразия в антигенсвязывающем сайте. Н3, например, может быть таким коротким, как два аминокислотных остатка, или большим, чем 26 аминокислотных остатков. Наименьшим антигенсвязывающим фрагментом является Fv, который состоит из доменов VH и VL. Fab-фрагмент (фрагмент связывания антигена) состоит из доменов VH-СН1 и VL-CL, ковалентно связанных дисульфидной связью между константными областями. Для преодоления тенденции нековалентно связанных доменов VH и VL в Fv диссоциироваться в клетке-хозяине может быть сконструирован так называемый одноцепочечный (sc) Fv-фрагмент (scFv), в котором гибкий и достаточно длинный полипептид связывает или С-конец VH с N-концом VL, или С-конец VL с N-концом VH. Наиболее часто используемым линкером был пептид из 15 аминокислотных остатков (Gly4Ser)3, но в данной области известны также и другие линкеры.
Разнообразие антител создается с использованием множественных генов зародышевой линии клеток, кодирующих вариабельные области, и различных соматических событий. Эти соматические события включают в себя рекомбинацию сегментов вариабельных генных сегментов с генными сегментами разнообразия (D-сегментами) и соединительными генными сегментами (J-сегментами) с образованием полной VH-области и рекомбинацию вариабельного и соединительного генных сегментов с образованием полной VL-области. Сам процесс рекомбинации является неточным, что приводит к потере или добавлению аминокислот в этих V(D)J-областях соединений. Эти механизмы разнообразия встречаются в развивающейся В-клетке перед подверганием действию антигена. После стимуляции антигеном экспрессируемые гены антител в В-клетках подвергаются соматической мутации. На основании приближенно определенного количества генных сегментов зародышевого типа, случайной рекомбинации этих сегментов и случайного спаривания VH-VL могут быть образованы до 1,6×107 различных антител (Fundamental Immunology, 3rd ed., ed. Paul, Raven Press, New York, NY, 1993). С учетом других процессов, способствующих разнообразию антител (таких как соматическая мутация), считается, что могут генерироваться до 1×1010 различных антител (Immunoglobulin Genes, 2nd ed., eds. Jonio et al., Academic Press, San Diego, CA, 1995). Вследствие этих многих процессов, участвующих в генерировании разнообразия антител, вряд ли вероятно, что независимо полученные моноклональные антитела со специфичностью в отношении одного и того же антигена будут иметь идентичные аминокислотные последовательности.
Таким образом, данное изобретение дополнительно относится к новым CDR, полученных из библиотек генов иммуноглобулинов человека. Структурой для несения CDR данного изобретения будет обычно последовательность тяжелой или легкой цепи антитела или ее существенная часть, в которой CDR находится в положении, соответствующем CDR природно встречающихся VH и VL. Структуры и местоположения вариабельных доменов иммуноглобулина могут быть определены, как описано в Sequences of Proteins of Immunological Interest, US Department of Health and Human Services, eds. Kabat et al., 1991.
ДНК-последовательности и аминокислотные (АА) последовательности описанных здесь антител, их scFv-фрагмент, домены VH и VL и CDR приведены в Списке последовательностей и имеют нумерацию, показанную в таблице 1. Для удобства положения для каждого CDR в доменах VH и VL приведены в таблице 2. Последовательности тяжелой и легкой цепей, включающие в себя домены VH и VL, являются идентичными в Myo29, Myo28 или Myo22.
| ТАБЛИЦА 1 | |||
| ДНК-последовательности и аминокислотные последовательности scFv, доменов VH и VL и CDR | |||
| Myo29 | Myo28 | Myo22 | |
| ДНК-последовательность scFv | SEQ ID NO:13 | SEQ ID NO:7 | SEQ ID NO:1 |
| АА-последовательность scFv | SEQ ID NO:14 | SEQ ID NO:8 | SEQ ID NO:2 |
| ДНК-последовательность VH | SEQ ID NO:15 | SEQ ID NO:9 | SEQ ID NO:3 |
| АА-последовательность VH | SEQ ID NO:16 | SEQ ID NO:10 | SEQ ID NO:4 |
| ДНК-последовательность VL | SEQ ID NO:17 | SEQ ID NO:11 | SEQ ID NO:5 |
| АА-последовательность VL | SEQ ID NO:18 | SEQ ID NO:12 | SEQ ID NO:6 |
| ДНК-последовательность scFv зародышевого типа | SEQ ID NO:25 | SEQ ID NO:19 | |
| АА-последовательность scFv зародышевого типа | SEQ ID NO:26 | SEQ ID NO:20 | |
| ДНК-последовательность VH зародышевого типа | SEQ ID NO:27 | SEQ ID NO:21 | |
| АА-последовательность VH зародышевого типа | SEQ ID NO:28 | SEQ ID NO:22 | |
| ДНК-последовательность VL зародышевого типа | SEQ ID NO:29 | SEQ ID NO:23 | |
| АА-последовательность VL зародышевого типа | SEQ ID NO:30 | SEQ ID NO:24 | |
| АА-последовательность Н1 | SEQ ID NO:31 | SEQ ID NO:37 | SEQ ID NO:43 |
| АА-последовательность Н2 | SEQ ID NO:32 | SEQ ID NO:38 | SEQ ID NO:44 |
| АА-последовательность Н3 | SEQ ID NO:33 | SEQ ID NO:39 | SEQ ID NO:45 |
| АА-последовательность L1 | SEQ ID NO:34 | SEQ ID NO:40 | SEQ ID NO:46 |
| АА-последовательность L2 | SEQ ID NO:35 | SEQ ID NO:41 | SEQ ID NO:47 |
| АА-последовательность L3 | SEQ ID NO:36 | SEQ ID NO:42 | SEQ ID NO:48 |
| Таблица 2 Положения CDR в scFv | |||
| CDR | Myo29(SEQ ID NO:26) | Myo28(SEQ ID NO:20) | Myo22(SEQ ID NO:2) |
| Н1 | 31-35 | 31-35 | 31-35 |
| Н2 | 50-66 | 50-66 | 50-66 |
| Н3 | 99-106 | 99-110 | 99-113 |
| L1 | 157-167 | 160-173 | 163-176 |
| L2 | 183-189 | 189-195 | 192-198 |
| L3 | 222-226 | 228-233 | 231-242 |
Заявляемые здесь антитела могут дополнительно содержать константные области антител или их части. Например, домен VL может быть присоединен к С-концевой стороне константных областей легкой цепи антитела, в том числе цепей Сκ или Сλ, предпочтительно цепей Сλ. Подобным образом, специфический антигенсвязывающий фрагмент на основе домена VH может быть присоединен на его С-концевой стороне ко всей тяжелой цепи иммуноглобулина или к части тяжелой цепи иммуноглобулина, полученной из любого изотипа антител, например, IgG, IgA, IgE и IgM, и любых подклассов антител, в частности IgG1 и IgG4. В примерах вариантов осуществления антитела содержат С-концевые фрагменты тяжелой и легкой цепей IgG1λ человека. ДНК-последовательности и аминокислотные последовательности для С-концевого фрагмента легкой цепи λ изображены в SEQ ID NO:50 и SEQ ID NO:51, соответственно. ДНК-последовательности и аминокислотные последовательности для С-концевого фрагмента тяжелой цепи IgG1 изображены в SEQ ID NO:52 и SEQ ID NO:53, соответственно.
Некоторые варианты осуществления данного изобретения включают в себя домен
VH и/или VL Fv-фрагмента Myo29, Myo28 или Myo22. Дополнительные варианты осуществления включают в себя один или более определяющих комплементарность районов (CDR) любого из этих доменов VH и VL. Один вариант осуществления включает в себя Н3-фрагмент домена VH Myo29, Myo28 или Myo22. Домены VH и VL данного изобретения в некоторых вариантах сделаны дом