Терапевтические комбинации, содержащие ингибитор поли(адф-рибоза)полимеразы
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается дозированной формы для введения млекопитающему, предназначенной для лечения или профилактики болезненного состояния у млекопитающего, опосредованного действием PARP, где дозированная форма содержит соединение формулы 1, его фармацевтически приемлемую соль или сольват, или их смеси, в количестве, эффективном для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 5,9 нг/мл соединения формулы 1 в течение, по меньшей мере, 24 часов после введения в организм млекопитающего, которая является концентрацией ингибитора, подавляющей на 89% (IC89) потребление клеточного NAD+и образование полимера поли АДФ-рибозы, и скорректирована с учетом связывания с белком. Предложенная дозированная форма обеспечивает стабильную величину концентрации в плазме 5,9 нг/мл AG-014699 в течение, по меньшей мере, 24 часов после введения в организм млекопитающего. 5 н. и 9 з.п. ф-лы, 4 ил., 23 табл.
Реферат
Данная заявка утверждает приоритет предварительной заявки США № 60/612458, поданной 22 сентября 2004 г., и предварительной заявки США № 60/683006, поданной 19 мая 2005 г., полное содержание которых включено здесь в виде ссылки.
Область техники, к которой относится изобретение
Данное изобретение главным образом относится к применению 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-она в качестве химического сенсибилизирующего вещества, которое повышает эффективность цитотоксических дозированных средств или лучевой терапии. Данное изобретение относится к фармацевтическим комбинациям 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-она, или его фармацевтически приемлемых солей и, по меньшей мере, одного дополнительного терапевтического средства, наборам, содержащим такие комбинации и способам применения таких комбинаций при лечении субъектов, страдающих такими заболеваниями как рак.
Предпосылки к созданию изобретения
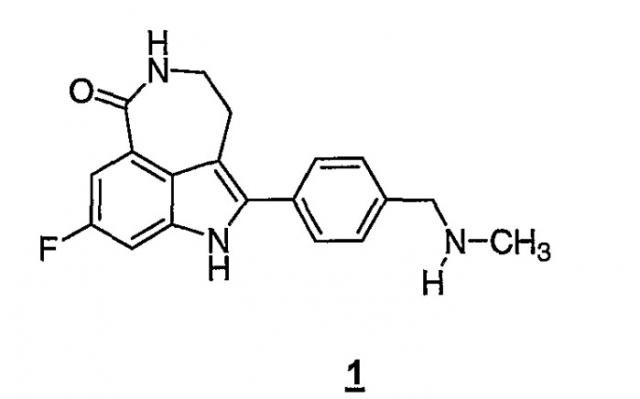
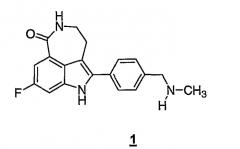
Соединение 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-он, представленное формулой 1
является синтетическим ингибитором поли-(AДФ-рибоза) полимеразы (PARP). Соединение формулы 1 и его соли, можно получить, как описано в патенте США №6495541; заявке PCT № PCT/IB2004/000915, международной публикации № WO 2004/087713; предварительных заявках на выдачу патента США №№60/612457, 60/612459 и 60/679296, раскрытия которых включены здесь в полном объеме в виде ссылки.
В настоящее время в семействе PARP, посредством гомологии ДНК последовательностей, выявлено восемнадцать ферментов, и изучены химические и ферментативные свойства семи из них: PARP-1 и PARP-2 стимулируются разрывами нитей ДНК, PARP-3 взаимодействует с PARP-1 и центросомой, PARP-4, также известный как PARP-запасник (VPARP), является самым большим PARP и связан с цитоплазматическими хранилищами, танкираза 1 и 2 (PARP-5a и 5b) связаны с теломерными белками, и функция PARP-7 (TiPARP) в настоящее время не ясна, но он может быть задействован в функции Т-клеток и может поли(АДФ-рибозил)ировать гистоны (Ame JC, Splenlehauer C and de Murcia G. The PARP Superfamily. Bioessays 26 882-893 (2004)). Фармакологические исследования показали, что соединение формулы 1 является ингибитором PARP-1 (Ki=1,4 нМ) и PARP-2 (Ki=0,17 нМ). Исходя из структурного подобия аминокислотных последовательностей среди ферментов PARP, соединение формулы 1, возможно, также связывается с высокой аффинностью с другими членами этого семейства.
Опосредованное ферментом восстановление одно- или двунитевых разрывов ДНК является потенциальным механизмом устойчивости к лучевой терапии или воздействию цитотоксических дозированных средств, чей механизм действия обусловлен повреждением ДНК. Таким образом, стратегией усиления действия этих средств является ингибирование ДНК-репаративных ферментов. PARP-1, наиболее изученный член семейства PARP, представляет собой ядерный фермент, регулируемый повреждением ДНК, опосредует передачу фрагментов АДФ-рибозы от NAD+ к ряду акцепторных белков. В зависимости от степени повреждения ДНК, активирование PARP-1 и последующее поли(АДФ-рибозил)ирование опосредуют восстановление поврежденной ДНК или индуцируют клеточную гибель. При умеренных повреждениях ДНК, PARP-1 играет значительную роль в процессе восстановления ДНК. С другой стороны, в случае массивных повреждений ДНК, избыточная активация PARP-1 истощает запасы АТФ (при восполнении NAD+), что в итоге приводит к гибели клеток в результате некроза (Tentori L, Portarena I, Graziani G. Potential applications of poly(ADP-ribose) polymerase (PARP) inhibitors. Pharmacol Res 2002, 45, 73-85). Это активирование PARP может также привести к высвобождению АИФ (апоптоз-индуцирующий фактор), который запускает независимый от каспазы путь апоптоза. (Hong SJ, Dawson TM and Dawson VL. Nuclear and mitochondrial conversations in cell death: PARP-1 and AIF. Trends in Pharmacological Sciences 25 259-264 (2004)).
В результате двойного назначения PARP-1 ингибиторы этого фермента, такие как 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-он, представленный формулой 1, могут действовать как химические сенсибилизирущие агенты (предотвращая восстановление ДНК, например, после противоопухолевой терапии), или в качестве дозированных средств при различных заболеваниях и токсических состояниях, которые предполагают окислительный или индуцированный оксидом азота стресс и последующую гиперактивацию PARP. Такие состояния включают неврологические и нейродегенеративные заболевания (например, болезнь Паркинсона, болезнь Альцгеймера) (Love S, Barber R, Wilcock GK. Increased poly(ADP-ribosyl)ation of nuclear proteins in Alzheimer's disease. Brain 1999; 122:247-53; Mandir AS, Przedborski S, Jackson-Lewis V, et al. Poly(ADP-ribose) polymerase activation mediates 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP)-induced parkinsonism. Proc Natl Acad Sci USA 1999; 96:5774-9); сердечно-сосудистые заболевания (например, инфаркт миокарда, ишемическо-реперфузионное повреждение) (Pieper AA, Walles T, Wei G, et al. Myocardial postischemic injury is reduced by poly(ADP-ribose) polymerase-1 gene disruption. J MoI Med 2000; 6:271-82; Szabó G, Bährle S, Stumpf N, et al. Poly(ADP-ribose) polymerase inhibition reduces reperfusion injury after heart transplantation. Circ Res 2002; 90:100-6; патент США 6423705); воспалительные заболевания, (Szabó C, Dawson V. Role of poly(ADP-ribose) synthetase in inflammation and ischaemia-reperfusion. TIPS 1998; 19:287-98); сосудистые нарушения при диабете (Soriano FG, Virág L, Szabó C. Diabetic endothelial dysfunction: role of reactive oxygen and nitrogen species production and poly(ADP-ribose) polymerase activation. J Mol Med 2001; 79: 437-48); артриты (Szabó C, Virág L, Cuzzocrea S, et al. Protection against peroxynitrite-induced fibroblast injury and arthritis development by inhibition of poly(ADP-ribose) synthase. Proc Natl Acad Sci USA 1998, vol.95, pp. 3867-72); и цисплатин-индуцированную нефротоксичность (Racz et al. «BGP-15 - a novel poly(ADP-ribose) polymerase inhibitor - protects against nephrotoxicity of cisplatin without compromising its antitumor activity» Biochem Pharmacol 2002; 63: 1099-111). Более того, показано, что опухолевые клетки, лишенные BRCA2, резко чувствительны к ингибиторам PARP, применяемым отдельно. (Bryant et al. «Specific killing of BRCA2 deficient tumors with inhibitors of poly(ADP-ribose)polymerase» Nature, 2005, vol. 434, pp. 913-917; Farmer et al. «Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy» Nature, 2005, vol. 434, pp. 917-921). Ингибиторы PARP также участвуют в усилении индукции экспрессии гена Reg в β-клетках и гена HGF и, соответственно, способствуют пролиферации панкреатических β-клеток в островках Лангерганса и тормозят клеточный апоптоз (публикация патентной заявки США 2004/0091453; публикация PCT № WO 02/00665). Дополнительно, ингибиторы PARP также используются в косметических препаратах, главным образом в лосьонах после загара (публикация PCT № WO 01/82877). В настоящее время отсутствуют реализуемые на рынке ингибиторы PARP.
Рак остается заболеванием, при котором медицинские потребности являются крайне неудовлетворенными. Цитотоксическая химиотерапия остается основой системной терапии большинства злокачественных новообразований, особенно на поздней стадии заболевания. Однако у пациентов с прогрессирующей или метастазирующей опухолью немногие цитотоксические химиотерапевтические средства или режимы эффективны в повышении общей выживаемости. Кроме того, маленькое терапевтическое окно, связанное с цитотоксическими веществами, приводит к сильной токсичности в сочетании с субоптимальной эффективностью. Таким образом, химическое сенсибилизирующее вещество, которое повышает эффективность цитотоксических дозированных средств в хорошо переносимых дозах может удовлетворять критической необходимости онкологических больных.
Лучевая терапия является эффективным способом лечения рака, применяемым при большинстве типов опухолей для ограниченного контроля заболевания. Более 50% всех онкологических больных будут получать лучевую терапию в течение их болезни (Foroudi F. et al. An evidence-based estimate of appropriate radiotherapy utilization rate for breast cancer. Int J Radiat Oncol Biol Phys. 2002, 53: 1240-53; Foroudi F. et al. An evidence-based estimate of the appropriate radiotherapy utilization rate for colorectal cancer. Int J Radiat Oncol Biol Phys. 2003, 56: 1295-307; Foroudi F. et al. Evidence-based estimate of appropriate radiotherapy utilization rate for prostate cancer. Int J Radiat Oncol Biol Phys. 2003, 55: 51-63; Barbera L. et al. Estimating the benefit and cost of radiotherapy for lung cancer. Int J Technol Assess Health Care. 2004, 20: 545-51). Однако даже в первой линии терапии раков, при которых лучевую терапию применяют в лечебных целях (например, рак головы и шеи, саркома мягких тканей и карцинома шейки матки), не все пациенты реагируют удовлетворительно. Таким образом, существует необходимость в способах лечения, которые увеличат реакцию у всех пациентов. Обычно стандартную химиотерапию проводят перед или после лучевой терапии. Альтернативным подходом является объединение лучевой терапии с новейшими противоопухолевыми средствами, которые специально разработаны для усиления эффективности лучевой терапии. Такие средства воздействуют на пять ключевых факторов, которые определяют реакцию опухоли на облучение («Cell survival as a determinant of tumor response». Basic clinical radiobiology 3rd Edition. Steel GG (Ed.). Arnold Press UK, pp. 52-63, 2002). К ним относятся способность к восстановлению повреждений ДНК, вызванных лучевой терапией; перераспределение клеток во время клеточного цикла после лучевой терапии (так что опухолевые клетки, которые были в устойчивой фазе при первой дозе облучения, могут прогрессировать к более чувствительной фазе посредством следующей фракции облучения); репопуляция, в результате чего выжившие клетки продолжают делиться, и таким образом увеличивается опухолевая масса между фракциями облучения; реоксигенация клеток, выживших в начальном цикле лучевой терапии, в результате являются более слабо оксигенированы, и наконец, врожденная радиочувствительность конкретной ткани. Среди этих факторов повышенное восстановление и репопуляция приводят к радиоустойчивости, тогда как перераспределение, реоксигенация и врожденная радиочувствительность могут делать опухоль более отзывчивой на лучевую терапию. Очевидно, что использование агентов, которые уменьшают способность к репарации ДНК, совместно с лучевой терапией имеют потенциальную возможность усилить радиотерапевтический результат. Активирование PARP-1 и последующее поли-(ADP-рибозил)ирование отмечены в ответ на повреждение ДНК, вызванное радиацией (Satoh MS & Lindahl T. «Role of poly(ADP-ribose) formation in DNA repair» Nature. 1992, 356: 356-358). Кроме того, клеточные линии и нокаут-мыши, выведенные с дефектом экспрессии и активности PARP-1, показывают сильную радиочувствительность, подтверждая, что PARP-1 является выгодной мишенью для потенцирования действием излучения (Wang et al. «Mice lacking ADPRT and poly(ADP-ribosyl)ation develop normally but are susceptible to skin disease». Genes Dev. 1995, 9: 509-20; de Murcia et al. «Requirement of poly(ADP-ribose) polymerase in recovery from DNA damage in mice and in cells» Proc Natl Acad Sci USA. 1997, 94: 7303-7; Masutani et al. «Function of poly(ADP-ribose) polymerase in response to DNA damage: gene-disruption study in mice» Mol Cell Biochem. 1999, 193: 149-52). В дополнение к прямым эффектам на репарацию ДНК, семейство ингибиторов PARP-1 детально является вазоактивным и по существу увеличивает потенциальные возможности для реоксигенации опухоли между фракциями облучения, что может далее способствовать усиленной реакции на облучение (Calabrese et al. «Anticancer chemo- and radio-sensitisation in vitro and in vivo by a potent novel poly(ADP-ribose) polymerase-1 (PARP-1) inhibitor, AG14361». J. Natl. Cancer Inst. 2004, 96: 56-67).
Краткое изложение сущности изобретения
В одном варианте осуществления настоящее изобретение относится к дозированной форме для применения у млекопитающих, где данная дозированная форма содержит соединение формулы 1:
его фармацевтически приемлемую соль или сольват, или их смесь, в количестве, эффективном для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 5,9 нг/мл соединения формулы 1 в течение, по меньшей мере, 24 часов после введения млекопитающему.
В другом варианте осуществления данное изобретение относится к дозированной форме для введения млекопитающему, где дозированная форма содержит соединение формулы 1, его фармацевтически приемлемую соль или сольват, или их смесь, в количестве, эффективном для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 10 нг/мл соединения формулы 1 в течение, по меньшей мере, 24 часов после введения млекопитающему.
В другом варианте осуществления данное изобретение относится к дозированной форме для введения млекопитающему, где дозированная форма содержит соединение формулы 1, его фармацевтически приемлемую соль или сольват, или их смесь, в количестве, эффективном для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 5,9 нг/мл соединения формулы 1 в течение, по меньшей мере, 24 часов после введения млекопитающему, где дозированная форма представляет собой лиофилизированный порошок для инъекций.
В другом варианте осуществления данное изобретение относится к дозированной форме для введения млекопитающему, где дозированная форма содержит соединение формулы 1, фармацевтически приемлемую соль или сольват, или их смесь, в количестве, эффективном для ингибирования в лимфоцитах перифирической крови фермента поли-(ADP-рибозил) полимераза, по меньшей мере, на 50% в течение, по меньшей мере, 24 часов после введения млекопитающему.
В другом варианте осуществления данное изобретение относится к дозированной форме для введения млекопитающему, где дозированная форма содержит соединение формулы 1, фармацевтически приемлемую соль или сольват, или их смесь, в количестве, эффективном для ингибирования в лимфоцитах периферической крови фермента поли-(ADP-рибозил) полимераза, по меньшей мере, на 50%, в течение, по меньшей мере, 24 часов после введения млекопитающему, где дозированная форма представляет собой лиофилизированный порошок для инъекций.
В другом варианте осуществления данное изобретение относится к дозированной форме для введения млекопитающему, где дозированная форма содержит соединение формулы 1, его фармацевтически приемлемую соль или сольват, или их смесь, в количестве от 1 до 48 мг/м2, выраженном как эквивалентная масса свободного основания соединения формулы 1.
В другом варианте осуществления данное изобретение относится к дозированной форме для введения млекопитающему, где дозированная форма содержит соединение формулы 1, его фармацевтически приемлемую соль или сольват, или их смесь, в количестве от 1 до 48 мг/м2, выраженном как эквивалентная масса свободного основания соединения формулы 1, где дозированная форма представляет собой лиофилизированный порошок для инъекций.
В другом варианте осуществления данное изобретение относится к дозированной форме для введения млекопитающему, где дозированная форма содержит соединение формулы 1, его фармацевтически приемлемую соль или сольват, или их смесь, в количестве от 2 до 96 мг, выраженном как эквивалентная масса свободного основания соединения формулы 1.
В другом варианте осуществления данное изобретение относится к дозированной форме для введения млекопитающему, где дозированная форма содержит соединение формулы 1, его фармацевтически приемлемую соль или сольват, или их смесь, в количестве от 2 до 96 мг, выраженном как эквивалентная масса свободного основания соединения формулы 1, где дозированная форма представляет собой лиофилизированный порошок для инъекций.
В другом варианте осуществления данное изобретение относится к способу лечения рака у млекопитающего, включающему введение млекопитающему
(a) соединения формулы 1, его фармацевтически приемлемой соли или сольвата, или их смеси в количестве, эффективном для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 5,9 нг/мл соединения формулы 1 в течение, по меньшей мере, 24 часов после введения млекопитающему; и
(б) терапевтически эффективного количества, по меньшей мере, одного противоопухолевого средства.
В другом варианте осуществления данное изобретение относится к способу лечения рака у млекопитающего, включающему введение млекопитающему
(a) соединения формулы 1, его фармацевтически приемлемой соли или сольвата, или их смеси в количестве, эффективном для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 5,9 нг/мл соединения формулы 1, по меньшей мере, в течение 24 часов после введения млекопитающему; и
(б) терапевтически эффективного количества, по меньшей мере, одного противоопухолевого средства,
где противоопухолевое средство применяют в течение 1 часа после применения соединения формулы 1.
В другом варианте осуществления, данное изобретение относится к способу лечения рака у млекопитающего, включающему введение млекопитающему
(a) соединения формулы 1, его фармацевтически приемлемой соли или сольвата, или их смеси в количестве, эффективном для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 5,9 нг/мл соединения формулы 1 в течение, по меньшей мере, 24 часов после введения млекопитающему; и
(б) терапевтически эффективного количества, по меньшей мере, одного противоопухолевого средства,
где рак выбран из рака легких, рака костей, рака поджелудочной железы, рака кожи, рака головы или шеи, кожной или внутриглазной меланомы, рака матки, рака яичников, рака прямой кишки, рака анальной области, рака желудка, рака толстой кишки, рака молочной железы, карциномы фаллопиевых труб, карциномы эндометрия, карциномы шейки матки, карциномы влагалища, карциномы вульвы, болезни Ходжкина, рака пищевода, рака тонкой кишки, рака эндокринной системы, рака щитовидной железы, рака паращитовидной железы, рака надпочечников, саркомы мягких тканей, рака уретры, рака пениса, рака предстательной железы, хронического или острого лейкоза, лимфоцитарной лимфомы, рака мочевого пузыря, рака почки или мочеточника, почечноклеточного рака, карциномы почечной лоханки, новообразования центральной нервной системы (ЦНС), первичной лимфомы ЦНС, опухолей позвоночника, глиомы ствола мозга, аденомы гипофиза, и их сочетаний.
В другом варианте осуществления, данное изобретение обеспечивает набор для лечения рака у млекопитающего, где набор содержит:
(a) количество соединения формулы 1, его фармацевтически приемлемой соли или сольвата, или их смеси, и фармацевтически приемлемый носитель или разбавитель в первой единичной дозированной форме;
(б) количество, по меньшей мере, одного противоопухолевого средства и фармацевтически приемлемый носитель или разбавитель по меньшей мере во второй единичной дозированной форме; и
(c) контейнер для содержания первой и, по меньшей мере, второй дозированных форм;
где количество соединения формулы 1 является эффективным для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 5,9 нг/мл соединения формулы 1 в течение, по меньшей мере, 24 часов после введения млекопитающему.
В другом варианте осуществления данное изобретение обеспечивает способ лечения рака, где способ включает применение у млекопитающего
(a) соединения формулы 1, его фармацевтически приемлемой соли или сольвата, или их смеси, в количестве, эффективном для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 5,9 нг/мл соединения формулы 1 в течение, по меньшей мере, 24 часов после введения млекопитающему; и
(б) комбинации иринотекана, 5-фторурацила и лейковорина.
В другом варианте осуществления данное изобретение обеспечивает способ лечения рака, где способ включает применение у млекопитающего
(a) соединения формулы 1, его фармацевтически приемлемой соли или сольвата, или их смеси, в количестве, эффективном для обеспечения стабильной величины концентрации в плазме, по меньшей мере, 5,9 нг/мл соединения формулы 1 в течение, по меньшей мере, 24 часов после введения млекопитающему; и
(б) дозы излучения, эффективной для уничтожения рака.
Определения и аббревиатуры терминов
Термин «соединение I» относится к фосфатной соли 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-она. Термин «соединение формулы 1» означает 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-он, свободное основание.
«Аномальный клеточный рост», как используется здесь, если не указано особо, означает клеточный рост, который не зависит от нормальных регуляторных механизмов (например, нарушение контактного ингибирования).
Термин «лечение», как используется здесь, если не оговорено особо, означает реверсирование, облегчение, торможение прогрессирования, или предотвращение заболевания или состояния, к которому этот термин применяется, или одного или нескольких симптомов такого заболевания или состояния. Термин «лечить», как используется здесь, если не оговорено особо, относится к процессу лечения как «лечение» определено непосредственно ранее.
Термин «радиосенсибилизирующее вещество», как используется здесь, означает дозированное средство, которое делает опухолевые клетки более чувствительными к лучевой терапии.
Термин «лучевая терапия», как используется здесь, включает наружную лучевую радиотерапию (XBRT) или дистанционную лучевую терапию, брахитерапию или радиотерапию с использованием закрытых источников излучения, или радиотерапию с использованием негерметизированного источника излучения. Различия между этими тремя основными направлениями лучевой терапии относятся к положению источника радиоактивного излучения; наружный находится вне тела, в то время как при радиотерапии с применением закрытого и негерметизированного источника излучения радиоактивный материал доставляется внутрь организма. Наружная лучевая радиотерапия является наиболее принятой формой лучевой терапии, при которой пациент лежит на кушетке, и внешний источник рентгеновских лучей направлен на конкретную область тела. Ионизирующее излучение взаимодействует с клетками и поглощается, разрушая ДНК клеток. Брахитерапия представляет собой применение лучевой терапии с использованием закрытых источников, которые помещаются как можно ближе к области, подвергающейся обработке. Этот вид лучевой терапии применяют при лечении опухолей, когда источник излучения может быть помещен в полость тела, например в пищевод или бронх, или когда опухоль достигаема для иглы или катетера, помещенных в опухоль, например, области головы и шеи и кожа. Брахитерапию возможно применять при большинстве локализаций опухоли. Ее можно применять в качестве первичного лечения или в комбинации с наружной лучевой радиотерапией. Лучевая терапия с использованием негерметизированного источника излучения относится к применению растворимых форм радиоактивных веществ, которые парентерально вводят в организм. У всех этих веществ есть одна общая особенность, а именно нерадиоактивная роль исходного вещества. Протонная терапия является частным случаем наружной лучевой радиотерапии, где частицы являются протонами.
Термин «радиоиммунотерапия», как используется здесь, означает лучевую терапию, при которой цитотоксические радионуклиды связаны с антителами с целью доставки токсинов прямо к опухолям-мишеням. Терапия с использованием направленного излучения по сравнению с использованием антител, сцепленных с токсинами (иммунотоксины), имеет преимущество, заключающееся в том, что прилегающие опухолевые клетки, не имеющие соответствующих антигенных детерминант, могут быть разрушены посредством перекрестного облучения. Радиоиммунотерапию иногда называют направленной лучевой терапией, но последний термин может также означать радионуклиды, связанные с неиммунными молекулами (лучевая терапия).
Фраза «фармацевтически приемлемая соль (соли)», как используется здесь, если не оговорено особым образом, включает соли кислотных или основных групп, которые могут присутствовать в соединении. Соединения, являющиеся по природе основаниями, способны образовывать большое разнообразие солей с различными неорганическими и органическими кислотами. Кислотами, которые можно использовать для получения фармацевтически приемлемых кислотных аддитивных солей таких основных соединений, являются те, которые образуют нетоксичные кислотные аддитивные соли, а именно соли, содержащие в себе фармацевтически приемлемые анионы, например ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, кальциевая соль этилендиаминтетрауксусной кислоты, камсилат, карбонат, хлорид, клавуланат, цитрат, дихлоргидрат, соль этилендиаминтетрауксусной кислоты, эдизилат, эстолат, эзилат, этилсукцинат, фумарат, глюцептат, глуконат, глутамат, гликолильарсанилат, гексилрезорцинат, гидрабамин, бромгидрат, хлоргидрат, иодид, изотионад, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилсульфат, мукат, напсилат, нитрат, олеат, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, салицилат, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодид и соли валериановой кислоты. В частности предпочтительные соли включают фосфаты и глюконаты.
Данное изобретение также включает меченные изотопами соединения, которые являются идентичными соединению, указанному в формуле 1, если не считать того, что один или несколько атомов замещены атомом, чья атомная масса или массовое число отличается от атомной массы или массового числа, обычно встречающегося в природе. Примеры изотопов, которые могут быть введены в соединение по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, например 2H, 3H, 11C, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F, и 36Cl, соответственно. Соединения по настоящему изобретению и фармацевтически приемлемые соли вышеуказанных соединений, которые содержат в себе вышеупомянутые изотопы и/или другие изотопы других элементов, находятся в пределах объема данного изобретения. Некоторые меченные изотопами соединения по настоящему изобретению, например те, в которые включены такие радиоактивные изотопы, как 3H, 14C, 11C или 18F, используются в анализе распределения в тканях дозированного средства и/или субстрата. Изотопы тритий, то есть 3H, и углерод -14, то есть 14C, чрезвычайно предпочтительны вследствие их легкого получения и выявления, и 11C и 18F для применения в позиционно-эмиссионной томографии. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, может оказать некоторые терапевтические преимущества, обусловленные большей метаболической стабильностью, например увеличение полужизни in vivo, или уменьшение требуемой дозировки, и таким образом, могут быть предпочтительны в некоторых случаях. Меченное изотопом соединение формулы 1 по настоящему изобретению обычно может быть получено в результате проведения процедур, описанных для немеченных соединений, с заменой немеченного изотопом реагента на легко доступный меченный изотопом реагент.
ADP - аденозиндифосфат.
AE - нежелательное явление.
ALT аланинаминотрансфераза.
ANC - абсолютное число нейтрофилов.
AST - аспартатаминотрансфераза.
AUC - область (площадь) под кривой зависимости концентрация-время.
AUC(0-24) - область (площадь) под кривой зависимости концентрация-время от момента времени 0 до 24 часов.
AUC(0-tlast) - область (площадь) под кривой зависимости концентрация-время от начального момента времени до последнего зарегистрированного наблюдения.
BLD - ниже уровня обнаружения.
BSA - площадь поверхности тела.
BUN - азот мочевины крови.
C0 - исходная концентрация.
CL - клиренс.
Cmax - максимальная концентрация в плазме.
CRC - колоректальный рак.
CTCAEv3 - общие номенклатурные критерии для нежелательных явлений, версия 3.
CV - сердечно-сосудистый.
DLT - предельная токсичность дозы.
DNA - дезоксирибонуклеиновая кислота.
EC50 - концентрация, обуславливающая 50% от максимального эффекта.
ECG - электрокардиограмма.
FcR - рецептор Fc.
5-FU - 5-фторурацил.
GI - желудочно-кишечный.
GIST - желудочно-кишечная стромальная опухоль.
GLP - апробированный лабораторный метод.
HCT - гематокрит.
HERG - ген человека ERG.
hERG-Ikr - ген человека hERG, блокирующий калиевый канал.
HGB - гемоглобин.
GI50 - концентрация, при которой подавляется рост 50% клеток.
IC50 - концентрация, при которой подавляется ферментативная активность на 50%.
IGF - инсулиноподобный фактор роста.
IGF-1 R - рецептор инсулиноподобного фактора роста, тип 1.
IL - интерлейкин.
IP - внутрибрюшинный.
IV - внутривенный.
LLN - нижняя граница нормы.
LLOQ - нижний предел количественных определений.
LV - лейковорин.
MMNG - N-метил-N'-нитро-N-нитрозогуанидин.
MTD - максимально переносимая доза.
NAD - никотинамидадениндинуклеотид.
NOAEL - уровень без отрицательных действий.
PARP - поли(АДФ-рибоза) полимераза.
PBMCs - моноциты периферической крови.
PD - фармакодинамика.
PID - доза, ингибирующая PARP.
PK - фармакокинетика.
PO - перорально.
RBC - эритроциты.
RECIST - критерии оценки ответной реакции солидных опхолей.
QC - контроль качества.
SAE - тяжелые неблагоприятные явления.
SWFI/SWI - стерильная вода для инъекций.
T1/2 - видимый конечный период полувыведения.
Tmax - время достижения Cmax.
ULN - верхняя граница нормы.
Vdss - объем распределения в стационарном состоянии.
WFI - вода для инъекций.
Краткое описание чертежей
На фиг.1 представлены данные эффективности темозоломида в комбинации с 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-оном в виде фосфатной соли в отношении ксенотрансплантата SW620.
На фиг.2 представлены данные эффективности темозоломида в комбинации с 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-оном в виде соли глюкуроновой кислоты в отношении ксенотрансплантата SW620.
На фиг.3 представлены средние профили зависимости концентрации в плазме от времени 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-оном на День-7 (фосфатная соль 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-оном, отдельно) и День 1 и 4 (фосфатная соль 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-оном плюс темозоломид), где фосфатную соль вводили посредством 30-минутной внутривенной инфузии и темозоломид давали
перорально в дозе 100 мг/м2.
На фиг.4 представлена медианная активность PARP в лимфоцитах периферической крови после введение фосфатной соли 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-оном.
Подробное описание изобретения
I. Фармацевтические составы, содержащие 8-фтор-2-{4-[(метиламино)метил]фенил}-1,3,4,5-тетрагидро-6H-азепино[5,4,3-cd]индол-6-он
Соединение формулы 1 и его соли могут быть получены, как описано в патенте США № 6495541; заявке PCT № PCT/IB2004/000915; предварительная заявка на выдачу патента США № 60/612457; и предварительная заявка на выдачу патента США № 60/612459, полные содержания которых включены здесь в виде ссылки. Некоторые исходные вещества могут быть получены в соответствии с методами, известными специалисту в уровне техники и некоторые синтетические модификации могут быть проведены в соответствии с методами, известными специалисту в уровне техники.
Соединение формулы 1 способно образовывать большое разнообразие различных солей с разными неорганическими и органическими кислотами. Несмотря на то, что такие соли должны быть фармацевтически приемлемыми для применения у млекопитающих, зачастую целесообразно на практике первоначально выделить соединение формулы 1 из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить последнюю в свободное основание соединения посредством обработки щелочным реагентом, и затем превратить последнее свободное основание в фармацевтически приемлемую кислотную аддитивную соль. Кислотные аддитивные соли основных соединений по настоящему изобретению легко получить посредством обработки основного соединения по существу эквивалентным количеством выбранной неорганической или органической кислоты в водорастворимой среде или в подходящем органическом растворителе, например метиловом или этиловом спирте. После тщательного выпаривания растворителя быстро получают необходимую твердую соль. Необходимую кислую соль также можно осадить из раствора свободного основания в органическом растворителе посредством добавления в раствор соответствующей неорганической или органической кислоты. Конкретные примеры получения предпочтительной соли, фосфатной соли, можно найти в заявке PCT № PCT/IB2004/000915; предварительной заявке на выдачу патента США № 60/612457; и предварительной заявке на выдачу патента США № 60/612459, полные содержания которых включены здесь в виде ссылки.
Применение соединения формулы 1 может быть осуществлено посредством любого способа, позволяющего доставить соединение до места его действия. Эти способы включают пероральные пути введения, парентеральные инъекции (в том числе внутривенные, подкожные, внутримышечные, внутрисосудистые или вливания), местное или ректальное введение.
Это соединение, например, может быть представлено в такой форме, подходящей для перорального применения, как таблетка, капсула, пилюля, порошок, состав с замедленным высвобождением, раствор, суспензия, для парентерального введения в виде стерильного раствора, суспензии или эмульсии, для местного применения в виде мази или крема, или для ректального введения в виде суппозитории.
Данное соединение может быть представленным в виде единичных дозированных форм, пригодных для однократного введения определенных доз. Предпочтительно, дозированные формы включают подходящий фармацевтический носитель или эксципиент и соединение формулы 1 в качестве активного ингредиента. Дополнительно, дозированные формы могут включать другие дозированные или фармацевтические вещества, носители, адъюванты и тому подобное.
Примеры форм для парентерального введения включают растворы или суспензии в стерильных водных растворах, например водные растворы пропиленгликоля или декстрозы. Такие дозированные формы при желании могут быть соответствующим образом забуферены.
Приемлемые фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Данная фармацевтическая композиция, при необходимости, может содержать в себе дополнительные ингредиенты, такие как ароматизаторы, связующие вещества, эксципиенты и тому подобное. Так при пероральном применении, таблетки, содержащие различные эксципиенты, такие как лимонная кислота, можно использовать вместе с различными дезинтегрирующими веществами, такими как крахмал, альгиновая кислота и некоторые сложные силикаты, и со связывающими веществами, такими как сахароза, желатин и камедь. Часто для получения таблеток дополнительно используют смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции схожего типа также могут использоваться в мягких и твердых наполненных желатиновых капсулах. Предпочтительные вещества для этого включают лактозу или молочный сахар, и полиэтиленгликоли с высокой молекулярной массой. В случае, когда для перорального применения желательны водные суспензии или эликсиры, действующее вещество в них может сочетаться с различными подслащивающими или ароматизирующими веществами, красящими веществами или красителями и, при желании, эмульгирующими веществами или суспендирующими веществами, вместе с такими разбавителями как вода, этанол, пропиленгликоль, глицерин или их сочетанием.
В предпочтительных вариантах осуществления дозированных форм по настоящему изобретению, дозированная форма представляет собой дозированную форму для перорального применения, более предпочтительно, таблетку или капсулу.
В предпочтительных вариантах осуществления способов по настоящему изобретению, соединение формулы 1 применяют парентерально, например, используя лиофилизированный порошок. Получение лиофилизированного порошка для инъекций для клинического использования описано в предварительной заявке на выдачу патента США № 60/612459, полное содержание которой включено здесь в виде ссылки.
Например, фосфатная соль соединения формулы 1 может быть приготовлена и поставлена в виде лиофилизированного порошка для инъекции, 12 мг/ампула (в виде свободного основания), в 10 мл/20 мм ампуле из оранжевого стекла, тип I. Готовая дозированная форма композиции фосфатной соли соединения формулы 1 может содержать в себе фосфатную соль соединения формулы 1, маннит, воду для инъекций и азот. Полученная готовая дозированная форма может представлять собой спекшуюся массу цвета от грязно-белого до желтого. Каждая готовая дозированная форма в ампуле может быт