Пиррольные и пиразольные ингибиторы daao
Иллюстрации
Показать всеИзобретение относится к новым соединениям общей формулы (I)
где R1 и R2 независимо выбраны из водорода, галогена, нитро, алкила, алкиларила и XYR5; Х и Y независимо выбраны из О и (CR6R7)n; R3 обозначает водород, алкил или М; М обозначает ион, выбранный из алюминия, кальция, лития, магния, калия, натрия, цинка или их смеси; Z обозначает CR4; R4 выбран из водорода, галогена, алкила, алкиларила и XYR5; R5 выбран из арила, замещенного арила, гетероарила и замещенного гетероарила; R6 и R7 независимо выбраны из водорода и алкила; n обозначает целое число от 1 до 6; по меньшей мере один из R1 и R2 обозначает XYR5; и по меньшей мере один из Х и Y обозначает
(CR6R7)n, а также к способу повышения концентрации D-серина и/или снижения концентрации токсичных продуктов окисления D-серина под действием DAAO у млекопитающего, включающему введение субъекту терапевтически эффективного количества соединения формулы I, к способу лечения шизофрении, лечения или профилактики потери памяти и/или познавательной способности, к способу улучшения способности к обучению, способу лечения невропатической боли, а кроме того, к фармацевтической композиции, обладающей DAAO ингибирующей активностью, на основе этих соединений. Технический результат: получены новые соединения и фармацевтическая композиция на их основе. 6 н. и 21 з.п. ф-лы, 4 табл.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка является непредварительной и заявляет приоритет согласно предварительной заявки США № 60/532979, поданной 29 декабря 2003 г. Полное описание предварительной заявки США № 60/532979 включено в данный документ посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Фермент оксидаза D-аминокислот (DAAO) метаболизирует D-аминокислоты, в частности, он метаболизирует D-серин in vitro при физиологических значениях pH. DAAO экспрессируется в мозге и периферических системах млекопитающих. D-серин как нейромедиатор играет важную роль в активации N-метил-D-аспартат (NMDA)-селективного подтипа глутаматного рецептора, ионного канала, экспрессирующегося в нейронах, который в данном документе обозначают как рецептор NMDA. Небольшие органические молекулы, которые ингибируют ферментативный цикл DAAO, могут контролировать уровни D-серина и таким образом влиять на активность рецептора NMDA в мозге. Активность рецептора NMDA
играет важную роль в ряде болезненных состояний, таких как шизофрения, психоз, атаксия, ишемия, некоторые виды боли, в том числе невропатическая боль, а также дефициты памяти и познавательной способности.
Небольшие органические молекулы, которые ингибируют ферментативный цикл DAAO, также могут регулировать продукцию токсичных метаболитов, образующихся в результате окисления D-серина, таких как пероксид водорода и аммиак. Так, данные молекулы могут оказывать влияние на прогрессирующую утрату клеток при нейродегенеративных заболеваниях. Нейродегенеративные заболевания представляют собой заболевания, при которых происходит прогрессирующая утрата функций нейронов ЦНС и/или периферических нейронов, которая обычно сопровождается (и, возможно, вызывается) физическим нарушением структуры либо самих нейронов, либо поверхности контакта с другими нейронами. Такие состояния включают в себя болезнь Паркинсона, болезнь Альцгеймера, болезнь Хантингтона и невропатическую боль. Глутаматные рецепторы N-метил-D-аспартата (NMDA) экспрессируются в возбуждающих синапсах во всей центральной нервной системе (ЦНС). Данные рецепторы опосредуют широкий ряд процессов в мозге, в том числе синаптическую пластичность, которые связаны с некоторыми видами формирования памяти и познавательной способности. Чтобы оказать влияние на нейропередачу, NMDA-глутаматные рецепторы должны связаться с двумя агонистами. Один из указанных агонистов представляет собой возбуждающую аминокислоту L-глутамат, тогда как второй, связывающийся по так называемому "глициновому сайту, нечувствительному к стрихнину", как сейчас считают, представляет собой D-серин. У животных D-серин синтезируется из L-серина под действием серин-рацемазы и разлагается до соответствующей кетокислоты под действием DAAO. Полагают, что серин-рацемаза и DAAO вместе играют ключевую роль в модулировании NMDA-опосредованной нейропередачи путем регуляции концентраций D-серина в ЦНС.
Болезнь Альцгеймера проявляется как форма слабоумия, которая обычно включает в себя психическое нарушение, сопровождающееся потерей памяти, спутанностью сознания и потерей ориентации. В контексте настоящего изобретения слабоумие определяется как синдром прогрессирующего ухудшения в разных сферах когнитивной функции, которое в конечном счете приводит к неспособности поддерживать нормальную социальную и/или профессиональную деятельность. Ранние симптомы включают в себя потерю памяти и умеренное, но прогрессирующее ухудшение конкретных когнитивных функций, таких как речь (афазия), моторные навыки (апраксия) и распознавание (агнозия). Самым ранним проявлением болезни Альцгеймера часто является ухудшение памяти, которое является необходимым условием для установления диагноза слабоумия по критериям как Национального института неврологических и коммуникативных заболеваний, так и Ассоциации по удару-болезни Альцгеймера и болезни Альцгеймера и родственным заболеваниям (Stroke-Alzheimer's Disease-and the Alzheimer's Disease and Related Disorders Association) (NINCDS-ADRDA) (McKhannet al., 1984, Neurology 34: 939-944), которые специализируются на болезни Альцгеймера, а также по критериям диагностического и статистического руководства по психическим заболеваниям Американской психиатрической ассоциации, четвертое издание (DSM-IV), которые применимы ко всем формам слабоумия. Когнитивную функцию пациента также можно оценить по когнитивной подшкале шкалы для оценки болезни Альцгеймера (ADAS-cog; Rosen et al., 1984, Am. J. Psychiatry 141: 1356-1364). Болезнь Альцгеймера обычно лечат ингибиторами ацетилхолинэстеразы, такими как гидрохлорид такрина или донепезил. К сожалению, несколько способов лечения потери памяти и ухудшения познавательной способности, существующих в настоящее время, не считаются достаточно эффективными и не позволяют достичь существенных изменений в состоянии пациента, в настоящее время также имеется недостаток стандартных ноотропных лекарственных средств для применения в таких способах лечения.
Нейропсихиатрические нарушения включают в себя шизофрению, аутизм и расстройство с дефицитом внимания. Клиницистам известны признаки, по которым различаются данные заболевания, а также многочисленные схемы их классификации. В качестве основы специалисты в данной области используют стандартную систему диагностики, изложенную в исправленном четвертом издании Диагностического и статистического руководства по психическим заболеваниям (DSM-IV-R), опубликованном Американской психиатрической ассоциацией, которое включено в данное описание посредством ссылки. В соответствии с DSM-IV психические заболевания оси I включают в себя: нарушения, диагностируемые у детей (такие, как расстройство дефицита внимания (ADD) и расстройство гиперактивности и дефицита внимания (ADHD)), и нарушения, диагностируемые у взрослых. Нарушения, диагностируемые у взрослых, включают в себя (1) шизофрению и психические расстройства; (2) когнитивные расстройства; (3) нарушения настроения; (4) нарушения, связанные с тревогой; (5) расстройство пищевого поведения; (6) нарушения, связанные с наркотической зависимостью; (7) личностные нарушения; и (8) "заболевания, еще не включенные" в данную схему.
ADD и ADHD представляют собой заболевания, которые чаще всего встречаются у детей и связаны с повышенной двигательной активностью и пониженной концентрацией внимания. Данные заболевания обычно лечат введением психостимуляторов, таких как метилфенидат и декстроамфетамина сульфат.
Шизофрения относится к группе психоневрологических заболеваний, характеризующихся расстройствами мыслительного процесса, такими как бредовые идеи, галлюцинации и экстенсивное отделение интересов пациента от интересов других людей. Приблизительно один процент населения земного шара страдает от шизофрении, причем данное заболевание характеризуется высоким процентом заболеваемости и смертности. Так называемые негативные симптомы шизофрении включают в себя эмоциональное отупение, анергию, алогию и социальную самоизоляцию, которые можно измерить с помощью SANS (Andreasen, 1983, шкала для оценки негативных симптомов (Scales for the Assessment of Negative Symptoms) (SANS), Iowa City, Iowa). Позитивные симптомы шизофрении включают в себя бредовые идеи и галлюцинации, которые можно измерить с помощью PANSS (шкала позитивных и негативных синдромов (Positive and Negative Syndrome Scale)) (Kay et al., 1987, Schizophrenia Bulletin 13: 261-276). Когнитивные симптомы шизофрении включают в себя ухудшение приобретения, организации и применения интеллектуальных знаний, которые можно измерить с помощью когнитивной подшкалы шкалы позитивных и негативных синдромов (PANSS-когнитивная подшкала) (Lindenmayer et al., 1994, J. Nerv. Ment. Dis. 182: 631-638) или с помощью когнитивной задачи, такой как тест с сортировкой карточек Висконсина. Для лечения позитивных симптомов шизофрении, таких как бредовые идеи и галлюцинации, можно использовать традиционные нейролептические средства, которые действуют на рецептор допамина D2. В большинстве случаев традиционные нейролептические средства и атипичные нейролептические средства, которые действуют на рецепторы допамина D2 и серотонина 5HT2, имеют ограниченную способность лечить когнитивные дефициты и негативные симптомы, такие как эмоциональное отупение (т.е. утрата мимики), анергия и социальная самоизоляция.
Другие состояния, которые проявляются в виде дефицитов памяти и познавательной способности, включают в себя легкую форму беспамятства и закрытую травму головы. Легкая форма беспамятства относится к умеренной утрате способности к восстановлению в памяти или вспоминанию информации, которая уже была запечетлена, усвоена и сохранена в памяти (например, способности вспомнить, где человек положил ключи или запарковал машину). Легкая форма беспамятства обычно встречается у людей старше 40 лет, ее можно диагностировать с помощью стандартных аналитических инструментов, таких как шкала памяти по Векслеру. Закрытая травма головы относится к клиническому состоянию после повреждения или травмы головы. Такое состояние, которое характеризуется ухудшением познавательной способности и памяти, может быть диагностировано как "амнезия вследствие общего медицинского состояния" в соответствии с DSM-IV.
Известные ингибиторы DAAO включают бензойную кислоту, пиррол-2-карбоновые кислоты и индол-2-карбоновые кислоты, как описано Frisell, et al., J. Biol. Chem., 223: 75-83 (1956) и Parikh et al., JACS, 80: 953 (1958). В литературе описано, что индольные производные и, особенно, некоторые индол-2-карбоксилаты используются для лечения нейродегенеративных заболеваний и нейротоксичных повреждений. EP 396124 раскрывает индол-2-карбоксилаты и их производные для лечения или терапии нейротоксичного повреждения, вызванного заболеванием ЦНС или травматическим событием, при лечении или терапии нейродегенеративного заболевания. Приводится несколько примеров травматических событий, которые могут приводить к нейротоксичному повреждению, в том числе гипоксия, аноксия и ишемия, связанные с перинатальной асфиксией, остановка сердца или удар. Нейродегенерация связана с такими заболеваниями ЦНС, как конвульсии и эпилепсия. Патенты США №№ 5373018; 5374649; 5686461; 5962496 и 6100289, Cugola, раскрывают лечение нейротоксичного повреждения и нейродегенеративного заболевания индольными производными. Ни в одной из вышеуказанных ссылок не упоминается улучшение или повышение способности к обучению, памяти или познавательной способности.
WO 03/039540 раскрывает улучшение способности к обучению, памяти или познавательной способности и лечение нейродегенеративных заболеваний с помощью ингибиторов DAAO, включающих индол-2-карбоновые кислоты. Однако остается потребность в новых лекарственных средствах, клинически эффективных при лечении дефектов памяти, ухудшенной способности к обучению и утраты познавательной способности, а также других симптомов, связанных с активностью или утратой рецептора NMDA.
van Herk, et al. (J. Med. Chem., 46 (18): 3945-51(2003)) описали некоторые пиразол-3-карбоновые кислоты как частичные агонисты рецептора никотиновой кислоты. Описан синтетический способ получения данных соединений и установлено, что указанные соединения ингибируют связывание никотиновой кислоты. Активность рецептора NMDA или ингибирование DAAO в данной работе не упоминается.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Неожиданно было обнаружено, что некоторые пиррольные и пиразольные производные более эффективно ингибируют активность DAAO, чем известные ингибиторы. Было показано, что данные соединения ингибируют DAAO in vitro при очень низких концентрациях, особенно, по сравнению с известными ингибиторами DAAO, такими как бензойная кислота, пиррол-2-карбоновая кислота и индол-2-карбоновая кислота. Благодаря способности ингибировать активность DAAO, некоторые пиррольные и пиразольные производные можно использовать для лечения ряда заболеваний и/или состояний, при которых модулирование уровня D-серина и/или продуктов его окисления приводит к эффективному улучшению симптомов при уменьшении нежелательных побочных эффектов. В частности, данные соединения можно использовать для повышения уровней D-серина и снижения уровней токсичных продуктов окисления D-серина; таким образом, указанные соединения можно использовать для улучшения способности к обучению, памяти и познавательной способности или для лечения шизофрении, для лечения или профилактики потери памяти и/или познавательной способности, связанной с болезнью Альцгеймера, для лечения атаксии или для профилактики утраты нейронной функции, характерной для нейродегенеративных заболеваний.
Соответственно, в одном аспекте данное изобретение относится к способам повышения уровня D-серина и снижения уровня токсичных продуктов окисления D-серина, к способам улучшения способности к обучению, памяти и/или способности к познаванию, к способам лечения шизофрении, лечения или профилактики потери памяти и/или утраты познавательной способности, связанных с болезнью Альцгеймера, лечения атаксии, невропатической боли или для профилактики утраты нейронной функции, характерной для нейродегенеративных заболеваний.
Данные способы включают введение субъекту терапевтического количества соединения формулы I или его фармацевтически приемлемых соли или сольвата
где
R1 и R2 независимо выбраны из водорода, галогена, нитро, алкила, ацила, алкиларила и XYR5; или R1 и R2 вместе образуют 5-, 6-, 7- или 8-членную замещенную или незамещенную карбоциклическую или гетероциклическую группу;
X и Y независимо выбраны из O, S, NH и (CR6R7)n;
R3 обозначает водород, алкил или M+;
M обозначает алюминий, кальций, литий, магний, калий, натрий, цинк или их смесь;
R6 и R7 независимо выбраны из водорода и алкила;
Z обозначает N или CR4;
R4 выбран из водорода, галогена, нитро, алкила, алкиларила и XYR5;
R5 выбран из арила, замещенного арила, гетероарила и замещенного гетероарила;
n обозначает целое число от 1 до 6;
по меньшей мере один из R1, R2 и R4 отличается от водорода и
по меньшей мере один из X и Y обозначает (CR6R7)n.
Во втором аспекте данное изобретение относится к способам лечения аутизма, шизофрении, болезни Альцгеймера, атаксии, невропатической боли или нейродегенеративных заболеваний, включающих в себя введение терапевтически эффективного количества вышеуказанного ингибитора оксидазы D-аминокислот (DAAO) формулы I субъекту, нуждающемуся в лечении одного или нескольких из указанных состояний.
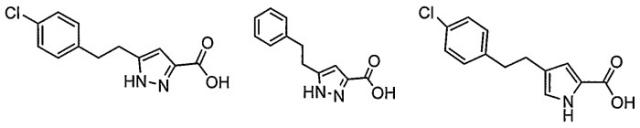
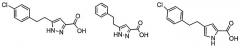
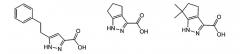
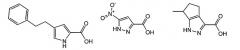
В предпочтительных воплощениях соединения формулы I представляют собой замещенные пиррол-2-карбоновые кислоты или пиразол-3-карбоновые кислоты, например:
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам повышения уровня D-серина и снижения уровня токсичных продуктов окисления D-серина, к способам улучшения способности к обучению, памяти и/или способности к познаванию или к способам лечения шизофрении, лечения или профилактики потери памяти и/или утраты познавательной способности, связанных с болезнью Альцгеймера, лечения атаксии, невропатической боли или для профилактики утраты нейронной функции, характерной для нейродегенеративных заболеваний. Данные способы включают введение субъекту терапевтического количества соединения формулы I
или его фармацевтически приемлемых соли или сольвата, где
R1 и R2 независимо выбраны из водорода, галогена, нитро, алкила, ацила, алкиларила и XYR5; или R1 и R2 вместе образуют 5-, 6-, 7- или 8-членную замещенную или незамещенную карбоциклическую или гетероциклическую группу;
X и Y независимо выбраны из O, S, NH и (CR6R7)n;
R3 обозначает водород, алкил или M+;
M обозначает алюминий, кальций, литий, магний, калий, натрий, цинк или их смесь;
R6 и R7 независимо выбраны из водорода и алкила;
Z обозначает N или CR4;
R4 выбран из водорода, галогена, нитро, алкила, алкиларила и XYR5;
R5 выбран из арила, замещенного арила, гетероарила и замещенного гетероарила;
n обозначает целое число от 1 до 6;
по меньшей мере один из R1, R2 и R4 отличается от водорода и
по меньшей мере один из X и Y обозначает (CR6R7)n.
Терапевтическое лечение соединением формулы I приводит к улучшению памяти и улучшению и/или повышению способности к обучению и познавательной способности, особенно у субъектов, страдающих от нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Хантингтона или болезнь Паркинсона. Данные соединения также облегчают когнитивные дисфункции, связанные с возрастом, и улучшают состояние при кататонической шизофрении.
Соединения формулы I обладают уникальными фармакологическими характеристиками в отношения ингибирования DAAO и влияют на активность рецептора NMDA в мозге, в частности, путем регуляции уровней D-серина. Следовательно, данные соединения можно эффективно использовать для лечения состояний и заболеваний, особенно заболеваний, связанных с ЦНС и опосредованных активностью DAAO, D-серина и/или рецептора NMDA, причем указанные соединения обладают пониженными побочными эффектами по сравнению с существующими в настоящее время стандартными лекарственными средствами. Указанные состояния и заболевания включают, не ограничиваясь ими, психоневрологические заболевания, такие как шизофрения, аутизм, расстройство дефицита внимания (ADD и ADHD) и нарушение способности к обучению у детей, и нейродегенеративные заболевания и нарушения, такие как MLS (мозжечковая атаксия), болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз, синдром Дауна, невропатическая боль, полиинфарктная деменция, эпилепсия, контузионные повреждения (например, повреждения спинного мозга и головы), нейродегенерация, вызванная вирусной инфекцией (например, СПИД, энцефалопатии), эпилепсия, легкая форма беспамятства и закрытая травма головы. Соединения формулы I также можно использовать для лечения нейротоксического повреждения, сопровождающего мозговой удар, тромбоэмболический удар, геморрагический удар, ишемию головного мозга, спазм мозговых сосудов, гипогликемию, амнезию, гипоксию, аноксию, перинатальную асфиксию и остановку сердца.
Соответственно настоящее изобретение относится к способам повышения концентрации D-серина и/или снижения концентрации токсичных продуктов окисления D-серина под действием DAAO у млекопитающих, к способам лечения шизофрении, лечения или профилактики потери памяти и/или познавательной способности, связанной с болезнью Альцгеймера, лечения или профилактики утраты нейронной функции, характерной для нейродегенеративных заболеваний, к способам улучшения способности к обучению, памяти и/или познавательной способности или лечения невропатической боли. Каждый из данных способов включает в себя введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемых соли или сольвата
где
R1 и R2 независимо выбраны из водорода, галогена, нитро, алкила, ацила, алкиларила, арилалкила и XYR5; или R1 и R2 вместе образуют 5-, 6-, 7- или 8-членную замещенную или незамещенную карбоциклическую или гетероциклическую группу;
X и Y независимо выбраны из O, S, NH и (CR6R7)n;
R3 обозначает водород, алкил или M+;
M обозначает алюминий, кальций, литий, магний, калий, натрий, цинк или их смесь;
Z обозначает N или CR4;
R4 выбран из водорода, галогена, нитро, алкила, алкиларила и XYR5;
R5 выбран из арила, замещенного арила, гетероарила и замещенного гетероарила;
R6 и R7 независимо выбраны из водорода и алкила;
n обозначает целое число от 1 до 6;
по меньшей мере один из R1, R2 и R4 отличается от водорода и
по меньшей мере один из X и Y обозначает (CR6R7)n.
В некоторых воплощениях D-серин или циклосерин можно вводить вместе с соединением (соединениями) формулы I.
Соединения формулы I обычно более селективны, чем известные ингибиторы DAAO, в том числе индол-2-карбоксилаты, и обладают более высокой селективностью в отношении ингибирования DAAO, чем в отношении связывания с сайтом связывания D-серина рецептора NMDA. Данные соединения также обладают предпочтительным профилем активности, в том числе хорошей биодоступностью. Соответственно их применение имеет преимущества по сравнению со многими известными в данной области способами лечения заболеваний, опосредованных активностью DAAO, D-серина или NMDA. Например, в отличие от многих традиционных нейролептических средств, ингибиторы DAAO могут вызывать желательное уменьшение когнитивных симптомов шизофрении. Традиционные нейролептические средства часто вызывают нежелательные побочные эффекты, в том числе позднюю дискинезию (необратимое нарушение непроизвольного движения), экстрапирамидальные симптомы и акатизию, которые можно уменьшить или ограничить путем введения соединения формулы I.
В другом аспекте настоящее изобретение также относится к соединениям формулы IA или их фармацевтически приемлемым солям или сольватам и к фармацевтическим композициям, содержащим данные соединения
где
R1a, R2a и R4 независимо выбраны из водорода, галогена, нитро, алкила, алкиларила, арилалкила и XYR5;
X и Y независимо выбраны из O, S, NH и (CR6R7)n;
R3 обозначает водород, алкил или M+;
M обозначает алюминий, кальций, литий, магний, калий, натрий, цинк или их смесь;
R5 выбран из арила, замещенного арила, гетероарила и замещенного гетероарила;
R6 и R7 независимо выбраны из водорода и алкила;
Z обозначает N или CR4;
n обозначает целое число от 1 до 6;
по меньшей мере один из R1а и R2а обозначает XYR5 и
по меньшей мере один из X и Y обозначает (CR6R7)n;
при условии, что формула 1A не включает в себя 5-фенетил-1H-пиразол-3-карбоновую кислоту, то есть если R1a обозначает водород, R2a обозначает XYR5; X и Y обозначают (CR6R7)n; R3 обозначает водород, R6 и R7 обозначают водород; Z обозначает N; n равно 2, R5 не может обозначать фенил.
Соединения формулы IA образуют подкласс соединений формулы I и, следовательно, могут использоваться в способах настоящего изобретения без ограничения.
В предпочтительных воплощениях соединения формул I и IA представляют собой пиррол-2-карбоновые кислоты, замещенные по 4 положению, или пиразол-3-карбоновые кислоты, замещенные по 5 положению. Предпочтительными заместителями для соединений формул I и IA, 4-замещенных пиррол-2-карбоновых кислот и 5-замещенных пиразол-3-карбоновых кислот являются арилалкил, замещенный арилалкил и высший алкил (C6C20). Предпочтительными арилалкильными заместителями являются арилэтильные группы, особенно фенетил, в этом случае соединения формул I и IA представляют собой пиррол-2-карбоновые кислоты, замещенные по 4 положению замещенной или незамещенной арильной группой, соединенной с 4 положением пиррола через двухатомный линкер, или пиразол-3-карбоновые кислоты, замещенные по 5 положению замещенной или незамещенной арильной группой, соединенной с 5 положением пиррола через двухатомный линкер. В других предпочтительных воплощениях соединений формул I и IA, пиррол-2-карбоновых кислот и пиразол-3-карбоновых кислот R1 и R2 вместе образуют 5-, 6-, 7- или 8-членную замещенную или незамещенную карбоциклическую или гетероциклическую группу.
Особенно предпочтительные пиррольные и пиразольные ингибиторы оксидазы D-аминокислот включают в себя:
Данное изобретение включает соединения формул I и IA, а также фармацевтически приемлемые соли и сольваты данных соединений. Термин "соединение или фармацевтически приемлемые соли или сольваты данного соединения" подразумевает включающее значение "или", то есть охватывает вещество, находящееся в виде и соли и сольвата. Фармацевтически приемлемые соли включают, без ограничения, неорганические соли алюминия, кальция, лития, магния, калия, натрия и цинка и органические соли лизина, N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина (N-метилглюкамина), прокаина и трометамина.
Соединения формул I и IA можно получить известными способами, используя методы, описанные в разделе Примеры, или с помощью способов, изображенных на схемах 1-5.
Схема 1
Способ синтеза исходных веществ: сложных эфиров 3-замещенных 1H-пиррол-2-карбоновых кислот
На схеме 1 R1 обозначает водород, галоген, нитро, алкил, ацил, алкиларил, арилалкил или XYR5; а R5 обозначает арил, замещенный арил, гетероарил или замещенный гетероарил.
Схема 2
Способ синтеза исходных веществ: сложных эфиров 5-замещенных 1H-пиррол-2-карбоновых кислот
Схема 3
Способ синтеза 4-замещенных, 3,4-дизамещенных-, 4,5-дизамещенных или 3,4,5-тризамещенных 1H-пиррол-2-карбоновых кислот
Примечание: все хлорангидриды кислот, используемые в качестве исходных веществ, либо получают из коммерческих источников, либо синтезируют из коммерчески доступных соответствующих карбоновых кислот с использованием тионилхлорида или оксалилхлорида. Можно использовать следующие стандартные экспериментальные условия: раствор требуемой кислоты в тионилхлориде (или в толуоле, содержащем 10 эквивалентов тионилхлорида) нагревают при 60°C в течение 1-4 часов с получением соответствующего ацилхлорида, затем растворитель упаривают в вакууме. Хлорангидриды кислот используют в реакциях ацилирования без дополнительной очистки.
Схема 4
Способ синтеза амин-замещенных 1H-пиррол-2-карбоновых кислот с использованием восстановительного аминирования
Примечание: на данной схеме Ar обозначает ароматическую группу, такую как фенил, или замещенную ароматическую группу, такую как 4-хлорфенил, или гетероарил, или замещенный гетероарил. Вместо ацетилхлорида можно также использовать другие хлорангидриды кислот, такие как, например, пропионилхлорид.
Схема 5
Способ синтеза 3,4-дизамещенных 1H-пиррол-2-карбоновых кислот по Бартону-Зарду
Примечание: на данной схеме Ar обозначает ароматическую группу, такую как фенил, или замещенную ароматическую группу, такую как 4-хлорфенил, n=0, 1 или 2, или гетероарил, или замещенный гетероарил, а R=водород, галоген, нитро, алкил или ацил.
Способы лечения настоящего изобретения можно применять к субъектам, включающим в себя людей (пациенты) и других млекопитающих, нуждающихся в лечении указанного состояния. Пациентами, нуждающимися в лечении с целью улучшения или повышения способности к обучению и памяти, являются пациенты, имеющие симптомы деменции или потери способности к обучению и памяти. Субъекты, страдающие амнезией, обладают ухудшенной способностью к восприятию новой информации или не способны вспомнить ранее усвоенную информацию или последние события. Дефицит памяти наиболее отчетливо обнаруживается с помощью задач, требующих спонтанного вспоминания, он также проявляется, если экзаменатор предоставляет субъекту стимул для вспоминания через некоторое время. Нарушение памяти должно быть достаточно тяжелым, чтобы вызвать значительное ухудшение социальной или профессиональной деятельности с существенным отклонением от первоначального уровня. Дефицит памяти может быть связан с возрастом, или он может возникать в результате заболевания или другого фактора. Деменция характеризуется несколькими клинически значимыми дефицитами познавательной способности, которые вызывают существенное отклонение от предыдущего уровня деятельности, в том числе ухудшением памяти, включающим в себя неспособность усваивать новый материал или забывание ранее усвоенного материала. Память можно формально тестировать путем измерения способности запечетлевать, сохранять, вспоминать и узнавать информацию. Для установления диагноза деменции также требуется присутствие, по меньшей мере, одного из следующих когнитивных нарушений: афазии, апраксии, агнозии или нарушения оперативной деятельности. Указанные нарушения речи, двигательной активности, узнавания объектов и абстрактного мышления соответственно должны быть достаточно тяжелыми, чтобы в сочетании с дефицитом памяти вызвать ухудшение профессиональной или социальной деятельности с отклонением от предыдущего более высокого уровня деятельности.
Соединения формулы I и IA также можно использовать в сочетании с терапией, включающей введение D-серина или его аналога, такого как соль D-серина, сложный эфир D-серина, алкилированный D-серин или предшественник D-серина, или в сочетании с терапией, включающей введение нейролептических средств, антидепрессантов, психостимуляторов и/или лекарственных средств, используемых для лечения болезни Альцгеймера.
Разработано несколько животных моделей способности к обучению и памяти для определения полезных эффектов лечения, связанных с повышением когнитивной функции, и побочных эффектов, связанных с потенциалом. Описание тестов, которые можно использовать для оценки изменений познавательной способности у видов, отличных от человека, приведено в Sarter, Martin, Intern. J. Neuroscience, 32: 765-774 (1987). Данные тесты включают в себя водный лабиринт Морриса (Stewart and Morris, Behavioral Neuroscience, R. Saghal, Ed., p. 107 (1993)), модели отсроченного несовпадения образца и социальной дискриминации.
Водный лабиринт Морриса является одной из наилучших утвержденных моделей способности к обучению и памяти, с его помощью можно определять действие ряда фармакологических средств, связанное с повышением когнитивных функций. Выполнение задачи в лабиринте очень зависит от манипуляций с гиппокампом, области мозга, важной для пространственного обучения животных и укрепления памяти у людей. Более того, улучшение выполнения водного лабиринта Морриса свидетельствует о возможной клинической эффективности соединения как усилителя когнитивной функции. Например, лечение ингибиторами холинэстеразы или селективными мускариновыми холинэргическими агонистами уменьшает дефицит способности к обучению по лабиринту Морриса в животной модели способности к обучению и памяти, а также у клинических популяций с деменцией. Кроме того, данная животная модель точно воспроизводит степень ухудшения с возрастом и повышение чувствительности энграммы к задержке или возмущающему воздействию перед тестированием, которые характерны для амнестических пациентов. Данный тест представляет собой простую задачу пространственного обучения, для выполнения которой животное помещают в резервуар с тепловатой водой, которой придают мутность путем добавления порошкообразного молока. Животных учат находить местоположение платформы с помощью зрительных ориентиров, расположенных в лабиринте и в помещении для испытаний; данный навык называют способностью находить местоположение предмета. Группы животных получают контрольный раствор или дозу лекарственного средства за определенное время до испытания или через определенное время после испытания. Через три дня после начала испытаний контрольные животные, как правило, достигают платформы в течение пяти-десяти секунд. Действие лекарственного средства, связанное с модулированием памяти, определяют по изменению данного периода времени. Во второй или опытной фазе тестирования животных, обученных находить положение платформы, помещают в резервуар, из которого удалена платформа. Животные, которые помнят положение платформы, проводят больше времени в секторе, в котором находилась платформа, и совершают больше пересечений места, ранее занятого платформой. Улучшение памяти или познавательной способности наблюдают у животных, проводящих больше времени в правильном секторе или совершающих больше пересечений места, ранее занятого платформой, по сравнению с контрольными животными. Ухудшение памяти или познавательной способности наблюдают у животных, проводящих меньше времени в правильном секторе или совершающих меньше пересечений места, ранее занятого платформой, по сравнению с контрольными животными.
В модели отсроченного несовпадения образца животному предоставляют стимул (например, рычаг A). Через некоторое время животному дают возможность выбирать из двух вариантов (например, рычаг A и рычаг B). Выбор варианта, не совпадающего с первоначальным стимулом (рычаг B), сопровождается наградой. Если частота выбора нужного варианта превышает случайное значение, значит, первоначальный стимул забыт. По мере увеличения времени между предоставлением стимула и выбором выполнение задачи ухудшается и выбор сводится к чистой случайности. Число правильных вариантов для определенного промежутка времени связано с познавательной способностью. Дефицит познавательной способности или памяти можно получить физическим способом, биохимическим способом или путем использования старых животных.
В тесте социального взаимодействия в клетку тестируемого животного (животное А) вводят чужое животное (животное В). Животное А распознает введенное животное как чужое и исследует его. Если животное B удалить и снова ввести его через некоторое время, тестируемое животное (животное A) будет тратить меньше времени на исследование нового обитателя клетки, поскольку оно его помнит с предыдущего введения. По мере увеличения времени между введениями тестируемое животное тратит больше времени на повторное исследование нового животного, поскольку хуже вспоминает его. Время, затрачиваемое на исследование нового обитателя клетки при повторном введении, обратно пропорционально познавательной способности. Дефицит познавательной способности или памяти можно получить физическим способом, биохимическим способом или путем использования старых животных.
Способы улучшения способности к обучению и памяти у людей можно оценить с помощью таких тестов, как шкала памяти по Векслеру и миниментальный тест (Minimental test). Стандартным клиническим тестом для определения ухудшения способности к обучению и памяти у пациента является миниментальный тест на способность к обучению и память (Folstein et al., J. Psychiatric Res. 12: 185, 1975), в особенности его используют для пациентов, страдающих от травмы головы, синдрома Корсакова или удара. Результат теста служит показателем кратковременной, рабочей памяти, которая быстро ухудшается на ранних стадиях заболеваний, связанных с деменцией или амнезией. Пациенту читают десять пар несвязанных между собой слов (например, армия-стол). Затем пациенту читают первое слово из каждой пары и просят вспомнить второе. Пониженное число вспоминаемых парных слов по сравнению с контрольной группой свидетельствует об ухудшении памяти. Вывод об улучшении способности к обучению и памяти делают на основании либо (a) статистически значимого отличия в выполнении теста пациентами, получающими лекарственный препарат, по сравнению с группой, получающей плацебо; либо (b) статистически значимого отклонения в выполнении теста от стандарта, соответствующего данной модели заболевания. Животные модели или клинические