Синтез -l-2'-дезоксинуклеозидов
Иллюстрации
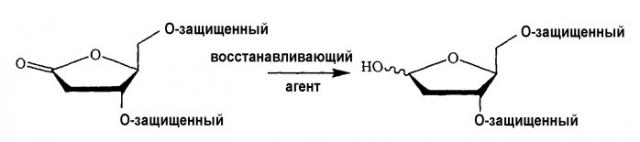
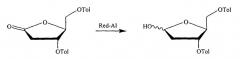
Показать всеИзобретение относится к способу получения 2'-дезокси-β-L-тимидина, включающему взаимодействие 5'-O-тритил- или 5'-O-диметокситритил-защищенного 2,2'-ангидро-1-β-L-арабинофуранозилтимина с восстановителем RedAl и комплексообразующим агентом 15-краун-5-эфиром в полярном растворителе 1,2-диметоксиэтане (DME) или тетрагидрофуране (ТГФ) с получением 5'-O-тритил- или 5'-O-диметокситритил-защищенного 2'-дезокси-(3-L-тимидина, подвергающегося при необходимости удалению защиты. Изобретение относится также к способу получения 2'-дезокси-(3-L-тимидина, включающему взаимодействие L-арабинозы с цианамидом с последующим взаимодействием промежуточного продукта - L-арабинофуранозиламинооксазолина - с циклизующим или конденсирующим агентом с образованием 2,2'-ангидро-1-(3-L-арабинофуранозилтимина; взаимодействие последнего с восстановителем RedAl и комплексообразующим агентом 15-краун-5-эфиром в полярном растворителе 1,2-диметоксиэтане (DME) или тетрагидрофуране (ТГФ) с получением 2'-дезокси-β-L-тимидина, причем L-арабинофуранозиламинооксазолин может быть защищен тритилом или диметокситритилом в положении 5' до или после взаимодействия с циклизующим или конденсирующим агентом; и удаление защиты необязательно защищенного 2'-дезокси-β-L-тимидина, если это необходимо или желательно. Применение в данных способах такого восстановителя, как Red-Al, и такого комплексообразующего агента, как 15-краун-5-эфир, вызывает реакцию внутримолекулярного замещения и образование требуемого нуклеозидного продукта с хорошими выходами. Соединение, полученное способами по настоящему изобретения, имеет важное значение в качестве противовирусных и/или антинеопластических средств. 2 н. и 11 з.п. ф-лы, 29 ил.
Реферат
Перекрестная ссылка на родственные заявки
Данное изобретение притязает на приоритет в соответствии с предварительными заявками на выдачу патента США № 60/483711, поданной 30 июня 2003 года, и 60/558616, поданной 1 апреля 2004 года.
Область техники
Данное изобретение относится к способам получения 2'-дезокси- или 2'-модифицированных нуклеозидов, в частности, β-L-2'-дезокситимидина. Настоящее изобретение представляет собой улучшенный способ, который легко масштабируется в целях промышленного производства. Соединения, полученные способом согласно настоящему изобретению, имеют важное значение в качестве противовирусных средств, антинеопластических средств и промежуточных продуктов синтеза фармацевтических соединений и композиций.
Уровень техники
HBV является второй причиной злокачественных опухолей человека, уступая только табаку. Механизм, посредством которого HBV индуцирует злокачественную опухоль, не известен, хотя предполагается, что он может непосредственно запускать развитие опухоли или косвенно запускать развитие опухоли посредством хронического воспаления, цирроза и регенерации клеток, связанных с инфекцией.
Вирус гепатита B достиг эпидемических уровней в мире. После инкубационного периода, составляющего от двух до шести месяцев, в течение которого хозяин не подозревает об инфекции, HBV-инфекция может приводить к острому гепатиту и повреждению печени, что вызывает боли в животе, желтуху и повышенные уровни в крови некоторых ферментов. HBV может вызывать скоротечный гепатит, быстро прогрессирующий, часто в форме смертельного заболевания, при котором разрушаются огромные участки печени.
Пациенты обычно излечиваются от острого гепатита. Однако у некоторых пациентов высокие уровни вирусного антигена сохраняются в крови в течение длительного или неограниченного периода времени, вызывая хроническую инфекцию. Хронические инфекции могут приводить к хроническому персистирующему гепатиту. Наиболее часто пациенты, инфицированные хроническим персистирующим HBV, встречаются в развивающихся странах. К середине 1991 года было примерно 225 миллионов хронических носителей HBV только в Азии, а во всем мире почти 300 миллионов носителей. Хронический персистирующий гепатит может вызывать утомление, цирроз печени и гепатоклеточную карциному, первичный рак печени.
В заявке WO 96/40164, поданной Emory University, UAB Research Foundation и национальным центром научных исследований (CNRS), описан ряд β-L-2',3'-дидезоксинуклеозидов для лечения гепатита B.
В заявке WO 95/07287, также поданной Emory University, UAB Research Foundation и национальным центром научных исследований (CNRS), описаны 2'- или 3'-дезокси- и 2',3'-дидезокси-β-L-пентофуранозилнуклеозиды для лечения ВИЧ-инфекции.
В заявке WO 96/13512, поданной Genencor International, Inc., и Lipitek, Inc., описано получение L-рибофуранозилнуклеозидов в качестве противоопухолевых средств и противовирусных средств.
Idenix Pharmaceuticals, Ltd. описывают 2'-дезокси-L-эритропентофуранонуклеозиды и их применение при лечении HBV в патентах США №№ 6395716; 6444652; 6566344 и 6539837. А также см. WO 00/09531. Описан способ лечения инфекции гепатита B у людей и других животных-хозяев, который заключается во введении эффективного количества биологически активного 2'-дезокси-β-L-эритропентофуранонуклеозида (альтернативно называемого β-L-dN или β-L-2'-dN) или его фармацевтически приемлемой соли, сложного эфира или пролекарства, включая β-L-дезоксириботимидин (β-L-dT), β-L-дезоксирибоцитидин (β-L-dC), β-L-дезоксирибоуридин (β-L-dU), β-L-дезоксирибогуанозин (β-L-dG), β-L-дезоксирибоаденозин (β-L-dA) и β-L-дезоксирибоинозин (β-L-dI), вводимых либо отдельно, либо в комбинации, необязательно в фармацевтически приемлемом носителе. Также заявлены 5'- и N4- (цитидин) или N6- (аденозин) ацилированные или алкилированные производные активного соединения или 5'-фосфолипиды или 5'-эфиры липидов.
Von Janta-Lipinski et al., в J. Med. Chem., 1998, 41 (12), 2040-2046, описывают применение L-энантиомеров 3'-фтор-модифицированных β-2'-дезоксирибонуклеозид-5'-трифосфатов для ингибирования полимераз гепатита B. В частности, 5'-трифосфаты 3'-дезокси-3'-фтор-β-L-тимидина (β-L-FTTP), 2',3'-дидезокси-3'-фтор-β-L-цитидина (β-L-FdCTP) и 2',3'-дидезокси-3'-фтор-β-L-5-метилцитидина (β-L-FMethCTP) заявлены в качестве эффективных ингибиторов ДНК-полимераз HBV. Кроме того, von Janta-Lipinski et al. описывают биологическую активность трифосфата β-L-тимидина (но не β-L-2'-dC) в качестве нуклеозидного ингибитора эндогенных ДНК-полимераз HBV и DHBV. Однако оценивали только трифосфорилированный β-L-тимидин, но не заявленную нефосфорилированную форму, и статья не содержит комментария по поводу того, фосфорилируются ли указанные β-L-нуклеозиды в клетках или in vivo, или, что более важно, не содержит комментария относительно эффективности фосфорилирования β-L-тимидина in vivo. Поэтому в статье не говориться о том, что β-L-тимидин может обладать какой-либо активностью по отношению к гепатиту B в клетке или in vivo. См. также WO 96/1204.
В Европейской заявке на выдачу патента № 0352248 A1 Johansson et al. описывают применение соединений L-рибофуранозила для лечения гепатита B.
Verri et al. описывает применение 2'-дезокси-β-L-эритропентофуранонуклеозидов в качестве антинеопластических средств и в качестве противогерпетических средств (Mol. Pharmacol. (1997), 51(1), 132-138 и Biochem. J. (1997), 328(1), 317-20). Saneyoshi et al. продемонстрировали применение 2'-дезокси-L-рибонуклеозидов в качестве ингибиторов обратной транскриптазы (I) для борьбы против ретровирусов и для лечения СПИДа, Jpn. Kokai Tokkyo Koho JP06293645 (1994).
Giovanni et al., в частности, тестировали 2'-дезокси-β-L-эритропентофуранонуклеозиды против вируса псевдобешенства (PRV), Biochem. J. (1993), 294 (2), 381-5.
Химиотерапевтические применения 2'-дезокси-β-L-эритропентофуранонуклеозидов исследовали Tyrsted et al. (Biochim. Biophys. Acta (1968), 155 (2), 619-22) и Bloch, et al. (J. Med. Chem. (1967), 10 (5), 908-12).
Morris S. Zedeck et al. впервые описали β-L-dA для ингибирования синтеза индуцируемых ферментов у Pseudomonas testosteroni, Mol. Phys. (1967), 3 (4), 386-95.
Кроме того, производные цитозина применимы в качестве промежуточных продуктов для получения таких лекарственных средств, как цитидиндифосфатхолин, родовое название которых цитиколин.
В публикации патента США № 20030083306, Idenix Pharmaceuticals, Ltd., описаны 3'-пролекарства 2'-дезокси-β-L-нуклеозидов для лечения HBV. См. также WO 01/96353.
В патенте США № 4957924 Beauchamp описывает различные терапевтические сложные эфиры ацикловира.
17-21 апреля 2002 года на конференции Европейской ассоциации по исследованию печени в Мадриде, Испания, Siihnel et al., Gilead Sciences, Inc., представили стендовое сообщение, свидетельствующее, что комбинации адефовира с β-L-2'-дезокситимидином дает аддитивный эффект против HBV in vitro.
Синтез нуклеозидов
Способы получения нуклеозидов и промежуточных фуранозильных соединений хорошо известны в предшествующем уровне техники. В 1952 Pratt и соавторы сообщили о синтезе L-дезокситимидина (LdT) из арабинозы (J. W. Pratt et al., J. Am. Chem. Soc., 1952, 74: 2200-2205). Путь синтеза, описанный Pratt, заключается в образовании метилгликозида из L-арабинозы с последующим превращением в метилтиотиокарбонат и восстановлением до дезоксисахара. Альтернативно 2-гидроксигруппу превращали в соответствующую ей группу мезилата, которую затем подвергали восстановительному расщеплению, чтобы получить конечный продукт LdT (J. W. Pratt et al., J. Am. Chem. Soc., 1952, 74:2200-2205; H. Urata et al., Nucleic Acids Res., 1992, 20:3325-3332).
Вариации синтеза LdT осуществляли Shull et al., Sznaidman et al., Wang et al. и Stick et al., каждый из которых превращал L-арабинозу в метил-2'-дезоксирибофуранозид через промежуточный гликаль (B.K. Shull et al., J. Carbohydr. Chem., 1996, 15:955-64; M. L. Sznaidman et al., Nucleosides, Nucleotides & Nucleic Acids, 2002, 21:155-63; Z.X. Wang et al., Nucleosides, Nucleotides & Nucleic Acids, 2001, 20:11-40; и R.V. Stick et al., Aust. J. Chem. 2002, 55:83-85).
В 1969 году Niedballa и Vorbruggen описали способ получения β-нуклеозидов посредством сочетания силилированного N-гетероциклического соединения, в частности пиримидина, с 1-O-алкил- или предпочтительно 1-ацил-защищенным сахаром, таким как 1-ацил-защищенная рибоза, дезоксирибоза, арабиноза или глюкоза. В реакции использовали реагент Фриделя-Крафтcа в качестве катализатора, и реакция протекала при температурах окружающей среды (DE 1919307, Schering Aktiengesellschaft). Авторы изобретения отмечали, что данный способ неожиданно давал почти исключительно β-аномерный продукт и мог работать в случае урацила и цитозина, но не в случае тимидина (DE 1919307, примеры 1-10 и 12-15).
В своих примерах Niedballa и Vorbruggen сообщили только об 1-O-ацетил-, 1-ацетил- и 1-O-метил-производных соединениях рибозы, дезоксирибозы и арабинофуранозы в качестве исходных реагентов (DE 1191307, примеры 1-16). Нигде не использовали 1-галогенсахар. К тому же авторы изобретений отмечали, что применение 1-галогенсахара в качестве реагента нежелательно из-за его нестабильности (DE 1191307; JP 63026183, Sato et al.). В одном примере, в котором цитозиновое основание подвергали взаимодействию с сахаром 2'-дезоксирибозой, исходным соединением была 1-O-метил-2-дезокси-3,5-дитолуилрибоза (DE 1919307, пример 7). Не является неожиданным то, что в данной реакции образовывался β-аномер почти при полном исключении α-аномера, так как известно, что 3'-сложноэфирные производные рибозы обычно предпочтительно образуют β-аномер по сравнению с α-аномерным продуктом.
В последующих патентах Vorbruggen et al. ссылались на свой более ранний способ синтеза (1969) как «очень невыгодный», так как отделение солей кислот Льюиса или катализаторов Фриделя-Крафтcа, образованных во время реакции, приводило к необходимости в многочисленных трудоемких стадиях при заключительной обработке, что давало более низкий процент выхода конечного продукта (DE 2508312, эквивалентная заявка Великобритании GB 1542442). В GB 1542442 сообщалось о замене в способе кислот Льюиса триметилсилиловыми сложными эфирами неорганических кислот и об исходных реагентах, которые представляли собой 1-галоген-, 1-O-алкил- или 1-O-ацил-сахар. Как указано ранее, во всех иллюстративных примерах использовали исходный реагент 1-O-ацетил-β-D-рибофуранозу, и следовательно, не был неожиданным полученный β-аномерный продукт при почти полном отсутствии α-аномера (GB 1542442, примеры 1-13).
Подобным образом в патенте США 4209613 Vorbruggen описал одностадийный синтез нуклеозидов, который заключался во взаимодействии силилированного основания нуклеозида с 1-O-ацил-, 1-O-алкил- или 1-галоген-производным защищенного сахара в присутствии катализатора Фриделя-Крафтcа, выбранного из любого катализатора из группы кислот Льюиса (US 4209613). Как указано ранее, во всех иллюстративных примерах использовали исходный реагент 1-O-ацетил-β-D-рибофуранозу, и опять-таки не был неожиданным полученный β-аномерный продукт при почти полном отсутствии α-аномера (US 4209613, примеры 1-16).
В патенте США 5750676, Vorbruggen et al. сообщили о способе, который заключался во взаимодействии свободного сахара с N-гетероциклическим основанием в присутствии силилирующего агента и инертного растворителя, содержащего кислоту Льюиса, при этом усовершенствование состояло в персилилировании свободного сахара. Не было сделано пояснений относительно аномерных соотношений продукта, и не говорится о преимуществе одной кислоты Льюиса. Однако примеры показали, что требовались многочисленные стадии обработки, чтобы получить конечные продукты, явный недостаток для производства в промышленном масштабе (US 5750676, примеры 1-3).
Еще один способ получения нуклеозидов, о котором сообщали Vorbruggen et al., заключался в синтезе в одном сосуде с использованием сложного триалкилсилилового эфира неорганической или сильной органической кислоты, главным образом катализатора Фриделя-Крафтcа, основания нуклеозида и 1-O-ацил-, 1-O-алкил- или 1-галогензамещенного производного защищенного производного сахара (US 4209613).
Промежуточный продукт в виде хлор-сахара
Хлор-сахар является важным промежуточным продуктом в образовании LdT и существуют многочисленные способы его синтеза. Неограничивающие примеры синтеза хлор-сахаров включают следующие способы.
Isbell, Bock et al. и Lundt et al. сообщали о синтезе LdT из D-ксилозы способом, в который включен промежуточный 1,4-лактон (H.S. Isbell, Methods in Carbohydrate Research, 1963, 2:13-14; K. Bock et al., Carbohydrate Research, 1981, 90:17-26; K. Bock et al., Carbohydrate Research, 1982, 104:79-85; и I. Lundt и R. Madsen, Topics in Current Chemistry, 2001, 215:177-191).
Bock et al. и Humphlett использовали D-галактозу в качестве исходного вещества, которую подвергали окислительному расщеплению и бромировали, получая D-ликсонолактон. Последующие стадии избирательного гидролиза и превращений давали промежуточный хлор-сахар, который затем можно было использовать для получения LdT (K. Bock et al., Carbohydrate Research, 1981, 90:17-26; K. Bock et al., Carbohydrate Research, 1979, 68:313-319; K. Bock et al., Acta Chem. Scand. B, 1984, 38:555-561; и W.J. Humphlett, Carbohydrate Research, 1967, 4:157-164).
Bock et al. также получали LdT из D-глюконолактона обработкой последнего водным раствором брома и гидразина и затем избытком водного раствора гидроксида калия с образованием первичного эпоксида. Затем они осуществляли перегруппировку Пейна первичного эпоксида во вторичный эпоксид на лактоне, и подвергали лактон окислительному расщеплению с образованием промежуточного хлор-сахара, который затем можно было использовать для получения LdT (K. Bock et al., Carbohydrate Research, 1979, 68:313-316; K. Bock et al., Acta Chem. Scand. B, 1984, 38:555-561). В некоторых упомянутых журнальных статьях Bock et al. описали образование хлор-сахара из D-галаконолактона и бромированием D-манноно-1,4-лактона.
Liotta и Hager сообщали о синтезе хлор-сахара из коммерчески доступного лактона способом синтеза, который включает стадию стереоселективной циклизации, а также способом синтеза, в котором используют промежуточный альдегид и модификацию Хорнера-Эммонса реакции Виттига (D. C. Liotta et al., Tetrahedron Letters, 1992, 33:7083-7086; и US 5414078).
Schinazi et al., Ravid et al. и Taniguchi et al. описали способы получения промежуточных хлор-сахаров из гидроксиглутаминовой кислоты, которую подвергают циклизации до производного рибонолактона, который затем может быть превращен в хлор-сахар (US 6348587 B1, R. F. Schinazi et al.; U. Ravid et al., Tetrahedron, 1978, 34:1449-1452; и M. Taniguchi et al., Tetrahedron, 1974, 30:3547-3552).
Jung et al. сообщили об использовании эпоксидирования по Шарплессу на коммерчески доступном спирте, чтобы получить эпоксид, который затем обрабатывали спиртом, получая диол, который затем превращали в ацетонид. Ацетонид подкисляли, получая требуемую рибофуранозу, которую затем превращали в хлор-сахар. Альтернативно эпоксиспирт подвергали гидроборированию, используя окисление по Сверну, и хлор-сахар образовывали из дитолуоил-производного (M. E. Jung et al., Tetrahedron Letters, 1998, 39:4615-4618).
Yadav et al. и Harada et al. описали синтезы, при которых использовали аллилбромид и озонолиз или 2-бромметил[1,3]диоксолан без озонолиза, чтобы получить хлор-сахара (J. S. Yadav et al., Tetrahedron Letters, 2002, 43:3837-3839; T. Harada et al., Chem. Lett., 1981, 1109-1110), тогда как Ohuri et al., Cheng et al. и Abramski et al. сообщали об обработке гликаля кислым метанолом с получением 2-дезоксирибофуранозы, которую затем превращали в требуемый хлор-сахар.
В JP 09059292 Takeya Mori описал синтез в одном сосуде 4-аминопиримидинового нуклеозида из 4-гидроксипиримидинового нуклеозида посредством защиты гидроксильных групп реагента триметилсилильными группами, последующим взаимодействием с оксихлоридом фосфора или 4-хлорфенилфосфордихлоридатом и аминированием водным раствором аммиака.
Chu сообщил о способе получения 2'-дезоксинуклеозидов, который заключается во взаимодействии нуклеозида, имеющего 2'- и 3'-гидроксильные группы, со смесью ацилбромида или ацилхлорида и бромистоводородной или хлористоводородной кислоты при умеренных температурах с получением производного галогенацилнуклеозида, защиту которого удаляли с образованием требуемого нуклеозидного продукта (US 5200514).
В Nucleosides and Nucleotides, 1996, 15 (1-3):749-769 Kamaike et al. описали образование 2'-дезоксирибонуклеозидов посредством реакций нуклеофильного замещения 4-азолил-1-β-D-рибофуранозилпиримидин-2(1H)она, полученного превращением из уридина с использованием [15N]фталимида в присутствии триэтиламина или DBU, с получением N4-фталоил[4-15N]цитидина с высокими выходами.
В JP 71021872 Sankyo Co. Ltd. представили реакцию силилированного основания цитозина, урацила, тимина или азаурацила с галогенидом сахара, таким как галогенированная рибоза или глюкоза, в присутствии растворителя и галогенида ртути.
D-ксилоза
Используя D-ксилозу в качестве исходного вещества, можно синтезировать 2'-дезоксинуклеозиды согласно способам, описанным в предшествующем уровне техники.
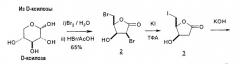
Okabe et al. описали синтез 2-дезокси-3,5-ди-O-пара-толуоил-α-L-эритропентофуранозилхлорида, который затем может быть подвергнут взаимодействию с получением β-L-2'-дезокситимидина (LdT) (Okabe et al., J. Org Chem., 1991, 56(14): 4392; Bock et al., Carbohydr. Res., 1981, 90:17-26; Bock et al., Carbohydr. Res., 1982, 104:79-85).
Далее следует неограничивающий список способов, используемых для получения промежуточных продуктов синтеза 2'-дезоксинуклеозидов, и в частности, 2'-дезокситимидина, из D-ксилозы.
Takahata et al. и Graf et al. сообщили об образовании 2,5-дибром-2,5-дидезокси-D-ликсо-1,4-лактона в результате взаимодействия ликсо-1,4-лактона с йодидом калия в ацетоне (Takahata et al., J. Org. Chem., 1994, 59:7201-7208; Graf et al., Liebigs Ann. Chem., 1993, 1091-1098).
Lundt et al., Bock et al. и Choi et al. описали инверсию 5-бром-2,5-дидезокси-D-треопентоно-1,4-лактона с образованием 2-дезокси-L-рибоно-1,4-лактона (Lundt et al., Topics in Current Chemistry, 2001, 215:177-191; Bock et al., Carbohydr. Res., 1981, 90:17-26; WO 01/72698, Y-R. Choi et al.).
Urata et al. и Zhang et al. сообщили о превращении 2-дезокси-3,5-ди-O-толуоил-α,β-L-рибозы в 2-дезокси-3,5-ди-O-пара-толуоил-α-L-эритропентофуранозилхлорид либо прямо из лактола в результате взаимодействия с хлористоводородной и уксусной кислотами, либо опосредованно через промежуточный 2-дезокси-7-метокси-3,5-ди-O-толуоил-α,β-L-рибозу в результате взаимодействия с уксусной и хлористоводородной кислотами (H. Urata et al., Nucleic Acids Res., 1992, 20(13):3325-3332; Zhang et al., Nucleosides and Nucleotides, 1999, 18 (11-12):2357).
Urata et al. также описали получение 2'-дезокси-3',5'-ди-O-пара-толуоил-L-тимидина из 2-дезокси-3,5-ди-O-пара-толуоил-α-L-эритропентофуранозилхлорида и силилированного тимина в присутствии хлороформа с последующим удалением защиты с образованием 2'-L-дезокситимидина (H. Urata et al., Nucleic Acids Res., 1992, 20 (13):3325).
Промежуточный 2,2'-ангидро-1-фуранозилнуклеозид
Показано, что 2'-дезокси- и 2'-замещенные нуклеозиды, и в частности, 2'-дезокси- или 2'-замещенные нуклеозиды, которые имеют пиримидиновые основания, стабилизируют олигонуклеотиды от разрушения нуклеазами. Разрушение нуклеазами является проблемой в области олигонуклеотидных терапевтических средств (Huryn et al., (1992), Chem. Rev. 92:1745-88; English et al., (1991), Angew. Chem. 30:613-722). Однако до настоящего времени модификацию пиримидиновых нуклеозидов во 2'-положении осуществили только в жестких условиях и способами синтеза, которые являются неэффективными, как правило, с низкими выходами продукта (Verheyden et al., (1971), J. Org. Chem. 36:250-254).
Tronchet et al. описали восстановление оксимного производного 2'-кетоуридина с помощью BH3, которое преимущественно дает 2'-гидрокси- или 2'-аминонуклеозиды в арабино-конфигурации (Tronchet et al., (1990), Tetrahedron Lett. 31:351). Указанная работа Tronchet является одной из немногих попыток стереоселективного синтеза 2'-рибофуранозиламино- или 2'-рибофуранозилгидроксилпиримидинов.
Ранние подходы к синтезу 2'-дезокси- или 2'-замещенных пиримидиновых нуклеозидов были сфокусированы на подходящих защитных группах для рибозы, ксилозы и арабинозы, которые были исходными реагентами в синтезах. Например, были предприняты многочисленные подходы к синтезу перацилированной рибофуранозы в качестве промежуточного продукта в способах получения нуклеозидов. Подходы включают i) 7-стадийный стереоспецифичный способ, который начинался с D-рибозы и давал β-D-2'-дезоксирибофуранозилтимидин с выходом конечного продукта около 40% (M. Jung и Y. Xu, Tetrahedron Lett. (1997), 38:4199); ii) 3-стадийный способ, начинающийся с L-рибозы и приводящий к выходу продукта, составляющему 56% (E. F. Recondo и H. Rinderknecht, Helv. Chim. Acta, (1959) 42:1171); iii) 8-стадийный способ с использованием L-арабинозы в качестве исходного вещества и получением примерно 20% выхода продукта (J. Du et al., Nucleosides and Nucleotides, (1999), 18:187); iv) 6-стадийный способ, начиная с L-ксилозы (% выхода конечного продукта не известен) (E. Moyroud и P. Strazewski, Tetrahedron (1999) 55:1277); и v) многостадийный способ, начинающийся с D-рибозы, которую сначала превращали в три-O-ацетилтимидин (патент США № 4914233).
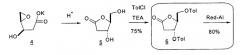
В 1959 году E. F. Recondo сообщил о 5-стадийном способе получения толуоил-, бензоил- и ацетил-защищенного рибофуранозила с выходом примерно 70-80% из D-рибозы (E. F. Recondo, Helv. Chim. Acta, (1959) 121:1171). Codington, Doerr и Fox описали синтез 2,2'-ангидро-1-(5-O-тритил-β-D-арабинофуранозил)тимина из β-D-тимидина в результате взаимодействия β-D-тимидина с тритилхлоридом и пиридином в течение 24 часов при комнатной температуре и затем примерно при 70°C в течение 3 часов, чтобы защитить 5'-OH на β-D-тимидине; затем посредством взаимодействия 5'-защищенного β-D-тимидина с тозилхлоридом (TsCl) и пиридином при 0°C, которое давало тозил-защищенную 2'-группу; и, наконец, посредством взаимодействия 5'-тритил-O-защищенного, 2'-тозил-O-защищенного β-D-тимидина с бензоатом натрия (NaOBz) и ацетамидом при 100°C в течение 1 часа с получением 2,2'-ангидро-1-(5'-O-тритил-β-D-арабинофуранозил)тимина с выходом 61% (Codington et al., J. Org. Chem., (1963) 29:558-64).
Сообщалось о ферментативном синтезе β-D-тимидина с использованием E. coli и гипоксантина на первой стадии и взаимодействием полученного в результате 2-монофосфорилированного соединения рибофуранозила с уридинфосфорилазой и извлечением требуемого продукта β-D-тимидина с выходом 45% с помощью хроматографии на колонке (А.И. Зинченко, Химия природных соединений, (1989), 4:587-88).
Другой способ синтеза нуклеозидов заключается в образовании промежуточного 5-метил-2,2'-ангидроуридина из «раскрытого нуклеозида». Раскрытый нуклеозид образуют посредством реакции внутримолекулярного нуклеофильного замещения, которая дает 2,2'-ангидро-1-(β-D-арабинофуранозил)нуклеозид в результате раскрытия цикла 2,2'-ангидронуклеозида. В заявке Японии Kokai № 8149398 (выложенная 2 мая 1981 года) описан синтез ангидронуклеозидов, который требует в качестве промежуточного продукта кислотно-аддитивной соли ацилированного иминоарабино[1',2':4,5]оксазолина. О применении доступного углеводного производного аминооксазолина в качестве предшественника ангидронуклеозида сообщали в 1971 году (J. Mol. Biol., (1970) 47:537).
Rao et al. сообщили о 6-стадийном синтезе, в котором использовали D-ксилозу в качестве исходного реагента, образуя 1-β-D-ксилофуранозилтимин, который затем обрабатывали PhOCOOPh (дифенилкарбонатом) и катализатором NaHCO3 в присутствии ДМФА при 140-150°C в течение примерно 4 часов, получая 2,2'-ангидро-1-(β-арабинофуранозил)тимин с выходом 55% (A. V. Rama Rao et al., J. Chem. Soc. Comm., (1994), p.1255; EP 0683171 B1). И Schinazi et al. и Manfredi et al. описали синтез, сходный с синтезом, описанным Rao et al., в котором использовали такие же реагенты, за исключением использования 1-β-D-арабинофуранозилтимина, а не 1-β-D-ксилофуранозилтимина (Schinazi et al., J. Med. Chem., (1979) 22:1273; Manfredi et al., Bioorg. Med. Chem. Letters, (2001) 11:1329-32).
Ранняя попытка образования 3',5'-дибензоил-защищенного 2,2'-ангидро-1-(β-рибонофуранозил)тимина описана Anton Holy et al. Holy et al. использовали β-D-рибонофуранозилтимин в качестве исходного соединения, его подвергали взаимодействию с 1,4 эквивалента PhOCOOPh и катализатором NaHCO3 в HMPA в течение примерно 20 минут при температуре около 150°C, чтобы образовать 2,2'-ангидро-1-(β-D-рибофуранозил)тимин (5-метилуридин), который подвергали взаимодействию с PhCOCN в ДМФА, чтобы защитить 3'- и 5'-OH-группы посредством образования 2,2'-ангидро-1-(β-3',5'-ди-O-бензоил)рибофуранозилтимин с входом примерно 87% (A. Holy et al., Collect. Czech. Commun., (1974), 39:3157-67). Holy et al. также сообщили о безуспешной попытке превратить 2-амино-β-D-арабинофурано[1',2':4,5]-2-оксазолин в O2,2'-ангидро-1-(β-D-арабинофуранозил)тимин (там же, 1377).
Fraser et al. усовершенствовали способ Holy, используя такой же исходный реагент и подвергая его взаимодействию с 1,2 эквивалента PhOCOOPh и катализатором NaHCO3 в присутствии HMPA примерно при 150°C в течение примерно 2 часов, получая 2,2'-ангидро-1-β-D-рибофуранозилтимин. Однако способ Fraser et al. давал сниженный процент выхода продукта, составляющий примерно 77%, по сравнению с выходом примерно 87%, полученным при синтезе согласно Holy et al. (Allister Fraser et al., J. Heterocycl. Chem., (1993) 30 (5):1277-88).
Yukio Aoyama et al. описали образование силил-защитного цикла, который охватывает как 3'-, так и 5'-положения β-1-D-(2-Br-рибофуранозил)тимина с выходом примерно 96% (Aoyama et al., Nucleosides and Nucleotides, (1996), 15 (1-3):733-8). 1-β-D-рибофуранозилтимин использовали в качестве исходного вещества и подвергали взаимодействию с TPDSCl2 и пиридином при комнатной температуре, получая 3'-, 5'-силил-защищенную циклическую структуру. Затем силил-защищенную структуру подвергали взаимодействию с TfCl и DMAP в CH2Cl2 при комнатной температуре с образованием промежуточного 2,2'-ангидропродукта и, наконец, промежуточный 2,2'-ангидропродукт подвергали взаимодействию с LiBr, BF3-OEt в 1,4-диоксане примерно при 60°C, получая конечный продукт, 1-β-D-2'-Br,3',5'-три-O-ди(диметил)силил)рибофуранозилтимин.
Mitsui Chemicals, Inc. сообщали о способах получения 2,2'-ангидро-1-(β-L-арабинофуранозил)тимина и 2,2'-ангидро-5,6-дигидроциклоуридина, который применим в качестве промежуточных продуктов при синтезе L-нуклеиновых кислот (публикация PCT № WO 02/044194; EP 1348712 A1). 7-стадийный способ согласно Mitsui включает: a) взаимодействие L-арабинозы с цианамидом с получением L-арабиноаминооксазолина; b) взаимодействие L-арабиноаминооксазолина с производным акриловой кислоты с образованием производного L-арабиноаминооксазолина, содержащего сложный эфир метилакриловой кислоты, связанный с N-атомом остатка оксазолина; c) взаимодействие продукта со стадии (b) с таким основанием, как, например, щелочной металл, алкоксид щелочного металла, карбонат щелочного металла, бикарбонат щелочного металла, гидроксид щелочного металла, гидрид щелочного металла, органическое основание, основная ионообменная смола и тому подобное, любое из которых образует при этом трициклическое кольцо, которое является производным L-2,2'-ангидронуклеиновой кислоты; d) изомеризацию производного L-2,2'-ангидронуклеиновой кислоты со стадии (c) с получением 2,2'-ангидро-1-(β-L-арабинофуранозил)тимина; e) 2,2'-ангидро-1-(β-L-арабинофуранозил)тимин со стадии (d) подвергают либо галогенированию и последующей защите, либо защите и последующему галогенированию, либо одновременному галогенированию и защите с образованием галогенированного по 2'-положению производного L-тимидина; f) дегалогенирование галогенированного производного L-тимидина со стадии (e); и g) деблокирование 3'- и 5'-положений продукта со стадии (f) с получением L-тимидина. Хотя Mitsui сообщал о хороших выходах продукта в результате данного синтеза, желательно иметь способ, который требует меньше стадий, чтобы его было легче адаптировать для крупномасштабного промышленного производства.
Вторым близким способом, найденным в предшествующем уровне техники, является способ, сообщенный Pfizer в EP 0351126 B1. Способ Pfizer заключается в новом пути образования O2,2'-ангидро-1-(β-D-арабинофуранозил)тиминовых нуклеозидов (ангидронуклеозидов), которые могут быть легко превращены в производные β-тимина. Способ включает реакцию конденсации между 2-амино-β-D-арабинофурано[1',2':4,5]-2-оксазолином или его 5'-тритил- или силил-защищенной формой предпочтительно с метил-2-формилпропионатом в H2O и NaOH при pH 8,1 в течение 48 часов при комнатной температуре с последующей обработкой водным раствором кислоты с получением O2,2'-ангидро-1-(β-D-арабинофуранозил)тимина с выходом примерно 42%. Альтернативы использования метил-2-формилпропионата включают применение метил-3-бромметилакрилата в присутствии DMAP и Et3N примерно при 80°C в течение 4 дней, что давало примерно 25% выход конечного продукта ангидротимидина; применение этил-2-формилпропионата в водном MeOH и Et3N при комнатной температуре в течение примерно 24 часов и затем примерно при 60°C еще в течение 24 часов для выхода ангидротимидинового продукта, составляющего примерно 8%; и применение метил-3-метоксиметакрилата в ДМСО примерно при 80°C в течение 4 дней с получением ангидротимидинового продукта с выходом примерно 32%.
Реакция конденсации по Pfizer включает использование в предпочтительном варианте основных катализаторов. Такими катализаторами являются третичные амины и неорганические соли, и предпочтительными среди них являются диметиламинопиридин, триэтиламин, N-метилморфолин и их комбинации. Pfizer сообщил, что предпочтительным способом превращения O2,2'-ангидро-1-(β-D-арабинофуранозил)тимина в β-тимидин была реакция ангидротимидина с HBr с последующим удалением Br в результате взаимодействия с BaSO4-отравленным Pd-катализатором. Желательно получить промышленно масштабируемый синтез, который мог бы исключить необходимость применения отравленного катализатора данного типа.
Boehringer-Ingelheim Pharma GMBH сообщили о 4-стадийном способе получения β-L-2'-дезокситимидина, в котором использовали L-арабинозу в качестве исходного вещества (публикация PCT № WO 03/087118). Способ включал: a) взаимодействие L-арабинозы с цианамидом в водном или водно-спиртовом растворе или в другом полярном растворителе, например, таком как ДМФА, пиридин или N-метилпирролидин, при температуре 80-100°C в присутствии основного катализатора, такого как NH3, Et3N или триэтилкарбонат, основный карбонат или двухосновный карбонат, с образованием производного L-арабинофуранозиламинооксазолина; b) взаимодействие производного L-арабинофуранозиламинооксазолина со стадии (a) с 2-метил-C-3-кислотой или ее активированным производным в инертном растворителе в условиях осаждения водой, например, таких как в присутствии ДМФА, ДМСО, NMP, ацетона, бензола, толуола или циклогексана и катализатора в виде основания третичного амина или неорганической соли, подобного DMAP, Et3N или N-метилморфолину, примерно при 20-80°C; c) взаимодействие β-L-2,2'-ангидротимидина со стадии (b) с нуклеофильным реагентом, таким как галогенводородная кислота, подобная HCl, HI или HBr, толуолсульфоновая кислота или тиоуксусная кислота, в растворителе ДМФА или трифторуксусной кислоте, чтобы разорвать связь C-O во 2'-положении; и d) взаимодействие β-L-2'-галогентимидина с катализатором, предпочтительно либо с Pd, либо с никелем Ренея, чтобы удалить группу галогена из 2'-положения и получить β-L-тимидин в качестве конечного продукта.
Предпочтительно перед выполнением стадий синтеза (a) или (b) любые свободные гидроксильные группы защищают, чтобы предотвратить их взаимодействие с производным аминооксазолина или с 2-метил-C-3-кислотой.
В указанном способе синтеза по Boehringer предпочтительные защитные группы включают бензил, дифенилметил, трифенилметил или силил, где три заместителя на силиле могут представлять собой C1-6-алкил или фенил, и фенильные группы необязательно могут быть дополнительно замещены. Любые защитные группы могут быть удалены на конечной стадии синтеза, и также могут быть добавлены стадии кристаллизации или очистки.
К сожалению, первая стадия способа, раскрытого Boehringer, требовала как минимум двух стадий экстракции, фильтрования и кристаллизации; вторая стадия способа требовала использования кипящего циклогексана и конечной очистки хроматографией; и четвертая стадия способа требовала использования катализатора Pd или никеля Ренея. Сообщенный выход промежуточного β-L-2,2'-ангидроарабинофуранозилтимина составлял примерно 49%. Таким образом, существует необходимость в способе синтеза, который избегает применения катализатора Pd или никеля Ренея и который обеспечивает более высокие проценты выхода промежуточного 2,2'-ангидротимидина.
Holy и Pragnacharyulu et al. описали применение L-арабинозы в качестве исходного вещества, которую подвергают взаимодействию с цианамидом, получая производное 1,2-оксазолина; производное оксазолина подвергают взаимодействию с этиловым эфиром пропионовой кислоты, получая промежуточный O2,2'-ангидро-L-тимидин, который подвергают бензоилированию и восстановительному расщеплению или обрабатывают хлористым водородом, получая требуемый хлор-сахар. (A. Holy, Coll. Czech. Chem. Commun. 1972, 37, 4072-4087).
Abushanab et al. сообщили о синтезе хлор-сахара, который заключается во взаимодействии сложного эфира метилоксиранкарбоновой кислоты с оксазолином с получением промежуточного O2,2'-ангидро-L-тимидина (E. Abushanab и P. V. P Pragnacharyula, патент США 5760208, 2 июня 1998 года), тогда как Asakura et al., Hirota et al. и A. Holy описали реакцию этилпропиолата с оксазолином с получением O2,2'-ангидро-L-уридина, который затем защищали по его 3'- и 5'-положениям и подвергали взаимодействию с хлористым водородом, получая 2'-дезокси-2'-хлор-сахар в качестве промежуточного продукта (J.-I. Asakura и M. J. Robins, J. Org. Chem. 1990, 55, 4928-4933; J.-I. Asakura и M. J. Robins, Tetrahedron Lett. 1988, 29, 2855-2858; K. Hirota, Y. Kitade, Y. Kanbe, Y. Isobe и Y. Maki, Synthesis, 1993, 210, 213-215; и A. Holy, Coll. Czech. Chem. Commun. 1972, 37, 4072-4087).
В 2003 году Abushanab и Pragnacharyulu сообщили о способе получения пиримидиновых нуклеозидов, который включает реакцию конденсации типа реакции Михаэля, между арабинорибофуранозиламинооксазолином и замещенным производным эпоксиметилата; последующее ацилирование конденсированного продукта обработкой пивалоилхлоридом, чтобы поместить группу хлора вo 2'-положении тимидина; и, наконец, дегалогенирование, чтобы удалить хлорный заместитель, если требуемым продуктом является 2'-дезокситимидин (патент США № 6596859).
Однако известно, что пивалоилхлорид вызывает раскрытие ангидроцикла и размещение группы хлора во 2'-положении тимидина, затем требует дополнительной стадии синтеза, чтобы удалить группу хлора. Также было бы полезно избежать применения дорогостоящего реагента метил-2-метилглицидата, который Abushanab и Pragnacharyulu используют в реакции конденсации в своем способе, а также применения ацетонитрила, используемого на второй стадии способа, и хроматографических разделений, требуемых на каждой стадии синтеза.
Pragnacharyulu et al. также сообщили об образовании 2,2'-ангидроаминооксазолина из L-арабинозы в результате взаимодействия L-арабинозы с H2NCN, которое обеспечивает возможность внутримолекулярного элиминирования одного концевого OH и одного H, чтобы получить промежуточный 2,2'-ангидроаминооксазолин (Pragnacharyulu et al., (1995), J. Org. Chem. 60:3096-99).
Sawai et al. описали стадию прямой циклизации при образовании 2,2'-ангидро(арабинофуранозил)тимина из D-арабинозы. Синтез этих авторов включал (1) получение D-арабинофуранозиламинооксазолина из D-арабинозы способами, известными в данной области; (2) взаимодействие D-арабинофуранозиламинооксазолина с этил-α-(бромметил)акрилатом в диметилацетамиде с получением оксазолино-N-разветвленного промежуточного продукта с выходом примерно 88%; и (3) взаимодействие промежуточного продукта, образованного на стадии (2), с KOtBu и трет-BuOH с получением 2,2'-ангидро(арабинофуранозил)тимина с выходом примерно 30%, или альтернативно, использование йодида водорода для раскрытия связи O2,2'-ангидро-L-тимидина и затем взаимодействие ациклического продукта с йодидом калия, чтобы получить ди-O-бензоил-2'-дезокситимидин (Sawai et al., (1994), Nucleosides and Nucleotides, 13 (6-7):1647-54; Sawai et al., Chem. Lett., 1994, 605-606). В данном способе выгодно избегают использования катализаторов, подобных отравленному Pd/BaSO4, но в результате получают более низкие выходы продуктов в %.
В патенте США № 4914233 Freskos et al. описали селективное выделение β-тимидина из смеси α- и β-аномеров посредством 5-стадийного способа, который заключается в образовании три-O-ацил-β-риботимидина и превращении 2,2'-ангидро-β-тимидина в 2'-галоген-2'-дезокси-5-метилуридин с последующим превращением последнего в β-тимидин.
В патенте США № 5212293 Green et al. сообщили о синтезе 2',3'-дидезоксинуклеозидов в результате взаимодействия защищенного ангидротимидина с галогенобразующим агентом, который содержал алюмоорганическое соединение для повышенной растворимости реагента.
В патенте США № 5596087 Alla et al. включили образование 2,2'-ангидротимидина, который подвергали бромированию и затем восстанавливали способами, известными специалистам в данной области, чтобы получить β-тимидин.
В патенте США № 6369040 Acevedo et al. описали 3',5'-защищенный 2,2'-ангидроуридин для синтеза соответствующих арабинозидов.
McGee и Murtiashaw, каждый, сообщили о получении промежуточного хлор-сахара из L-арабинозы в качестве исходного вещества, которое включает образование промежуточного O2,2'-ангидро-L-тимидина, полученного из других соединений реагентов, отличных от соединений, используемых Holy или Pragnacharyulu et al. (D. McGee, Boehringer Ingelheim Proposal to Novirio Pharmaceuticals, Inc., May 17, 2002; C. W. Murtiashaw, Eur. Patent, 0351126 B1, January 18, 1995).
McGee et al. описали способ получения 2'-модифицированных нуклеозидов в результате реакции внутримолекулярного замещения (патент США № 6090932). McGee et al. сообщили о введении заместителя во 2'-положении 2,2'-ангидроуридина при тщательном выборе 3'-заместителя, который может быть активирован, вызывая стереоспецифичное в