Пептидные векторы
Иллюстрации
Показать всеДанное изобретение относится к цитотоксическим соединениям направленного действия, которые представляют собой пептидные производные камптотецина, доксирубицина и палитаксела, их фармацевтическим композициям и применению для получения лекарственного средства для лечения патологических состояний, связанных с аберрантной или нежелательной пролиферацией, миграцией и/или физиологической активностью клеток. 23 н. и 20 з.п. ф-лы, 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к терапевтическим композициям и их применению в лечении патологических состояний. Более конкретно, данное изобретение обеспечивает соединения, композиции и способы для лечения патологических состояний, связанных с аберрантной или нежелательной клеточной пролиферацией, миграцией и/или физиологической активностью.
УРОВЕНЬ ТЕХНИКИ
Большинство цитотоксических лекарственных средств проявляет нежелательные токсичные побочные действия вследствие отсутствия у них селективного действия в отношении тканей или клеток, требующих терапевтического действия. Испытывались различные подходы для достижения селективной доставки цитотоксических агентов к клеткам-мишеням.
С использованием лигандов биологических рецепторов в качестве носителей лекарственных средств для нацеливания этих лекарственных средств на представляющие интерес клетки можно уменьшить токсические побочные действия и в значительной степени улучшить эффективность доставки лекарственных средств. Например, в международной патентной публикации № WO 97/19954 описаны конъюгаты антрациклинового цитотоксического агента, такого как доксорубицин, с пептидным гормоном, таким как LHRH, бомбезин или соматостатин. Этот цитотоксический агент ковалентно присоединен к пептиду через линкер формулы -С(О)-(СН2)n-C(O)-, n=0-7.
Подобным образом, в Европейской патентной заявке № ЕР1118336 описаны конъюгаты аналогов соматостатина например, октреотида, ланреотида и вапреотида, и цитотоксического лекарственного средства, такого как паклитаксел, доксорубицин или камптотецин, через спейсер, который, как указано, имеет структуру -С(О)-(СН2)n-C(O)-, n=0-7.
В публикации патентной заявки США № 2002/0115596 описаны конъюгаты цитотоксических агентов и олигопептидов, причем указано, что аминокислотные последовательности этих пептидов расщепляются преимущественно свободным специфическим антигеном предстательной железы. Сообщается, что такие конъюгаты применимы для лечения рака предстательной железы и доброкачественной гиперплазии предстательной железы.
В публикации патентной заявки США № 2003/0064984 описаны конъюгаты цитотоксических аналогов СС-1065 и дуокармицинов с расщепляемыми линкерными плечами и нацеливающим агентом, таким как антитело или пептид. Показано, что эти цитотоксические аналоги высвобождаются при расщеплении этого линкера.
В международной патентной заявке № WO 02/34237 описаны конъюгаты активных агентов, ковалентно присоединенных непосредственно к полипептиду. Утверждается, что этот полипептид стабилизирует активный агент, например, в желудке, посредством конформационной защиты.
Однако остается существенная потребность в нацеленных цитотоксических лекарственных средствах с улучшенными свойствами в отношении специфичности нацеливания, системной токсичности и фармакокинетики.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает цитотоксические соединения направленного действия (нацеленные), содержащие цитотоксическую часть молекулы, связанную с нацеливающей частью, такой, например, как лиганд биологического рецептора. Эти две части молекулы связаны через линкер, например, как описано формулой I:
Х-В 1 -В 2 -В 3 -В 4 -Z (I)
где Х означает цитотоксический или цитостатический агент;
каждый из В1, В2, В3 и В4 означает, независимо для каждого случая, (Doc)m, (Aepa)n, -(C(О)-А1-А2-А3-А4-А5-С(О))s- или (аминокислота)р,
каждый из А1 и А5 означает, независимо для каждого случая, СR1R2;
каждый из R1 и R2 означает, независимо для каждого случая, Н, F, Br, Cl, I, C(1-30)алкил, C(2-30)алкенил, замещенный C(1-30)алкил, замещенный С(2-30)алкенил, SR3, S(O)R4 или S(O)2R5, или R1 и R2 вместе могут образовывать С(3-30)циклоалкил, С(3-30)гетероцикл или С(5-30)арильное кольцо;
каждый R3, R4 и R5 означает, независимо для каждого случая, C(1-30)алкил, C(2-30)алкенил, замещенный C(1-30)алкил или замещенный С(2-30)алкенил;
каждый из А2, А3 и А4 означает, независимо для каждого случая, СR6R7, O, S, (CH2)t или отсутствует;
каждый или R6 и R7 означает, независимо для каждого случая, H, F, Br, Cl, I, C(1-30)алкил, C(2-30)алкенил, замещенный C(1-30)алкил, замещенный С(2-30)алкенил, SR3, S(O)R4 или S(O)2R5, или R6 и R7 вместе могут образовывать кольцевую систему;
m равно, независимо для каждого случая, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10;
n равно, независимо для каждого случая, 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10;
р равно, независимо для каждого случая, 0, 1 или 2;
s равно, независимо для каждого случая, 1, 2, 3, 4 и 5;
t равно, независимо для каждого случая, 0, 1, 2 или 3;
Z означает лиганд биологического рецептора, его аналог или производное указанного лиганда или указанного аналога;
при условии, что:
когда Х является доксорубицином или производным доксорубицина, по меньшей мере одно из m и n не равно 0, и
когда Х является паклитакселом или производным паклитаксела, В1 является (аминокислота)р и р равно 1 или 2.
Первый предпочтительный вариант осуществления связан с соединением в соответствии с формулой (I), в котором Х означает цитотоксическую часть молекулы. Более предпочтительно Х означает антрациклин. Еще более предпочтительно, Х означает камптотецин, производное камптотецина, паклитаксел, производное паклитаксела, доксорубицин или производное доксорубицина; при условии, что когда Х является доксорубицином или производным доксорубицина, по меньшей мере одно из m и n не равно 0, и когда Х является паклитакселом или производным паклитаксела, В1 является (аминокислота)р и р равно 1 или 2.
В дополнительном предпочтительном варианте осуществления указанного первого предпочтительного варианта осуществления данное изобретение связано с соединениями формулы (I), в которых
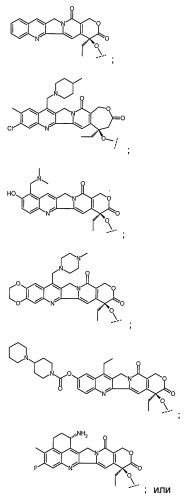
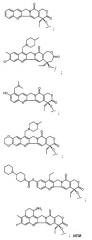
Х означает камптотецин или производное камптотецина, причем указанное производное камптотецина представляет собой
или Х означает паклитаксел или производное паклитаксела, причем указанное производное паклитаксела представляет собой
или Х означает доксорубицин или производное доксорубицина, причем указанное производное доксорубицина представляет собой
Второй предпочтительный вариант осуществления связан с соединением в соответствии с формулой (I), в котором лиганд Z является соматостатином, бомбезином или LHRH или их аналогом или производным указанного лиганда или указанного аналога.
В следующем предпочтительном варианте указанного второго предпочтительного варианта осуществления данное изобретение связано с соединениями формулы (I), в которых Z означает
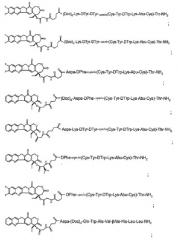
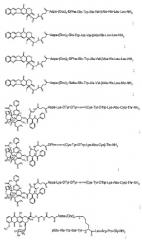
аналог соматостатина в соответствии с формулой:
-DPhe-цикло(Cys-Tyr-DTrp-Lys-Abu-Cys)-Thr-NH2;
-DPhe-цикло(Cys-3ITyr-DTrp-Lys-Val-Cys)-Thr-NH2;
-DPhe-цикло(Cys-3ITyr-DTrp-Lys-Abu-Cys)-Thr-NH2;
-DPhe-цикло(Cys-3ITyr-DTrp-Lys-Thr-Cys)-Thr-NH2;
-Lys-DTyr-DTyr-цикло(Cys-Tyr-DTrp-Lys-Abu-Cys)-Thr-NH2;
-Caeg-цикло(DCys-3Pal-DTrp-Lys-DCys)-Thr(Bzl)-Tyr-NH2;
-D2Nal-цикло[Cys-Tyr-DTrp-Lys-Val-Cys]-Thr-NH2;
-DPhe-цикло[Cys-Phe-DTrp-Lys-Thr-Cys]-Thr-ол;
-цикло({4-(-NH-C2H4-NH-CO-O)Pro}-Phg-DTrp-Lys-Tyr(4-Bzl)-Phe) или
-DPhe-цикло[Cys-Tyr-DTrp-Lys-Val-Cys]-Trp-NH2;
или его фармацевтически приемлемой солью;
или аналог LHRH в соответствии с формулой:
Glp-His-Trp-Ser-Tyr-DLys(-)-Leu-Arg-Pro-Gly-NH2;
Glp-His-Trp-Ser-Tyr-DOrn(-)-Leu-Arg-Pro-Gly-NH2;
Glp-His-Trp-Ser-Tyr-DDab(-)-Leu-Arg-Pro-Gly-NH2;
Glp-His-Trp-Ser-Tyr-DDap(-)-Leu-Arg-Pro-Gly-NH2;
Glp-His-Trp-Ser-Tyr-DApa(-)-Leu-Arg-Pro-Gly-NH2;
Glp-His-Trp-Ser-Tyr-DLys(-)-Leu-Arg-Pro-NHEt;
Glp-His-Trp-Ser-Tyr-DOrn(-)-Leu-Arg-Pro-NHEt;
Glp-His-Trp-Ser-Tyr-DDab(-)-Leu-Arg-Pro-NHEt;
Glp-His-Trp-Ser-Tyr-DDap(-)-Leu-Arg-Pro-NHEt;
Glp-His-Trp-Ser-His-DLys(-)-Trp-Tyr-Pro-Gly-NH2;
Glp-His-Trp-Ser-His-DOrn(-)-Trp-Tyr-Pro-Gly-NH2;
Glp-His-Trp-Ser-His-DDab(-)-Trp-Tyr-Pro-Gly-NH2 или
Glp-His-Trp-Ser-His-DDap(-)-Trp-Tyr-Pro-Gly-NH2;
или его фармацевтически приемлемой солью;
или аналог бомбезина в соответствии с формулой:
-Gln-Trp-Ala-Ala-βAla-His-Phe-Nle-NH2; (SEQ ID NO:1)
-Gln-Trp-Ala-Val-Gly-His-Leu-Ψ(CH2-NH)-Leu-NH2; (SEQ ID NO:2)
-Gln-Trp-Ala-Val-Gly-His-Leu-Ψ(CH2-NH)-Phe-NH2; (SEQ ID NO:3)
-Gln-Trp-Ala-Ala-βAla-His-Leu-Leu-NH2; (SEQ ID NO:4)
-Gln-Trp-Ala-Ala-βAla-His-Leu-Nle-NH2; (SEQ ID NO:5)
-Gln-Trp-Ala-Val-βAla-His-Phe-Nle-NH2; (SEQ ID NO:6)
-Gln-Trp-Ala-Val-βAla-His-Ala-Nle-NH2; (SEQ ID NO:7)
-Gln-Trp-Ala-Val-βAla-Ala-Phe-Nle-NH2; (SEQ ID NO:8)
-Gln-Trp-Ala-Val-Gly-His-Leu-Leu-NH2; (SEQ ID NO:9)
-Gln-Trp-Ala-Val-Gly-His-Leu-Met-NH2; (SEQ ID NO:10)
-Gln-Trp-Ala-Val-Gly-His-Phe-Met-NH2; (SEQ ID NO:11)
-DAla-Gln-Trp-Ala-Val-βAla-His-Phe-Nle-NH2;
-DPhe-Gln-Trp-Ala-Ala-βAla-His-Phe-Nle-NH2;
-DPhe-Gln-Trp-Ala-Val-βAla-Ala-Phe-Nle-NH2;
-DPhe-Gln-Trp-Ala-Val-βAla-His-Phe-Nle-NH2;
-DPhe-Gln-Trp-Ala-Val-βAla-His-Phe-Nle-NH2;
-DPhe-Gln-Trp-Ala-Val-βAla-His-Ala-Nle-NH2;
-DPhe-Gln-Trp-Ala-Val-βAla-His-Leu-Leu-NH2;
-DPhe-Gln-Trp-Ala-Val-βAla-His-Leu-Nle-NH2;
-DPhe-Gln-Trp-Ala-Val-Gly-His-Leu-Ψ(CH2-NH)-Leu-NH2;
-DPhe-Gln-Trp-Ala-Val-Gly-His-Leu-Ψ(CH2-NH)-Phe-NH2;
-DPhe-Gln-Trp-Ala-Val-Gly-His-Leu-Met-NH2;
-DPhe-Gln-Trp-Ala-Val-Gly-His-Phe-Met-NH2;
-DPhe-Gln-Trp-Ala-Val-Gly-His-Leu-Leu-NH2;
или его фармацевтически приемлемой солью.
Третий предпочтительный вариант осуществления связан с соединением в соответствии с формулой (I), где по меньшей мере одно из m и n не равно 0.
Четвертый предпочтительный вариант осуществления связан с соединением, структура которого конкретно здесь описана. Более предпочтительными являются соединения и промежуточные продукты, описанные в примерах 1-79 здесь. Еще более предпочтительными являются соединения примеров 19-25, 28-32, 40-42, 45-65 и 74-79.
Пятый предпочтительный вариант осуществления связан с соединением в соответствии с формулой:
или его фармацевтически приемлемой солью. Более предпочтительными являются соединения в соответствии с формулой
или их фармацевтически приемлемая соль. Еще более предпочтительными являются соединения формулы
или их фармацевтически приемлемая соль.
Шестой предпочтительный вариант осуществления связан с соединением, выбранным из соединений, перечисленных в таблице А.
Седьмой предпочтительный вариант осуществления связан с соединением, выбранным из соединений, перечисленных в таблице В.
Восьмой предпочтительный вариант осуществления связан с соединением, выбранным из соединений, перечисленных в таблице С.
Девятый предпочтительный вариант осуществления связан с соединением, выбранным из соединений, перечисленных в таблице D.
Десятый предпочтительный вариант осуществления связан с соединением, выбранным из соединений, перечисленных в таблице Е.
Одиннадцатый предпочтительный вариант осуществления связан с соединением, выбранным из соединений, перечисленных в таблице F.
Двенадцатый предпочтительный вариант осуществления связан с соединением, выбранным из соединений, перечисленных в таблице G.
Тринадцатый предпочтительный вариант осуществления связан с соединением, выбранным из соединений, перечисленных в таблице Н.
Четырнадцатый предпочтительный вариант осуществления связан с соединением, выбранным из соединений, перечисленных в таблице I.
Во втором аспекте согласно изобретению описана фармацевтическая композиция, содержащая эффективное количество нацеленного цитотоксического соединения, содержащего цитотоксическую часть молекулы, связанную с нацеливающей частью молекулы, такой, например, как лиганд биологического рецептора, или его фармацевтически приемлемая соль, и фармацевтически приемлемый носитель. Эти две молекулы связаны через линкер, например, как описано определяемой здесь формулой I.
В третьем аспекте согласно изобретению описан способ лечения заболевания у субъекта, нуждающегося в этом, предусматривающий введение указанному субъекту терапевтически эффективного количества нацеленного цитотоксического соединения в соответствии с определяемой здесь формулой I или его фармацевтически приемлемой соли, причем указанное заболевание выбрано из группы, состоящей из фиброза, доброкачественной гиперплазии предстательной железы, атеросклероза, рестеноза, рака молочной железы, рака ободочной кишки, рака поджелудочной железы, рака предстательной железы, рака легкого, мелкоклеточного рака легкого, рака яичника, эпидермального рака и гемопоэтического рака.
В четвертом аспекте согласно изобретению описан способ лечения заболевания у субъекта, нуждающегося в этом, предусматривающий введение указанному субъекту терапевтически эффективного количества нацеленного цитотоксического соединения в соответствии с определяемой здесь формулой I или его фармацевтически приемлемой соли, причем указанное заболевание выбрано из группы, состоящей из доброкачественной гиперплазии предстательной железы, рестеноза, рака молочной железы, рака ободочной кишки, рака поджелудочной железы, рака предстательной железы, рака легкого, мелкоклеточного рака легкого, рака яичника, эпидермального рака и гемопоэтического рака.
В пятом аспекте согласно изобретению описан способ лечения заболевания у субъекта, нуждающегося в этом, предусматривающий введение указанному субъекту терапевтически эффективного количества нацеленного цитотоксического соединения в соответствии с определяемой здесь формулой I или его фармацевтически приемлемой соли, причем указанное заболевание характеризуется нежелательной пролиферацией клеток, которые экспрессируют один или несколько рецепторов соматостатинового типа.
В шестом аспекте согласно изобретению описан способ лечения заболевания у субъекта, нуждающегося в этом, предусматривающий введение указанному субъекту терапевтически эффективного количества нацеленного цитотоксического соединения в соответствии с определяемой здесь формулой I, или его фармацевтически приемлемой соли, причем указанное заболевание характеризуется нежелательной пролиферацией клеток, которые экспрессируют один или несколько рецепторов бомбезинового типа.
В седьмом аспекте согласно изобретению описан способ лечения заболевания у субъекта, нуждающегося в этом, предусматривающий введение указанному субъекту терапевтически эффективного количества нацеленного цитотоксического соединения в соответствии с определяемой здесь формулой I, или его фармацевтически приемлемой соли, причем указанное заболевание характеризуется нежелательной пролиферацией клеток, которые экспрессируют один или несколько рецепторов LHRH-типа.
В данном контексте термин «аминокислота» относится к любым природно встречающимся и неприродным аминокислотам, в том числе, но не только, к α-аминокислотам, β-аминокислотам, γ-аминокислотам, и аминокислоты могут быть либо D-аминокислотами, либо L-аминокислотами, если нет других указаний. За исключением N-концевой аминокислоты, все аббревиатуры (например, Ala) аминокислот в этом описании обозначают структуру -NH-C(R)(R')-CO-, где каждый из R и R', независимо означает водород или боковую цепь аминокислоты (например, R=СН3 и R'=Н для Ala), или R и R' могут быть соединены с образованием кольцевой системы. Для N-концевой аминокислоты эта аббревиатура означает структуру (R2R3)-N-C(R)(R')-CO-, где R2 и R3 имеют значения, определяемые в формуле (I).
Примерный перечень предпочтительных аминокислот включает в себя, но не ограничивается ими, Ala, Arg, Asp, Asn, Cys, Glu, pGlu, Gln, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr, Val, β-Ala, Act, Apc, GABA, Apn, Ahx, Ahp, Aoc, Anc, Adc, Aun, Ado, Acc, A3c, A4c, A5c, A6c, Aib, Orn, Dab, Dap, hArg, 4Pal, 3Pal, 2Pal, Abu, Cha, Cit, Nle, Nva, Taz, 2Thi, 3Thi, Dhp, Dmt, 2Fua, 3Hyp, 4Hyp, Inc, Inp, Ktp, hLeu, Oic, hPhe, Pip, Sar, Thz, Tic, Tle, Phg и Caeg.
Пептидная часть соединений согласно изобретению может быть также обозначена посредством другого формата, например (Tyr11)Соматостатин(1-14)-NH2, с замененной аминокислотой (замененными аминокислотами) из природной последовательности, помещенными между первым набором скобок (например, Tyr11 вместо Phe11 в соматостатине). Числа между вторым набором скобок относятся к количеству аминокислот, присутствующих в этом пептиде (например, соматостатин (1-11) означает аминокислоты 1-11 пептидной последовательности для соматостатина). Обозначение “NH2”, например, в (Tyr11)Соматостатин(1-14)-NH2 указывает на то, что С-конец этого пептида является амидированным. (Tyr11)Соматостатин(1-14) или альтернативно (Tyr11)Соматостатин(1-14)-ОН указывает на то, что С-конец является свободной кислотой.
“Алкил” означает углеводородную группу, содержащую один или несколько атомов углерода, в которой множественные атомы углерода, если они присутствуют, соединены простыми связями. Алкильная углеводородная группа может иметь прямую цепь или содержит одно или несколько ответвлений или одну или несколько циклических групп.
“Замещенный алкил” означает алкил, в котором один или несколько атомов этой углеводородной группы замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогена (например, фтора, хлора, брома или иода), -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -C1-2-алкила, замещенного 1-6 атомами галогена, -CF3, -OCH3, -OCF3 и -(СН2)0-4-СООН. В различных вариантах присутствуют 1, 2, 3 или 4 заместителя. Присутствие -(СН2)0-4-СООН приводит к образованию алкилкарбоновой кислоты. Примеры алкилкарбоновых кислот, содержащих -(СН2)0-4-СООН или состоящих из -(СН2)0-4-СООН, включают в себя 2-норборнануксусную кислоту, трет-масляную кислоту и 3-циклопентилпропионовую кислоту.
«Гетероалкил» означает алкил, в котором один или несколько атомов углерода в углеводородной группе заменены одной или несколькими из следующих групп: амино, амидо, -О- или карбонил. В различных вариантах осуществления присутствуют 1 или 2 гетероатома.
“Замещенный гетероалкил” означает гетероалкил, в котором один или несколько атомов водорода углеводородной группы заменены одним или несколькими заместителями, выбранными из группы, состоящей из галогена (т.е. фтора, хлора, брома и иода), -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -C1-2-алкила, замещенного 1-6 атомами галогена, -CF3, -OCH3, -OCF3 и -(СН2)0-4-СООН. В различных вариантах присутствуют 1, 2, 3 или 4 заместителя.
«Алкенил» означает углеводородную группу, состоящую из двух или более атомов углерода, в которой присутствуют одна или несколько двойных связей углерод-углерод. Алкенильная углеводородная группа может иметь прямую цепь или содержит одно или несколько ответвлений или циклических групп.
«Замещенный алкенил» означает алкенил, в котором один или несколько атомов водорода углеводородной группы заменены одним или несколькими заместителями, выбранными из группы, состоящей из галогена (т.е. фтора, хлора, брома и иода), -ОН, -CN, -SH, -NH2, -NHCH3, -NO2, -C1-2-алкила, замещенного 1-6 атомами галогена, -CF3, -OCH3, -OCF3 и -(СН2)0-4-СООН. В различных вариантах присутствуют 1, 2, 3 или 4 заместителя.
«Арил» означает необязательно замещенную ароматическую группу с по меньшей мере одним кольцом, имеющим конъюгированную пи-электронную систему, содержащую до двух конъюгированных или конденсированных кольцевых систем. Арил включает в себя карбоциклическую арильную, гетероциклическую арильную и биарильную группы. Предпочтительно арил является 5- или 6-членным кольцом. Предпочтительные атомы для гетероциклического арила являются одним или несколькими атомами серы, кислорода и/или азота. Примеры арила включают в себя фенил, 1-нафтил, 2-нафтил, индол, хинолин, 2-имидазол и 9-антрацен. Арильные заместители выбраны из группы, состоящей из -С1-4 алкила, -С1-4 алкокси, галогена (т.е. фтора, хлора, брома и иода), -ОН, -CN, -SH, -NH2, -NO2, -C1-2-алкила, замещенного 1-5 атомами галогена, -CF3, -OCF3 и -(СН2)0-4-СООН. В различных вариантах присутствуют 1, 2, 3 или 4 заместителя.
«Алкиларил» означает «алкил», присоединенный к «арилу».
Термин циклоалкил включает в себя моноциклоалкильную группу или бициклоалкильную группу с указанным количеством атомов углерода, известную специалистам с квалификацией в данной области.
Термин гетероцикл включает в себя моноциклические и бициклические системы, имеющие один или несколько гетероатомов, таких как кислород, азот и/или сера. Эти кольцевые системы могут быть ароматическими, такими как, например, пиридин, индол, хинолин, пиримидин, тиофен (также известный как тиенил), фуран, бензотиофен, тетразол, дигидроиндол, индазол, N-формилиндол, бензимидазол, тиазол и тиадиазол. Эти кольцевые системы могут быть также неароматическими, такими как, например, пирролидин, пиперидин, морфолин и т.п.
Химику с обычной квалификацией в данной области будут известны некоторые комбинации содержащих гетероатом заместителей, перечисленных в данном изобретении, определяющих соединения, которые будут менее стабильными при физиологических условиях. Таким образом, такие соединения являются менее предпочтительными.
Doc означает 8-амино-3,6-диоксаоктановую кислоту, представленную структурой
.
Aepa означает 4-(2-аминоэтил)-1-карбоксиметилпиперазин, представленный структурой
.
Suc или succ означает сукцинил, представленный формулой
.
Glut или глутарил имеет следующую структуру
.
Камптотециновая часть молекулы имеет следующую структуру
.
Части производного камптотецина включают в себя, но не ограничиваются ими
Паклитакселовая часть молекулы имеет следующую структуру
Доксорубициновая часть молекулы имеет следующую структуру
Часть молекулы, образованная производным доксорубицина, включает в себя, но не ограничиваются ею
DLys(-) представлен структурой
.
DOrn(-) представлен структурой
.
DDab(-) представлен структурой
.
DDap(-) представлен структурой
.
DApa(-) представлен структурой
.
Некоторые используемые здесь аббревиатуры определяются следующим образом:
Abu - α-аминомасляная кислота
Асс - 1-амино-1-цикло(С3-С9)алкилкарбоновая кислота
А3с - 1-амино-1-циклопропанкарбоновая кислота
А4с - 1-амино-1-циклобутанкарбоновая кислота
А5с - 1-амино-1-циклопентанкарбоновая кислота
А6с - 1-амино-1-циклогексанкарбоновая кислота
Асt - 4-амино-4-карбокситетрагидропиран, представленный структурой
Aib - α-аминоизомасляная кислота
Ala или А - аланин
β-Ala - бета-аланин
Арс означает структуру
Arg или R - аргинин
hArg - гомоаргинин
Asn или N - аспарагин
Asp или D - аспарагиновая кислота
Ava - 5-аминовалериановая кислота
Cha - β-циклогесилаланин
Cys или С - цистеин
Dab - 2,4-диаминомасляная кислота
Dap - 2,3-диаминопропионовая кислота
Dhp - 3,4-дегидропролин
Dmt - 5,5-диметилтиазолидин-4-карбоновая кислота
Doc - 8-амино-3,6-диоксаоктановая кислота, показанная структурой
2Fua - β-(2-фурил)аланин
Gln или Q - глутамин
Glu или Е - глутаминовая кислота
pGlu или Glp - пироглутаминовая кислота
Gly или G - глицин
His или Н - гистидин
3Hyp - транс-3-гидрокси-L-пролин, т.е. (2S,3S)-3-гидроксипирролидин-2-карбоновая кислота
4Hyp - 4-гидроксипролин, т.е. (2S,4R)-4-гидроксипирролидин-2-карбоновая кислота
Ile или I - изолейцин
Inc - индолин-2-карбоновая кислота
Inp - изонипекотиновая кислота
Ktp - 4-кетопролин
Leu или L - лейцин
hLeu - гомолейцин
Lys или K - лизин
Met или М - метионин
Nle - норлейцин
Nva - норвалин
Oic - октагидроиндол-2-карбоновая кислота
Orn - орнитин
2Pal - β-(2-пиридинил)аланин
3Pal - β-(3-пиридинил)аланин
4Pal - β-(4-пиридинил)аланин
Phe или F - фенилаланин
hPhe - гомофенилаланин
Pip - пипеколиновая кислота
Pro или Р - пролин
Sar - саркозин или N-метилглицин
Ser или S - серин
Taz - β-(4-тиазолил)аланин, показанный структурой
2Thi - β-(2-тиенил)аланин
3Thi - β-(3-тиенил)аланин
Thr или Т - треонин
Thz - тиазолидин-4-карбоновая кислота
Tic - 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота
Tle - трет-лейцин
Trp или W - триптофан
Tyr или Y - тирозин
Val или V - валин
Gaba - 4-аминомасляная кислота
Apn - 5-аминопентановая кислота
Ahx - 6-аминогексановая кислота
Ahp - 7-аминогептановая кислота
Aoc - 8-аминооктановая кислота
Anc - 9-аминононановая кислота
Adc - 10-аминодекановая кислота
Aun - 11-аминоундекановая кислота
Ado - 12-аминододекановая кислота
Phg - фенилглицин
Caeg - N-(2-аминоэтил)-N-(2-цитозинил-1-оксоэтил)глицин, показанный структурой
Некоторые другие используемые здесь аббревиатуры определяются следующим образом:
Aloc: аллилоксикарбонил
Вос: трет-бутилоксикарбонил
Bhoc: бензгидрилоксикарбонил
Bzl: бензил
DCM: дихлорметан
Dde: 1-(4,4-диметил-2,6-диоксоциклогекс-1-илидин)этил
DIC: N,N-диизопропилкарбодиимид
DIЕA: диизопропилэтиламин
Dmab: 4-{N-(1-(4,4-диметил-2,6-диоксоциклогексилиден)-3-метилбутил)амино}бензил
DMAP: 4-(диметиламино)пиридин
DMF: диметилформамид
DNP: 2,4-динитрофенил
Et: этил
Fmoc: флуоренилметилоксикарбонил
HBTU: гексафторфосфат 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония
cHex: циклогексил
HOAT: гексафторфосфат О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония
HOВt: 1-гидроксибензотриазол
Mmt: 4-метокситритил
NMP: N-метилпирролидон
Pbf: 2,2,4,6,7-пентаметилгидробензофуран-5-сульфонил
tBu: трет-бутил
TIS: триизопропилсилан
TOS: тозил
trt: тритил
TFA: трифторуксусная кислота
TFFH: гексафторфосфат тетраметилфторфорамидиния
Z: бензилоксикарбонил
Греческая буква «пси» “ψ” используется здесь для указания того, что пептидная связь заменена псевдопептидной связью. При обозначении аминокислотной последовательности термин ψ используется в контексте -А-ψ-(Х-Х')-В, где А представляет собой аминоацильный радикал, карбонильная группа которого модифицирована до Х, а В представляет собой аминоацильный радикал, α-аминогруппа которого модифицирована до Х'. Х и Х' служат символами элементов последовательности, разделенных связью например-Leu-ψ-(CH2-NH)-Leu.
ПОДРОБНОЕ ОПИСАНИЕ
В данном изобретении описаны нацеленные цитотоксические соединения (направленного действия), содержащие цитотоксическую
часть молекулы, связанную с нацеливающей частью, такой, например, как лиганд биологического рецептора, и способы, относящиеся к их терапевтическому применению для лечения неоплазии, гиперплазии и других состояний, связанных с нежелательной пролиферацией клеток.
Примерами пептидов соматостатина, применимых в данном изобретении, являются описанные здесь пептиды. Дополнительными примерами являются пептиды, охватываемые формулами, или пептиды, специально указанные в публикациях, приведенных ниже, каждая из которых тем самым включена в качестве ссылки в ее полном виде:
Заявка РСТ № WO 03/057214 (2003)
Заявка на патент США № 20030191134 (2003)
Заявка на патент США № 20030083241 (2003)
Патент США № 6316414 (2001)
Заявка РСТ № WO 92/10215 (2002)
Заявка РСТ № WO 99/22735 (1999)
Заявка РСТ № WO 98/08100 (1998)
Заявка РСТ № WO 98/44921 (1998)
Заявка РСТ № WO 98/45285 (1998)
Заявка РСТ № WO 98/44922 (1998)
Заявка на Европейский патент № Р5 164 EU (Автор: G. Keri);
VanBinst, G. et al., Peptide Research 5:8 (1992);
Horvath, A. et al., Abstract, “Conformations of Somatostatin Analogs Having Antitumor Activity”, 22nd European peptide Symposium, September 13-19, 1992, Interlaken, Switzerland;
Заявка РСТ № WO 91/09056 (1991);
Заявка на Европейский патент № 0363589 А2 (1990);
Патент США № 4904642 (1990);
Патент США № 4871717 (1989);
Патент США № 4853371 (1989);
Патент США № 4725577 (1988);
Патент США № 4684620 (1987);
Патент США № 4650787 (1987);
Патент США № 4603120 (1986);
Патент США № 4585755 (1986);
Заявка на Европейский патент № 0203031 А2 (1986);
Патент США № 4522813 (1985);
Патент США № 4486415 (1984);
Патент США № 4485101 (1984);
Патент США № 4435385 (1984);
Патент США № 4395403 (1983);
Патент США № 44369179 (1983);
Патент США № 4360516 (1982);
Патент США № 4358439 (1982);
Патент США № 4328214 (1982);
Патент США № 4316890 (1982);
Патент США № 4310518 (1982);
Патент США № 4291022 (1981);
Патент США № 4238481 (1980);
Патент США № 4235886 (1980);
Патент США № 4224199 (1980);
Патент США № 4211693 (1980);
Патент США № 4190648 (1980);
Патент США № 4146612 (1979);
Патент США № 4133782 (1979);
Патент США № 5506339 (1996);
Патент США № 4261885 (1981);
Патент США № 4728638 (1988);
Патент США № 4282143 (1981);
Патент США № 4215039 (1980);
Патент США № 4209426 (1980);
Патент США № 4190575 (1980);
Европейский патент № 0389180 (1990);
Заявка на Европейский патент № 0505680 (1982);
Заявка на Европейский патент № 0083305 (1982);
Заявка на Европейский патент № 0030920 (1980);
Заявка РСТ № WO 88/05052 (1988);
Заявка РСТ № WO 90/12811 (1990);
Заявка РСТ № WO 97/01579 (1997);
Заявка РСТ № WO 91/180016 (1991);
Заявка Соединенного Королевства № GB 2095261 (1981) и
Французская заявка № FR 2552655 (1983).
Примеры пептидов LНRН (рилизинг-фактор лютеинизирующего гормона), применимых в данном изобретении, описаны здесь. Дополнительными примерами являются пептиды, охватываемые формулами, или пептиды, специально указанные в публикациях, приведенных ниже, каждая из которых тем самым включена в качестве ссылки в ее полном виде:
Заявка на Европейский патент № 0081877 (1983)
Заявка на Европейский патент № 0328089 (1989)
Заявка на Европейский патент № 0417454 (1991)
Заявка на Европейский патент № 0626170 (1994)
Заявка на Европейский патент № 0832107 (1998)
Заявка на Европейский патент № 1340768 (2003)
Заявка на патент США № 2003040482 (2003)
Патент США № 4317815 (1982)
Патент США № 4431635 (1984)
Патент США № 4581169 (1986)
Патент США № 4628044 (1986)
Патент США № 4642332 (1987)
Патент США № 4656247 (1987)
Патент США № 4721775 (1988)
Патент США № 5075224 (1991)
Патент США № 5140009 (1992)
Патент США № 5484592 (1996)
Патент США № 5885966 (1999)
Патент США № 6284733 (2001)
Патент США № 6559282 (2003)
Заявка РСТ № WO 00/24764 (2000)
Заявка РСТ № WO 90/11298 (1990)
Заявка РСТ № WO 92/15330 (1992)
Заявка РСТ № WO 94/14841 (1994)
Заявка РСТ № WO 94/25060 (1994)
Заявка РСТ № WO 96/40757 (1996)
Примеры пептидов бомбезина, применимых в данном изобретении, описаны здесь. Дополнительными примерами являются пептиды, охватываемые формулами, или пептиды, специально указанные в публикациях, приведенных ниже, каждая из которых тем самым включена в качестве ссылки в ее полном виде:
Заявка на Европейский патент № 0309297 (1989)
Заявка на Европейский патент № 0339193 (1989)
Заявка на Европейский патент № 0402852 (1990)
Заявка на Европейский патент № 0434979 (1991)
Заявка на Европейский патент № 0468497 (1992)
Заявка на Европейский патент № 0835662 (1998)
Заявка на патент США № 2003050436 (2003)
Заявка на патент США № 2003166539 (2003)
Патент США № 5084555 (1992)
Патент США № 5100873 (1992)
Патент США № 5217955 (1993)
Патент США № 5369094 (1994)
Патент США № 5410018 (1995)
Патент США № 5620955 (1997)
Патент США № 5723578 (1998)
Патент США № 5843903 (1998)
Патент США № 5877277 (1999)
Патент США № 6156725 (2000)
Патент США № 6307017 (2001)
Заявка РСТ № WO 90/03980 (1990)
Заявка РСТ № WO 91/06563 (1991)
Заявка РСТ № WO 91/17181 (1991)
Заявка РСТ № WO 94/02018 (1994)
Заявка РСТ № WO 94/21674 (1994)
Способы синтеза пептидов соматостатина, LHRH и бомбезина хорошо документированы и находятся в рамках возможностей рядовых специалистов в данной области. Дополнительные процедуры синтеза обеспечены в следующих примерах. Следующие примеры иллюстрируют также способы синтеза нацеленных цитотоксических соединений согласно изобретению.
Пример 1
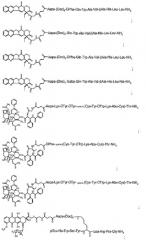
H-Lys(Boc)-DTyr(tBu)-DTyr(tBu)-Cys(Trt)-Tyr(tBu)-DTrp(Boc)-Lys(Boc)-Abu-Cys(Trt)-Thr(tBu)-Rink Amide MBHA Resin
Указанный в заголовке конъюгат защищенный пептид-смола автоматически синтезировали на пептидном синтезаторе модели 433А Applied Biosystems (ABI) (Foster City, CA) с использованием флуоренилметоксикарбонил (Fmoc)-химии. Использовали амидную смолу МВНА (4-метилбензилгидриламин) Ринка (Nоvabiochem, San Diego, CA) с замещением 0,72 ммоль/г. Использовали следующие Fmoc-аминокислоты (AnaSpec, San Jose, CA): Fmoc-Thr(tBu)-OH, Fmoc-Cys(Trt)-ОН, Fmoc-Lys(Boc)-ОН, Fmoc-DTrp(Boc)-ОН, Fmoc-Tyr(tBu)-ОН, Fmoc-DTyr(tBu)-ОН, Fmoc-Phe-OH, Fmoc-Cys(Trt)-ОН, Fmoc-Thr(tBu)-ОН и Fmoc-Abu-ОН. Этот синтез проводили в масштабе 0,25 ммоль. Группы Fmoc удаляли обработкой 20% пиперидином в N-метилпирролидоне (NМР) в течение 30 минут. В каждой стадии связывания Fmoc-аминокислоту (4 экв., 1 ммоль) сначала преактивировали в 2 мл раствора, содержащего 0,45 М гексафторфосфат 2-(1 -Н-бензотриазол-1-ил)-1,1,2,3-тетраметилурония (HBTU) и 0,45 М 1-гидроксибензотриазол (HOВТ) в N,N-диметилформамиде (ДМФ). Полученный активированный эфир аминокислоты, 1 мл диизопропилэтиламина (DIEA) и 1 мл NMP добавляли к этой смоле. Пептидный синтезатор ABI 433A программировали для выполнения следующего цикла реакций: (1) промывание NMP, (2) удаление защитной группы Fmoc 20% пиперидином в NMP в течение 30 минут, (3) промывание NMP, (4) связывание преактивированной Fmoc-аминокислоты в течение 1 часа. Смолу связывали последовательно в соответствии с этой последовательностью реакций. После сборки пептидной цепи Fmoc удаляли и эту смолу промывали полностью с использованием ДМФ и дихлорметана (ДХМ).
Пример 2
Н-Doc-Doc-Doc-Doc-Lys(Boc)-DTyr(tBu)-DTyr(tBu)-Cys(Trt)-Tyr(tBu)-DTrp(Boc)-Lys(Boc)-Abu-Cys(Trt)-Thr(tBu)-Rink Amide MBHA Resin
Указанный в заголовке конъюгат защищенный пептид-смола синтезировали по существу в соответствии с процедурой, описанной в примере 1. Fmoc-8-амино-3,6-диоксаоктановую кислоту (Fmoc-Doc-OH) покупали из Chem-Impex International, Wood Dale, IL. После сборки Н-Lys(Boc)-DTyr(tBu)-DTyr(tBu)-Cys(Trt)-Tyr(tBu)-DTrp(Boc)-Lys(Boc)-Abu-Cys(Trt)-Thr(tBu)-Rink Amide MBHA Resin (в масштабе 0,45 ммоль) этот конъюгат защищенный пептид-смола переносили в реакционный сосуд на шейкере для ручного синтеза. Смолу встряхивали с ДМФ-раствором Fmoc-Doc-OH (1,5 экв. 0,75 ммоль), N,N-диизопропилкарбодиимидом (DIC, 1,5 экв., 0,75 ммоль) и HOВТ (1,5 экв., 0,75 ммоль) в течение 2 часов. Смолу промывали ДМФ и обрабатывали 20% пиперидином в ДМФ для удаления защитной Fmoc-группы. Остальные три остатка Doc последовательно связывали со смолой с использованием той же самой процедуры ручной операции. После удаления защитной Fmoc-группы 20% пиперидином в ДМФ комплекс защищенный пептид-смола промывали ДМФ и ДХМ.
Пример 3
Н-Doc-Doc-Doc-Doc-Doc-Doc-Lys(Boc)-DTyr(tBu)-DTyr(tBu)-Cys(Trt)-Tyr(tBu)-DTrp(Boc)-Lys(Boc)-Abu-Cys(Trt)-Thr(tBu)-Rink Amide MBHA Resin
Указанный в заголовке конъюгат защищенный пептид-смола синтезировали по существу в соответствии с процедурой, описанной в примере 2.
Пример 4
Н-Aeрa-Lys(Boc)-DTyr(tBu)-DTyr(tBu)-Cys(Trt)-Tyr(tBu)-DTrp(Boc)-Lys(Boc)-Abu-Cys(Trt)-Thr(tBu)-Rink Amide MBHA Resin
Указанный в заголовке конъюгат защищенный пептид-смола синтезировали по существу в соответствии с процедурой, описанной в примере 1. Fmoc-4-(2-аминоэтил)-1-карбоксиметилпиперазин (Fmoc-Аера-ОН) покупали из Neosystem, Strasbourg, France. После сборки Н-Lys(Boc)-DTyr(tBu)-DTyr(tBu)-Cys(Trt)-Tyr(tBu)-DTrp(Boc)-Lys(Boc)-Abu-Cys(Trt)-Thr(tBu)-Rink Amide MBHA Resin этот конъюгат защищенный пептид-смола переносили в реакционный сосуд на шейкере для ручного синтеза. Fmoc-Аера-ОН (1,5 экв., 0,75 ммоль) преактивировали гексафторфосфатом О-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU, 1,4 экв., 0,7 ммоль) и 1-гидрокси-7-азабензотриазолом (HOAT, 1,4 экв., 0,7 ммоль) в 2 мл ДМФ в течение 2 минут. Полученный активированн