Способ получения органических солей, содержащих анионы бис(перфторалкил)фосфината
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения органических солей, которые содержат анионы бис(перфторалкил)фосфината, и может быть применено в органическом синтезе. Отличием предлагаемого способа является то, что он включает проведение реакции трис(перфторалкил)фосфиноксида со спиртом и органическим основанием, более сильным, чем спирт. Технический результат - разработка нового способа получения органических солей со свойствами ионных жидкостей. 10 з.п.ф-лы.
Реферат
Представленное изобретение касается способа получения органических солей, содержащих анионы бис(перфторалкил)фосфината, и солей, полученных с помощью этого способа, и их применения как ионных жидкостей.
Четвертичные аммониевые и фосфониевые соли типично получают путем алкилирования аминов или фосфинов. С этой целью, используют разнообразные алкилирующие агенты, такие как, например, алкилгалоиды, алкилсульфаты, алкилтрифлаты, inter alia. Этот способ также может быть использован для синтеза солей, содержащих гетероциклические катионы. Недостатком этого способа является высокая стоимость алкилирующего агента, токсичность этих алкилирующих агентов (диметилсульфат, например, является высоко токсичным). Кроме того, с помощью этого способа получают соли, которые содержат только некоторые анионы. Для того чтобы получить соли, содержащие другие анионы, необходимо провести дополнительную стадию ионного обмена, используя реакцию соли с кислотой Бронстеда или солью металла. Это делает синтез органических солей, содержащих некоторые анионы, очень дорогим.
В последние годы возрос интерес к органическим солям, которые имеют очень низкую температуру плавления. Эти соединения, благодаря их низкой температуре плавления, все больше и больше используются как ионные жидкости, подтверждением чего могут служить некоторые обзоры, опубликованные в последние годы (Р.Wasserscheid, W.Keim, "lonische Flüssigkeiten - neue Lösungen für die Übergangsmetallkatalyse" [Ионные жидкости - новые растворы для катализа переходными металлами], Angew. Chem. 112 (2000) pp.3926-3945; R.Sheldon, "Catalytic reactions in ionic liquids" [Каталитические реакции в ионных жидкостях], Chem. Commun. 2001, pp.2399-2407; M.J.Earle, К.R.Sheldon, "Ionic liquids. Green solvent for the future" [Ионные жидкости. "Зеленый" растворитель будущего]. Pure Appl. Chem. 72, No.7 (1999), pp.1391-1398; Т.Welton, "Room temperature ionic liquids of alkylimidazolium cations and fluoroanions" [Ионные жидкости с комнатной температурой плавления на основе катионов алкилимидазолиния и фтор-анионов], J. of Fluorine Chem. 105 (2000) pp.221-227). Термин ионная жидкость используется для обозначения соединения, которое является жидким при комнатной температуре или относительно низких температурах. Кроме того, он включает органические катионы, такие как, например, катионы тетраалкиламмония, тетраалкилфосфония, N-алкилпиридиния, 1,3-диалкилимидазолиния и триалкилсульфония, и обычно неорганические анионы, такие как, например, BF4 -, РF6 -, SbF6 -, NO3 -, СF3SО3 -, (СF3SО2)2N-, АrSO3 -, СF3СO2 -, СН3СО2 -, Al2Cl7 -.
Свойства ионных жидкостей, такие как, например, температура плавления, термическая и электрохимическая стабильность и вязкость, сильно зависят от природы аниона и катиона. Полярность и гидрофильность или липофильность могут быть откорректированы с помощью выбора пригодной пары катион/анион. Каждый новый анион и каждый новый катион открывают новые возможности по регулировке свойств ионных жидкостей.
С точки зрения практического применения ионных жидкостей экономическая эффективность, то есть стоимость, является решающей. И учитывая данный фактор, то есть вследствие их очень высоких стоимостей производства, известные ионные жидкости в настоящее время не сравнимы с нормальными органическими растворителями. Поэтому очень важным является разработка новых способов получения ионных жидкостей с низкой стоимостью производства.
Недавно был предложен способ получения бис(перфторалкил)фосфиновой кислоты (DE 10216997). Нейтрализация этих кислот с использованием органических оснований, например гидроксида тетрабутиламмония, приводит к образованию соответствующих солей. Кроме того, бис(перфторалкил)фосфиновая кислота может быть использована для превращения органических хлоридов в органические соли, которые содержат анион бис(перфторалкил)фосфината с выделением НСl. Однако синтез соответствующих хлоридов (или бромидов) путем алкилирования описывается выше или также сначала необходимо использовать дорогие гидроксиды алкиламмония или алкилфосфония.
Реакция трис(гептафторпропил)фосфиноксида с метанолом, которая приводит к образованию простого диметилового эфира и бис(гептафторпропил)фосфиновой кислоты, известна из предшествующего уровня техники (N.V.Pavlenko, et al., J, Gen. Chem. USSR (Engl. Transl.), 59, No.3 (1989) pp.474-476). Образование этого продукта было объяснено через образование промежуточного продукта сложного диметилового эфира бис(гептафторпропил)фосфиновой кислоты, который потом алкилирует исходный материал метанолом, приводя к образованию простого диметилового эфира.
Целью представленного изобретения является обеспечение промышленно и экономически выгодного способа получения солей, которые содержат анионы бис(перфторалкил)фосфината, и который не имеет недостатков предшествующего уровня техники. В частности, целью представленного изобретения является обеспечение способа, который имеет хорошие выходы и является более простым и менее дорогим, по сравнению с известными из предшествующего уровня техники способами.
Эта цель достигается в соответствии с изобретением с помощью характеризующего его независимого пункта формулы изобретения и зависимых пунктов формулы изобретения.
Изобретение характеризуется тем фактом, что трис(перфторалкил)фосфиноксид образует соответствующую соль, которая содержит анион бис(перфторалкил)фосфината с хорошими выходами вследствие простой реакции со спиртом и органическим основанием, которое является более сильным основанием, чем спирт.
Анион бис(перфторалкил)фосфината может быть представлен с помощью формулы [(RF)2Р(O)O]-, где RF в каждом случае, независимо один от другого, представляет собой перфторалкильную группу, как описано ниже.
Трис(перфторалкил)фосфиноксид может быть описан с помощью формулы [(RF)3P=O, где RF в каждом случае, независимо один от другого, представляет собой перфторалкильную группу, как описано ниже.
Присутствие более сильного основания, чем спирт, подавляет нежелательное образование простого диалкилового эфира, и образуются соответствующие органические соли, которые содержат анион бис(перфторалкил)фосфината.
Моногидроперфторалканы, которые образуются как побочный продукт в способе в соответствии с изобретением, также являются ценными веществами. Они могут быть выделены и использованы для разных целей, таких как, например, как указано в DE 10216995.
В способе в соответствии с изобретением виртуально не образуются посторонние вещества, которые будут разрушаться. Кроме того, благодаря используемым исходным материалам и одностадийной реакции способ в соответствии с изобретением может быть осуществлен с небольшими затратами.
Способ в соответствии с изобретением преимущественно обеспечивает получение соединений, которые содержат анион бис(перфторалкил)фосфината, только в одну стадию. Кроме того, все необходимые исходные материалы для вновь вводимой катионной алкильной группы являются не дорогими алкилирующими агентами, а дешевыми спиртами.
Таким образом, способ в соответствии с изобретением для получения органических солей, которые содержат анионы бис(перфторалкил)фосфината, включает, по меньшей мере, реакцию трис(перфторалкил)фосфиноксида со спиртом и органическим основанием, которое является более сильным основанием, чем спирт.
В предпочтительном варианте способа в соответствии с изобретением используемым органическим основанием является соединение общей формулы (1)
или общей формулы (2)
в которой Х представляет собой
, , или ,
Y представляет собой -O-, -S-, -Se-, -C(=O)-, -C(=S)- или -C(=Se)-,
R представляет собой -Н для Y≠О и где, в случае формулы (2), все R не могут быть одновременно Н,
неразветвленный или разветвленный алкил, имеющий 1 -20 атомов С,
неразветвленный или разветвленный алкенил, имеющий 2-20 атомов С и одну или большее количество двойных связей,
неразветвленный или разветвленный алкинил, имеющий 2-20 атомов С и одну или большее количество тройных связей, или
насыщенный, частично или полностью ненасыщенный циклоалкил, имеющий 3-7 атомов С, в частности фенил, который может быть замещен алкильными группами имеющими 1-6 атомов С,
где заместители R, в каждом случае, являются одинаковыми или разными,
где заместители R могут быть связаны друг с другом, образуя пары с помощью простой или двойной связи,
где один или большее количество, но не все, заместители R могут быть частично или полностью замещены галогенами, в частности -F и/или -Сl, или частично -CN или -NO2,
и где один или два не соседних атома углерода заместителя R могут быть заменены атомами и/или группами атомов, которые выбирают из группы -O-, -С(O)-,
-С(O)O-, -C(O)NH-, -C(O)NR'-, -S-, -S(O)-, -S(O)NH-, -S(O)NR'-, -S(O)O-, -S(O)2-, -S(O)2O-, -S(O)2NH-, -S(O)2NR'-, -N=, -N=N-, -NH-, -NR'-, -PH-, -PR'-, -P(O)R'-, -P(O)R'-O-,
-O-P(O)R'-O- и -PR'2=N-, где R' представляет собой не-, частично или перфторированный C1-C6-алкил, С3-С7-циклоалкил, незамещенный или замещенный фенил или незамещенный или замещенный гетероцикл.
Таким образом, кроме водорода, пригодными заместителями R органических оснований используемых в соответствии с изобретением являются C1-C20-, в частности С1-С12-алкильиые группы, и насыщенные или ненасыщенные, то есть также ароматические, С3-С7-циклоалкильные группы, которые могут быть замещены
C1-С6-алкильными группами, в частности фенил. Однако, в случае основания формулы (2), все R не могут одновременно быть водородами, то есть основанием не может быть H2O, H2S или H2Se.
Алкильная группа, которая имеет 1-12 атомов С, означает, например, метил, этил, изопропил, пропил, бутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2- или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, гептил, октил, нонил, децил, ундецил или додецил. Алкильные группы также могут быть частично или полностью замещены галогенами, в частности -F и/или -Сl. Фторированными алкильными группами являются дифторметил, трифторметил, пентафторэтил, пентафторпропил, гептафторпропил, гептафторбутил или нонафторбутил. Термин перфторалкильная группа означает, что все атомы Н алкильной группы заменены атомами F.
Неразветвленным или разветвленным алкенилом, который имеет от 2 до 20 атомов С, в котором также может присутствовать ряд двойных связей, является, например, аллил, 2- или 3-бутенил, изобутенил, втор-бутенил, кроме того, 4-пентенил, изопентенил, гексенил, гептенил, октенил, -C9H17, -C10H19 до -С20Н39, предпочтительно аллил, 2- или 3-бутенил, изобутенил, втор-бутенил, кроме того, преимущество отдается 4-пентенилу, изопентенилу или гексенилу.
Неразветвленным или разветвленным алкинилом, который имеет от 2 до 20 атомов С, в котором также может присутствовать ряд тройных связей, является, например, этинил, 1- или 2-пропинил, 2- или 3-бутинил, кроме того, 4-пентинил, 3-пентинил, гексинил, гептинил, октинил, -C9H15-, -С10Н17 до -С20Н37, предпочтительно этинил, 1- или 2-пропинил, 2- или 3-бутинил, 4-пентинил, 3-пентинил или гексинил.
Незамещенными насыщенными, или частично, или полностью ненасыщенными циклоалкильными группами, имеющими 3-7 атомов С, являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклопента-1,3-диенил, циклогексенил, циклогекса-1,3-диенил, циклогекса-1,4-диенил, фенил, циклогептенил, циклогепта-1,3-диенил, циклогепта-1,4-диенил или циклогепта-1,5-диенил, который может быть замещен C1-С6-алкильными группами, где циклоалкильная группа или циклоалкильная группа, замещенная C1-С6-алкильными группами, могут, в свою очередь, также быть замещены атомами галогена, такими как F, Cl, Br или I, в частности F или Cl, CN или NO2.
Три или два заместителя R органического основания могут быть одинаковыми или разными. Заместители R также могут быть связаны таким путем, что образуются моно-, би- или полициклические основания, например, предпочтительно гетероциклические соединения пиридин, имидазол, пиразол, триазол, пиридазин, пиримидин, пиразин, тиазол, оксазол, бензоксазол, бензотиазол, пирролидин, пиперидин, пиперазин, морфолин, индол, индолин, хинолин, изохинолин или анилин, каждый из которых может, необязательно, быть замещен
неразветвленным или разветвленным алкилом, который имеет 1-20 атомов С,
неразветвленным или разветвленным алкенилом, который имеет 2-20 атомов С, и одну или большее количество двойных связей,
неразветвленным или разветвленным алкинилом, который имеет 2-20 атомов С, и одну или большее количество тройных связей или
насыщенным, частично или полностью ненасыщенным циклоалкилом, который имеет 3-7 атомов С, в частности фенил,
который может быть замещен алкильными группами, имеющими 1-6 атомов С.
Указанные гетероциклы являются предпочтительно незамещенными или замещенными неразветвленными или разветвленными алкильными группами, которые имеют 1-20 атомов С, в частности 1-12 атомов С.
Заместители R могут быть частично или полностью замещены атомами галогенов, в частности F и/или Cl, или частично CN или NO2, но где все заместители R не должны быть в полностью галогенированной форме. Кроме того, заместители R могут содержать один или два не соседних гетероатома или группы атомов, которые выбирают из группы O, С(O), С(O)O, C(O)NH, C(O)NR', S, S(O), S(O)NH, S(O)NR', S(O)O, SO2, SO2O, SO2NH, SO2NR', N, N=N, NH, NR', PH, PR', P(O)R', P(O)R'O, OP(O)R'O и PR'2=N, где R' может быть не-, частично или перфторированным C1-С6-алкилом, С3-С7-циклоалкилом, незамещенным или замещенным фенилом или незамещенным или замещенным гетероциклом.
В R' С3-С7-циклоалкил представляет собой, например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
В R' замещенный фенил представляет собой фенил, который является замещенным C1-C6-алкилом, C1-C6-алкенилом, NO2, F, Cl, Вr, I, ОН, C1-C6-алкокси, CN, SCN, SCF3, SO2CF3, С(O)O-С1-С6-алкилом, NH2, C1-С6-алкиламино или C1-С6-диалкиламино, C(O)NR''2, SO2OR'', SO2X', SO2NR''2 или NHC(O)R'', где X' представляет собой F, Cl или Br и R'' представляет собой не-, частично или перфторированный C1-C6-алкил или С3-С7-циклоалкил, как определено для R', например о-, м- или п-метилфенил, о-, м- или п-этилфенил, о-, м- или п-пропилфенил, о-, м- или п-изопропилфенил, о-, м- или п-трет-бутилфенил, о-, м- или п-аминофенил, о-, м- или п-(N,N-диметиламино)фенил, о-, м- или п-нитрофенил, о-, м- или п-гидроксифенил, о-, м- или п-метоксифенил, о-, м- или п-этоксифенил, о-, м- или п-(трифторметил)фенил, о-, м- или п-(трифторметокси)фенил, о-, м- или п-(трифторметилсульфонил)фенил, о-, м- или п-фторфенил, о-, м- или п-хлорфенил, о-, м- или п-бромфенил, о-, м- или п-йодфенил, кроме того, предпочтительно 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-диметилфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дигидроксифенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дифторфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дихлорфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дибромфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-диметоксифенил, 5-фтор-2-метилфенил, 3,4,5-триметоксифенил или 2,4,5-триметилфенил.
В R' гетероцикл означает насыщенный или ненасыщенный моно- или бициклический гетероциклический радикал, который имеет от 5 до 13 кольцевых членов, где могут присутствовать 1, 2 или 3 атома N и/или 1 или 2 атома S или О и гетероциклический радикал может быть моно- или полизамещенным C1-C6-алкилом, C1-C6-алкенилом, NO2, F, Cl, Br, I, ОН, C1-C6-алкокси, CN, SCN, SCF3, SO2СF3, С(O)O-C1-C6-алкилом, NH2, C1-C6-алкиламино или C1-C6-диалкиламино, C(O)NR''2, SO2OR'', SO2X', SO2NR''2 или NHC(O)R'', где X' и R'' имеют значения, указанные выше.
Гетероциклическим радикалом является предпочтительно замещенный или незамещенный 2- или 3-фурил, 2- или 3-тиенил, 1-, 2- или 3-пирролил, 1-, 2-, 4- или 5-имидазолил, 3-, 4- или 5-пиразолил, 2-, 4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 3- или 4-пиридил, 2-, 4-, 5- или 6-пиримидинил, кроме того, предпочтительно 1,2,3-триазол-1-, -4- или -5-ил, 1,2,4-триазол-1-, -4- или -5-ил, 1 - или 5-тетразол, 1,2,3-оксадиазол-4- или -5-ил, 1,2,4-оксадиазол-3- или -5-ил, 1,3,4-тиадиазол-2- или -5-ил, 1,2,4-тиадиазол-3- или -5-ил, 1,2,3-тиадиазол-4- или -5-ил, 2-, 3-, 4-, 5- или 6-2Н-тиопиранил, 2-, 3- или 4-4Н-тиопиранил, 3- или 4-пиридазинил, пиразинил, 2-, 3-, 4-, 5-, 6- или 7-бензофурил,
2-, 3-, 4-, 5-, 6- или 7-бензотиенил, 1-, 2-, 3-, 4-, 5-, 6- или 7-1H-индолил, 1-, 2-, 4- или 5-бензимидазолил, 1-, 3-, 4-, 5-, 6- или 7-бензопиразолил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 3-, 4-, 5-, 6- или 7-бензизоксазолил, 2-, 4-, 5-, 6- или 7-бензотиазолил, 2-, 4-, 5-, 6- или 7-бензоизотиазолил, 4-, 5-, 6- или 7-бенз-2,1,3-оксадиазолил, 1-, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолинил, 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолинил, 1-, 2-, 3-, 4- или 9-карбазолил, 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8- или 9-акридинил, 3-, 4-, 5-, 6-, 7- или 8-циннолинил, 2-, 4-, 5-, 6-, 7- или 8-хиназолинил или 1-, 2- или 3-пирролидинил.
Без ограничения обобщением, примерами заместителей R органических оснований, используемых в соответствии с изобретением, являются
-СН3, -С2Н5, -С3Н7, -СН(СН3)2, -С4Н9, -С(СН3)3, -С5Н11, -С6Н13, -C7H15, -С8Н17, -C9H19, -С10Н21, -С12Н25, -С20Н41, -ОСН3, -ОСН(CH3)2, -СН2OСН3, -С2Н4OСН(CH3)2, -SСН3, -SСН(CH3)2, -C2H4SC2H5, -С2Н4SСН(CH3)2, -S(O)СН3,
-СН2SO2СН3, -OSO2СН3, -СН2N(Н)С2Н5, -С2Н4N(Н)С2Н5, -СН2N(СН3)СН3, -С2Н4N(СН3)СН3, -N(CH3)2, -N(СН3)С3Н5, -N(СН3)СF3, -O-C4H8-O-C4H9, -S-C2H4-N(C4H9)2, -СF3, -C2F5, -С3F7, -C4F9, -С(СF3)3, -CF2SO2CF3, -C2F4N(C2F5)C2F5, -CFH2, -CHF2, -CH2CF3, -C2F2H3,
-С3FН6, -СН2С3F7, -С(СFН2)3, -СНО, -СН2С(O)СН3, -СН2С(O)С2Н5, -СН2С(O)ОСН3, СН2С(O)ОС2Н5, -С(O)СН3, -С(O)ОСН3, -СН=СН2, -СН2СН=СН2, -С(СН3)=СН2, -СН=СНСН3, -СН2СН=СНСН3, -O-СН=СН2, -O-СН2СН=СН2, -С≡СН, -СН2С≡СН, -С≡CCН3, -СН2C≡ССН3,
Выбор пригодного основания для способа в соответствии с изобретением является абсолютно несложным для среднего специалиста в данной области. Особое предпочтение в соответствии с изобретением отдается основаниям, которые выбирают из группы, включающей (C2H5)3N, (C2H5)2NH, (С2Н5)3Р, (С2Н5O)3Р, (С4Н9)3Р,
СН3-S-СН3, (CH3)2N-С(O)-N(CH3)2, С6Н5-Sе-С6Н5, гуанидин, пиридин, имидазол, N-метилимидазол, бензоксазол, бензотиазол, пирролидин, пиперидин, пиперазин, анилин, N,N-диметиланилин, бензиламин, N-этилбензиламин или дифенилсульфид.
Пригодный спирт выбирают так, что образуется желаемый катион после алкилирования с использованием основания. Соответствующий выбор является абсолютно не сложным для среднего специалиста в данной области. Без он ограничения обобщением спирт описывается формулой ROH-ОН, используя способ в соответствии с изобретением, предпочтительно алифатический спирт, то есть ROH в этом случае представляет собой алифатическую группу. Особое предпочтение отдается вариантам способа, в котором спирт выбирают из группы, включающей метанол, этанол, изопропанол, н-пропанол, аллиловый спирт, бутанол, гексанол или бензиловый спирт, но также используют фторированные алифатические спирты, такие как 4,5,5-трифторпент-4-ен-1-ол или 3,3,4,4,5,5,5-гептафторпентан-1-ол.
Трис(перфторалкил)фосфиноксиды, используемые в соответствии с изобретением, можно получить с помощью обычных методик, известных среднему специалисту в данной области. Эти соединения предпочтительно получают с помощью реакции с гексаметилдисилоксаном (V.Ya.Sememii et al., J. Gen. Chem. USSR (Engl. Trans.) 55, No.12 (1985), 2415-2417). Соответствующие описания включены сюда как ссылки и рассматриваются как часть описания.
Также в соответствии с изобретением можно использовать смеси двух или большего количества трис(перфторалкил)фосфиноксидов. Предпочтительно в каждом случае в способе в соответствии с изобретением реагирует только один трис(перфторалкил)фосфиноксид.
Трис(перфторалкил)фосфиноксиды, используемые в соответствии с изобретением, или их соответствующие производные имеют три перфторалкильные группы, обозначенные аббревиатурой RF выше, и которые являются одинаковыми или разными. В каждом случае предпочтение отдается применению трис(перфторалкил)фосфиноксидов, имеющих одинаковые перфторалкильные группы.
В предпочтительном воплощении способа в соответствии с изобретением используют трис(перфторалкил)фосфиноксид, в котором перфторалкильные группы содержат от 1 до 20 атомов С и являются неразветвленными или разветвленными. Особое предпочтение отдается исходным материалам, в которых перфторалкильные группы имеют от 1 до 12 атомов С.
Без ограничения обобщением используемым трис(перфторалкил)фосфиноксидом является соединение, которое выбирают из группы включающей (СF3)3Р(О), (С2F5)3Р(O), (С3F7)3Р(O) и (С4F9)3Р(O).
Пригодной реакционной средой для способа в соответствии с изобретением является предпочтительно обычный полярный или неполярный растворитель, известный специалисту в данной области. Альтернативно способ в соответствии с изобретением также может быть осуществлен без присутствия растворителя. Без ограничения обобщением используемым полярным растворителем является особенно предпочтительно дихлорметан, 1,2-диметоксиэтан, бензол или их смеси.
Температура, при которой проводят реакцию в соответствии с изобретением, предпочтительно находится в интервале температур от -20 до 200°С. Реакцию особенно предпочтительно проводят при температуре в интервале от 0 до 100°С. Температурой реакции является очень особенно предпочтительно комнатная температура.
В предпочтительном варианте способ в соответствии с изобретением осуществляют без избытка или с до пятикратным избытком одного из реактантов, исходя из молярных количеств. Реакцию особенно предпочтительно проводят, используя приблизительно эквимолярные количества исходных материалов.
Кроме того, представленное изобретение касается органических солей, которые содержат анионы бис(перфторалкил)фосфината, полученных с помощью способа в соответствии с изобретением.
Соединения, полученные в способе в соответствии с изобретением, имеют солеподобный характер, относительно низкие температуры плавления (обычно ниже 100°С) и могут быть использованы как ионные жидкости.
Соли, полученные в способе в соответствии с изобретением, могут быть использованы как растворители для многих синтетических или каталитических реакций, например ацилирования или алкилирования Фриделя-Крафтса, циклоприсоединения Дильса-Альдера, реакции гидрирования и окисления, реакции Хека, конденсации Сузуки, гидроформилирования.
Также можно использовать соединения, полученные с помощью способа в соответствии с изобретением как неводные электролиты, необязательно, в комбинации с другими электролитами, известными среднему специалисту в данной области, или как токопроводящую соль в электрохимических ячейках.
В дополнение, соли, полученные с помощью способа в соответствии с изобретением, могут быть использованы как неводные полярные вещества в пригодных реакциях, как катализатор фазового переноса, как поверхностно-активное вещество (поверхностно-активный агент), как пластификатор или как среда для гетерогенизации гомогенных катализаторов.
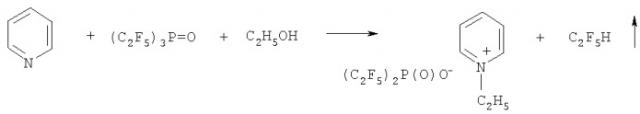
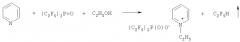
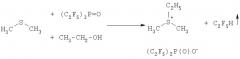
Приведенная далее общая схема раскрывает способ в соответствии с изобретением
где RF, R, X, Y и ROH имеют значения, указанные в описании. Приведенная стрелка в случае моногидроперфторалкана RFH означает, что соединение является летучим.
Полное описание содержания всех заявок, патентов и публикаций, упомянутых выше и ниже, включается в эту заявку с помощью ссылок.
Даже без дополнительных комментариев понятно, что специалист в данной области способен использовать приведенное выше описание в широких рамках. Поэтому предпочтительные воплощения и примеры должны рассматриваться только как наглядное описание, которое абсолютно не ограничивается каким-либо путем.
Спектры ЯМР снимали с растворов в дейтерированных растворителях при 20°С на спектрометре Bruker Avance 300 с 5 мм 1Н/ВВ широкополосной головкой с дейтериевым затвором. Частота измерений разных ядер составляет
1H: 300,13 МГц, 11B: 96,92 МГц, 19F: 282,41 МГц и 31Р: 121,49 МГц. Способ отсчета указывается отдельно для каждого спектра или каждого набора данных.
Примеры
Пример 1. N-Этилпиридиния бис(пентафторэтил)фосфинат
15,69 г (38,8 ммоль) трис(пентафторэтил)фосфиноксида, (С2F5)3Р=O, смешивают с 20 см3 дихлорметана и 3,09 г (39,1 ммоль) пиридина в 50 мл колбе, снабженной обратным холодильником, охлажденным до -65 - -70°С. Прибавляют 1,85 г (40,2 ммоль) этанола на протяжении 15 минут при комнатной температуре при перемешивании реакционной смеси с помощью магнитной мешалки. Обратный холодильник нагревают до комнатной температуры и дихлорметан отгоняют. Остаток высушивают при 60°С в вакууме 1,4 Па, получая 14,56 г темно-красного очень вязкого материала. Выход N-этилпиридиния бис(пентафторэтил)фосфината составляет 91,7%.
19F ЯМР (относительно CCl3F - внутренний стандарт; растворитель CD3CN): -80,13 m (2СF3); -124,81 dm (2CF2); 2JP,F=67 Гц.
1H ЯМР (относительно ТМС; растворитель CD3СN): 1,59 t (СН3); 4,59 q (СН2); 8,03 m (2CH); 8,50 tt (CH); 8,78 m (2CH); 3JH,H=7,3 Гц; 3JH,H =7,8 Гц; 4JH,H=1,2 Гц.
31Р ЯМР (относительно 85% Н3РO4; растворитель СD3СN): -2,19 quin.; 3JP,F=67 Гц.
Пример 2. Этилдиметилсульфония бис(пентафторэтил)фосфинат
4,92 г (12,2 ммоль) трис(пентафторэтил)фосфиноксида, (С2F5)3Р=O, смешивают с 20 см3 1,2-диметоксиэтана и 0,775 г (12,5 ммоль) диметилсульфида в 50 мл колбе, снабженной обратным холодильником. Прибавляют на протяжении 1 минуты при перемешивании реакционной смеси с помощью магнитной мешалки при комнатной температуре 0,560 г (12,2 ммоль) этанола. Реакционную смесь кипятят с обратным холодильником на протяжении 5 часов и 1,2-диметоксиэтан отгоняют. Остаток высушивают при 40°С в вакууме 1,4 Па, получая 4,18 г твердого материала. Выход этилдиметилсульфония бис(пентафторэтил)фосфината составляет 87,4%.
19F ЯМР (относительно ССl3F - внутренний стандарт; растворитель CD3CN): -80,19 m (2СF3); -124,96 dm (2CF2); 2JP,F=69 Гц.
1H ЯМР (относительно ТМС; растворитель CD3СN): 1,37 t (СН3); 2,81 s (2СН3); 3,28 q (CH2); 3JH,H=7,4 Гц.
31P ЯМР (относительно 85% Н3РO4; растворитель СD3СN): -1,86 quin.; 2JP,F=69 Гц.
Пример 3. N-Метилбензоксазолия бис(пентафторэтил)фосфинат
9,40 г (23,3 ммоль) трис(пентафторэтил)фосфиноксида, (C2F5)3P=O, смешивают с 20 см3 сухого 1,2-диметоксиэтана и 2,77 г (23,3 ммоль) бензоксазола в 50 мл колбе, снабженной обратным холодильником. Прибавляют на протяжении 5 минут при перемешивании реакционной смеси с помощью магнитной мешалки при комнатной температуре 0,745 г (23,3 ммоль) метанола. Реакционную смесь перемешивают на протяжении 1 часа и 1,2-диметоксиэтан отгоняют. Остаток высушивают при 40°С в вакууме 1,4 Па, получая 9,44 г твердого материала (температура плавления 78-79°С). Выход N-метилбензоксазолия бис(пентафторэтил)фосфината составляет 93,1%.
19F ЯМР (относительно CCl3F - внутренний стандарт; растворитель CD3СN): -80,16 m (2СF3); -124,93 dm (2CF2); 2JP,F=71 Гц.
1Н ЯМР (относительно ТМС; растворитель СD3СN): 4,20 d (СН3); 7,85 m (2СН); 8,01 m (2CH); 10,05 br. s (CH); 4JH,H=1,0 Гц.
31P ЯМР (относительно 85% Н3РO4; растворитель СD3СN): -1,77 quin.; 2JP,F=71 Гц.
Пример 4. Триэтил-изо-пропиламмония бис(пентафторэтил)фосфинат
9,30 г (23,0 ммоль) трис(пентафторэтил)фосфиноксида, (C2F5)3P=O, смешивают с 8,34 г (82,4 ммоль) триэтиламина а 50 мл колбе, снабженной обратным холодильником и магнитной мешалкой. К этой реакционной смеси при 0°С (охлаждение на бане со льдом) при перемешивании прибавляют 1,41 г (23,5 ммоль) изо-пропанола. Реакционную смесь перемешивают при 0°С на протяжении 5 часов и при комнатной температуре на протяжении 36 часов. Все летучие продукты удаляют при 50°С в высоком вакууме при 1,4 Па, получая 9,25 г твердого материала, который содержит 37% триэтиламмония бис(пентафторэтил)фосфината и 63% триэтил-изо-пропиламмония бис(пентафторэтил)фосфината.
Для того чтобы выделить триэтил-изо-пропиламмония бис(пентафторэтил)фосфинат, эту смесь растворяют в 15 см3 воды и обрабатывают при комнатной температуре водным KОН (0,477 г КОН в 5 см3 воды). Воду удаляют на роторном испарителе и остаток высушивают на протяжении трех часов при 50°С в высоком вакууме (1,4 Па), получая 8,70 г твердого материала, который суспендируют в 15 см3 дихлорметана, осадок отфильтровывают и дважды промывают на фильтре 5 см3 дихлорметана. После удаления дихлорметана получают 5,9 г твердой соли. Выход триэтил-изо-пропиламмония бис(пентафторэтил)фосфината составляет 57,7%, исходя из трис(пентафторэтил)фосфиноксида.
19F ЯМР (относительно ССl3F - внутренний стандарт; растворитель CD3СN): -80,18 m (2СF3); -124,89 dm (2CF2); 2JP,F=66 Гц.
1Н ЯМР (относительно ТМС; растворитель СD3СN): 1,29 tm (3СН3); 1,38 dm (2СН3); 3,31 q (3CH2); 3,71 hep.(CH); 3JH,H=7,3 Гц; 3JH,H=6,7 Гц.
31P ЯМР (относительно 85% H3PO4; растворитель СD3СN): -2,32 quin. (1Р); 2JP,F=66 Гц.
Пример 5: Этилтрибутилфосфония бис(пентафторэтил)фосфинат
12,00 г (29,7 ммоль) трис(пентафторэтил)фосфиноксида, (С2F5)3Р=O, смешивают с 20 см3 дихлорметана и 6,00 г (29,7 ммоль) трибутилфосфина в 50 мл, колбе, снабженной обратным холодильником, в котором поддерживается температура от минус 65 до минус 70°С. На протяжении 3 минут при комнатной температуре при перемешивании реакционной смеси с помощью магнитной мешалки прибавляют 1,37 г (29,7 ммоль) этанола. Обратный холодильник нагревают до комнатной температуры и дихлорметан отгоняют. Остаток высушивают при 60°С в вакууме 1,4 Па, получая 15,60 г твердого материала (температура плавления 42-43°С). Выход этилтрибутилфосфония бис(пентафторэтил)фосфината составляет 98,7%.
19F ЯМР (относительно ССl3F - внутренний стандарт; растворитель CD3CN): -80,21 m (2СF3); -124,89 dm (2CF2); 2JP,F=65 Гц.
1Н ЯМР (относительно ТМС; растворитель CD3CN): 0,94 t (3СН3); 1,17 dt (СН3); 1,46 m (6СН2); 2,11 m (3CH2); 2,15 dq (СН2); 3JH,H=7,1 Гц; 3JH,H=7,6 Гц; 3JP,H=13,0 Гц;
4JP,H=18,2 Гц.
31Р ЯМР (относительно 85% H3РO4; растворитель СD3СN): 34,73 br. s (1P); -2,39 quin. (1P); 2JP,F=65 Гц.
Пример 6. Тетраэтиламмония бис(пентафторэтил)фосфинат
12,62 г (31,2 ммоль) трис(пентафторэтил)фосфиноксида, (C2F5)3P=O, смешивают с 20 см3 дихлорметана и 3,16 г (31,2 ммоль) триэтиламина в 50 мл колбе, снабженной обратным холодильником, в котором поддерживается температура от минус 65 до минус 70°С. На протяжении 3 минут при комнатной температуре при перемешивании реакционной смеси с помощью магнитной мешалки прибавляют 1,44 г (31,2 ммоль) этанола. Обратный холодильник нагревают до комнатной температуры и дихлорметан отгоняют. Остаток высушивают при 60°С в вакууме 1,4 Па, получая 13,07 г твердого материала (температура плавления 103-105°С). Выход тетраэтиламмония бис(пентафторэтил)фосфината составляет 97,1%.
19F ЯМР (относительно ССl3F - внутренний стандарт; растворитель СD3СN): -80,23 m (2СF3); -124,94 dm (2CF2); 2JP,F=65 Гц.
1Н ЯМР (относительно ТМС; растворитель CD3CN): 1,20 tm (СН3); 3,18 q (CH2);
3JH,H=7,3 Гц.
31P ЯМР (относительно 85% Н3РO4; растворитель СD3СN): -2,33 quin.; 2JP,F=65 Гц.
Пример 7. N-Этилбензотиазолия бис(пентафторэтил)фосфинат
10,74 г (26,6 ммоль) трис(пентафторэтил)фосфиноксида, (C2F5)3P=O, смешивают с 20 см3 дихлорметана и 3,53 г (26,1 ммоль) бензотиазола в 50 мл колбе, снабженной обратным холодильником, в котором поддерживается температура от минус 65 до минус 70°С. На протяжении 5 минут при комнатной температуре при перемешивании реакционной смеси с помощью магнитной мешалки прибавляют 1,22 г (26,5 ммоль) этанола. Обратный холодильник нагревают до комнатной температуры и дихлорметан отгоняют. Остаток высушивают при 60°С в вакууме 1,4 Па, получая 13,07 г твердого материала (температура плавления 76-77°С). Выход N-этилбензотиазолия бис(пентафторэтил)фосфината составляет 82,0%, исходя из бензотиазола.
19F ЯМР (относительно ССl3F - внутренний стандарт; растворитель СD3СN): -80,08 m (2СF3); -124,81 dm (2CF2); 2JP,F=67 Гц.
1Н ЯМР (относительно ТМС; растворитель СD3СN): 1,66 t (СН3); 4,81 q (СН2); 7,88 m (2CH); 8,30 m (2CH); 10,34 s (CH); 3JH,H=7,3 Гц.
31P ЯМР (относительно 85% H3PO4; растворитель СD3СN): -2,00 quin.; 2JP,F=67 Гц.
Пример 8. N,N-Диметилимидазолиния бис(пентафторэтил)фосфинат
20,49 г (50,7 ммоль) трис(пентафторэтил)фосфиноксида, (C2F5)3P=O, смешивают с 30 см3 дихлорметана и 4,16 г (50,7 ммоль) N-метилимидазола в 100 мл колбе, снабженной обратным холодильником, в котором поддерживается температура от минус 65 до минус 70°С. На протяжении 15 минут при комнатной температуре при перемешивании реакционной смеси с помощью магнитной мешалки прибавляют 1,623 г (50,7 ммоль) метанола. Обратный холодильник нагревают до комнатной температуры и дихлорметан отгоняют. Остаток высушивают при 60°С в вакууме 1,4 Па, получая 19,23 г твердого материала. Выход N,N-диметилимидазолиния бис(пентафторэтил)фосфината составляет 95,2% (температура плавления 35-37°С).
19F ЯМР (относительно CCl3F - внутренний стандарт; растворитель СD3СN): -80,18 m (2CF3); -124,90 dm (2CF2); 2JP,F =66 Гц.
1H ЯМР (о