Способ получения l-аминокислот с использованием бактерии семейства enterobacteriaceae
Иллюстрации
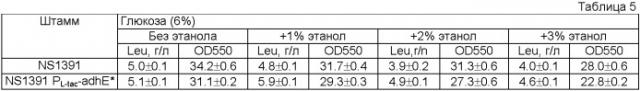
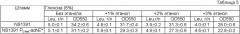
Показать всеИзобретение относится к биотехнологии и представляет собой способ получения L-аминокислоты с использованием бактерии рода Escherichia, причем бактерия модифицирована таким образом, что активность алкогольдегидрогеназы, кодируемой геном adhE, у этой бактерии увеличена. Изобретение позволяет получать L-аминокислоты с высокой степенью эффективности. 4 н. и 15 з.п. ф-лы, 5 ил., 6 табл.
Реферат
Область техники
Настоящее изобретение относится к микробиологической промышленности, конкретно к способу получения L-аминокислоты, такой как L-треонин, L-лизин, L-гистидин, L-фенилаланин, L-аргинин, L-триптофан, L-глутаминовая кислота и L-лейцин путем ферментации с использованием бактерии с повышенной активностью алкогольдегидрогеназы.
Описание предшествующего уровня техники
Традиционно L-аминокислоты получают в промышленном масштабе методами ферментации с использованием штаммов микроорганизмов, выделенных из природных источников, или их мутантов. В большинстве случаев микроорганизмы модифицируют таким образом, чтобы увеличить производственный выход L-аминокислот.
Описано много технологий для увеличения производственного выхода L-аминокислот, включая трансформацию микроорганизмов рекомбинантной ДНК (см., например, патент США US 4,278,765). Другие технологии увеличения производственного выхода включают увеличение активности ферментов, участвующих в биосинтезе аминокислот и/или снижение чувствительности ферментов-мишеней к ингибированию по типу обратной связи образующейся L-аминокислотой (см., например, патенты США 4,346,170; 5,661.012 и 6,040,160).
Для оптимизации главного пути биосинтеза необходимого компонента может быть выполнено дальнейшее улучшение штаммов-продуцентов L-аминокислот. Обычно это может быть достигнуто путем внесения в питательную среду бактерий повышенного количества источника углерода, такого как сахар, например глюкоза. Несмотря на то, что система PTS обеспечивает эффективный транспорт глюкозы в клетку, для высокопродуктивного штамма доступность этого источника углерода может быть недостаточной. Другим способом увеличения продуктивности штаммов-продуцентов L-аминокислоты и уменьшения стоимости целевой L-аминокислоты является использование альтернативных источников углерода, таких как спирты, в частности этанол.
Алкогольдегидрогеназа (этанолоксидоредуктаза, AdhE) бактерии Escherichia coli является многофункциональным ферментом, который катализирует ферментативный синтез этанола путем двух последовательных реакций NADH-зависимого восстановления ацетил-коэнзима А, а также дезактивирует пируватформиатлиазу, которая расщепляет пируват с образованием ацетил-коэнзима А и формиата.
AdhE синтезируется в больших количествах (примерно 3·104 копий на клетку) при анаэробном росте бактерий в среде, содержащей глюкозу, и образует спиральные структуры, называемые спиросомами, длиной примерно 0.22 мкм, которые содержат 40-60 молекул AdhE (Kessler, D., Herth, W., and Knappe, J., J. Biol. Chem., 267, 18073-18079 (1992)). Когда клетки Е. coli переводят из анаэробных условий культивирования в аэробные, транскрипция гена adhE уменьшается и поддерживатся в пределах 10% от уровня, наблюдаемого в анаэробных условиях (Chen, Y. М., and Lin, Е. С.С., J. Bacteriol. 173, 8009-8013 (1991); Leonardo, М. R., Cunningham, P. R., and dark, D. P., J. Bacteriol. 175, 870-878 (1993); Mikulskis, A., Aristarkhov, A., and Lin, Е. C. C., J. Bacteriol. 179, 7129-7134 (1997); Membrillo-Hemandez, J., and Lin, Е. C. C., J. Bacteriol. 181, 7571-7579 (1999)). Трансляция мРНК AdhE также является регулируемой, для чего необходима РНКаза III (Membrillo-Hernandez, J., and Lin, Е. С.С., J. Bacteriol. 181, 7571-7579 (1999); Aristarkhov, A. et al, J. Bacteriol. 178, 4327-4332 (1996)). Было также обнаружено, что AdhE является основной мишенью при стрессе, вызванном перекисью водорода (Tamarit, J., Cabiscol, E., and Ros, J., J. Biol. Chem. 273, 3027-3032 (1998)).
Несмотря на обратимый характер двух NADH-зависимых реакций, катализируемых AdhE, выделенные из природных источников штаммы Е. coli не обладают способностью к росту на этаноле, когда он используется в качестве единственного источника углерода и энергии, поскольку в аэробных условиях понижается транскрипция гена adhE (Chen, Y. М. and Lin, Е. С.С., J. Bacteriol. 73, 8009-8013 (1991); Leonardo, М. R., Cunningham, P. R. & Clark, D. P., J. Bacteriol. 175 870-878 (1993)), тогда как период полураспада белка AdhE уменьшается при аэробном метаболизме за счет катализируемого металлами окисления [metal-catalyzed oxidation (MCO)].
Мутантные штаммы Е. coli, способные расти в аэробных условиях на этаноле, который используется в качестве единственного источника углерода и энергии, были получены и описаны ранее [мутанты с заменой Ala267Thr растут на этаноле со скоростью удвоения 240 мин; мутанты с заменами Ala267Thr и Glu568Lys - со скоростью удвоения 90 мин при 37°С) (Membrillo-Hemandez, J. et al, J. Biol. Chem. 275, 33869-33875 (2000); Holland-Staley, С.A. et al, J. Bacteriol. 182, 6049-6054 (2000))]. Очевидно, что при катализе двух последовательных реакций в направлении, противоположном физиологическому, синтез ацетил-коэнзима А становится лимитирующей стадией для белка AdhE природного типа. В противовес увеличению скорости реакции Vmax при замене А267Т в белке AdhE снижается термостабильность этого фермента и повышается его чувствительность к повреждению окислением, катализируемым металлами [МСО]. Вторая аминокислотная замена, Е568К, в AdhE (A267T/E568K) частично восстанавливала стабильность белка и устойчивость к повреждению МСО без улучшения каталитической активности при окислении субстрата.
Однако в настоящее время отсутствуют сообщения об использовании бактерий семейства Enterobacteriaceae с повышенной активностью как нативной алкогольдегидрогеназы, так и мутантной алкогольдегидрогеназы, устойчивой к аэробной инактивации, для целей увеличения продуцирования ими L-аминокислот путем ферментации в питательной среде, содержащей этанол.
Описание изобретения
Цели настоящего изобретения включают повышение продуктивности штаммов-продуцентов L-аминокислоты и предоставление способа получения неароматических или ароматических L-аминокислот с использованием указанных штаммов.
Данная цель была достигнута путем обнаружения того факта, что экспрессия природного или мутантного гена adhE, кодирующего алкогольдегидрогеназу, под контролем промотора, функционирующего в аэробных условиях культивирования, приводит к увеличению выработки L-аминокислот, таких как L-треонин, L-лизин, L-гистидин, L-фенилаланин, L-аргинин, L-триптофан, L-глутаминовая кислота и/или L-лейцин.
Целью настоящего изобретения является предоставление мутантной алкогольдегидрогеназы, устойчивой к аэробной инактивации, выбранной из группы, состоящей из:
(А) белка, включающего аминокислотную последовательность, представленную в SEQ ID NO: 2, за тем исключением, что указанный белок содержит мутацию в положении 568 в SEQ ID NO: 2, и содержащего по крайней мере одну дополнительную мутацию, способствующую улучшению роста бактерии в жидкой среде, содержащей этанол в качестве единственного источника углерода, отличающейся тем, что указанная дополнительная мутация находится в положении, отличном от положения 267 в SEQ ID NO: 2; и
Б) варианта белка (А), обладающего активностью алкогольдегидрогеназы. Также целью настоящего изобретения является предоставление мутантной алкогольдегидрогеназы, описанной выше, отличающейся тем, что указанная дополнительная мутация выбрана из группы, состоящей из:
A) замены остатка глутаминовой кислоты в положении 560 в SEQ ID NO: 2 на остаток другой аминокислоты;
Б) замены остатка фенилаланина в положении 566 в SEQ ID NO: 2 на остаток другой аминокислоты;
B) замены остатка глутаминовой кислоты, остатка метионина, остатка тирозина, остатка изолейцина и остатка аланина в положениях 22, 236, 461, 554 и 786 соответственно в SEQ ID NO: 2 на остатки других аминокислот; и
Г) комбинации этих замен.
Также целью настоящего изобретения является предоставление мутантной алкогольдегидрогеназы, описанной выше, отличающейся тем, что указанная дополнительная мутация выбрана из группы, состоящей из:
A) замены остатка глутаминовой кислоты в положении 560 в SEQ ID NO: 2 на остаток лизина;
Б) замены остатка фенилаланина в положении 566 в SEQ ID NO: 2 на остаток валина;
B) замены остатка глутаминовой кислоты, остатка метионина, остатка тирозина, остатка изолейцина и остатка аланина в положениях 22, 236, 461, 554 и 786 в SEQ ID NO: 2 на остаток глицина, остаток валина, остаток цистеина, остаток серина и остаток валина соответственно; и
Г) комбинации этих замен.
Также целью настоящего изобретения является предоставление фрагмента ДНК, кодирующего мутантную алкогольдегидрогеназу, описанную выше.
Также целью настоящего изобретения является предоставление бактерии-продуцента L-аминокислоты семейства Enterobacteriaceae, содержащей мутантную алкогольдегидрогеназу, описанную выше.
Также целью настоящего изобретения является предоставление бактерии-продуцента L-аминокислоты семейства Enterobacteriaceae, отличающейся тем, что указанная бактерия модифицирована таким образом, что активность мутантной алкогольдегидрогеназы, описанной выше, в этой бактерии увеличена.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что активность мутантной алкогольдегидрогеназы в этой бактерии увеличена путем усиления экспрессии гена, кодирующего указанную мутантную алкогольдегидрогеназу.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что активность указанной мутантной алкогольдегидрогеназы в этой бактерии увеличена путем модификации последовательности, контролирующей экспрессию гена, кодирующего указанную алкогольдегидрогеназу, или путем увеличения количества копий гена, кодирующего указанную алкогольдегидрогеназу.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия выбрана из группы, состоящей из Escherichia. Enterobacter, Erwinia, Klebsiella, Pantoea, Providencia, Salmonella, Serratia, Shigella и Morganella.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия является продуцентом L-треонина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия дополнительно модифицирована таким образом, что у этой бактерии усилена экспрессия гена, выбранного из группы, состоящей из:
- мутантного гена thrA, кодирующего аспартокиназу-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи;
- гена thrB, кодирующего гомосеринкиназу;
- гена thrC, кодирующего треонинсинтазу;
- гена rhiA, кодирующего предполагаемый трансмембранный белок;
- гена asd, кодирующего аспартат-β-полуальдегиддегидрогеназу;
- гена aspC, кодирующего аспартатаминотрансферазу (аспартаттрансаминазу); и
- комбинации этих генов.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия модифицирована таким образом, что экспрессия указанного мутантного гена thrA, указанного гена thrB, указанного гена thrC и указанного гена rhtA в этой бактерии усилена.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия является продуцентом L-лизина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия является продуцентом L-гистидина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия является продуцентом L-фенилаланина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия является продуцентом L-аргинина.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия является продуцентом L-триптофана.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия является продуцентом L-глутаминовой кислоты.
Также целью настоящего изобретения является предоставление бактерии, описанной выше, отличающейся тем, что указанная бактерия является продуцентом L-лейцина.
Также целью настоящего изобретения является предоставление способа получения L-аминокислоты, включающего:
А) выращивание в питательной среде, содержащей этанол, бактерии семейства Enterobacteriaceae - продуцента L-аминокислоты, содержащей алкогольдегидрогеназу; и
Б) выделение L-аминокислоты из культуральной жидкости,
причем ген, кодирующий указанную алкогольдегидрогеназу, экспрессируется под контролем ненативного промотора, функционирующего в аэробных условиях культивирования.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанный ненативный промотор выбран из группы, состоящей из Ptac, Plac, Ptrc, PR и PL.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанная алкогольдегидрогеназа устойчива к аэробной инактивации.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанная алкогольдегидрогеназа синтезируется бактерией, выбранной из группы, состоящей из Escherichia coli, Erwinia carotovora, Salmonella typhimurium, Shigella flexneri, Yersmia pestis, Pantoea ananatis, Lactobacillus plantarum и Lactococctis lactis.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанная алкогольдегидрогеназа содержит аминокислотную последовательность, представленную в SEQ ID NO: 2, за исключением остатка глутаминовой кислоты в положении 568, замещенного остатком другой аминокислоты, иным, чем остаток аспарагиновой кислоты.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанная алкогольдегидрогеназа содержит аминокислотную последовательность, представленную в SEQ ID NO: 2 за исключением остатка глутаминовой кислоты в положении 568, замещенного остатком лизина.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанная алкогольдегидрогеназа содержит по крайней мере одну дополнительную мутацию, способствующую улучшению роста указанной бактерии в жидкой среде, содержащей этанол в качестве единственного источника углерода.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанная дополнительная мутация выбрана из группы, состоящей из:
А) замены остатка глутаминовой кислоты в положении 560 в SEQ ID NO: 2 на остаток другой аминокислоты;
Б) замены остатка фенилаланина в положении 566 в SEQ ID NO: 2 на остаток другой аминокислоты;
В) замены остатка глутаминовой кислоты, остатка метионина, остатка тирозина, остатка изолейцина и остатка аланина в положениях 22, 236, 461, 554 и 786 соответственно в SEQ ID NO: 2 на остаток другой аминокислоты; и
Г) комбинации этих замен.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанная дополнительная мутация выбрана из группы, состоящей из:
A) замены остатка глутаминовой кислоты в положении 560 в SEQ ID NO: 2 на остаток лизина;
Б) замены остатка фенилаланина в положении 566 в SEQ ID NO: 2 на остаток валина;
B) замены остатка глутаминовой кислоты, остатка метионина, остатка тирозина, остатка изолейцина и остатка аланина в положениях 22, 236, 461, 554 и 786 в SEQ ID NO: 2 на остатки глицина, валина, цистеина, серина и валина соответственно; и
Г) комбинации этих замен.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанная бактерия принадлежит к роду, выбранному из группы, состоящей из Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Providencia, Salmonella, Serratia, Shigella и Morganella.
Также целью настоящего изобретения является предоставление способа, описанного выше, отличающегося тем, что указанная L-аминокислота выбрана из группы, состоящей из L-треонина, L-лизина, L-гистидина, L-фенилаланина, L-аргинина, L-триптофана, L-глутаминовой кислоты и L-лейцина.
Подробное описание наилучшего способа осуществления изобретения
Алкогольдегидрогеназа является Fe2+-зависимым многофункциональным белком с активностью ацетальдегид-СоА-дегидрогеназы на N-концевом участке, железо-зависимой алкогольдегидрогеназы на С-концевом участке и пируват-формиатлиазы-дезактивазы. Синонимы включают В 1241, AdhC, Ana. В аэробных условиях период полураспада активного белка AdhE уменьшается за счет катализируемого металлами окисления при аэробном метаболизме.
Фраза «мутантная алкогольдегидрогеназа, устойчивая к аэробной инактивации» означает, что мутантная алкогольдегидрогеназа сохраняет свою активность в аэробных условиях или что ее активность в аэробных условиях снижается незначительно по сравнению со снижением активности алкогольдегидрогеназы природного типа.
Фраза «активность алкогольдегидрогеназы» означает способность фермента катализировать реакцию NAD-зависимого окисления спиртов с образованием альдегидов или кетонов. Алкогольдегидрогеназа (ЕС 1.1.1.1) обладает активностью по отношению к этанолу, н-пропанолу и н-бутанолу. Активность алкогольдегидрогеназы может быть обнаружена и измерена, например, методом, описанным Membrillo-Hemandez, J. и соавт.(J. Biol. Chem. 275, 33869-33875 (2000)).
Алкогольдегидрогеназа кодируется геном adhE, и в качестве гена алкогольдегидрогеназы в настоящем изобретении может быть использован любой ген adhE бактерий, принадлежащих к родам Escherichia, Erwinia, Klebsiella, Salmonella, Shigella, Yershinia, Pantoea, Lactobacillus и Lactococcus. Конкретные примеры источника гена adhE включают такие бактериальные штаммы, как Escherichia coli, Erwinia carotovora, Salmonella enterica. Salmonella typhimurium, Shigella flexneri, Yersinia pseudotuberculosis, Pantoea ananatis, Lactobacillus plantarum и Lactococcus lactis. Ген adhE дикого типа, кодирующий алкогольдегидрогеназу из Escherichia coli, изучен (нуклеотиды, комплементарные нуклеотидам с 1294669 по 1297344 в последовательности с инвентарным номером NC_000913.2, gi: 49175990 в базе данных GenBank). Ген adhE расположен между открытыми рамками считывания ychG и ychE на хромосоме штамма E.coli K-12. Другие гены adhE, кодирующие алкогольдегидрогеназу, были также расшифрованы: ген adhE Erwinia carotovora (нуклеотиды с 2634501 по 2637176 в последовательности с инвентарным номером NC_004547.2; gi: 50121254 в базе данных GenBank); ген adhE Salmonella enterica (нуклеотиды с 1718612 по 1721290 в последовательности с инвентарным номером NC_004631.1; gi: 29142095 в базе данных GenBank); ген adhE из Salmonella typhimurium (нуклеотиды с 1 по 2637 в последовательности с инвентарным номером U68173.1; gi: 1519723 в базе данных GenBank); ген adhE из Shigella flexneri (нуклеотиды, комплементарные нуклеотидам с 1290816 по 129349 в последовательности с инвентарным номером NC_004741.1, gi: 30062760 в базе данных GenBank); ген adhE из Yersinia pseudotuberculosis (нуклеотиды, комплементарные нуклеотидам с 2478099 по 2480774 в последовательности с инвентарным номером NC_006155.1; gi: 51596429 в базе данных enBank); ген adhE из Pantoea ananatis (SEQ ID NO: 29); ген adhE из Lactobaccillus plantarum (UniProtKB Entry: Q88RY9_LACPL); ген adhE из Lactococcus lactis MG1363 (инвентарный номер AJ001007 в EMBL) и т.п. (см. Фиг.2). Нуклеотидная последовательность гена adhE из Escherichia coli представлена в Перечне последовательностей под номером SEQ ID NO. 1. Аминокислотная последовательность, кодируемая этим геном adhE, представлена в Перечне последовательностей под номером SEQ ID NO.2.
Следовательно, ген adhE может быть получен методом ПЦР (полимеразная цепная реакция; White, T.J. et al,. Trends Genet., 5, 185 (1989)) с использованием праймеров, сконструированных на основе известной нуклеотидной последовательности гена хромосомы Е. coli. Гены других организмов, кодирующие алкогольдегидрогеназу, могут быть получены сходным образом.
Ген adhE из Escherichia coli представлен фрагментом ДНК, который кодирует следующий белок (А) или (Б):
(А) белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 2; или
(Б) вариант белка с аминокислотной последовательностью, показанной в SEQ ID NO: 2, который обладает активностью алкогольдегидрогеназы.
Ген adhE из Pantoea ananatis представлен фрагментом ДНК, который кодирует следующий белок (А) или (Б);
(А) белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 30; или
(Б) вариант белка с аминокислотной последовательностью, показанной в SEQ ID NO: 30, который обладает активностью алкогольдегидрогеназы.
Ген adhE из Shigella flexneri представлен фрагментом ДНК, который кодирует следующий белок (А) или (Б):
(А) белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 53; или
(Б) вариант белка с аминокислотной последовательностью, показанной в SEQ ID NO: 53, который обладает активностью алкогольдегидрогеназы.
Ген adhE из Yersinia pestis представлен фрагментом ДНК, который кодирует следующий белок (А) или (Б):
(А) белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 54; или
(Б) вариант белка с аминокислотной последовательностью, показанной в SEQ ID NO: 54, который обладает активностью алкогольдегидрогеназы.
Ген adhE из Erwinia carotovora представлен фрагментом ДНК, который кодирует следующий белок (А) или (Б):
(А) белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 55; или
(Б) вариант белка с аминокислотной последовательностью, показанной в SEQ ID NO: 55, который обладает активностью алкогольдегидрогеназы.
Ген adhE из Salmonella typhimurium представлен фрагментом ДНК, который кодирует следующий белок (А) или (Б):
(А) белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 56; или
(Б) вариант белка с аминокислотной последовательностью, показанной в SEQ ID NO: 56, который обладает активностью алкогольдегидрогеназы.
Ген adhE из Lactobacillus plantarum представлен фрагментом ДНК, который кодирует следующий белок (А) или (Б):
(А) белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 57; или
(Б) вариант белка с аминокислотной последовательностью, показанной в SEQ ID NO: 57, который обладает активностью алкогольдегидрогеназы.
Ген adhE Lactobacillus lactis представлен фрагментом ДНК, который кодирует следующий белок (А) или (Б):
(А) белок, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 58; или
(Б) вариант белка с аминокислотной последовательностью, показанной в SEQ ID NO: 58, который обладает активностью алкогольдегидрогеназы.
Термин «вариант белка» в значении, в котором он используется в настоящем изобретении, означает белок, имеющий изменения в аминокислотной последовательности, а именно делеции, вставки, добавления или замены аминокислот, при условии, что при этом сохраняется необходимый уровень активности алкогольдегидрогеназы. Количество изменений в варианте белка зависит от положения в трехмерной структуре или типа аминокислотного остатка. Количество изменений может быть от 1 до 30, предпочтительно от 1 до 15 и наиболее предпочтительно от 1 до 5 изменений для белка (А). Данные изменения в вариантах белка являются консервативными мутациями, при которых сохраняется функция белка. Другими словами, данные изменения могут иметь место в областях белка, некритичных для его функции. Это становится возможным благодаря тому, что некоторые аминокислоты обладают высокой гомологией друг к другу, и поэтому третичная структура или активность белка не нарушаются при таких заменах. Поэтому вариантом белка (Б) может быть белок, имеющий гомологию не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90% и наиболее предпочтительно не менее 95% по отношению к полной аминокислотной последовательности алкогольдегидрогеназы, представленной в SEQ ID NO. 2, при условии сохранения активности алкогольдегидрогеназы.
Гомология между двумя аминокислотными последовательностями может быть установлена с использованием хорошо известных методов, например компьютерной программы BLAST 2.0, которая определяет три параметра: число аминокислот, идентичность и сходство.
Замена, делеция, вставка или добавление одного или нескольких аминокислотных остатков должны представлять собой консервативную(-ые) мутацию(-и), позволяющую(-ие) сохранить активность фермента. Характерными консервативными мутациями являются консервативные замены. Примеры консервативных замен включают замену Аlа на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или А1а, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Туг, замену Не на Leu, Met, Val или Phe, замену Leu на Не, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Аlа, замену Thr на Ser или Аlа, замену Тrp на Phe или Туr, замену Туr на His, Phe или Trp и замену Val на Met, Ile или Leu.
Результаты сравнения первичных последовательностей алкогольдегидрогеназ из Escherichia соli, Shigella flexneri, Pantoea ananatis, Yersinia pestis, Erwinia carotovora, Salmonella typhimurium (грамотрицательные бактерии) и Lactobacillus plantarum, Lactococcus lactis (грамположительные бактерии) свидетельствуют о высоком уровне гомологии этих белков (см. Фиг.2). С этой точки зрения замены или делеции аминокислотных остатков, которые являются идентичными (отмеченные звездочками), во всех вышеупомянутых белках могут быть значимыми для их функции. Допустимой является замена сходных (отмеченных двоеточием) аминокислотных остатков на сходные аминокислотные остатки без снижения активности белка. Но модификации других неконсервативных аминокислотных остатков могут не приводить к изменению активности алкогольдегидрогеназы.
ДНК, кодирующая по существу тот же белок, что и алкогольдегидрогеназа, описанная выше, может быть получена, например, путем модификации нуклеотидной последовательности ДНК, кодирующей алкогольдегидрогеназу (SEQ ID NO: 1), например, посредством сайт-направленного мутагенеза таким образом, что удаляют, заменяют, вставляют или добавляют нуклеотидные последовательности, кодирующие один или несколько аминокислотных остатков в определенном сайте. Фрагмент ДНК, модифицированной, как описано выше, может быть получен с помощью общеизвестных мутагенных воздействий. Такие воздействия включают обработку препарата ДНК, кодирующей белки настоящего изобретения, гидроксиламином или обработку бактерии, содержащей указанную ДНК, УФ-облучением или реагентами, такими как N-метил-N'-нитро-N-нитрозогуанидин или азотистая кислота.
Белок, по существу такой же, что и алкогольдегидрогеназа, может быть получен путем экспрессии ДНК с описанной выше мутацией в соответствующей клетке и исследования активности продукта экспрессии. ДНК, кодирующая по существу тот же белок, что и алкогольдегидрогеназа, может также быть получена путем выделения ДНК, гибридизующейся в жестких условиях с зондом, имеющим нуклеотидную последовательность, которая содержит, например, нуклеотидную последовательность, показанную в SEQ ID NO: 1, и кодирует белок, обладающий активностью алкогольдегидрогеназы. Упомянутые «жесткие условия» включают такие условия, при которых так называемые специфические гибриды образуются, а неспецифические гибриды не образуются. Например, жесткие условия могут включать условия, при которых ДНК с высокой степенью гомологии, например ДНК с идентичностью не менее 50%, предпочтительно не менее 60%, более предпочтительно не менее 70%, еще более предпочтительно не менее 80%, более предпочтительно не менее 90%, наиболее предпочтительно не менее 95%, могут гибридизоваться друг с другом, а ДНК с идентичностью ниже вышеуказанной не могут гибридизоваться друг с другом. С другой стороны, примером жестких условий могут быть условия, при которых ДНК может гибридизоваться при концентрации соли, соответствующей стандартным условиям отмывки при гибридизации по Саузерну, например 1XSSC, 0.1% SDS, предпочтительно 0.1XSSC, 0.1% SDS, при 60°С. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, такова, как рекомендовано производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны HybondTM N+ (Amersham) при жестких условиях - 15 минут. Предпочтительна двух-трехкратная отмывка.
Часть нуклеотидной последовательности SEQ ID NO: 1 также может быть использована в качестве зонда. Зонды могут быть приготовлены методом ПЦР с использованием праймеров, основанных на нуклеотидной последовательности SEQ ID NO: 1, и фрагмента ДНК, содержащего нуклеотидную последовательность SEQ ID NO: 1, в качестве матрицы. Когда в качестве зонда используется фрагмент ДНК, имеющий длину около 300 п.о., условия отмывки для гибридизации включают, например, 50°С, 2XSSC и 0.1% SDS.
Описанные выше замена, делеция, вставка или добавление нуклеотидов также включают мутации, имеющие место в природе (мутант или вариант), например мутации, которые обусловлены изменчивостью вида или рода бактерии и которые затрагивают алкогольдегидрогеназу.
Алкогольдегидрогеназа дикого типа может подвергаться катализируемому металлами окислению. Хотя такая алкогольдегидрогеназа дикого типа также может использоваться, в настоящем изобретении предпочтительно использование мутантной алкогольдегидрогеназы, устойчивой к аэробной инактивации. Фраза «мутантная алкогольдегидрогеназа, устойчивая к аэробной инактивации» означает, что мутантная алкогольдегидрогеназа сохраняет свою активность в аэробных условиях или ее активность снижается в меньшей степени по сравнению с алкогольдегидрогеназой дикого типа.
В случае экспрессии гена adhE из Е. coli алкогольдегидрогеназа дикого типа включает аминокислотную последовательность, представленную в SEQ ID NO: 2. Пример мутации алкогольдегидрогеназы SEQ ID NO: 2, которая ведет к устойчивости к аэробной инактивации, является замена остатка глутаминовой кислоты в положении 568 остатком лизина. Однако введение мутации в ген adhE, например, в положении 568 в последовательности SEQ ID NO: 2 может приводить к замедлению роста в жидкой среде, содержащей этанол в качестве источника углерода, и в этом случае предпочтительно, чтобы мутантная алкогольдегидрогеназа содержала по крайней мере одну дополнительную мутацию, способную улучшить рост бактерии в жидкой среде, содержащей этанол в качестве единственного источника углерода. Например, рост E.coli улучшается, когда остаток глутаминовой кислоты в положении 568 в алкогольдегидрогеназе с последовательностью SEQ ID NO: 2 замещается другой аминокислотой с введением дополнительной мутации, выбранной из группы, состоящей из:
A) замены остатка глутаминовой кислоты в положении 560 в последовательности SEQ ID NO: 2 остатком другой аминокислоты, например остатком лизина;
Б) замены остатка фенилаланина в положении 566 в последовательности SEQ ID NO: 2 остатком другой аминокислоты, например остатком валина;
B) замены остатка глутаминовой кислоты, остатка метионина, остатка тирозина, остатка изолейцина и остатка аланина в положениях 22, 236, 461, 554 и 786 соответственно в последовательности SEQ ID NO: 2 остатками других аминокислот, например остатком глицина, остатком валина, остатком цистеина, остатком серина и остатком валина соответственно; и
Г) комбинации этих замен.
Ссылка на номера положения в последовательности, например фраза «аминокислотные остатки в положениях 22, 236, 554, 560, 566, 568 и 786» относится к положениям этих остатков в аминокислотной последовательности AdhE дикого типа E.coli. Однако положение аминокислотного остатка может изменяться. Например, если в N-концевой области встраивается аминокислотный остаток, то аминокислотный остаток, изначально находящийся в положении 22, приобретает положение 23. В таком случае аминокислотным остатком в положении 22 согласно настоящему изобретению является аминокислотый остаток, изначально находящийся в положении 22.
Мутантный белок AdhE может включать делецию, замену, вставку или добавление одной или нескольких аминокислот в одном или во множестве положений, отличных от определенных в А) - В), при условии, что активность алкогольдегидрогеназы при этом не теряется или не снижается.
Мутантный белок AdhE и мутантный ген adhE согласно настоящему изобретению могут быть получены из гена adhE природного типа, например, путем сайт-специфического мутагенеза с использованием общеизвестных методов, таких как ПЦР (полимеразная цепная реакция; ссылка на White, T.J. et al.. Trends Genet., 5, 185 (1989)) с использованием праймеров, сконструированных на основе нуклеотидной последовательности гена.
Транскрипция гена adhE в клетках Е. coli дикого типа индуцируется только в анаэробных условиях, главным образом в ответ на повышение уровня восстановленного NADH (Leonardo, M. R., Cunningham, P. R. & Clark, D. P, J. Bacteriol. 175 870-878 (1993)).
В настоящем изобретении бактериальный штамм, используемый для продукции L-аминокислоты, модифицирован таким образом, что экспрессия гена adhE контролируется ненативным промотором, т.е. промотором, который не контролирует экспрессию гена adhE в штамме дикого типа. Такая модификация может быть достигнута заменой нативного промотора гена adhE на хромосоме ненативным промотором, который функционирует в аэробных условиях культивирования таким образом, что ген adhE оказывается функционально связанным с ненативным промотором. В качестве ненативного промотора, функционирующего в аэробных условиях культивирования, может использоваться любой промотор, обеспечивающий экспрессию на определенном уровне вышеописанного гена adhE в аэробных условиях. Что касается уровня белка AdhE в настоящем изобретении, активность алкогольдегидрогеназы в экстракте клеток, измеренная методом, описанным Clark and Cronan (J. Bacteriol. 141 177-183 (1980)), должна быть 1.5 ед или более, предпочтительно 5 ед или более и более предпочтительно 10 ед или более на мг белка. Аэробные условия культивирования могут быть такими, какие обычно используются для культивирования бактерий, в которых кислород поставляется такими методами, как встряхивание, аэрация и перемешивание. Конкретно, может использоваться любой промотор, о котором известно, что он способствует экспрессии гена в аэробных увловиях культивирования. Например, могут использоваться промоторы генов, вовлеченных в гликолиз, пентозофосфатный путь, цикл трикарбоновых кислот, пути биосинтеза аминокислот и т.д. Кроме того, предпочтительно использовать промоторы, о которых известно, что они являются сильными промоторами, функционирующими в аэробных условиях: Рtac промотор, Рlac промотор, Ptrp промотор, Рtrc промотор, PR или PL промоторы фага λ.
Использование ненативного промотора можно сочетать с увеличением числа копий гена. Например, встраивание гена adhE, функционально связанного с ненативным промотором, в вектор, способный функционировать в бактерии семейства Enterobacteriaceae, и введение вектора в бактерию увеличивает число копий гена в клетке. Предпочтительно использование низкокопийных векторов. Примеры низкокопийных векторов включают, но не ограничиваются ими, pSClOl, pMW118, pMW119 и т.п. Термин «низкокопийный вектор» используется для векторов, число копий которого - до 5 на клетку. Увеличение числа копий гена adhE также может быть достигнуто введением множества копий гена в хромосомную ДНК бактерии путем, например, гомологичной рекомбинации, µ-интеграции и т.п. Гомологичная рекомбинация осуществляется с использованием последовательности, которая присутствует на хромосомной ДНК в качестве целевой во множестве копий. Последовательности, имеющие множество копий на хромосомной ДНК, включают, но не ограничиваются ими, повторяющиеся ДНК или инвертированные повторы, присутствующие на концах транспозона. Также, как раскрыто в U.S. Patent No. 5,595,889, можно включить ген adhE в транспозон для переноса и включения множества копий гена в хромосомную ДНК. В этих примерах ген adhE может быть помещен под контроль промотора, функционирующего в аэробных условиях культивирования. Кроме того, действие промотора может быть усилено, например, введением в промотор мутации для увеличения уровня транскрипции гена, локализованного за промотором. Кроме того, известно, что замена нескольких нуклеотидов в области между сайтом связывания рибосомы (ribosome binding site (RBS)) и инициирующим кодоном, особенно в последовательности, локализованной непосредственно перед инициирующим кодоном, значительно влияет на уровень трансляции РНК. Например, было обнаружено 20-кратное увеличение уровня экспрессии в зависимости от природы трех нуклеотидов, предшествующих инициирующему кодону (Gold et al., Annu. Rev. Microbiol., 35, 365-403, 1981; Hui et al., EMBO J., 3, 623-629, 1984). Ранее было показано, что мутация rhtA23 - замена G на А в положении -1 относительно инициирующего кодона ATG (ABSTRACTS of 17th International Congress of Biochemistry and Molecular Biology in conjugation with 1997 Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract No. 457). Следовательно, можно предположить, что мутация rhtA23 увеличивает экспрессию гена rhtA и, как следствие, увеличивает устойчивость к треонину, гомосерину и некоторым другим веществам, транспортируемым из клетки.
Более того, также можно ввести нуклеотидную замену в область промотора гена adhE на бактер