Белки, относящиеся к семейству всl-2, и их фрагменты и их применение у пациентов со злокачественной опухолью
Иллюстрации
Показать всеИзобретение относится к области медицины и касается белков, относящихся к семейству Bcl-2, их фрагментов, а также к их применению для пациентов со злокачественной опухолью. Сущность изобретения заключается в том, что заявленные белки и пептидные фрагменты, в частности, применимы в композициях вакцин для лечения злокачественной опухоли. Изобретение, кроме того, относится к способам лечения с применением указанных композиций. Также аспектом изобретения является получение Т-клеток и рецепторов Т-клеток, специфически узнающих заявленные белки и пептидные фрагменты. Преимущество изобретения заключается в повышении эффективности лечения опухолевых заболеваний. 11 н. и 50 з.п. ф-лы, 2 табл., 12 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в общем относится к области профилактики и терапии злокачественных опухолей. В частности, предлагаются изолированные белки, регулирующие апоптоз, или их пептидные фрагменты, которые способны вызывать иммунные ответы против злокачественной опухоли. В частности, предлагается применение таких белков, относящихся к семейству белков Bcl-2, и их иммуногенных пептидных фрагментов при лечении, диагностике и прогнозировании злокачественных опухолей.
УРОВЕНЬ ТЕХНИКИ
Развитие резистентности злокачественных клеток к широкому множеству химиотерапевтических средств является основным препятствием для успешного лечения злокачественной опухоли. Лекарственная резистентность наблюдается в широком диапазоне типов злокачественных клеток. Многие механизмы вносят вклад в лекарственную резистентность, включая инактивацию лекарственных средств, вытеснение лекарственного средства наносами клеточной мембраны, мутации в мишенях лекарственных средств и неспособность инициировать апоптоз. Предотвращение апоптоза может возникать в результате множества условий, включая удерживание потенциала митохондриальной мембраны и цитокинную стимуляцию.
Поиск белков, ответственных за резистентные к лекарственным средствам фенотипы, показал участие противоапоптозной молекулы Bcl-2. Сверхэкспрессия Bcl-2 играет роль в развитии лекарственной резистентности при лейкозе и других подверженных апоптозу опухолях и, следовательно, в плохом прогнозе при различных злокачественных опухолях человека. Bcl-2 относится к семейству белков, семейству Bcl-2, представители которого регулируют апоптоз. В семейство входят как проапоптозные, так и противоапоптозные представители. Хотя точное понимание того, каким образом Bcl-2 оказывает свое противоапоптозное влияние, остается труднодостижимым, обнаружено, что он экспрессируется во многих злокачественных опухолях, включая рак легкого, ободочной и прямой кишки, простаты и молочной железы, а также лейкозы и лимфомы.
Таким образом, Bcl-2 является решающим клеточным фактором, так как повышенные уровни экспрессии данного белка придают резистентность к апоптозным стимулам, тем самым внося вклад в патогенез и прогрессирование злокачественной опухоли.
Способ, благодаря которому иммунная система млекопитающих узнает и взаимодействует с чужеродными или посторонними веществами, является сложным. Важным аспектом системы является T-клеточный ответ. Указанный ответ требует, чтобы T-клетки узнавали и взаимодействовали с комплексами молекул клеточной поверхности, называемых лейкоцитарными антигенами человека (HLA), составляющими главный комплекс гистосовместимости человека (MHC), и пептидов. Пептиды происходят из более крупных молекул, которые процессируются клетками, которые, в свою очередь, представляют молекулу HLA/MHC. Взаимодействие T-клеток и комплексов HLA/пептид ограничено, при этом требуется T-клетка, которая специфична по отношению к конкретной комбинации молекулы HLA и пептида. Если специфичная T-клетка не присутствует, то T-клеточный ответ отсутствует, даже если имеется комплекс партнеров. Подобным образом, ответа нет, если отсутствует конкретный комплекс, а T-клетка присутствует.
Механизм, посредством которого T-клетки узнают клеточные аномалии, также вовлечен в развитие злокачественной опухоли. Например, в W092/20356 описано семейство генов, которые процессируются в пептиды, которые, в свою очередь, экспрессируются на клеточных поверхностях и могут приводить к лизису опухолевых клеток специфическими CTL. Указанные гены названы семейством MAGE и кодируют так называемые «предшественники антигенов отторжения опухоли», или молекулы «TRAP», и полученные из них пептиды называют «антигенами отторжения опухоли», или «TRA».
В WO 94/05304 описаны нонапептиды, которые связываются с молекулой HLA-A1. В указанной работе обнаружено, что учитывая известную специфичность конкретных пептидов по отношению к конкретным молекулам HLA, следует предполагать, что конкретный пептид связывает одну молекулу HLA, но не связывает другие. Это имеет важное значение, так как разные люди имеют разные HLA-фенотипы. В результате, несмотря на то, что идентификация конкретного пептида как партнера для конкретной молекулы HLA имеет диагностическое и терапевтическое направления, они уместны только для людей с данным конкретным фенотипом HLA.
Таким образом, хорошо установлено, что пептидные эпитопы, происходящие из ассоциированных с опухолями антигенов (TAA), могут узнаваться в качестве антигенов цитотоксическими T-лимфоцитами (CTL) в контексте молекул MHC. Однако хотя общепринято, что большинство, если не все опухоли являются антигенными, только немногие действительно являются иммуногенными в том смысле, что прогрессирование опухоли легко контролируется иммунной системой.
Чтобы преодолеть указанное ограничение, начато несколько иммунотерапевтических исследований, например вакцинации полученными из TAA пептидами. В случае миеломы, опухоли, для которой охарактеризовано наибольшее количество определяемых CTL TAA, сильные CTL-ответы против антигенов были индуцированы вакцинацией, и у некоторых пациентов имела место полная ремиссия заболевания. Однако большинство пептидных эпитопов, используемых в указанных испытаниях вакцинации, являются специфичными для меланоцитов, и указанные пептиды не могут быть применены в случае опухолей немеланоцитного происхождения. Кроме того, экспрессия указанных TAA гетерогенна в разных опухолях от разных пациентов и может варьироваться даже среди метастазов, полученных от одного пациента. Однако в последнюю пару лет идентифицирован ряд специфичных для опухолей пептидных антигенов, которые экспрессируются в нескольких разных злокачественных опухолях, т.е. HER-2, Muc-1 и теломераза.
Апоптоз представляет собой генетическую программу самоубийства клеток, и было выдвинуто предположение, что ингибирование апоптоза является важным механизмом, вовлеченным в образование злокачественной опухоли посредством удлинения продолжительности жизни клеток, способствующего накоплению трансформирующих мутаций. Сурвивин является недавно идентифицированным представителем семейства ингибиторов апоптозных белков (IAP). При общем анализе экспрессии генов, охватывающем примерно 4 миллиона транскриптов, сурвивин идентифицирован как один из основных генов, неизменно подвергаемых повышающей регуляции во многих типах злокачественной опухоли, но не в нормальной ткани. Солидные злокачественные образования, сверхэкспрессирующие сурвивин, включают рак легкого, ободочной кишки, молочной железы, поджелудочной железы и простаты, а также гематопоэтические злокачественные образования. Кроме того, сообщалось, что ряд меланомных и немеланомных злокачественных опухолей кожи неизменно являются сурвивин-положительными. Сверхэкспрессия сурвивина в большинстве злокачественных опухолей человека свидетельствует о главной роли ингибирования апоптоза в прогрессировании опухоли, эта точка зрения подтверждается наблюдением, что в случае рака прямой и ободочной кишки и рака мочевого пузыря, а также нейробластомы экспрессия сурвивина связана с неблагоприятным прогнозом. В отличие от этого сурвивин не выявляется в нормальных тканях взрослого организма. Указанные характеристики квалифицируют сурвивин как подходящий TAA как в диагностических, так и терапевтических целях.
Таким образом в последнее десятилетие идентифицировано большое количество TAA, которые узнаются CTL ограниченным по главному комплексу гистосовместимости (MHC) образом. Так как сурвивин сверхэкспрессируется в большинстве злокачественных опухолей человека и ингибирование его функции приводит к повышенному апоптозу, указанный белок может служить в качестве мишени для терапевтических CTL-ответов.
Белок сурвивин и его возможное диагностическое и терапевтическое применение описаны в (1) и патенте США 6245523, которые включены в данное описание в виде ссылки. Сурвивин представляет собой цитоплазматический белок с молекулярной массой 16,5 кД, содержащий один BIR и высокозаряженную двуспиральную область на карбоксильном конце вместо пальца RING, который ингибирует апоптоз, индуцированный отменой фактора роста (IL-3), при перенесении в предшественники B-клеток. Ген, кодирующий сурвивин, почти идентичен последовательности протеазного рецептора-1 эффекторных клеток (EPR-1), но ориентирован в противоположном направлении, таким образом свидетельствуя о существовании двух отдельных генов, дуплицированных в конфигурации «голова к голове». Соответственно, сурвивин может быть описан как антисмысловой продукт EPR-1. Функционально ингибирование экспрессии сурвивина повышающей регуляцией его природного антисмыслового транскрипта EPR-1 приводит к массивному апоптозу и снижению клеточного роста.
В US 6245523 описано выделение очищенного сурвивина и предлагаются молекулы нуклеиновой кислоты, которые кодируют белок сурвивин, и антитела и другие молекулы, которые связываются с сурвивином. В US 6245523 также описаны активные против апоптоза фрагменты белка сурвивина и его варианты, в которых аминокислотный остаток был встроен с N- или C-конца или внутри описанной последовательности сурвивина. В частности, заявлено, что такие пептиды должны содержать ключевые функциональные остатки, необходимые для апоптоза, например Trp в положении 67, Pro в положении 73 и Cys в положении 84.
В последнее десятилетие многочисленные клинические испытания показали возможность специфичной вакцинации пептидами для индукции противоопухолевых T-клеточных ответов у пациентов со злокачественной опухолью. Однако протекание болезни у пациентов в большинстве случаев не улучшалось. Указанное несоответствие во многих случаях объяснялось механизмами ускользания опухолевых клеток от иммунного надзора. В случае терапевтической методики целенаправленного воздействия на антигены, которые играют незначительную роль в злокачественном росте, селекция дефицитных по антигену злокачественных клеток является общеизвестным ограничением.
Однако в случае пациентов с раком молочной железы наблюдали парадоксальную роль белка Bcl-2. В первичных опухолях молочной железы негативность по Bcl-2 была связана с плохим клиническим исходом. Кроме того, сообщалось, что сверхэкспрессия белка Bcl-2 коррелирует с опухолями, позитивными по рецептору эстрогена, и опосредована элементами ответа на рецептор эстрогена в промоторной области гена Bcl-2. Прогноз эстроген-позитивных опухолей является более благоприятным, чем прогноз негативных по рецептору эстрогена опухолей. Предлагалось несколько возможных объяснений указанных видимо парадоксальных результатов, например ингибирующее влияние Bcl-2 на пролиферацию клеток, регуляция экспрессии Bcl-2 эстрогеном и/или присутствие антагонистов Bcl-2, которые ингибируют его цитопротекторную функцию.
Однако указанные выше исследования также показали, что сверхэкспрессия Bcl-2 в злокачественной опухоли молочной железы коррелирует с лекарственной резистентностью и что понижающая регуляция Bcl-2 антисмысловыми олигонуклеотидами модулирует лекарственную чувствительность в связи с апоптозом. Кроме того, трансфекция гена Bcl-2 в линии раковых клеток молочной железы неизменно приводила к повышенной резистентности к апоптозу. Кроме того, описано, что присутствие другого ингибитора апоптоза, белка сурвивина в карциноме молочной железы, тесно связано с экспрессией Bcl-2 и с пониженным индексом апоптоза (AI) и плохой общей выживаемостью. Сходная связь между сурвивином и Bcl-2 описана при нейробластоме, раке желудка, раке прямой и ободочной кишки, лимфоме Ходжкина с высокой степенью злокачественности. Таким образом, при карциноме молочной железы, как и в случае большинства других злокачественных опухолей человека, ингибирование апоптоза является общим признаком, и экспрессии противоапоптозных генов, например генов сурвивина и/или Bcl-2, может вызывать более выраженные противоапоптозные эффекты, которые отражаются в виде пониженного апоптозного индекса. Недавно показано, что сурвивин является мишенью для спонтанной T-клеточной реактивности у пациентов с различными злокачественными опухолями. Указанные первоначальные находки позже были подтверждены и подкреплены (авторами данного изобретения и другими исследователями).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на открытии того, что пептиды, ограниченные классом I MHC, могут быть получены из другого класса регулирующих апоптоз белков, отличных от сурвивина, т.е. семейства белков Bcl-2, которые способны связываться с HLA-молекулами класса I MHC и при этом вызывать иммунные ответы CTL у пациентов, страдающих злокачественными заболеваниями. Указанные наблюдения показывают, что белки, относящиеся к семейству белков Bcl-2, действуют как молекулы TRAP, которые процессируются клетками in vivo в пептиды, обладающие функцией TRA. Указанные наблюдения открывают путь для новых терапевтических и диагностических способов, которые в общем могут быть применимы в борьбе со злокачественными заболеваниями.
В настоящем изобретении выявлено, что Bcl-2 является подходящей мишенью для иммунотерапии ряда злокачественных заболеваний. Bcl-2 является важным клеточным фактором, и его экспрессия имеет важное значение для жизнеспособности опухолевых клеток. Таким образом, Bcl-2 является привлекательной мишенью для вакцинации, поскольку ускользание от иммунного надзора при понижающей регуляции или утрате экспрессии данного белка нарушило бы устойчивый опухолевый рост. Кроме того, в исследованиях, которые привели к настоящему изобретению, авторы проводили поиск и выявили спонтанную T-клеточную реактивность в PBL против полученных из Bcl-2 пептидов у пациентов с раком молочной железы с использованием анализа ELISPOT.
Соответственно, настоящее изобретение в первом аспекте относится к изолированному белку, относящемуся к семейству белков Bcl-2, или его иммуногенно активному пептидному фрагменту для применения в качестве лекарственного средства для профилактики или лечения злокачественной опухоли. В частности, изобретение относится к изолированным иммуногенно активным пептидным фрагментам, полученным из белка, относящегося к семейству белков Bcl-2, для применения в качестве лекарственного средства для профилактики или лечения злокачественной опухоли.
В следующем аспекте изобретение относится к фармацевтической композиции, содержащей указанный выше белок и/или пептидный фрагмент согласно изобретению.
Также аспект изобретения относится к композиции вакцины, содержащей изолированный белок, относящийся к семейству белков Bcl-2, или его иммуногенно активный пептидный фрагмент или нуклеиновую кислоту, кодирующую указанный белок или указанный пептидный фрагмент, для применения в качестве лекарственного средства для профилактики или лечения злокачественной опухоли.
В следующих аспектах изобретение относится к диагностическому набору для диагностики ex vivo или in situ наличия у пациента со злокачественной опухолью T-клеток в PBL или в опухолевой ткани, которые взаимодействуют с представителем семейства белков Bcl-2, при этом набор содержит пептидный фрагмент согласно изобретению, который определен выше; комплекс пептидного фрагмента согласно изобретению и молекулы HLA класса I или фрагмента такой молекулы.
Целью изобретения также является способ выявления у пациента со злокачественной опухолью наличия T-клеток, взаимодействующих с представителем семейства белков Bcl-2, при этом способ включает в себя осуществление контакта образца опухолевой ткани или образца крови с комплексом согласно изобретению, который определен выше, выявление связывания комплекса с тканью или клетками крови.
Кроме того, предлагается молекула, которая способна специфически связываться с пептидным фрагментом согласно изобретению, и молекула, которая способна блокировать такое связывание.
В другом аспекте изобретение относится к способу лечения злокачественного заболевания, при этом способ включает в себя введение пациенту, страдающему от заболевания, эффективного количества фармацевтической композиции согласно изобретению, молекулы согласно изобретению, которая способна специфически связываться с пептидным фрагментом согласно изобретению, и/или молекулы согласно изобретению, которая способна блокировать такое связывание.
В еще одном аспекте изобретение относится к применению белка или пептидного фрагмента, который определен в данном описании, в производстве лекарственного средства для лечения злокачественного заболевания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Основной целью настоящего изобретения является получение изолированных белков, относящихся к семейству белков Bcl-2, или их иммунологически активных пептидных фрагментов для применения в качестве лекарственного средства для профилактики или лечения злокачественной опухоли.
Семейство белков Bcl-2 включает в себя несколько белков, которые регулируют апоптоз. К данному семейству относятся как проапоптозные, так и противоапоптозные представители. В данном описании представлено исследование потенциальных возможностей данного семейства белков в качестве фармацевтических или диагностически активных веществ при злокачественной опухоли, с конкретной ссылкой на белок Bcl-2. Кроме того, подробно описаны потенциальные возможности Bcl-XL и Mcl-1 в качестве фармацевтически и диагностически активного вещества. Однако весьма вероятно, что иммунные ответы, подобные иммунным ответам, наблюдаемым против белка Bcl-2 или его фрагментов, существуют или могут быть внесены пациентам со злокачественной опухолью против других представителей семейства белков Bcl-2, например других противоапоптозных белков, таких как Mcl-1 или Bcl-XL, которые также связаны с лекарственной резистентностью и сверхэкспрессируются в злокачественной опухоли. Соответственно, изобретение относится к любому представителю семейств белков Bcl-2, предпочтительно любому противоапоптозному представителю, который способен вызывать иммунные ответы у пациентов со злокачественной опухолью, например к белку, выбранному из группы, состоящей из Bcl-2, Bcl-w, Mcl-1, Bfl-1/A1, Bcl-b, Bcl2-L-10 и Bcl-XL, предпочтительно выбранному из группы, состоящей из Bcl-2, Mcl-1, Bcl-w и Bcl-XL, более предпочтительно выбранному из группы, состоящей из Bcl-2, Mcl-1 и Bcl-XL.
Представители противоапоптозного семейства Bcl-2 проявляют свое онкогенное влияние посредством ингибирования апоптоза в клетках, которым в норме суждено погибнуть, тем самым способствуя накоплению клеток in vivo.
Все представители семейства белков Bcl-2 содержат по меньшей мере один из четырех консервативных мотивов, известных как домены гомологии Bcl-2 (BH) (BH1, BH2, BH3 и BH4). Кроме наличия доменов BH предпочтительные противоапоптозные молекулы имеют заякоривающий в мембране домен на карбоксильном конце (TM). Противоапоптозные представители, такие как Bcl-2 и Bcl-XL, содержат все четыре домена BH наряду с трансмембранным доменом. Многодоменные проапоптозные белки, такие как Bax и Bak, содержат все, кроме домена BH4. Вторая подгруппа проапоптозных белков, известных как белки «только с BH3-доменом» (например, Bad и Bid), состоит из молекул, которые содержат только домен BH3 и в которых отсутствуют другие домены BH. В проапоптозных белках, таких как Bcl-XS и Mcl-1S, представляющих собой альтернативно сплайсированные формы генов bcl-x и mcl-1 соответственно, отсутствуют домены BH1 и BH2. Кроме того, в Mcl-1S отсутствует трансмембранный домен. Белки, относящиеся к семейству Bcl-2, описаны, например, в ссылке 6.
Хотя предпочтительно, чтобы белок, относящийся к семейству белков Bcl-2, обладал противоапоптозными свойствами, в настоящем изобретении также подразумевается, что белок, относящийся к семейству Bcl-2, может быть проапоптозным белком, например белком, выбранным из группы, состоящей из Bax, Bok/Mtd, Bad, Bik/Nbk, Bid, Hrk/DP5, Bim, Noxa, Bmf и PUMA/bbc3.
В одном предпочтительном варианте осуществления изобретения белком, относящимся к семейству белков Bcl-2, является Bcl-2, предпочтительно Bcl-2 человека, более предпочтительно Bcl-2, имеющий последовательность с исходным номером доступа P10415 в базе данных SwissProt.
В другом предпочтительном варианте осуществления изобретения белком, относящимся к семейству белков Bcl-2, является Bcl-XL, предпочтительно Bcl-XL человека, более предпочтительно Bcl-XL, имеющий последовательность с исходным номером доступа Q07817 в базе данных SwissProt.
В еще одном предпочтительном варианте осуществления изобретения белком, относящимся к семейству Bcl-2, является Mcl-1, предпочтительно Mcl-1 человека, более предпочтительно Mcl-1, имеющий последовательность с исходным номером доступа Q07820 в базе данных SwissProt.
Так как в ряде злокачественных опухолей человека экспрессируются высокие уровни Bcl-2 и других представителей семейства Bcl-2, иммунотерапевтическая методика, нацеленная на указанные антигены, может иметь широкие клинические применения. Основное беспокойство при таком подходе может вызывать введение аутореактивных иммунных ответов. Таким образом, будущее вакцинации, основанной на представителях данного семейства белков, будет зависеть как от терапевтической эффективности, так и от типа побочных эффектов, которые могут следовать после иммунизации. Когда впервые использовали пептиды, полученные из антигенов дифференцировки меланоцитов, для лечения пациентов с меланомой в стадии IV, предполагали, что это может привести к выраженному разрушению меланоцитов, которое, в свою очередь, проявилось бы клинически, например, в виде витилиго или ретинита. Однако клинический опыт показал, что частота витилиго у пациентов, получавших вакцинации, не была значимо выше, чем частота связанной с меланомой гипопигментации у пациентов, получавших другие формы терапии. Кроме того, не сообщалось о серьезных побочных эффектах в различных испытаниях вакцины против аутоантигенов.
В одном применимом варианте предлагаются новые пептидные фрагменты, ограниченные классом I MHC (также называемые в данном изобретении «пептидами»), которые характеризуются наличием по меньшей мере одного из нескольких признаков, одним из которых является способность связываться с молекулой HLA класса I, по которой он ограничен, с аффинностью, измеряемой по количеству пептида, которое способно к половине от максимального улавливания молекулы HLA класса I (значение C50), которое составляет не более 50 мкМ, как определено с помощью анализа связывания при сборке, который описан в данной публикации. Указанный анализ сборки осуществляют, как описано ранее (2), и анализ основан на стабилизации молекулы HLA после нагрузки пептидом дефицитной по переносчику пептидов линии клеток T2. Затем имеющие правильную укладку стабильные тяжелые цепи HLA подвергают иммунопреципитации, используя конформационно-зависимые антитела, и количественно оценивают связывание пептида.
Анализ обеспечивает простой способ скрининга выбранных для исследования пептидов в отношении их способности связываться с молекулой данного аллеля HLA с указанной выше аффинностью. В предпочтительных вариантах пептидный фрагмент согласно изобретению представляет собой фрагмент, имеющий значение C50, которое не превышает 30 мкМ, например значение C50, которое не превышает 20 мкМ, включая значения C50, не превышающие 10 мкМ, не превышающие 5 мкМ и не превышающие 2 мкМ.
Однако более предпочтительными пептидами согласно настоящему изобретению являются пептиды, способные вызывать специфичный T-клеточный ответ, который определяют анализом ELISPOT, например анализом ELISPOT, описанным в данной публикации ниже в примере 1, раздел 4. Некоторые пептиды, хотя и не связываются с MHC с высокой аффинностью, все же могут вызывать T-клеточный ответ, определяемый в ELISPOT. Другие пептиды, способные к связыванию с MHC с высокой аффинностью, также вызывают T-клеточный ответ, определяемый в ELISPOT. Оба вида пептидов являются предпочтительными пептидами согласно изобретению.
Следовательно, предпочтительными пептидами согласно настоящему изобретению являются пептиды, способные вызывать специфичный T-клеточный ответ, измеряемый в анализе ELISPOT, при этом измеряют более 50 специфичных для пептида пятен на 108 клеток, более предпочтительно на 107, еще более предпочтительно на 106, еще более предпочтительно на 105 клеток, например на 104 клеток.
Как указано выше, система HLA представляет собой главную систему гистосовместимости человека (MHC). В общем, системы MHC контролируют ряд параметров: трансплантационные антигены, тимусзависимые иммунные ответы, некоторые факторы комплемента и предрасположенность к определенным заболеваниям. Более конкретно, MHC кодирует три разных типа молекул, т.е. молекулы класса I, II и III, которые определяют более общие характеристики MHC. Из указанных молекул молекулы класса I представляют собой так называемые молекулы HLA-A, HLA-B и HLA-C, которые представлены на поверхности большинства нуклеированных клеток и тромбоцитов.
Пептиды согласно настоящему изобретению характеризуются своей способностью связываться (являются ограниченными по) конкретной молекуле HLA класса I MHC. Таким образом, в одном варианте пептид представляет собой пептид, который ограничен молекулой HLA-A класса I MHC, включая HLA-A1, HLA-A2, HLA-A3, HLA-A9, HLA-A10, HLA-A11, HLA-Aw19, HLA-A23(9), HLA-A24(9), HLA-A25(10), HLA-A26(10), HLA-A28, HLA-A29(w19), HLA-A30(w19), HLA-A31(w19), HLA-A32(w19), HLA-Aw33(w19), HLA-Aw34(10), HLA-Aw36, HLA-Aw43, HLA-Aw66(10), HLA-Aw68(28), HLA-A69(28). В литературе также используют более простые обозначения, в которых используют только основное числовое обозначение, например HLA-A19 или HLA-A24 вместо HLA-Aw19 и HLA-A24(49) соответственно. В конкретных вариантах пептид согласно изобретению ограничен типом молекулы HLA класса I MHC, выбранным из группы, состоящей из HLA-A1, HLA-A2, HLA-A3, HLA-A11 и HLA-A24.
Пептиды согласно изобретению могут быть получены, например, из известных последовательностей представителя семейства белков Bcl-2 (3). В предпочтительном варианте осуществления изобретения пептид содержит (или, более предпочтительно, состоит из) не более чем 200, предпочтительно не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, и еще более предпочтительно, не более чем 15, например не более чем 10, например, в диапазоне от 9 до 10 следующих друг за другом аминокислот одного из указанных выше представителей семейства белков Bcl-2, предпочтительно из Bcl-2 с исходным номером доступа P10415, Mcl-1 с исходным номером доступа Q07820 или Bcl-XL с исходным номером доступа Q07817 в базе данных SwissProt.
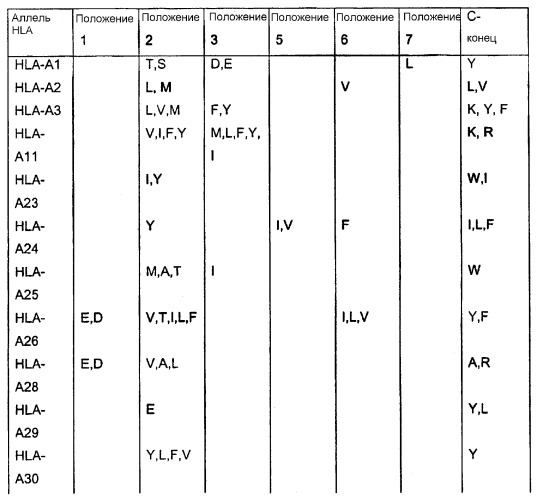
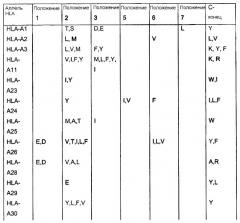
Отбор пептидов, потенциально обладающих способностью связываться с конкретной молекулой HLA, можно осуществить посредством выравнивания известных последовательностей, которые связываются с данной конкретной молекулой HLA, чтобы таким образом выявить преобладание нескольких родственных аминокислот в конкретных положениях пептидов. Такие преобладающие аминокислотные остатки также называют в данном описании «якорные остатки» или «мотивы якорных остатков». Следуя такому относительно простому способу, основанному на известных данных о последовательностях, которые можно найти в доступных базах данных, можно получить пептиды из молекулы семейства белков Bcl-2, которые вероятно связываются с конкретной молекулой HLA. Типичные примеры таких анализов для ряда молекул HLA приведены ниже:
* В одном варианте нет конкретного якорного остатка для данного положения, однако в предпочтительном варианте якорным остатком является R или A.
Таким образом, в качестве примера нонапептиды, потенциально обладающие способностью связываться с HLA-A1, могли бы иметь одну из следующих последовательностей: Xaa-T-D-Xaa-Xaa-Xaa-L-Xaa-Y, Xaa-T-E-Xaa-Xaa-Xaa-L-Xaa-Y; Xaa-S-D-Xaa-Xaa-Xaa-L-Xaa-Y или Xaa-S-E-Xaa-Xaa-Xaa-L-Xaa-Y (Xaa означает любой аминокислотный остаток). Подобным образом могут быть сконструированы последовательности, потенциально обладающие способностью связываться с любой другой молекулой HLA.
Будет понятно, что специалист в данной области сможет идентифицировать дополнительные «мотивы якорных остатков» для данной молекулы HLA.
Таким образом, в применимых вариантах пептиды согласно изобретению включают пептиды, последовательности которых содержат в случае каждого из конкретных аллелей HLA, перечисленных в таблице, любой из аминокислотных остатков, которые указаны в таблице.
Таким образом, пептидами согласно изобретению могут быть любые из указанных выше пептидов, содержащих непрерывные последовательности из представителей семейства белков Bcl-2, в которых в пределах от 1 до 10, предпочтительно в пределах от 1 до 5, более предпочтительно в пределах от 1 до 3, еще более предпочтительно в пределах от 1 до 2, еще более предпочтительно, если 1 аминокислота заменена другой аминокислотой, предпочтительно таким образом, чтобы пептид содержал одну или несколько, предпочтительно все якорные остатки данного конкретного пептида HLA-A, которые указаны в таблице выше.
Неограничивающий пример того, как получить пептиды представителей семейства белков Bcl-2, содержащие якорные остатки данного специфичного для HLA-A пептида, описан в примере 3 в разделе «ответ на модифицированные пептиды». Соответственно в одном варианте осуществления изобретения пептид может представлять собой любой пептид, содержащий не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из RLKRDWLVK (SEQ ID NO: 62), QSDEIISRY (SEQ ID NO: 63) и QSEEIISRY (SEQ ID NO: 64), более предпочтительно, выбранной из группы, состоящей из RLKRDWLVK (SEQ ID NO: 62).
Таким образом, простой способ идентификации пептидов согласно изобретению включает в себя следующие стадии: выбор конкретной молекулы HLA, например молекулы, с высокой частотой встречающейся в данной популяции, осуществление анализа на основе выравнивания, который описан выше для идентификации «мотивов якорных остатков» в белке из семейства белков Bcl-2, выделение или конструирование пептидов подходящего размера, которые содержат один или несколько идентифицированных якорных остатков, и тестирование полученных в результате пептидов в отношении (i) способности связываться с конкретной молекулой HLA с использованием анализа сборки, который описан в данной публикации, (ii) способности пептидов вызывать появление INF-γ-продуцирующих клеток в популяции PBL пациента со злокачественной опухолью с частотой, составляющей по меньшей мере 1 на 104 PBL, определяемой в анализе ELISPOT, описанном в данном публикации, и/или (iii) способности пептидов выявлять in situ в опухолевой ткани CTL, которые реагируют на тестируемые эпитопные пептиды.
В конкретных вариантах пептид согласно изобретению является ограниченным по HLA-A2 пептидом, полученным из Bcl-2, имеющим последовательность, выбранную из следующих последовательностей: ALVGACITL (SEQ ID NО:1), ALSPVPPVV (SEQ ID NO:2), SLALVGACI (SEQ ID NO:3), KTLLSLALV (SEQ ID NO:4), LLSLALVGA (SEQ ID NO:5), WLSLKTLLSL (SEQ ID NO:6), AAAGPALSPV (SEQ ID NO:7), PLFDFSWLSL (SEQ ID NO:8), FTARGRFATV (SEQ ID NO:9), YLNRHLHTWI (SEQ ID NO:10), NIALWMTEYL (SEQ ID NO:11).
В одном предпочтительном варианте пептидом может быть любой пептид, состоящий из не более чем 200, предпочтительно не более чем 100, более предпочтительно не более чем 50, еще более предпочтительно не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из ALVGACITL (SEQ ID NO:1), ALSPVPPW (SEQ ID NO:2), SLALVGACI (SEQ ID NO:3), KTLLSLALV (SEQ ID NO:4), LLSLALVGA (SEQ ID NO:5), WLSLKTLLSL (SEQ ID NO:6), AAAGPALSPV (SEQ ID NO:7), PLFDFSWLSL (SEQ ID NO:8), FTARGRFATV (SEQ ID NO:9), YLNRHLHTWI (SEQ ID NO:10), NIALWMTEYL (SEQ ID NO:11), более предпочтительно, выбранной из группы, состоящей из NIALWMTEYL (SEQ ID NO: 11), YLNRHLHTWI (SEQ ID NO: 10), PLFDFSWLSL (SEQ ID NO: 8) и WLSLKTLLSL (SEQ ID NO: 6), еще более предпочтительно выбранной из группы, состоящей из PLFDFSWLSL (SEQ ID NO: 8) и WLSLKTLLSL (SEQ ID NO: 6).
В другом предпочтительном варианте пептид может представлять собой любой пептид, состоящий из не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из EMQVLVSRI (SEQ ID NO: 44), TAYQSFEQV (SEQ ID NO: 43), YLNDHLEPWI (SEQ ID NO: 42), RIAAWMATYL (SEQ ID NO: 45), WMATYLNDHL (SEQ ID NO: 46), VLVSRIAAWM (SEQ ID NO: 48) и VAFFSFGGAL (SEQ ID NO: 49), более предпочтительно, из группы, состоящей из TAYQSFEQV (SEQ ID NO: 43), YLNDHLEPWI (SEQ ID NO: 42), RIAAWMATYL (SEQ ID NO: 45), WMATYLNDHL (SEQ ID NO: 46), VLVSRIAAWM (SEQ ID NO: 48) и VAFFSFGGAL (SEQ ID NO: 49), еще более предпочтительно, выбранной из группы, состоящей из TAYQSFEQV (SEQ ID NO: 43), VAFFSFGGAL (SEQ ID NO: 49), VLVSRIAAWM (SEQ ID NO: 48) и RIAAWMATYL (SEQ ID NO: 45) или выбранной из группы, состоящей из TAYQSFEQV (SEQ ID NO: 43) и WMATYLNDHL (SEQ ID NO: 46) или выбранной из группы, состоящей из YLNDHLEPWI (SEQ ID NO: 42).
В еще одном предпочтительном варианте пептид может представлять собой любой пептид, состоящий из не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из RIAAWMATY (SEQ ID NO: 50) и ALCVESVDK (SEQ ID NO: 51), более предпочтительно, выбранной из группы, состоящей из RIAAWMATY (SEQ ID NO: 50).
В еще одном предпочтительном варианте пептид может представлять собой любой пептид, состоящий из не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из YLREQATGAK (SEQ ID NO: 52), SITDVLVRTK (SEQ ID NO: 53), LISFGAFVAK (SEQ ID NO: 54), RLLFFAPTR (SEQ ID NO: 55), RTKRDWLVK (SEQ ID NO: 56) и DIKNEDDVK (SEQ ID NO: 57), более предпочтительно, выбранной из группы, состоящей из RLLFFAPTR (SEQ ID NO: 55) и RTKRDWLVK (SEQ ID NO: 56).
В еще одном предпочтительном варианте пептид может представлять собой любой пептид, состоящий из не более чем 200, предпочтительно, не более чем 100, более предпочтительно, не более чем 50, еще более предпочтительно, не более чем 25, еще более предпочтительно, не более чем 20, еще более предпочтительно, не более чем 15, еще более предпочтительно, не более чем 10 аминокислот и содержащий (или, более предпочтительно, состоящий из) последовательности, выбранной из группы, состоящей из PAEEEEDDLY (SEQ ID NO: 58), SPEEELDGY (SEQ ID NO: 59), QSLEIISRY (SEQ ID NO: 60) и AGVGAGLAY (SEQ ID NO: 61), более предпочтительно, выбранной из группы, состоящей из PAEEEEDDLY (SEQ ID NO: 58) и QSLEIISRY (SEQ ID NO: 60).
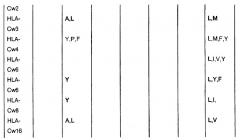
В следующих применимых вариантах пептид согласно изобретению является пептидом, который ограничен по молекуле HLA-B класса I MHC, включая любую из следующих молекул: HLA-B5, HLA-B7, HLA-B8, HLA-B12, HLA-B13, HLA-B14, HLA-B15, HLA-B16, HLA-B17, HLA-B18, HLA-B21, HLA-Bw22, HLA-B27, HLA-B35, HLA-B37, HLA-B38, HLA-B39, HLA-B40, HLA-Bw41, HLA-Bw42, HLA-B44, HLA-B45, HLA-Bw46 и HLA-Bw47. В конкретных вариантах тип HLA-B класса I MHC, с которым пептид согласно изобретению способен связываться, выбран из HLA-B7, HLA-B35, HLA-B44, HLA-B8, HLA-B15, HLA-B27 и HLA-B51.
В следующих применимых вариантах пептид согласно изобретению является пептидом, который ограничен по молекуле HLA-C класса I MHC, включая следующие молекулы: HLA-Cw1, HLA-Cw2, HLA-Cw3, HLA-Cw4, HLA-Cw5, HLA-Cw6, HLA-Cw7 и HLA-Cw1.
Предпочтительно пептидный фрагмент согласно изобретению содержит менее 50 аминокислотных остатков и более предпочтительно он содержит не более чем 20 аминокислотных остатков, например не более чем 10 аминокислотных остатков. В конкретных вариантах пептид является гептапептидом, октопептидом, нонапептидом, декапептидом или ундекапептидом.
Пептид согласно изобретению, как указано выше, получен из представителя семейства белков Bcl-2 или его фрагмен