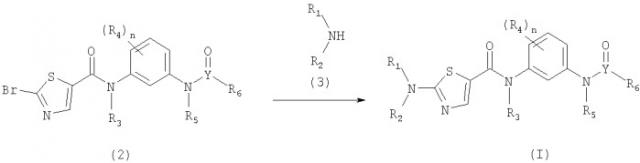
Соединения и композиции в качестве ингибиторов протеинкиназ
Иллюстрации
Показать всеНастоящее изобретение относится к соединениям формулы Ia. Соединения настоящего изобретения обладают свойствами ингибитора протеинкиназы. В формуле Iа
m выбран из 0 и 1, R1 выбирают из группы, включающей водород, метил, изопропил, имидазолилпропил, пиперазинилпропил, пиридинил, диэтиламинопропил, гидроксиэтил, пиримидинил, морфолинопропил, фенил, циклопропил, морфолиноэтил, бензил и морфолино, где любой пиридинил, имидазолил, пиперазинил или пиримидинил в составе R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей метил, метиламино, диметиламинометил, циклопропиламино, гидроксиэтиламино, диэтиламинопропиламино, пирролидинилметил, морфолино, морфолинометил, пиперазинилметил и пиперазинил, причем любой морфолино и пиперазинил в составе R1 необязательно дополнительно замещен радикалом, выбранным из группы, включающей метил, гидроксиэтил и этил, R2, R3 и R5 каждый означает водород, R4 означает метил, L выбирают из группы, включающей -NR5C(O)- и -C(O)NR5-, R10 означает трифторметил, a R11 выбирают из группы, включающей галоген, морфолинометил, пиперазинил, необязательно замещенный группой метил, этил или гидроксиэтил; пиперазинилметил, необязательно замещенный группой метил или этил, имидазолил, необязательно замещенный метилом, пирролидинилметокси и пиперидинил, необязательно замещенный гидроксигруппой. Изобретение также относится к фармацевтической композиции, включающей терапевтически эффективное количество соединения, и к применению соединений настоящего изобретения для получения лекарственного средства. 3 н. и 1 з.п. ф-лы, 1 табл.
Реферат
Перекрестные ссылки на родственные заявки
В данной заявке испрашивается приоритет в связи с временной заявкой на выдачу патента США №60/647606, зарегистрированной 25 января 2005 г. Указанная заявка включена в данное описание в полном объеме в качестве ссылки.
Предпосылки создания изобретения
Область техники
Настоящее изобретение относится к новому классу соединений, фармацевтическим композициям, включающим такие соединения, и способам использования таких соединений для лечения или профилактики заболеваний или нарушений, связанных с аномальной или нерегулируемой активностью киназы, прежде всего заболеваний или нарушений, связанных с аномальной активацией киназ Abl, Bcr-Abl, FGFR3, PDGFRβ, Flt3 и b-Raf.
Предпосылки создания изобретения
Протеинкиназы относятся к многочисленному семейству белков, которые играют главную роль в регуляции множества клеточных явлений и поддерживают функционирование клетки. Такие киназы включают, без ограничения перечисленным, рецепторные тирозинкиназы, такие как рецепторная киназа фактора роста тромбоцитов (PDGF-R) и рецептор фактора роста фибробластов, FGFR3, нерецепторные тирозинкиназы, такие как киназа Abl и гибридная киназа BCR-Abl, и серинтреонинкиназы, такие как киназы b-RAF, SGK, MAP (например, МКК4, МКК6 и т.п.) и SAPK2α и SAPK2β. Аномальная активность киназы наблюдается при многих патологических состояниях, таких как доброкачественные и злокачественные пролиферативные заболевания и заболевания, связанные с аномальной активацией иммунной и нервной системы.
Новые соединения по настоящему изобретению ингибируют активность одной или более протеинкиназ, и, таким образом, ожидается, что такие соединения можно использовать для лечения связанных с киназами заболеваний.
Краткое описание сущности изобретения
Один объект настоящего изобретения относится к соединениям формулы I,
где
n равен 0, 1, 2, 3 и 4,
R1 выбирают из группы, включающей водород, C1-С6алкил, С6-С10арил(С0-С4)алкил, С5-С10гетероарил(С0-С4)алкил, С3-С12циклоалкил(С0-С4)алкил, С3-С8гетероциклоалкил(С0-С4)алкил и -XNR7R8,
причем любой арил, гетероарил, циклоалкил или гетероциклоалкил в составе R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, C1-С6алкил, галогензамещенный C1-С6алкил, C1-С6алкокси, галогензамещенный C1-С6алкокси, C1-С6алкилтио, галогензамещенный C1-С6алкилтио, -XNR7R8, -XNR7XNR7R8, -XNR7R9, С6-С10арилС0-С4алкил, С5-С10гетероарил(С0-С4)алкил, С3-С12циклоалкил(С0-С4)алкил и С3-С8гетероциклоалкил(С0-С4)алкил, причем любой арил, гетероарил, циклоалкил или гетероциклоалкил в составе R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, C1-С6алкил, галогензамещенный C1-С6алкил, гидроксизамещенный C1-С6алкил, C1-С6алкокси и галогензамещенный C1-С6алкокси, причем любой алкил в составе R1 необязательно включает метилен, замененный на атом О, где
Х каждый независимо выбирают из группы, включающей химическую связь и C1-С6алкилен, R7 и R8 независимо выбирают из группы, включающей водород и C1-С6алкил, причем любой R7 и R8 необязательно включает метилен, замененный на атом О, a R9 выбирают из группы, включающей С6-С10арил(С0-С4)алкил, С5-С10гетероарил(С0-С4)алкил, С3-С12циклоалкил(С0-С4)алкил и С3-С8гетероциклоалкил(С0-С4)алкил,
R2 выбирают из группы, включающей водород и C1-С6алкил,
R3 выбирают из группы, включающей водород и C1-С6алкил,
R4 выбирают из группы, включающей галоген, C1-С6алкил, галогензамещенный C1-С6алкил, C1-С6алкокси, галогензамещенный C1-С6алкокси, C1-С6алкилтио и галогензамещенный C1-С6алкилтио,
R15 выбирают из группы, включающей -NR5Y(O)R6 и -Y(O)NR5R6, где
Y выбирают из группы, включающей С, S, S(O), Р и Р(O),
R5 выбирают из группы, включающей водород и C1-С6алкил, а
R6 выбирают из группы, включающей С6-С10арил, С5-С10гетероарил, С3-С12циклоалкил и С3-С8гетероциклоалкил, причем указанный арил, гетероарил, циклоалкил или гетероциклоалкил в составе R6 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей галоген, C1-С6алкил, галогензамещенный C1-С6алкил, C1-С6алкокси, галогензамещенный C1-С6алкокси, C1-С6алкилтио, галогензамещенный С1-С6алкилтио, С6-С10арил(С0-С4)алкил, С5-С10гетероарил(С0-С4)алкил, С3-С12циклоалкил(С0-С4)алкил, С3-С8гетероциклоалкил(С0-С4)алкокси и С3-С8гетероциклоалкил(С0-С4)алкил, или арил, гетероарил, циклоалкил или гетероциклоалкил в составе R6 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей гидрокси, галоген, C1-С6алкил, галогензамещенный C1-С6алкил, гидроксизамещенный С1-С6алкил, C1-С6алкокси и галогензамещенный C1-С6алкокси, к N-оксидам, пролекарствам, защищенным производным, индивидуальным изомерам, смесям изомеров, фармацевтически приемлемым солям и сольватам (например, гидратам) указанных соединений.
Второй объект настоящего изобретения относится к фармацевтической композиции, которая включает соединение формулы I или N-оксид, их индивидуальные изомеры, смеси изомеров или фармацевтически приемлемые соли указанных соединений в смеси с одним или более пригодных экципиентов.
Третий объект настоящего изобретения относится к способу лечения заболевания млекопитающего, которое чувствительно к ингибированию активности киназы, прежде всего, к ингибированию активности киназы Abl, Bcr-Abl, FGFR3, PDGFRβ, Flt3 и b-Raf, что, в свою очередь, приводит к профилактике, подавлению или снижению интенсивности патологии и/или симптомов заболеваний, причем указанный способ включает введение млекопитающему терапевтически эффективного количества соединения формулы I или его N-оксида производного, индивидуальных изомеров, смеси изомеров или фармацевтически приемлемых солей указанных соединений.
Четвертый объект настоящего изобретения относится к применению соединения формулы I для получения лекарственного средства, предназначенного для лечения заболевания животного, которое связано с активностью киназы, прежде всего, с активностью киназы Abl, Bcr-Abl, FGFR3, PDGFRβ, Flt3 и b-Raf, причем активность указанных киназ вызывает развитие патологии и/или симптомов заболевания.
Пятый объект настоящего изобретения относится к способу получения соединений формулы I и их N-оксидов, пролекарств, защищенных производных, индивидуальных изомеров, смеси изомеров и фармацевтически приемлемых солей указанных соединений.
Описание предпочтительных вариантов осуществления изобретения
Определения
Термин «алкил» означает группу или структурный элемент в составе других групп, такой как, например, галогензамещенный алкил и алкокси, с прямой или разветвленной цепью. С1-С4алкокси включает метокси, этокси и т.п. Галогензамещенный алкил включает трифторметил, пентафторэтил и т.п.
Термин «арил» означает моноциклическое или конденсированное ароматическое бициклическое кольцо, содержащее от 6 до 10 атомов углерода в цикле. Например, арил включает фенил или нафтил, предпочтительно фенил. Термин «арилен» означает двухвалентный радикал арильной группы.
Термин «гетероарил» означает арил, определенный выше, который содержит один или более гетероатомов в цикле. Например, гетероарил включает пиридил, индолил, индазолил, хиноксалинил, хинолинил, бензофуранил, бензопиранил, бензотиопиранил, бензо[1,3]диоксол, имидазолил, бензимидазолил, пиримидинил, фуранил, оксазолил, изоксазолил, триазолил, тетразолил, пиразолил, тиенил и т.п.
Термин «циклоалкил» означает насыщенную или частично ненасыщенную, моноциклическую, конденсированную бициклическую или мостиковую полициклическую систему, содержащую указанное число атомов в цикле. Например, С3-С10циклоалкил включает циклопропил, циклобутил, циклопентил, циклогексил и т.п.
Термин «гетероциклоалкил» означает циклоалкил, определенный выше, в котором один или более атомов углерода в цикле заменены на остаток, выбранный из группы, включающей -О-, -N=, -NR-, -C(O)-, -S-, -S(O)- или -S(O)2-, где R означает водород,
С1-С4алкил или азотзащитную группу. Например, С3-С8гетероциклоалкил, используемый в данном контексте для описания соединения по настоящему изобретению, включает морфолино, пирролидинил, пирролидинил-2-он, пиперазинил, пиперидинил, пиперидинилон, 1,4-диокса-8-азаспиро[4.5]дец-8-ил и т.п.
Термин «галоген» предпочтительно означает хлор или фтор, а также бром или иод.
Термин «панель киназ» означает группу киназ, включающую киназы Abl (человека), Abl(T315I), JAK2, JAK3, ALK, JNK1α1, ALK4, KDR, Aurora-A, Lck, Blk, MAPK1, Bmx, MAPKAP-K2, BR, MEK1, CaMKII (крысы), Met, CDKl/циклинВ, p70S6K, CHK2, PAK2, CK1, PDGFRα, CK2, PDK1, c-kit, Pim-2, c-RAF, PKA(h), CSK, PKBα, cSrc, PKCα, DYRK2, Plk3, EGFR, ROCK-I, Fes, Ron, FGFR3, Ros, Flt3, SAPK2α, Fms, SGK, Fyn, SIK, GSK3β, Syk, IGF-1R, Tie-2, IKKβ, TrKB, IR, WNK3, IRAK4, ZAP-70, ITK, AMPK (крысы), LIMK1, Rsk2, Axl, LKB1, SAPK2β, BrSK2, Lyn (h), SAPK3, ВТК, МАРКАР-К3, SAPK4, CaMKIV, MARK1, Snk, CDК2/циклинА, MINK, SRPK1, CDК3/циклинЕ, MKK4(m), TAK1, CDK5/p25, MKK6(h), TBK1, CDK6/циклинD3, MLCK, TrkA, CDК7/циклинН/МАТ1, MRCKβ, TSSK1, CHK1, MSK1, Yes, CKld, MST2, ZIPK, c-Kit (D816V), MuSK, DAPK2, NEK2, DDR2, NEK6, DMPK, PAK4, DRAK1, PAR-1Bα, EphAl, PDGFRβ, EphA2, Pim-1, EphA5, PKBβ, EphB2, PKCβI, EphB4, PKCδ, FGFR1, PKCη, FGFR2, РКСθ, FGFR4, PKD2, Fgr, PKG1β, Flt1, PRK2, Hck, PYK2, HIPK2, Ret, IKKα, RIPK2, IRR, ROCK-II (человека), JNK2α2, Rse, JNK3, Rsk1(h), PI3-Kγ, PI3-Кδ и Р13-Кβ. Действие соединения по настоящему изобретению оценивают в отношении панели киназ (дикого типа и/или мутантных форм), и установлено, что они ингибируют активность по крайней мере одной киназы из указанной панели киназ.
Термин «мутантные формы киназы BCR-Abl» означает формы киназы, содержащие одну или несколько замен аминокислот по сравнению с киназой дикого типа. Мутации в последовательности киназы BCR-Abl приводят к изменению участков контактирования белка и ингибитора (например, гливек и т.п.), в большинстве случаев при этом происходит превращение из инактивированного в активное состояние, т.е. образуется конформация белка, с которой не связывается гливек. При клинических испытаниях было установлено, что набор мутаций, выявленных в связи с устойчивым фенотипом, медленно возрастает, но непрерывно в течение времени. Мутации происходят в четырех основных участках. Одна группа мутаций (G250E, Q252R, Y253F/H, E255K/V) включает аминокислоты, которые образуют фосфатсвязывающую петлю для АТФ (также известную под названием Р-петля). Вторая группа мутаций (V289A, F311L, T315I, F317L) была обнаружена в участке, связывающимся с гливеком и напрямую взаимодействующим с ингибитором за счет образования водородных связей или ван-дер-ваальсовских взаимодействий. Третья группа мутаций (М351Т, E355G) находится в непосредственной близости к каталитическому домену. Четвертая группа мутаций (H396R/P) располагается в петле активации, конформация которой является «молекулярным переключателем», отвечает за активацию/инактивацию киназы. Точечные мутации киназы BCR-ABL связаны с устойчивостью к гливеку, обнаруженной у пациентов CML и ALL, и включают мутации M224V, L248V, G250E, G250R, Q252R, Q252H, Y253H, Y253F, Е255К, E255V, D276G, Т277А, V289A, F311L, T315I, T315N, F317L, М343Т, М315Т, E355G, F359V, F359A, V379I, F382L, L387M, L387F, Н396Р, H396R, А397Р, S417Y, Е459К и F486S (положения аминокислот обозначены однобуквенным кодом, согласно информации в базе данных номер ААВ60394, и соответствуют киназе ABL тип 1а, см. статью Martinelli и др., Haematologica/The Hematology Journal, April, 90-4 (2005)). Если в контексте не указано иное, то Всr-Abl означает киназу дикого типа и ее мутантные формы.
Термин «лечить» и «лечение» означает способ снижения интенсивности заболевания и/или сопровождающих его симптомов.
Описание предпочтительных вариантов осуществления настоящего изобретения
Настоящее изобретение относится к соединениям, композициям и способам лечения заболевания, связанного с киназами, прежде всего, такими как киназы Abl, Bcr-Abl, FGFR3, PDGFRβ, Flt3 и b-Raf. Например, лейкоз и другие пролиферативные заболевания, связанные с киназой BCR-Abl, можно лечить за счет ингибирования киназы BCR-Abl дикого типа и ее мутантных форм.
В одном варианте осуществления настоящего изобретения предлагаются соединения формулы I, характеризующиеся формулой Ia
где
m равно 0 и 1,
R1 выбирают из группы, включающей водород, C1-С6алкил, С6-С10арил(С0-С4)алкил, C5-C10гетероарил(С0-С4)алкил, С3-С12циклоалкил(С0-С4)алкил, С3-С8гетероциклоалкил(С0-С4)алкил и -XNR7R8,
где любой арил, гетероарил, циклоалкил или гетероциклоалкил в составе R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей С1-С6алкил, -XNR7R8, -XNR7XNR7R8, -XNR7R9, С5-С10гетероарил(С0-С4)алкил и С3-С8гетероциклоалкил(С0-С4)алкил, где любой гетероарил или гетероциклоалкил в составе R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей C1-С6алкил и гидроксизамещенный C1-С6алкил, где любой алкил в составе R1 необязательно включает метилен, замененный на атом О, а каждый Х независимо выбирают из группы, включающей химическую связь и C1-С6алкилен, R7 и R8 независимо выбирают из группы, включающей водород и C1-С6алкил, причем любой метилен в составе R7 и
R8 необязательно заменен на атом О, и R9 означает С3-С12циклоалкил(С0-С4)алкил,
R2 выбирают из группы, включающей водород и С1-С6алкил,
R3 выбирают из группы, включающей водород и С1-С6алкил,
R4 выбирают из группы, включающей галоген, С1-С6алкил, галогензамещенный C1-С6алкил, C1-С6алкокси и галогензамещенный C1-С6алкокси,
L выбирают из группы, включающей -NR5C(O)- и -C(O)NR5-,
R5 выбирают из группы, включающей водород и C1-С6алкил,
R10 означает галогензамещенный C1-С6алкил и
R11 выбирают из группы, включающей водород, галоген, С5-С10гетероарил и С3-С8гетероциклоалкил, где гетероарил или гетероциклоалкил в составе R10 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей гидрокси и C1-С6алкил.
В другом варианте осуществления настоящего изобретения R1 выбирают из группы, включающей водород, метил, изопропил, имидазолилпропил, пиперазинилпропил, пиридинил, диэтиламинопропил, гидроксиэтил, пиримидинил, морфолинопропил, фенил, циклопропил, морфолиноэтил, бензил и морфолино, где любой пиридинил, имидазолил, пиперазинил или пиримидинил в составе R1 необязательно замещен 1-3 радикалами, независимо выбранными из группы, включающей метил, метиламино, диметиламинометил, циклопропиламино, гидроксиэтиламино, диэтиламинопропиламино, пирролидинилметил, морфолино, морфолинометил, пиперазинилметил и пиперазинил, где любой морфолино и пиперазинил в составе R1 необязательно замещен радикалом, выбранным из группы, включающей метил, гидроксиэтил и этил, a R2, R3 и R5 каждый означает водород и R4 означает метил.
В еще одном варианте осуществления настоящего изобретения m равно 0 и 1, R10 означает трифторметил и R11 выбирают из группы, включающей галоген, морфолинометил, пиперазинил, необязательно замещенный группой метил, этил или гидроксиэтил; означает пиперазинилметил, необязательно замещенный группой метил или этил, означает имидазолил, необязательно замещенный метилом, пирролидинилметокси и пиперидинил, необязательно замещенный гидроксигруппой.
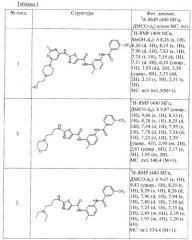
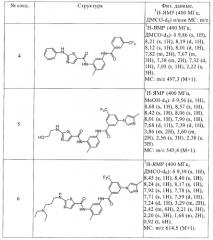
Предпочтительные соединения по настоящему изобретению выбирают из группы, включающей [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-(3-диэтиламинопропиламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-{6-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-метилпиримидин-4-иламино}тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-(2-гидроксиэтиламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-{6-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-метилпиримидин-4-иламино}тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-(3-морфолин-4-илпропиламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-(3-диэтиламинопропиламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-фениламинотиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-(2-гидроксиэтиламино)тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-(3-диэтиламинопропиламино)тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-(3-морфолин-4-илпропиламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-[6-(4-этилпиперазин-1-ил)-2-метилпиримидин-4-иламино]тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-(6-циклопропиламино-2-метилпиримидин-4-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-[6-(2-гидроксиэтиламино)-2-метилпиримидин-4-иламино]тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-[6-(3-диэтиламинопропиламино)-2-метилпиримидин-4-иламино]тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-(2-метил-6-морфолин-4-илпиримидин-4-иламино)тиазол-5-карбоновой кислоты, {5-[3-(4-гидроксипиперидин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-(2-гидроксиэтиламино)тиазол-5-карбоновой кислоты, {5-[3-(4-гидроксипиперидин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {5-[3-(4-гидроксипиперидин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-(2-морфолин-4-илэтиламино)тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-(2-гидроксиэтиламино)тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-бензиламинотиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-(2-морфолин-4-илэтиламино)тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-[6-(2-гидроксиэтиламино)-2-метилпиримидин-4-иламино]тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-(6-циклопропиламино-2-метилпиримидин-4-иламино)тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-(2-метил-6-морфолин-4-илпиримидин-4-иламино)тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-[6-(4-этилпиперазин-1-ил)-2-метилпиримидин-4-иламино]тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-[6-(3-диэтиламинопропиламино)-2-метилпиримидин-4-иламино]тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-(2-метил-6-метиламинопиримидин-4-иламино)тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-[6-(2-гидроксиэтиламино)-2-метилпиримидин-4-иламино]тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-(6-циклопропиламино-2-метилпиримидин-4-иламино)тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-(2-метил-6-морфолин-4-илпиримидин-4-иламино)тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-[6-(4-этилпиперазин-1-ил)-2-метилпиримидин-4-иламино]тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-[6-(3-диэтиламинопропиламино)-2-метилпиримидин-4-иламино]тиазол-5-карбоновой кислоты, {5-[4-(4-этилпиперазин-1-илметил)-3-трифторметилфенилкарбамоил]-2-метилфенил}амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {5-[4-(4-этилпиперазин-1-илметил)-3-трифторметилфенилкарбамоил]-2-метилфенил}амид 2-метиламинотиазол-5-карбоновой кислоты, {5-[4-(4-этилпиперазин-1-илметил)-3-трифторметилфенилкарбамоил]-2-метилфенил}амид 2-аминотиазол-5-карбоновой кислоты, {5-[4-(4-этилпиперазин-1-илметил)-3-трифторметилфенилкарбамоил]-2-метилфенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(4-морфолин-4-илметил-3-трифторметилфенилкарбамоил)фенил]амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(4-пиперазин-1-илметил-3-трифторметилфенилкарбамоил)фенил]амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, {2-метил-5-[4-(4-метилпиперазин-1-илметил)-3-трифторметилфенилкарбамоил]фенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилфенилкарбамоил]фенил}амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {2-метил-5-[4-(4-метилпиперазин-1-илметил)-3-трифторметилфенилкарбамоил]фенил}амид 2-метиламинотиазол-5-карбоновой кислоты, [2-метил-5-(4-пиперазин-1-илметил-3-трифторметилфенилкарбамоил)фенил]амид 2-циклопропиламинотиазол-5-карбоновой кислоты, [2-метил-5-(4-пиперазин-1-илметил-3-трифторметилфенилкарбамоил)фенил]амид 2-метиламинотиазол-5-карбоновой кислоты, [2-метил-5-(4-морфолин-4-илметил-3-трифторметилфенилкарбамоил)фенил]амид 2-циклопропиламинотиазол-5-карбоновой кислоты, [2-метил-5-(4-морфолин-4-илметил-3-трифторметилфенилкарбамоил)фенил]амид 2-метиламинотиазол-5-карбоновой кислоты, (5-{[1-трет-бутил-5-(4-метилпиперазин-1-илметил)-1Н-пиразол-3-карбонил]амино}-2-метилфенил)амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилпиперазин-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилфенилкарбамоил]фенил}амид 2-метиламинотиазол-5-карбоновой кислоты, {2-метил-5-[4-(4-метилпиперазин-1-илметил)-3-трифторметилфенилкарбамоил]фенил}амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {5-[4-(4-этилпиперазин-1-илметил)-3-трифторметилбензоиламино]-2-метилфенил}амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-циклопропиламинотиазол-5-карбоновой кислоты, (5-{3-[4-(2-гидроксиэтил)пиперазин-1-ил]-5-трифторметилбензоиламино}-2-метилфенил)амид 2-циклопропиламинотиазол-5-карбоновой кислоты, {5-[(5-трет-бутилтиофен-2-карбонил)амино]-2-метилфенил}амид 2-(2-морфолин-4-илэтиламино)тиазол-5-карбоновой кислоты, {5-[(5-трет-бутилтиофен-2-карбонил)амино]-2-метилфенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, {5-[(5-трет-бутил-2-метил-2Н-пиразол-3-карбонил)амино]-2-метилфенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-{5-[4-(2-гидроксиэтил)пиперазин-1-ил]пиридин-2-иламино}тиазол-5-карбоновой кислоты, (5-{3-[4-(2-гидроксиэтил)пиперазин-1-ил]-5-трифторметилбензоиламино}-2-метилфенил)амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, {5-[3-(4-этилпиперазин-1-ил)-5-трифторметилбензоиламино]-2-метилфенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилфенилкарбамоил)фенил]амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилфенилкарбамоил)фенил]амид 2-(пиридин-3-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилфенилкарбамоил)фенил]амид 2-циклопропиламинотиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилфенилкарбамоил)фенил]амид 2-(3-имидазол-1-илпропиламино)тиазол-5-карбоновой кислоты, {5-[(5-трет-бутил-2-метил-2Н-пиразол-3-карбонил)амино]-2-метилфенил}амид 2-(2-морфолин-4-илэтиламино)тиазол-5-карбоновой кислоты, [5-(4-хлор-3-трифторметилбензоиламино)-2-метилфенил]амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, {5-[(1-трет-бутил-5-метил-1Н-пиразол-3-карбонил)амино]-2-метилфенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, {2-метил-5-[3-(пирролидин-2-илметокси)-5-трифторметилбензоиламино]фенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилпиперазин-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, {2-метил-5-[3-(4-метилимидазол-1-ил)-5-трифторметилбензоиламино]фенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилфенилкарбамоил)фенил]амид 2-(6-метилпиридин-3-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилфенилкарбамоил)фенил]амид 2-(2-морфолин-4-илэтиламино)тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилфенилкарбамоил)фенил]амид 2-изопропиламинотиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилфенилкарбамоил)фенил]амид 2-[3-(4-метилпиперазин-1-ил)пропиламино]тиазол-5-карбоновой кислоты, [2-метил-5-(4-пиперазин-1-илметил-3-трифторметилбензоиламино)фенил]амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, {5-[4-(4-этилпиперазин-1-илметил)-3-трифторметилбензоиламино]-2-метилфенил}амид 2-(пиридин-2-иламино)тиазол-5-карбоновой кислоты, [2-метил-5-(4-морфолин-4-илметил-3-трифторметилбензоиламино)фенил]амид 2-циклопропиламинотиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-{6-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-метилпиримидин-4-иламино}тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-[6-(4-метилпиперазин-1-ил)пиримидин-4-иламино]тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-{6-[4-(2-гидроксиэтил)пиперазин-1-ил]пиримидин-4-иламино}тиазол-5-карбоновой кислоты, [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-[2-метил-6-(4-метилпиперазин-1-ил)пиримидин-4-иламино]тиазол-5-карбоновой кислоты и [2-метил-5-(3-трифторметилбензоиламино)фенил]амид 2-{4-[4-(2-гидроксиэтил)пиперазин-1-ил]пиридин-2-иламино}тиазол-5-карбоновой кислоты.
Применение в фармакологии
Соединения по настоящему изобретению модулируют активность киназ, и, таким образом, их можно использовать для лечения нарушений или заболеваний, при которых киназы принимают участие в развитии патологии и/или симптомов заболевания. Примеры киназ, активность которых ингибируется соединениями и композициями, описанными в настоящем описании, и в отношении которых используют способы, описанные в данном контексте, включают, без ограничения перечисленным, киназы Abl, Bcr-Abl, FGFR3, PDGFRβ, Flt3 и b-Raf.
Тирозинкиназа Абельсона (т.е. Abl, с-Abl) участвует в регуляции клеточного цикла, клеточного ответа на генотоксичный стресс и участвует в передаче информации об окружающей клетку среде через интегриновый сигнал. В основном, было установлено, что белок Abl выполняет сложные функции в качестве клеточного модуля, который интегрирует сигналы от различных внеклеточных и внутриклеточных источников и влияет на клеточный цикл и апоптоз. Тирозинкиназа Абельсона включает производные, такие как гибридный белок (онкопротеин) BCR-Abl с нарушенной активностью тирозинкиназы, или киназа v-Abl. Киназа BCR-Abl играет основную роль в патогенезе 95% случаев хронического миелолейкоза (CML) и в 10% случаев острого лимфоидного лейкоза. Продукт STI-571 (гливек) является ингибитором онкогенной тирозинкиназы BCR-Abl, который используют для лечения хронического миелолейкоза (CML). Однако некоторые пациенты на стадии недифференцируемого лейкоза CML являются устойчивыми к STI-571 из-за мутаций в киназе BCR-Abl. В настоящее время известно 22 мутации, причем основные мутации включают G250E, E255V, T315I, F317L и М351Т.
Соединения по настоящему изобретению ингибируют киназу abl, прежде всего киназу v-abl. Соединения по настоящему изобретению также ингибируют киназу BCR-Abl дикого типа и мутантные формы, и, таким образом, их можно использовать для лечения Bcr-abl-позитивного рака и опухолей, таких как лейкоз (прежде всего, хронический миелолейкоз и острый лимфоидный лейкоз, при которых проявляются особые механизмы апоптоза), а также влияют на подгруппу лейкозных стволовых клеток, и такие соединения можно использовать для очистки таких клеток in vitro после их удаления (например, после удаления костного мозга) и для повторной имплантации клеток после их очистки от раковых клеток (например, повторная имплантация очищенных клеток костного мозга).
PDGF (тромбоцитарный фактор роста) является распространенным фактором роста, который играет важную роль при нормальном росте, а также при патологической пролиферации клеток, такой как канцерогенез и заболевания клеток гладкой мускулатуры кровеносных сосудов, такие как, например, атеросклероз и тромбоз. Соединения по настоящему изобретению ингибируют активность рецептора PDGF (PDGFR), и, таким образом, их можно использовать для лечения опухолевых заболеваний, таких как глиомы, саркомы, опухоли предстательной железы и опухоли толстой кишки, молочной железы и яичника.
Соединения по настоящему изобретению можно использовать не только в качестве веществ, подавляющих опухоли, такие как, например, мелкоклеточный рак легких, но также в качестве агента для лечения доброкачественных пролиферативных заболеваний, таких как атеросклероз, тромбоз, псориаз, склеродерма и фиброз, для защиты стволовых клеток, например для снижения гемотоксичного влияния химиотерапевтических агентов, таких как 5-фторурацил, и для лечения астмы. Соединения по настоящему изобретению, прежде всего, можно использовать для лечения заболеваний, которые чувствительны к ингибированию рецепторной киназы PDGF.
Соединения по настоящему изобретению можно использовать для лечения нарушений, возникающих в результате трансплантации, такой как, например, аллогенная трансплантация, прежде всего, при отторжении ткани, такой как, прежде всего, облитеративный бронхиолит (ОB), т.е. хроническое отторжение аллогенных трансплантатов легкого. В отличие от пациентов, не страдающих ОB, у пациентов с ОB часто наблюдается повышенная концентрация PDGF в бронхоальвеолярной промывной жидкости.
Соединения по настоящему изобретению также являются эффективными для лечения заболеваний, связанных с миграцией клеток гладкой мускулатуры сосудов и пролиферацией (связанной в основном с PDGF и PDGF-R), таких как рестеноз и атеросклероз. Такое влияние и результат действия соединений по настоящему изобретению на пролиферацию или миграцию клеток гладкой мускулатуры сосудов in vitro и in vivo наблюдается после введения соединений по настоящему изобретению, а также при изучении влияния указанных соединений на загустевание сосудистой интимы после механической травмы in vivo.
Некоторые аномальные пролиферативные состояния, как было установлено, связаны с экспрессией белка raf и, таким образом, являются чувствительными к ингибированию экспрессии белка raf. Аномально высокий уровень экспрессии белка raf также вызывает трансформацию и аномальную пролиферацию клеток. Такие аномальные пролиферативные состояния, как было установлено, являются чувствительными к ингибированию экспрессии белка raf. Например, экспрессия белка c-raf влияет на аномальную пролиферацию клеток, так как в 60% всех клеточных линий карциномы легкого наблюдаются чрезвычайно высокие уровни мРНК c-raf и белка. Другие примеры аномальных пролиферативных состояний включают гиперпролиферативные нарушения, такие как рак, опухоли, гиперплазия, фиброз легких, ангиогенез, псориаз, атеросклероз и пролиферация клеток гладкой мускулатуры в кровеносных сосудах, такие как стеноз или рестеноз после ангиопластики. Путь передачи сигнала в клетке, который включает белок raf, также связан с воспалительными заболеваниями, характеризующимися пролиферацией Т-клеток (активация и рост Т-клеток), такими как, например, отторжение ткани трансплантата, эндотоксический шок и гломерулярный нефрит.
Киназа Flt3 входит в состав семейства рецепторных тирозинкиназ (RTK) типа III. Киназа Flt3 (киназа fms-подобная тирозинкиназа) также известна под названием киназа FLk-2 (эмбриональная киназа 2 печени). Аномальная экспрессия гена Flt3 была установлена у взрослого человека и детей с диагнозом лейкоз, такой как острый миелолейкоз (AML), AML, сопровождающийся трехлинейной миелодисплазией (AML/TMDS), острый лимфобластный лейкоз (ALL) и миелодиспластический синдром (MDS). Активирующие мутации рецептора Flt3 были выявлены приблизительно у 35% пациентов, страдающих от острого миелобластного лейкоза (AML), причем такие заболевания характеризуются неблагоприятным прогнозом. Наиболее распространенная мутация включает дупликацию в рамке в околомембранном домене, а еще у 5-10% пациентов выявлена точечная мутация (аспарагин 835). Обе мутации связаны с конститутивной активацией активности тирозинкиназы Flt3, что приводит к пролиферации и активации сигналов в отсутствие лиганда. Установлено, что пациенты, у которых выявлена мутантная форма рецептора, практически не поддаются лечению. Таким образом, существует множество доказательств, что гиперактивированная (мутантная) активность киназы Flt3 является причиной лейкоза и миелодиспластического синдрома человека. В связи с этим существует необходимость поиска новых ингибиторов рецептора Flt3 в качестве перспективных терапевтических средств для лечения пациентов, для которых современные способы лечения неэффективны, а также для которых ранее применяли неэффективные способы лечения и/или способ лечения с использованием трансплантации стволовых клеток.
Лейкоз, как правило, возникает вследствие приобретенного (ненаследственного) генетического повреждения ДНК незрелых гематопоэтических клеток в костном мозге, лимфатических узлах, селезенке или других органах кроветворной и иммунной системы. При таком заболевании наблюдается ускоренный рост и блокада созревания клеток, что приводит к накоплению клеток, названных «лейкобласты», которые не способны выполнять функции нормальных клеток крови, а также к отсутствию продуцирования нормальных клеток костного мозга, что приводит к дефициту эритроцитов (анемия), тромбоцитов и нормальных лимфоцитов. Властные клетки, как правило, образуются в костном мозге и развиваются в зрелые клетки крови, включающие приблизительно 1% всех клеток костного мозга. При заболевании лейкозом бластные клетки не развиваются должным образом и накапливаются в костном мозге. При остром миелолейкозе (AML) такие клетки называют миелобластами, а при остром лимфобластном лейкозе (ALL) такие клетки называют лимфобластами. Другой тип лейкоза включает смешанный лейкоз (MLL).
Термин «AML, сопровождающийся трехлинейной миелодисплазией (AML/TMDS)» означает обычную форму лейкоза, которая характеризуется дисгематопоэтической картиной, аналогичной картине при остром лейкозе, неэффективной индукционной химиотерапией и возможностью рецидива чистого миелодиспластического синдрома.
Термин «миелодиспластический синдром (MDS)» означает группу заболеваний крови, при которых происходит нарушение функции костного мозга, что приводит к дефициту числа здоровых клеток крови. По сравнению с лейкозом, при котором только один тип клеток крови образуется в больших количествах, при миелодиспластическом синдроме поражены некоторые, а иногда и все типы клеток крови. Каждый год в США зарегистрировано по крайней мере 10000 новых случаев. У одной трети пациентов с диагнозом MDS развивается острый миелолейкоз. В связи с этим такое заболевание иногда называют предлейкозом. Миелодиспластический синдром иногда также называют миелодиспластическим димиелопоэзом или олигобластным лейкозом, или вялотекущим лейкозом, при котором большое количество бластных клеток остается в костном мозге.
Миелодиспластический синдром, аналогично лейкозу, возникает при генетическом повреждении ДНК в отдельной кле