Стабильная эмульсия для парентерального введения плохо растворимых в воде соединений, обладающих противоопухолевой активностью, и способ ее получения
Иллюстрации
Показать всеИзобретение относится к новой эмульсии типа «масло в воде», предназначенной для парентерального введения. Эмульсия содержит в качестве активного ингредиента плохо растворимое в воде соединение с противоопухолевой активностью из класса таксанов, например паклитаксел или доцетаксел в концентрации от 1 до 30 мг в 1 мл эмульсии. Эмульсия также содержит лецитин, эффективное количество антиоксиданта, стабилизатор эмульсии, диметилсульфоксид в качестве со-растворителя активного ингредиента и сополимер лактида и гликолида в качестве стабилизатора активного ингредиента. Эмульсия содержит частицы с размером менее 100 нм в количестве не менее 80%. Эмульсия по изобретению является стабильной при разведении инфузионными растворами. Изобретение устраняет недостатки, связанные с наличием в применяемых в терапии опухолевых заболеваний композициях со-растворителей, оказывающих токсическое действие на организм человека, а также с нестабильностью известных эмульсий при разбавлении инфузионными растворами. 2 н. и 27 з.п. ф-лы, 6 ил., 1 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к области фармацевтики, более конкретно, к созданию новой эмульсии типа «масло в воде», содержащей в качестве активного ингредиента плохо растворимое в воде соединение с противоопухолевой активностью. Эмульсия предназначена для парентерального введения человеку с целью терапии опухолей. Указанная эмульсия может быть подвергнута для продления срока хранения лиофильной сушке. Эмульсия и лиофилизат отличаются высокой стабильностью при разведении инфузионными растворами. Изобретение относится также к способу приготовления эмульсии, содержащей не менее 80% частиц размером менее 100 нм, путем раздельного приготовления водной и масляной фаз и смешения фаз с применением гомогенизаторов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Ежегодно в мире выявляется сотни новых перспективных биологически активных соединений. Однако лишь единицы доходят до производства на их основе лекарственных средств и широкого применения в клинической практике.
Причиной этого могут являться выявленные при начальных клинических и доклинических исследованиях побочные эффекты применения соединения, или же трудности при создании подходящей лекарственной формы ввиду низкой растворимости соединения в фармацевтически приемлемых растворителях.
К слабо растворимым в воде соединениям относятся те соединения, растворимость которых не превышает 0,1 мг/мл. Такое соединение предпочтительно имеет молекулярную массу, не превышающую 1000. Наиболее предпочтительно, такое соединение характеризуется хорошей растворимостью в органических растворителях (хлороформе, этилацетате, этаноле, изопропаноле, от 0,1 до 100 мг/мл).
В ряду слабо растворимых в воде соединений с противоопухолевой активностью широко представлены алкалоиды растительного происхождения, полусинтетические производные алкалоида камптотецина.
Многие из разработанных за последние несколько десятилетий противоопухолевых препаратов являются цитостатиками - соединениями, которые способны тормозить, угнетать или блокировать размножение клеток. Поскольку раковые клетки делятся гораздо быстрее обычных, введенный в организм человека цитостатик взаимодействует преимущественно с клетками опухоли. Однако в организме человека есть здоровые клетки, которые делятся быстрее обычного, - это клетки костного мозга, клетки кожи, волосяные луковицы, эпителий слизистых оболочек. Это обстоятельство обуславливает, наряду с положительным терапевтическим эффектом уменьшения или остановки роста опухоли при лечении цитостатическим препаратом, сильные побочные эффекты, в некоторых случаях приводящие к прерыванию лечения пациента данным видом препарата.
Существенным аспектом эффективного лечения является доставка лекарства к цели (опухоли). Из уровня техники известно большое количество таких способов доставки.
Наиболее распространенными способами являются парентеральное введение непосредственно в опухоль (внутриопухолевое введение), пероральное введение с участием желудочно-кишечного тракта и, наконец, парентеральное введение с участием кровеносной системы. Первый способ не эффективен на поздних стадиях заболеваний, или в случае таких типов заболеваний, когда опухолевые клетки способны мигрировать по кровеносной системе. Второй способ не применим в случае низких показателей всасывания действующих веществ.
Парентеральное внутривенное введение противоопухолевых препаратов представляет собой сложную задачу. Как было отмечено выше, механизм действия многих цитостатических препаратов заключается в подавлении синтеза ДНК и/или нарушении клеточного цикла, приводящем к гибели клетки. При этом предпочтительно поддерживать концентрацию препарата в крови и/или зараженной ткани в течение такого времени, чтобы наибольшее число клеток опухоли прошло через фазу клеточного цикла, на которую распространяется действие препарата.
В связи с этим стандартные комбинации лечения многих злокачественных опухолей (например, немелкоклеточный рак легкого, рак желудка, остеосаркома) подразумевают режимы химиотерапии с длительными инфузиями противоопухолевых препаратов. Для этого лекарственная форма препарата должна быть пригодной для внутривенного введения и оставаться стабильной при разбавлении инфузионными растворами в течение как минимум нескольких часов (время инфузии).
В случае слабо растворимых в воде биологически активных соединений решением проблемы растворимости в воде является создание лекарственной формы на основе биосовместимых спиртов (этанола, изопропанола), которые для повышения растворимости действующего вещества и стабильности его раствора при разбавлении инфузионньми средами дополнительно смешивают с различными поверхностно-активными веществами.
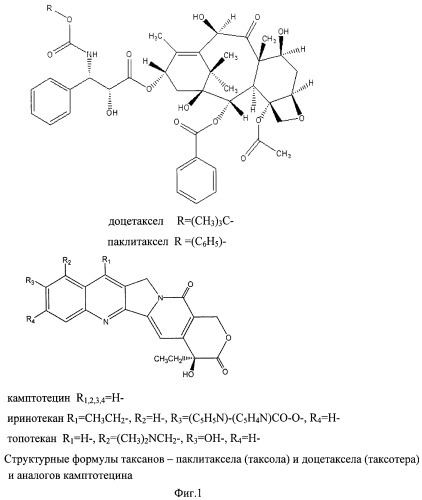
Примерами подобного решения являются широко применяемые в клинической практике и одобренные в США и Европе для лечения различных опухолей лекарственные формы препаратов класса таксанов, а именно паклитаксела и доцетаксела (Фиг.1).
В настоящий момент названные таксаны получают полусинтетическим методом из экстракта иголок тиса Taxus Baccata. Препарат Таксол компании Бристол-Майерс Сквибб представляет собой раствор паклитаксела в этаноле и Кремофоре (полиоксиэтилированное касторовое масло) в соотношении 1:1(Rowinsky, Lorraine, Cazenave и Donehower, Journal of the National Cancer Institute. 82 (15), 1247-1259 (1990)). Препарат Таксотер фирмы Авентис Фарма представляет собой концентрированный раствор доцетаксела в полисорбате 80, перед разбавлением инфузионным раствором к концентрату добавляют 13%-ный раствор этанола в воде для инъекций (справочник Видаль, изд-во АстраФармСервис, издание 8-е, стр.Б-597).
Однако существенным недостатком подобных решений является способность спиртов, особенно в сочетании с поверхностно-активными веществами, экстрагировать пластификаторы из пластмассовых емкостей для хранения препарата или из систем для инфузионного введения. В уровне техники описаны побочные эффекты, вызываемые у пациентов пластификаторами (например, ди-(2-этилгексилфталатом), к таким эффектам относятся нарушение дыхательной функции (Physical and chemical stability of paclitaxel infusions in different container types // Donyai P., Sewell G., Journal of Oncology Pharmacy Practice, vol. 12, No.4, 211-222 (2006)).
В уровне техники описаны токсические эффекты Кремофора и Полисорбата 80, среди которых особенно распространены реакции гиперчувствительности и эффекты со стороны сердечно-сосудистой системы (Cremophor EL: the drawbacks and advantages of vehicle selection for drug formulation // Gelderblom H., Verweij J., Nooter K., Sparreboom A. / Eur J Cancer., 2001, 37(13), 1590-1598; Cardiovascular effects of radioactive microsphere suspensions and Tween 80 solutions // Millard R. W., Baig, H., Vatner S.F. / Am J Physiol Heart. Circ. Physiol.,1977; 232: H331-H334).
Другим решением для перспективных с точки зрения терапевтической активности слабо растворимых в воде соединений являются фармацевтические композиции в виде эмульсий. Такие композиции позволяют осуществить доставку действующего вещества, плохо растворимого в воде и других полярных фармацевтически приемлемых жидкостях, в кровь или другие жидкие среды организма. Улучшение растворимости действующего вещества за счет включения в частицы эмульсии обычно позволяет достичь высоких его концентраций в крови за короткие промежутки времени. Кроме того, стабильность многих действующих веществ в эмульсионных фармацевтических композициях оказывается выше, чем наблюдаемая стабильность вещества в гомогенных водных или спиртовых растворах.
Для создания стабильных эмульсий активно используют различные классы поверхностно-активных агентов, которые способствуют образованию в водных растворах различных структурированных элементов, например мицелл или липосом, или же полимерных сеток. В такие структурированные элементы можно включать слабо или плохо растворимое в воде терапевтически активное вещество в концентрациях, во много раз превышающих растворимость такого вещества в воде.
Современные способы гомогенизации эмульсий (такие как гомогенизация высокого давления, ультразвуковые методы) позволяют получать эмульсии, размер частиц которых делает возможным безопасный ввод в кровь пациента путем инъекций или инфузий.
По соображениям биологической совместимости и безопасности в качестве эмульгаторов и стабилизаторов жировой эмульсии используют липиды биологических мембран. К таким липидам относятся фосфолипиды, получаемые главным образом из соевого или яичного лецитина или полученные синтетически, а также сфинголипиды.
При этом, помимо фосфолипидов, лецитины из природных источников содержат триглицериды и гликолипиды в соотношениях, зависящих от источника получения лецитина.
Эмульсии «масло в воде», содержащие растительные жиры и стабилизированные лецитином, широко используются, например, в качестве компонентов парентерального питания (Липовеноз, № гос. регистрации П №013613/01-2002 и др.). Введение таких эмульсий приводит к образованию в крови капелек, аналогичных получаемым при всасывании компонентов жиров при их переваривании в желудочно-кишечном тракте [Парентеральное питание с использованием жировых эмульсий, содержащих жирные кислоты со средней длиной молекулы в триглицеридах // Штатнов М.К. Вестник интенс. терапии, 2001, 1]. Такие эмульсии для парентерального питания описаны, например, в патенте США №5461037.
Было сделано несколько попыток введения субстанций с различным терапевтическим действием в эмульсии для парентерального питания, сообщалось о более низком уровне нефротоксичности по сравнению с неэмульсионным аналогом препарата.
Широко известны эмульсионные лекарственные формы таксанов с токоферолами в качестве масляной фазы. Токоферолы, широко известный класс природных антиоксидантов, за счет особенностей строения способны растворять таксаны.
Из уровня техники известна возможность добавления стабилизатора таксана в эмульсию типа «масло в воде». В международной заявке WO 0209695 (заявитель Атосса ХелфКейр) описаны эфиры масляной кислоты в качестве стабилизаторов эмульсии «масло в воде» с содержанием таксанов.
В патенте РФ 2157200 описана композиция на основе ненасыщенных и анионных фосфолипидов с таксанами в качестве действующего начала. Способ получения фармацевтической композиции, согласно независимому пункту №25 данного изобретения, состоит в приготовлении дисперсии путем растворения в спирте одного или нескольких ненасыщенных фосфолипидов, одного или нескольких отрицательно заряженных фосфолипидов и действующего начала из класса таксоидов, выбираемого среди доцетаксела или производных доцетаксела и последующем выпаривании всего или части спирта до получения геля или вязкой жидкости, которую поглощают путем добавления воды при перемешивании, затем гомогенизируют, после чего в случае необходимости полученную дисперсию замораживают или лиофилизируют».
Данный способ приготовления подразумевает трудоемкую стадию выпаривания этанола, используемого в качестве растворителя таксанового действующего начала, которая, возможно, способствует увеличению размера частиц в эмульсии после упаривания, и содержит две стадии гомогенизации.
В патентах РФ 2236226 и 2279895 (заявитель компания «Галена АС») описаны фармацевтические композиции с таксанами в качестве действующего вещества для перорального введения. Недостатком данных композиций является поступление в кровь действующего вещества с участием желудочно-кишечного тракта, что влечет за собой увеличение токсического действия на эпителий желудочно-кишечного тракта и ткань печени.
Эмульсия на основе витамина Е, представителя класса токоферолов, в качестве масляной фазы Токосол (Tocosol) для инъекций является одним из немногих препаратов, допущенных к клиническим исследованиям [ // Paclitaxel injectable emulsion: Phase 2a study of weekly administration in patients with non-small-cell lung cancer (NSCLC) // N.Bogdanova, N.Karaseva, N.Ognerubov, O.Golubeva, P.Weiden, Journal of Clinical Oncology, 2004 ASCO Meeting Proceedings (Post-Meeting Edition), v.22, 14S (July 15 Supplement), 2004, 7133].
В патентах, раскрывающих получение и свойства эмульсии, нет упоминаний об устойчивости этой эмульсии при 5-10-кратном разведении эмульсии инфузионными растворами (Заявка США N 2003/01014015, заявитель компания Сонус Фармасьютикалс; Tocol emulsions for drug solubilization and parenteral delivery Panayiotis // P.Constantinidesa, Alex Tustianb, Dean R.Kessler. Advanced Drug Delivery Reviews, 2004, 56, 1243-1255).
Использование растительных масел в качестве компонентов эмульсий описано в уровне техники. Одним из примеров широко используемой эмульсии «масло в воде», известной в уровне техники, является препарат анестезирующего действия «Диприван» компании Астра Зенека, который содержит 10 объемных процентов соевого масла, и его современный аналог Ампофол, содержащий 6 объемных процентов соевого масла [The pharmacodynamic effects of a lower-lipid emulsion of propofol: a comparison with the standard propofol emulsion. // Song D., Hamza M., White P.F., Klein K., Recart A., Khodaparast O. Anesthesia and Analgesia, 2004; 98, 687-691].
Антиоксидант в составе эмульсии не только препятствует окислению действующего вещества и вспомогательных компонентов эмульсии при ее хранении (например, ненасыщенных жирных кислот, входящих в состав растительных масел), но и способен оказывать дополнительный терапевтический эффект [The use of antioxidants with First-Line Chemotherapy in two cases of Ovarian Cancer // Drisko J.A., Chapman J., Hunter V.J., Journal of American College of Nutrition, vol.22, N2, pp.118-123].
Большинство из разрабатываемых эмульсий содержит этанол в качестве со-растворителя для таксанов, при этом, как правило, при приготовлении эмульсии имеется этап удаления этанола из эмульсии.
В качестве стабилизатора эмульсии «масло-в-воде» в технике использовали Плюроник F68, однако при разбавлении полученных эмульсий инфузионными растворами, содержащими большое количество неорганических солей, стабильность таких эмульсий резко падала (Pluronic block copolymers as novel polymer therapeutics for drug and gene delivery // A.Kabanov, E.Batrakova, V.Alakhov, // J.Control. Release, 82, 2002, 189-212). Сообщалось, что полимерные мицеллы Плюроника 123 (с включением паклитаксела в качестве действующего вещества) обеспечивали пролонгированную циркуляцию паклитаксела в крови и влияют на его распределение в организме.
При этом для продления срока хранения эмульсии известен способ ее лиофилизации с последующим перерастворением. Однако и для таких лиофилизованных эмульсий, при решении проблемы ее продолжительного хранения, остается проблема получения стабильной эмульсии после перерастворения и разбавления в инфузионной среде. В заявке США 2003/0099674 раскрыто получение лиофилизатов из эмульсий типа «масло в воде». В ней в качестве со-растворителя для таксанов используют этанол, и после смешивания фаз эмульсии требуется осуществить дополнительную стадию выпаривания этанола.
К преимуществам водно-масляных эмульсий при парентеральном внутривенном введении можно отнести высокую концентрацию плохо растворимого в воде активного ингредиента; присутствие в составе растительного масла, широко применяемого в качестве компонента парентерального питания, лецитина в качестве эмульгатора, оказывающего дополнительный терапевтический эффект.
К недостатками известных решений можно отнести нестабильность подобных концентрированных эмульсий при разведении инфузионными растворами, содержащими большое количество неорганических солей, оказывающих негативное влияние на стабильность эмульсии за счет увеличения ионной силы раствора.
В связи с этим актуальна задача получения эмульсии для парентерального введения, характеризующейся высокой концентрацией активного ингредиента, размерами частиц в нанодиапазоне (менее 1 мкм), нетоксичностью для парентерального введения человеку и стабильностью при разведении инфузионными растворами.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
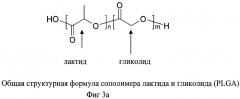
В соответствии с изобретением описывается эмульсия типа «масло в воде», включающая плохо растворимое в воде соединение с противоопухолевой активностью (активный ингредиент), лецитин в качестве эмульгатора и стабилизатора и антиоксидант. Кроме того, эмульсия содержит блок-сополимер молочной и гликолевой кислот (сополимер лактида и гликолида (Фиг.3а) в качестве стабилизатора для соединения с противоопухолевой активностью (активного ингредиента)).
В одном из вариантов осуществления изобретения под соединением с противоопухолевой активностью подразумевают соединения класса таксанов.
Предположительно, эффект стабилизации таксана PLGA можно объяснить образованием комплекса между таксаном и сополимером лактида и гликолида. Предпочтительно, эмульсии согласно изобретению содержат 1-30 мг/мл таксана. Для растворения таксанов используется диметилсульфоксид (ДМСО), количество которого в конечной эмульсии не превышает 3 об.%.
При этом отличительным свойством указанной эмульсии является ее стабильность при разведении инфузионными растворами.
Изобретение относится также к способу приготовления эмульсии. После раздельного формирования водной и масляной фаз путем растворения или диспергирования компонентов водную и масляную фазу смешивают, применяя подходящий способ гомогенизации для создания частиц приемлемого для внутривенного введения размера.
Эмульсионная композиция согласно изобретению из соображений удлинения срока ее хранения может подвергаться лиофилизации. При этом после растворения в воде и/или инфузионной жидкости лиофилизат сохраняет свойства эмульсионной композиции, а именно характеризуется распределением частиц по размерам, пригодным для внутривенного введения пациенту.
Термины, использованные выше и применяемые далее в описании, имеют следующие значения, если не указано иное.
Согласно изобретению, термин «эмульсия» подразумевает дисперсию одной жидкости в другой с размерами частиц от 10-5 до 10-9 м, в том числе мицелл и липосом. Однако для внутривенного введения в рамках настоящего изобретения изготовляется эмульсия с размерами частиц от до 5×10-7 до 10-9 м.
Термин "стабильность эмульсии" в течение определенного периода времени - это способность эмульсии сохранять свои свойства. Под явлениями, изменяющими свойства эмульсии, подразумеваются, например, коалесценция, седиментация, обращение фазы и прочие явления, влияющие на распределение, форму и размер частиц эмульсии.
Согласно изобретению, термин «мицелла» подразумевает объединения индивидуальных амфифильных молекул, каждая из которых содержит гидрофильный и гидрофобный участки. Объединения молекул могут принимать формы микроскопических сфер, эллипсоидов, цилиндров. Липосомы отличаются от мицелл наличием бислойной мембраны, образованной двумя структурированными слоями амфифильных молекул, взаимно ориентированными гидрофильными частями в полярную жидкость (например, воду, а гидрофобными частями - друг к другу.
Под «лецитином» в одном аспекте настоящего изобретения подразумеваются фосфолипиды, а именно фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и фосфатидилинозитол, лизофосфатидилхолин как в индивидуальном виде, так и в виде смесей в различных соотношениях. В зависимости от природы источника получения лецитина, помимо перечисленных соединений, смесь необязательно содержит различные триглицериды, стерины, жирные кислоты и углеводы. Источниками получения лецитина в рамках настоящего изобретения является яичный желток («яичный лецитин») или соевые бобы («соевый лецитин»). В определенных аспектах настоящего изобретения лецитин дополнительно содержит сфинголипиды, ганглиозиды, фосфатидную кислоту, кардиолипиды.
Термин «Стабилизатор эмульсии» относится к веществу, которое является биосовместимым и которое способно вызывать формирование мицелл или липосом.
Термин «антиоксидант» относится к химическому соединению или же к смеси соединений, которые в составе фармацевтической композиции способствуют предотвращению окисления действующего вещества и вспомогательных компонентов в эмульсии.
Термин «парентеральное введение» обозначает введение препарата в организм пациента, минуя желудочно-кишечный тракт. В рамках воплощения данного изобретения термин «парентеральное введение» относится преимущественно к внутривенному введению, а именно инъекциям или инфузиям.
Термин «размер частиц» относится к среднему размеру частиц дисперсионной фазы эмульсии.
Термин «инъекция» подразумевает введение препарата в организм пациента внутривенно, подкожно, внутримышечно при помощи шприца.
Термин «инфузия» подразумевает введение препарата в организм пациента внутривенно при помощи специальных систем, подразумевающих, в зависимости от заболевания/дозы, различные скорости введения препарата. При этом инфузия подразумевает предварительное разбавление препарата перед введением специальными инфузионными растворами или инфузионными жидкостями.
Под термином «инфузионные растворы» или «инфузионные жидкости» в рамках настоящего изобретения подразумевают жидкости соответствующей осмолярности для разбавления препаратов с целью длительных внутривенных введений с целью поддержания терапевтической дозы препарата в крови в течение длительного времени. Примерами таких жидкостей, в зависимости от природы заболевания и назначенного лечения, являются физиологический раствор, плазмозамещающие жидкости, например растворы декстрозы, декстрана (Реополиглюкин, Фрагмин, Фраксипарин, Клексан) и другие.
«Пациент» относится предпочтительно к людям. Эти и другие объекты настоящего изобретения более подробно представлены ниже в описании и формуле изобретения.
Под таксанами в рамках настоящего изобретения подразумеваются паклитаксел или доцетаксел (общая формула таксанов по изобретению приведена на фиг.1).
Проценты, если не указано иное, выражены в количестве мг на 1 мл эмульсии.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящего изобретения рассматривается эмульсия типа «масло в воде» с плохо растворимым в воде соединением с противоопухолевой активностью в качестве действующего вещества с добавлением лецитина.
В предпочтительном варианте осуществления изобретения, концентрация плохо растворимого в воде соединения с противоопухолевой активностью в эмульсии находится в диапазоне от 1 до 30 мг/мл. В наиболее предпочтительном варианте изобретения, концентрация соединения в эмульсии находится в интервале от 15 до 30 мг/мл.
В наиболее предпочтительном варианте изобретения, в качестве плохо растворимого в воде соединения с противоопухолевой активностью, эмульсия содержит соединение класса таксанов, более конкретно, паклитаксел и доцетаксел.
В соответствии с изобретением, эмульсия типа «масло в воде» представляет собой масляную фазу, диспергированную в водной фазе. При этом соотношение частей водной фазы к масляной составляет от 1:1 до 20:1. В наиболее предпочтительном варианте осуществления изобретения, соотношение составляет от 15:1 до 10:1.
В рамках настоящего изобретения, масляная фаза представляет собой дисперсию компонентов в соевом масле, сафлоровом масле, оливковом масле, или персиковом масле, причем названные масла используются в качестве основы для масляной фазы как по отдельности, так и в виде смесей. Предпочтительный вариант изобретения подразумевает использование соевого масла в качестве основы масляной фазы эмульсии.
Согласно одному из вариантов воплощения изобретения, для введения активного ингредиента - плохо растворимого в воде соединения с противоопухолевой активностью - используют его концентрированный раствор в диметилсульфоксиде (ДМСО). При этом в предпочтительном варианте осуществления изобретения соотношение количеств активного ингредиента и ДМСО выбирают с таким расчетом, чтобы концентрация активного ингредиента в конечной эмульсии предпочтительно составляла не менее 15 мг/мл, а концентрация ДМСО в конечной эмульсии составляла не более 3 об.%.
Таким образом, концентрация ДМСО в эмульсии не превышает нормы Государственной Фармакопеи по остаточным растворителям [Общая фармакопейная статья ОФС 42-004-01, Минздрав РФ, с.4]. В уровне техники описана безопасность внутривенного введения ДМСО в виде 10%-ного водного раствора (Richard D. Brobyn (1975) // The human toxicology of dimethyl sulfoxide). Принимая во внимание предпочтительный способ введения препарата путем долговременной инфузии разбавленных инфузионной жидкостью в соотношениях от 1:5 до 1:20, следует считать концентрацию ДМСО безопасной для введения пациенту.
В определенном варианте осуществления изобретения, в качестве стабилизатора таксанов используют блок-сополимер молочной и гликолевой кислот (или сополимер лактида и гликолида, сокращенно PLGA, Фиг. 3а). При этом молекулярный вес полимера предпочтительно находится в интервале от 20 до 70 тысяч дальтон. При этом в предпочтительном варианте осуществления изобретения сополимер лактида и гликолида представляет собой сополимер D-лактида и L-гликолида, при этом отношение D-лактида к L-гликолиду составляет от примерно 70:30 до примерно 30:70.
Использование сочетания ДМСО и PLGA вместо этанола и других биосовместимых спиртов в качестве растворителя для активного ингредиента - плохо растворимых в воде соединений с противоопухолевой активностью - позволяет получать эмульсию с высоким содержанием активного ингредиента. В предпочтительном варианте осуществления изобретения, таким активным ингредиентом является соединение класса таксанов. В наиболее предпочтительном варианте, концентрация таксана в конечной эмульсии находится в интервале от 15 до 30 мг/мл. В наиболее предпочтительном варианте осуществления изобретения, концентрация таксана в эмульсии находится в интервале от 20 до 25 мг/мл.
Согласно аспекту настоящего изобретения, в качестве компонента водной и масляной фазы по изобретению используют лецитин. В предпочтительном варианте осуществления изобретения, под лецитином подразумевают смесь фосфолипидов, содержащую приблизительно 40 массовых процентов или более фосфатидилхолина. Лецитин в рамках настоящего изобретения выполняет роль эмульгатора и смачивающего агента. Поскольку лецитин является компонентом биологических мембран в клетках, он метаболизируется в организме человека и считается нетоксичным (статус GRAS (generally recognized as safe) Управления по санитарному надзору за качеством пищевых продуктов и медикаментов CLUA(FDA)). В предпочтительном варианте осуществления изобретения в качестве эмульгатора и стабилизатора эмульсий типа «масло в воде» используют соевый лецитин.
В определенных предпочтительных вариантах, эмульсия содержит в качестве компонента стабилизатор эмульсии, который представляет собой полимер. Соответственно в понятие "полимер" включаются, например, димеры, тримеры и олигомеры. В других определенных предпочтительных вариантах стабилизирующее вещество включает неполимерный материал, в том числе, например, мономерные молекулы. Стабилизирующее вещество может быть нейтральным или положительно, или отрицательно заряженным.
В роли дополнительных полимерных стабилизаторов эмульсии, согласно аспекту настоящего изобретения, могут выступать блок-сополимеры. В предпочтительном варианте изобретения, в роли подобных полимеров выступают блок-сополимеры полиэтиленгликоля и полипропиленгликоля. Такие блок-сополимеры с разной величиной блоков выпускаются компанией Айсиай под торговой маркой Синпероник® и компанией Басф под торговой маркой Плюроник®. В предпочтительном варианте осуществления изобретения в качестве таких стабилизаторов используют Плюроники (Фиг.3б). Каждый Плюроник® построен из двух симметрично расположенных по краям полиоксиэтиленовых фрагментов (Е) и расположенного в середине полиоксипропиленового фрагмента (Р), выполняющего роль гидрофобной части молекулы.
Некоторые примеры возможных соотношений фрагментов приведены в таблице 1.
| Таблица 1. Плюроники общей формулы (ПЭО)m(ППО)n(ПЭО)m | |||||
| Плюроник®, название | n | m | Mw | %ПЭО | ККМ |
| L61 | 4 | 30 | 2090 | 10 | 1.1 10-4 |
| L101 | 7 | 55 | 3500 | 10 | 2.1 10-6 |
| Р85 | 50 | 40 | 4500 | 50 | 6.5 10-6 |
| F68 | 30 | 153 | 8400 | 80 | 4.8 10-4 |
| F127 | 65 | 200 | 12600 | 70 | 2.8 10-6 |
| Примечание: ПЭО - полиэтиленоксид, | |||||
| ППО - полипропиленоксид, | |||||
| ККМ - критическая концентрация мицеллообразования |
Введение в эмульсионные лекарственные формы Плюроников обусловлено не только их предполагаемой ролью стабилизаторов эмульсии, известных из уровня техники, но и тем, что они способствуют более длительной циркуляции действующих веществ в организме. Наличие Плюроников с объемной гидрофобной частью усиливает флип-флоп липидов биологической мембраны, что способствует улучшению транспорта действующих веществ в раковую клетку (Relationship between the structure of amphiphilic copolymers and their ability ro disturb liid bilayers // Demina Т., Grozdova I., Krylova O., Zhimov A., Istratov V., Frey H., Kautz H., Melik-Nubarov N. //'Biochemistry, 2005, 44, 10, 4042-4054).
В еще одном варианте осуществления изобретения, под стабилизаторами в составе эмульсии подразумевают ПАВ типа замещенных полиэтиленгликолей. В предпочтительном варианте осуществления изобретения, под замещенньми полиэтиленгликолями подразумевают простые и сложные эфиры ПЭГ с числом звеньев от 5 до 20, необязательно содержащие сорбитановые звенья. Полимеры Бриж (BRIJ) представляют собой полиэтиленгликоли, молекулы которых содержат на одном конце алкоксильную группу, в то время как гидроксильная группа с другого конца полимерной цепи является свободной. В определенных вариантах осуществления изобретения, под простыми и сложными эфирами ПЭГ подразумевают соединения, выбранные из группы, включающей Бридж 96 (Brij96), Бридж 99 (Brij 99), Твин 80 (Tween 80). В наиболее предпочтительном варианте изобретения, в качестве стабилизатора эмульсии используют Brij96, под которым подразумевают простой эфир полиэтиленгликоля-10 и олеилового спирта.
Согласно следующему варианту воплощения изобретения, эмульсия содержит в качестве стабилизаторов соли желчных кислот, олеаты, производные холестерина. В наиболее предпочтительном варианте осуществления изобретения, в качестве стабилизаторов эмульсия содержит гликохолат натрия, дезоксихолат натрия, олеат натрия или холестерин.
Согласно одному из вариантов осуществления изобретения, в состав эмульсии может входить антиоксидант. При этом основным требованием к антиоксиданту является его фармацевтическая приемлемость во вводимых концентрациях. Примерами антиоксидантов в рамках настоящего изобретения являются токоферолы (~витамин Е), флавоноиды, катехины, витамины А, Е, С, бета-каротин (~витамин А). В предпочтительном варианте осуществления изобретения, в качестве антиоксидантов в качестве компонентов эмульсии используется витамин Е, С или убихинон. В наиболее предпочтительном варианте осуществления изобретения, эмульсия содержит витамин Е в качестве антиоксиданта.
В одном из вариантов осуществления изобретения, в роли антиоксиданта может выступать бензиловый спирт. Помимо антиоксидантных свойств данное соединение является широко применяемым в пищевой и медицинской промышленности консервантом. Данное соединение используется как растворитель в препарате Гидрокортизон, лиофилизированный порошок для приготовления инъекционного раствора по 100 мг и 500 мг (производитель Хемофарм Концерн А.Д., Югославия).
При этом специалисту в данной области техники очевидно, что маслорастворимые антиоксиданты из вышеперечисленных классов вводятся в эмульсию путем растворения в масле, а водорастворимые антиоксиданты растворяются в воде при приготовлении водной фазы.
В одном из вариантов осуществления изобретения, количество антиоксиданта находится в интервале от 0,01 до 2 мас.%.
Согласно настоящему изобретению, способ получения эмульсии состоит из следующих операций:
- приготовляют масляную фазу эмульсии из масляной основы и маслорастворимых компонентов. В зависимости от природы вводимых в масляную фазу компонентов, в качестве масляной основы используют соевое масло, оливковое масло, сафлоровое масло или персиковое масло. Возможно также использование смесей вышеуказанных масел в любых приемлемых с точки зрения значения вязкости конечной эмульсии комбинациях. В предпочтительном варианте осуществления изобретения в качестве масляной основы используют соевое масло и/или оливковое масло. В наиболее предпочтительном варианте осуществления изобретения в качестве масляной основы используют соевое масло.
- для введения активного ингредиента используют его концентрированный раствор в диметилсульфоксиде (ДМСО). Высокая растворимость большинства плохо растворимых в воде соединений с противоопухолевой активностью в ДМСО, усиленная комплексообразованием с PLGA, создает возможность введения большого количества активного ингредиента и избежать добавления в качестве со-растворителей токсикологически опасных доз со-растворителей, например Кремофора или Полисорбата 80. Содержание ДМСО в конечной эмульсии, согласно настоящему изобретению, находится в интервале от 0,1 до 3 об%. В предпочтительном варианте осуществления изобретения, содержание ДМСО в конечной эмульсии составляет примерно от 0,01 до 2 об.%. В наиболее предпочтительном варианте осуществления изобретения, содержание ДМСО в конечной эмульсии составляет от 0,01 до 0,5 об.%. В соответствии со следующим аспектом настоящего изобретения, способ получения эмульсии характеризуется тем, что
а) раздельно готовят водную и масляную фазы, при этом водную фазу готовят путем эмульгирования в воде лецитина, добавления стабилизаторов эмульсии; масляную фазу готовят путем добавления раствора активного ингредиента в диметилсульфоксиде и сополимера лактида и гликолида (PLGA) к раствору лецитина в масле и последующим добавлением стабилизатора эмульсии;
б) смешением водной и масляной фаз эмульсии;
в) с последующими, в случае необходимости, стерильной фильтрацией полученной эмульсии, замораживанием и лиофильной сушкой в стерильных условиях.
При этом приготовление масляной фазы, так же как и приготовление водной фазы, подразумевает использование шейкера для обеспечения эффективного растворения или диспергирования компонентов. Согласно одному из вариантов осуществления изобретения, после смешения водной и масляной фаз эмульсию подвергают обработке ультразвуком в течение периода времени от 1 минуты до 30 минут с целью предварительной гомогенизации эмульсии. Далее осуществляют гомогенизацию эмульсии при помощи одного из следующих типов гомогенизаторов: гомогенизатор высокого давления, роторно-статорный гомогенизатор, ультразвуковой гомогенизатор. Использование гомогенизации такого типа позволяет получать эмульсию с не менее чем 80% частиц, размеры которых не превышают 100 нм (наноэмульсия).
Полученная в соответствии с изобретением эмульсия может быть подвергнута лиофилизации с целью упрощения ее хранения и транспортировки. Согласно изобретению, лиофилизация подразумевает замораживание эмульсии с последующим удалением в вакууме летучих компонентов. Преимущества такого способа высушивания - отсутствие воздействия высоких температур на эмульсию и сохранение ее дисперсной фазы.
Согласно данному аспекту изобретения, эмульсию подвергают лиофильной сушке в диапазоне температур от -50°С до -10°С и значениях вакуума менее 0,001 мБар. При этом важно соблюсти условие, что лиофилизат при повторном разбавлении водой или инфузионными жидкостями сохраняет характерные для эмульсии свойства, а именно распределение частиц по размерам, пригодное для внутривенного введения (не более 1 мкм, предпочтительно не более 500 нм, наиболее предпочтительно не более 100 нм).
С точки зрения широкого применения подобной лиофилизованной композиции в клинической практике, необходимо оптимизировать процесс перерастворения лиофилизата таким образом, чтобы он не требовал применения специальной аппаратуры (например, шейкера) и мог быть легко осуществлен медперсоналом.
В одном варианте данного изобретения для соблюдения перечисленных условий требуется введение добавок, препятствующих слипанию частиц и/или облегчающих повторное растворения лиофилизата. К таким добавкам можно отнести различные Сахара, полимеры или аминокислоты, например глюкозу, лактозу, маннозу, трегалозу, маннит, сорбит, мальтодекстрин, декстран, декстран сульфат, хитозан.
Таким обра