Применение пролинспецифичных эндопротеаз для гидролиза пептидов и белков
Иллюстрации
Показать всеИзобретение относится к области медицины и касается применения пролинспецифичных эндопротеаз для гидролиза пептидов и белков. Сущность изобретения включает применение пролинспецифической эндопротеазы, имеющей рН оптимум ниже 5,5 для изготовления диетической добавки или лекарственного средства для in vivo лечения целиакии, или заболеваний, связанных с присутствием богатых пролином пептидов в потребляемой пище, а также в качестве диетической добавки или лекарственного средства для предотвращения целиакии. Преимущество изобретения заключается в усилении гидролиза пищевых белков с высоким содержанием пролина. 4 н. и 9 з.п. ф-лы, 10 табл., 3 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к протеолитическому гидролизу пептидов или полипептидов.
Уровень техники
Известно, что обогащенные пролином белки, входящие в состав пищи, такие как казеины коровьего молока или глютены зерновых культур, с трудом поддаются протеолитическому расщеплению в желудочно-кишечном тракте человека. В результате может происходить накопление пептидов с высоким содержанием пролина, что может приводить к нежелательным последствиям у определенных групп людей. Некоторые из этих последствий были отнесены на счет того факта, что пептиды с высоким содержанием пролина действуют как опиоиды, которые связываются с рецепторами в периферических тканях и центральной нервной системе. Например, синдромы, наблюдаемые у пациентов, страдающих аутизмом и шизофренией, были связаны с потреблением пищевых белков с высоким содержанием пролина. Другие последствия являются результатом непереносимости пептидов с высоким содержанием пролина. Например, конкретные последовательности, обогащенные пролином, несут ответственность за наблюдаемую токсичность глютена при целиакии (глютеновой болезни). Целиакия является широко распространенным аутоиммунным заболеванием тонкого кишечника, которое может быть вылечено только пожизненной диетой, исключающей глютен. Кроме этого целиакия иногда сопровождается психиатрическими и неврологическими симптомами, показывающими, насколько далеко идущие последствия может иметь нарушение метаболизма пептидов с высоким содержанием пролина.
Белки коровьего молока связаны с ростом и здоровьем и являются важным ингредиентом рациона человека. Казеины составляют приблизительно 80% общего количества белка в коровьем молоке, являясь важным источником аминокислот, кальция и фосфатов. Казеин ориентировочно состоит из 50% альфа-казеинов, 35% бета-казеинов, 13% каппа-казеинов и 3% гамма-казеинов. В человеческом молоке фракция альфа-казеина в основном отсутствует.
Известно, что при метаболизме казеина образуется ряд новых биологически активных пептидов. Из альфа и бета-казеиновых фракций были выделены и идентифицированы опиоидные пептиды, названные, соответственно, альфа-казоморфины и бета-казоморфины. Фармакологические эффекты, в особенности, бета-казоморфинов широко изучены. Бета-казоморфин с последовательностью Tyr-Pro-Phe-Pro-Gly-Pro-Ile является основным опиоидным пептидом коровьего молока, который называют BCM-7 (бета-казоморфин (1-7); Chang et al. (1985) Journal of Biological Chemistry, 260, 9706-9712). В отдалении от фрагмента BCM-7, в положениях 60-66 аминокислотной последовательности молекулы бета-казеина меньшие фрагменты, подобные BCM-7, такие как Tyr-Pro-Phe-Pro (бета-казоморфин (1-4)) и Tyr-Pro-Phe-Pro-Gly (бета-казоморфин (1-5)) в положениях 60-63 и 60-64 соответственно, а также все более крупные пептиды, родственные BCM-7, вплоть до длины цепи в 11 аминокислотных остатков (в положениях 60-70), проявляют по крайней мере определенную степень опиоидной активности. N-концевой трипептид BCM-7, т.е. последовательность Tyr-Pro-Phe в положениях 60-62 не обладает опиоидной активностью. Утверждалось, что генетический вариант бета-казеина, именуемый A1 (имеющий гистидиновый, а не пролиновый, как у A2 бета-казеина, остаток в положении 67) приводит к образованию меньшего количества молекул BCM-7.
Основная причина образования различных бета-казоморфинов заключается в том, что их аминокислотная последовательность относительно богата пролиновыми остатками. Поскольку пептидные связи, включающие пролиновые остатки, с трудом подвергаются протеолитическому расщеплению, бета-казоморфиновые последовательности имеет тенденцию сохраняться после воздействия желудочно-кишечных протеаз в желудке и кишечном проходе. По той же причине можно предположить, что указанные бета-казоморфиновые последовательности имеют тенденцию сохраняться после инкубирования с другими протеазами, например протеазами, которые, как правило, используются в промышленном производстве белковых гидролизатов. Это предположение подразумевает, что все широко доступные белковые гидролизаты или продукты, содержащие эти белковые гидролизаты, содержат BCM-7 или близкородственные пептиды. Поскольку пептидный фрагмент BCM-7 и родственные ему молекулы связаны с определенными заболеваниями, наличие таких молекул в белковых гидролизатах, которые достаточно часто используются в рационе питания таких групп риска как дети младшего возраста, престарелые и больные, является нежелательным. Результаты анализов связывания опиатного рецептора с человеческими и коровьими бета-казоморфинами показывают, что фрагменты, обладающие опиоидной активностью, связываются с опиатными рецепторами в мембране мозга крысы. Было показано, что бета-казеины более селективны по отношению к мю-лигандам, с небольшим сродством к дельта- и каппа- подтипам рецепторов. В соответствии с этими и другими исследованиями, утверждается, что бета-казоморфины обладают разнообразными желудочно-кишечными, болеутоляющими, респираторными, сердечно-сосудистыми, эндокринными и иммуномодулирующими воздействиями. Общая структурная особенность опиоидных пептидов, включающих остаток пролина, состоит в наличии фрагмента Tyr-Pro-Phe/Trp (Okada et al., Vitamins and Hormones 2002, 65, 257-279).
Хотя у нормальных индивидуумов пептидазы в кишечном эпителиальном слое и в крови способны справиться с расщеплением бета-казоморфинов, полагают, что это не всегда имеет место у пациентов, страдающих шизофренией, аутизмом, ADHD (синдромом дефицита внимания и гиперактивности) или другими аффективными расстройствами. Например, с появлением таких расстройств были связаны генетические изменения в ферментной активности дипептидилпептидазы плазмы IV (DPP IV), ведущие к неполному расщеплению пептидов с высоким содержанием пролина. Кроме того, постоянно обнаруживается гиперпептидурия, т.е. повышенная концентрация в моче пептидов, являющихся производными казеина или глютена (Reichelt, W.H. et al; (1997) Dev. Brain Dysfunct; 10:44-55). В настоящее время научная литература предоставляет неопровержимые доказательства того, что неполное расщепление пептидов с высоким содержанием пролина может вносить определенный вклад в развитие и тяжелое протекание подобных заболеваний. Помимо имеющегося в казеине фрагмента BCM-7, в этой связи также упоминались устойчивые к протеазам пептиды, являющиеся производными глютена. Уже в 1979 Panksepp (Trends in Neuroscience 1979; 2:174-177) предложил теорию избытка опиоидов, в которой он предположил, что нарушение метаболизма опиоидов является частью патогенеза при аутизме. В настоящее время мы понимаем, что многие пептиды с высоким содержанием пролина весьма устойчивы к расщеплению такими пептидазами желудка и поджелудочной железы, как пепсин, трипсин, химотрипсин и т.п., и что только определенные ферменты, как, например, присутствующие в числе прочих на границе ворсинок эпителиального слоя желудочно-кишечного тракта, способны гидролизовать пептидные связи, образованные пролином.
Глютен представляет собой нерастворимую фракцию белка таких зерновых культур, как пшеница, рожь, овес, ячмень, кукуруза и рис, которая остается после промывания с целью удаления крахмала и водорастворимых компонентов. Глютен может быть подразделен по растворимости на 4 основные фракции, т.е. альбумин, глобулин, проламин и глютелин. Среди перечисленных фракций проламиновые и глютелиновые фракции пшеницы, кукурузы, ячменя и овса особенно отличаются относительно высоким содержанием аминокислот пролина и глутамина. Современные данные подразумевают, что обогащенные пролином последовательности являются главным фактором в развитии целиакии. Целиакия, известная так же как глютеновая энтеропатия, представляет собой аутоиммунное заболевание тонкого кишечника, вызванное употреблением в пищу глютеновых белков. Она проявляется, как правило, в раннем детстве тяжелыми симптомами, такими как хроническая диарея и вздутие живота; в более поздний период жизни симптомы включают усталость, потерю веса из-за нарушения всасывания в пищеварительном тракте и неврологические симптомы. Среди обогащенных пролином фракций различных зерновых культур наиболее токсичными, по-видимому, являются альфа-глиадин пшеницы, гордеин ячменя, секалин ржи и авенин овса (Schuppan, D.; Gastroenterology 2000; 119:234-242). Единственным эффективным лечением пациентов с целиакией является пожизненная диета, исключающая глютен. У больных целиакией часто наблюдаются различные аутоиммунные расстройства, в особенности диабет типа 1, герпетиформный дерматит, аутоиммунный тиреоидит, расстройства, связанные с коллагеном, аутоиммунная потеря волос и аутоиммунный гепатит. Это показывает, что за счет неизвестных механизмов, не леченная целиакия вызывает предрасположенность к аутоиммунным заболеваниям других органов (Schuppan, D.; Gastroenterology 2000; 119:234-242). Более того, существуют указания на то, что легкая форма целиакии имеется у группы людей, страдающих синдромом раздраженного кишечника (IBS). IBS представляет собой расстройство, которое мешает нормальной работе толстой кишки и характеризуется спастической болью в животе, запором и диареей. IBS, как правило, начинается в возрасте около 20 лет и причиняет большое количество дискомфорта и страданий. Употребление в пищу пшеницы, ячменя, риса или молочных продуктов связано с усилением симптомов IBS.
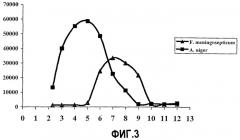
Недавно Shan и сотрудники (Science; vol.297, 27 September 2002:2275-2279) идентифицировали пептид с высоким содержанием пролина, состоящий из 33 аминокислотных остатков и являющийся производным глиадина, который, как полагают, является источником набора основных T-клеточных эпитопов, специфичных для больных целиакией. В то время как экстракт ферментов, полученный из малых пограничных клеток кишечных ворсинок, неспособен гидролизовать этот 33-мерный пептид, добавление бактериальной пролилолигопептидазы из Flavobacterium meningosepticum ведет к быстрому расщеплению с сопутствующим сильным понижением стимуляции соответствующих T-клеточных клонов. В подражание более ранним работам по пероральному введению папаина (Messer, M. и Baume, P.E.; Lancet 1976; 2:1022) статья показывает потенциал пролилолигопептидазы в качестве пищевого фермента при детоксикации глютена ферментной терапией.
Пролилолигопептидазы (EC 3.4.21.26) обладают уникальной возможностью предпочтительного расщепления пептидов с карбоксильной стороны пролиновых остатков. В пролилолигопептидазах, выделенных из млекопитающих, а также в пролилолигопептидазах, выделенных из Flavobacterium meningosepticum, был идентифицирован специфический пептидазный домен, который не позволяет крупным структурированным белкам приблизиться к активному сайту фермента. Фактически, эти ферменты не способны расщеплять белки, содержащие более чем приблизительно 30 аминокислотных остатков, поэтому такие ферменты в настоящее время носят название «пролил олигопептидазы» (Fulop et al: Cell, Vol.94, 161-170, July 24, 1998). Все известные пролилолигопептидазы являются цитозольными ферментами, оптимальное значение pH которых находится вблизи нейтрального, причем они характеризуются тем фактом, что они неспособны эффективно расщеплять молекулы, содержащие более чем приблизительно, 30 аминокислотных остатков. Тот факт, что данные ферменты демонстрируют оптимальное значение pH, которое соответствует величинам pH, преобладающим в наиболее удаленной части желудочно-кишечного тракта, делает их идеально пригодными в качестве пищевых добавок, поддерживающих процесс переваривания поступающего с пищей глютена в кишечнике.
Другим ферментом, который может оказаться полезным для инактивации токсичных пептидов, обогащенных пролином, является фермент дипептидилпептидаза IV (US2002/0041871A). Дипептидилпептидаза IV, также именуемая Xaa-Pro-дипептидиламинопептидазой (EC 3.4.14.5), катализирует отделение N-концевого дипептида Xaa-Xbb от пептида с N-концевой последовательностью Xaa-Xbb-Xcc-, в случае если Xbb предпочтительно является пролином, при условии, что Xcc не является пролином. Дипептидилпептидаза IV была выделена из большого количества источников млекопитающих, например, богатым источником этого фермента являются пограничные мембраны кишечных ворсинок. Кроме того, фермент был выделен из таких микробных источников, как пищевые микроорганизмы Saccharomyces, Lactococcus и Aspergillus. Как и пролилолигопептидазы, все известные дипептидилпептидазы IV представляют собой ферменты с почти нейтральным оптимальным значением pH и, таким образом, они подходят для поддержания процесса расщепления в кишечнике.
Благодаря возможным применениям пролин-специфичной олигопептидазы и дипептидилпептидазы IV в лечении целиакии или шизофрении, аутизма, или других аффективных расстройств, было подано несколько заявок на патенты, относящиеся к различным аспектам данной темы. Например, патенты США 6447772 и WO 01/24816 описывают композиции, содержащие дипептидилпептидазу IV, WO 03/068170 описывает композиции, содержащие пролин-специфичные олигопептидазы, необязательно объединенные с дипептидилпептидазой IV, WO 02/45523 описывает низкоаллергенные гидролизаты белков, полученные с применением пролин-специфичных эндопротеаз, и WO 03/028745 описывает композиции, содержащие бактериальные штаммы, которые способны понижать концентрацию токсичных для кишечника пептидов с высоким содержанием пролина. WO 96/36239 описывает преимущества продуктов, полученных от крупного рогатого скота, в основном, свободного от аллели бета-казеина A1.
Сущность изобретения
Настоящее изобретение относится к способу протеолитического гидролиза пептидов или полипептидов, причем упомянутые пептиды или полипептиды содержат от 4 до 40, предпочтительно от 5 до 35, аминокислотных остатков, и упомянутые пептиды или полипептиды не подвергаются гидролизу под действием субтилизина, согласно которому упомянутые пептиды или полипептиды подвергаются гидролизу под действием пролин-специфичной эндопротеазы при pH 6,5 или ниже, предпочтительно, 5,5 или ниже и более предпочтительно 5,0 или ниже, с целью гидролиза упомянутых пептидов или полипептидов. Предпочтительно, в данном способе гидролизу подвергается не менее 70%, более предпочтительно не менее 80% и, наиболее предпочтительно, не менее 90% пептида или полипептида.
В соответствии с другим вариантом осуществления, способ по настоящему изобретению относится к способам протеолитического гидролиза пептидов или полипептидов, причем указанные пептиды или полипептиды содержат от 4 до 40, предпочтительно от 5 до 35 аминокислотных остатков и включают трипептидный фрагмент Glu-Xxx-Pro, Gln-Xxx-Pro, Tyr-Pro-Phe или Tyr-Pro-Trp, согласно которому упомянутые пептиды или полипептиды подвергаются гидролизу под действием пролин-специфичной эндопротеазы при pH 6,5 или ниже, предпочтительно, 5,5 или ниже и более предпочтительно 5,0 или ниже, с целью гидролиза упомянутых пептидов или полипептидов. Предпочтительно, в данном способе гидролизу подвергается не менее 70%, более предпочтительно не менее 80% и наиболее предпочтительно не менее 90% пептида или полипептида.
Кроме того, в настоящем изобретении разработан способ протеолитического гидролиза пептидов или полипептидов, причем указанные пептиды или полипептиды содержат от 4 до 40, предпочтительно от 5 до 35 аминокислотных остатков, и аминокислотные остатки пептидов или полипептидов включают не менее 30%, предпочтительно не менее 40%, остатков пролина и/или глутамина, согласно которому упомянутые пептиды или полипептиды подвергаются гидролизу под действием пролин-специфичной эндопротеазы при pH 6,5 или ниже, предпочтительно, 5,5 или ниже и более предпочтительно 5,0 или ниже, с целью гидролиза упомянутых пептидов или полипептидов, при условии, что пептиды или полипептиды содержат не менее 10% остатков пролина. Предпочтительно, в данном способе гидролизу подвергается не менее 70%, более предпочтительно не менее 80% и наиболее предпочтительно не менее 90% пептида или полипептида.
Пептиды или полипептиды в способе по настоящему изобретению предпочтительно включают фрагмент Gln-Xxx-Pro или Glu-Xxx-Pro и содержат 9 или более аминокислотных остатков. Эти пептиды или полипептиды преимущественно гидролизуются до пептидов, содержащих 8 или менее аминокислотных остатков. В случае, если пептиды или полипептиды включают фрагмент Tyr-Pro-Phe или Tyr-Pro-Trp, предпочтительно подвергается гидролизу связь между Pro и Phe или Pro и Trp.
Предпочтительная эндопролин-специфичная эндопротеаза, применяемая в способе по настоящему изобретению, предпочтительно представляет собой пролин-специфичную эндопротеазу, полученную из Aspergillus или принадлежащую к семейству серинпротеаз S28. Данный фермент предпочтительно имеет оптимальное значение pH ниже 6,5, предпочтительно ниже 5,5, более предпочтительно ниже 5,0, для гидролиза пептидов или полипептидов, включающих от 4 до 40, предпочтительно от 5 до 35 аминокислотных остатков, которые не подвергаются гидролизу под действием субтилизина.
Пролин-специфичные эндопротеазы могут применяться при значениях pH ниже 5,5 для гидролиза пептидов с высоким содержанием пролина, которые имеют отношение к психиатрическим расстройствам, включая аутизм, шизофрению, ADHD, биполярное аффективное расстройство и депрессию, а также расстройства, связанные с целиакией, такие как аутоиммунные расстройства, в особенности, диабет 1 типа, герпетиформный дерматит, аутоиммунный тиреоидит, заболевания, связанные с коллагеном, аутоиммунную потерю волос, а также аутоиммунный гепатит и IBS.
Этот фермент преимущественно применяется для производства пищевых продуктов, например, пива или хлеба, которые не содержат связанных с целиакией эпитопов, предпочтительно глютеновых эпитопов, более предпочтительно, эпитопов пшеницы или ячменя.
Настоящее изобретение также относится к применению пролин-специфичной эндопротеазы, которая, предпочтительно, представляет собой фермент Aspergillus, более предпочтительно Aspergillus niger, в качестве лекарственного средства или к применению в производстве лекарственных средств.
В соответствии с другим вариантом осуществления настоящего изобретения, пролин-специфичную эндопротеазу применяют для производства пищевых добавок или лекарственных средств для лечения или профилактики психиатрических расстройств, включая аутизм, шизофрению, ADHD, биполярное аффективное расстройство и депрессию, а также расстройств, связанных с целиакией, как, например, аутоиммунных расстройств, в особенности диабета 1 типа, герпетиформного дерматита, аутоиммунного тиреоидита, заболеваний, связанных с коллагеном, аутоиммунной потери волос, а также аутоиммунного гепатита и IBS.
Пролин-специфичная эндопротеаза преимущественно применяется для производства пищевых добавок или медикаментов для индивидуумов, не достигших 25-летнего возраста.
В соответствии с настоящим изобретением пролин-специфичная эндопротеаза также применяется для получения пищевых добавок или лекарственных средств, предназначенных для лечения или профилактики психиатрических расстройств, включая аутизм, шизофрению, ADHD, биполярное аффективное расстройство и депрессию, а также расстройств, связанных с целиакией, как, например, аутоиммунных расстройств, в особенности диабета 1 типа, герпетиформного дерматита, аутоиммунного тиреоидита, заболеваний, связанных с коллагеном, аутоиммунной потери волос, а также аутоиммунного гепатита и IBS.
Кроме того, настоящее изобретение относится к применению пролин-специфичной эндопротеазы для гидролиза белков или пептидов, включающих более 30 аминокислотных остатков. В целях, соответствующих настоящему изобретению, предпочтительно применяется пролин-специфичная эндопротеаза Aspergillus, более предпочтительно A. niger.
Настоящее изобретение также относится к применению пролин-специфичной протеазы, которая активна при pH 5 или ниже 5 в присутствии пепсина.
Настоящее изобретение преимущественно относится к способу протеолитического гидролиза указанных пептидов или белков, присутствующих в числе молочных белков, полученных от крупного рогатого скота, несущего аллели бета-казеина A1 или бета-казеина A2.
Кроме этого в способе по настоящему изобретению могут быть использованы белки. Во-первых, белок должен подвергаться гидролизу до пептидов, включающих от 4 до 40 аминокислотных остатков. Гидролиз белка должен быть осуществлен до процесса гидролиза по настоящему изобретению или одновременно с ним.
Помимо этого настоящее изобретение относится к применению пролин-специфичной эндопротеазы, имеющей оптимальное значение pH ниже 6,5, предпочтительно, ниже 5,5, более предпочтительно ниже 5,0, в качестве пищевой добавки, в качестве лекарственного средства, для производства пищевых добавок, для производства лекарственных средств или для производства корма, включая корм домашних животных, предназначенного для животных, предпочтительно млекопитающих, не являющихся человеком.
Подробное описание изобретения
Цели предыдущего уровня техники, в основном, заключались либо в удалении из пищи токсичных пептидов с высоким содержанием пролина до ее употребления, либо в пероральном введении корректирующих ферментов для компенсации неправильного процесса пищеварения в кишечнике. Подразумевается, что в нормальном процессе желудочно-кишечного пищеварения, первой стадией расщепления поступающих с пищей белков является протеолиз в желудке под действием фермента пепсина. Вторая стадия осуществляется в тонком кишечнике, т.е. двенадцатиперстной кишке и тощей кишке, расположенных непосредственно вслед за желудком. В двенадцатиперстной кишке происходит увеличение кислотного pH содержимого желудка за счет добавления соков поджелудочной железы, содержащих также большое количество эндо- и карбоксипептидаз. Катализируемое этими ферментами дальнейшее расщепление разрушенных пепсином пищевых белков осуществляется в полости двенадцатиперстной кишки и тощей кишки при значениях pH более 5. Перед транспортом через стенку кишечника происходит третья стадия, которая включает дальнейший гидролиз пептидов в пограничной поверхностной мембране ворсинок кишечного эпителия. Данная стадия осуществляется целым рядом протеаз, включающим DPP IV, которые локализованы в мембранах этих эпителиальных клеток. В предыдущем уровне техники предполагалось, что в кишечнике индивидуумов, страдающих некоторыми заболеваниями, на которые нацелено настоящее изобретение, некоторые из этих эпителиальных ферментов и, в особенности, DPP IV являются частично неактивными или даже вообще отсутствуют. У пациентов с целиакией уровни этих эпителиальных ферментов, вероятно, являются нормальными, но у этой группы индивидуумов даже небольшие количества определенных пептидов с высоким содержанием пролина могут спровоцировать сильный воспалительный T-клеточный ответ. Имевшееся в предшествующем уровне техники решение заключалось в том, что для минимизации уровней токсичных пептидов с высоким содержанием пролина, присутствующих в полости кишечника, в полость кишечника человека вводились корректирующие энзимы, предназначенные для перорального приема. В рамках этого подхода, в предшествующем уровне техники выбирались ферменты, как можно более близкие к природным ферментам человека, т.е. ферменты, которые активны в кишечнике при pH превышающем 5. Эти ферменты известного уровня техники неактивны в кислой среде, или же лекарственные формы для перорального введения, содержащие эти ферменты известного уровня техники, снабжены соответствующим покрытием, чтобы предотвратить их активность в кислой среде.
Авторы настоящего изобретения обнаружили, что ферменты, развивающие основную активность в условиях кислой среды желудка, предлагают лучшее решение проблемы неэффективного расщепления пептидов с высоким содержанием пролина. Данный подход является новым и открывает возможность применения для решения данной проблемы других ферментов, помимо известных в литературе.
Как обсуждалось выше, несколько публикаций были направлены на возможности применения для профилактики нарушенного метаболизма опиоидов таких ферментов, как дипептидилпептидаза IV и пролилолигопептидаза. Для этого выбраны ферменты дипептидилпептидаза IV и пролилолигопептидаза, которые, как правило, активны при значениях pH, близких к нейтральным. Смысл этого заключается в том, что указанные ферменты будут эффективно гидролизовать обогащенные пролином белки только при значениях pH выше 5. Принимая во внимание pH-профиль желудочно-кишечного тракта человека, эти ферменты известного уровня техники не станут активными до достижения дистальной части двенадцатиперстной кишки, т.е. далеко за пределами желудка. Однако дистальная часть двенадцатиперстной кишки является основным участком абсорбции белков и, как также известно, она подвергается поражению у пациентов с целиакией. Таким образом, фактически ферменты известного уровня техники начнут работать там, где уже нанесена часть ущерба.
Кроме того, ферменты известного уровня техники становятся активными только после значительного предварительного разрушения белков с высоким содержанием пролина. Время, требуемое для достижения этого предварительного разрушения под действием ферментов поджелудочной железы, еще больше ограничивает период времени, который имеется у перорально применяемых ферментов для полного гидролиза последовательностей с высоким содержанием пролина. В соответствии с настоящим изобретением применяется фермент, который способен расщеплять большинство белковых последовательностей с высоким содержанием пролина и/или глутамина до того, как пища поступает в тонкий кишечник. Обычное время пребывания пищи в желудке обеспечивает период времени, необходимый для достаточного гидролиза белков с высоким содержанием пролина или глутамина. Более того, в соответствии с настоящим изобретением предпочтительно применяется фермент, который способен расщеплять пептиды с карбоксильной стороны пролиновых остатков и, кроме того, способен расщеплять интактные белки с карбоксильной стороны пролиновых остатков, даже в присутствии пепсина. Ферменты известного уровня техники будут гидролизованы в условиях низкого pH желудка и под действием протеолитического фермента пепсина, который секретируется в желудке. Однако вплоть до настоящего момента в рамках описываемого способа неизвестно применение подобных ферментов, устойчивых к кислоте/пепсину. Подход, примененный в настоящем изобретении, приведет к значительному расщеплению пептидов, полипептидов и белков с высоким содержанием пролина еще до достижения кишечника, вместо подхода известного уровня техники, который предлагает имитировать естественный процесс гидролиза пептидов с высоким содержанием пролина в кишечнике. Предпочтительный фермент, применяемый в способе по настоящему изобретению, представляет собой фермент, который проявляет активность при значениях pH ниже 5 в присутствии пепсина, и который способен расщеплять пищевые белки или полипептиды, а также пептиды. Решения известного уровня техники во всех случаях нуждаются в коферменте, который осуществляет предварительный гидролиз пищевого белка до пептидов, и только после этого дополнительные пролин-специфичные ферменты могут начать проявление своей активности.
Термины «пептид» или «олигопептид» в рамках настоящей заявки определены как цепи, содержащие от двух до тридцати аминокислотных остатков, связанных пептидными связями. Термины «пептид» и «олигопептид» считаются синонимами (что соответствует общепринятому толкованию), и каждый из этих терминов может применяться вместо другого в зависимости от контекста. В рамках настоящей заявки «полипептид» определен как цепь, содержащая более 30 аминокислотных остатков.
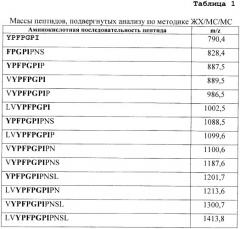
Подразумевается, что пептиды или полипептиды, включающие от четырех до сорока аминокислотных остатков, которые не подвергаются гидролизу под действием субтилизина (EC 3.4.21.62), предпочтительно субтилизина Carlsberg, являются пептидами или полипептидами, которые остаются интактными после инкубирования в течение 2 часов при pH 8,0 и 60°C в суспензии или растворе, содержащем 20 г/л белка, причем соотношение фермента к субстрату составляет 0,12 AU-A (Алкалазных единиц по Anson) протеазных единиц на грамм белка. AU-A протеазная единица определена, в соответствии с указанным в Analytical Method LUNA #2003-32153-01, выпущенным Novozymes (Denmark). Интактный означает, что после инкубирования исходный пептид или полипептид образует более 80%, предпочтительно, более 90%, более предпочтительно, более 95% итоговых продуктов ферментной реакции. Практически ферментное расщепление выполняют при указанных условиях, используя 40 микролитров алкалазы на грамм имеющегося белкового субстрата. Примером такого не подвергающегося гидролизу пептида является пептид VYPFPGPIPN, образующийся при гидролизе бета-казеина, который описан в примере 4. Другим примером подобного, не подвергающегося гидролизу полипептида, является 33-мерный продукт, описанный в примере 6.
Олигопептидаза представляет собой фермент, классифицируемый как EC 3.4.21.26 и принадлежащий к семейству серинпротеаз род SC, семейство S9.
Все формулы или последовательности (олиго)пептидов и полипептидов записаны в настоящей заявке слева направо в направлении от амино-конца к карбокси-концу, в соответствии с общепринятой практикой. Буквенные коды аминокислот, используемые в заявке, общеизвестны в технике и могут быть найдены в Sambrook, et al. (Molecular Cloning: A Laborotary Manual, 2nd ed. Cold Spring Harbor Laborotary, Cold Spring Harbor Laborotary Press, Cold Spring Harbor, NY, 1989). Подразумевается, что аминокислоты Xxx, Xaa, Xbb или Xcc могут являться любыми аминокислотами. Под термином «фрагмент» подразумевается последовательность аминокислот, которая является частью пептида, полипептида или белка. В настоящей заявке имеется в виду, что глутамин (Q или Gln) является глутамином или глутаматом (E или Glu). Например, в химически дезамидированном глютене значительная часть имевшихся природных глутаминовых остатков превращена в форму глутамата. Следовательно, фрагмент Gln-Xxx-Pro также включает фрагмент Glu-Xxx-Pro. Кроме этого, в других пептидах, полипептидах или белках глутамин может быть превращен в глутамат, например, благодаря значению pH среды, температуре или с помощью ферментной реакции, например, под действием трансглутаминазы.
Под пептидом или полипептидом с высоким содержанием пролина (обогащенным пролином) имеется в виду пептид или полипептид, содержащий от 4 до 40 аминокислотных остатков, причем аминокислотные остатки пептида или полипептида включают не менее 30%, предпочтительно не менее 40%, пролиновых и/или глутаминовых остатков, при условии, что пептид или полипептид содержит не менее 10% пролиновых остатков. «Пищевая добавка», согласно адаптированному определению DSHEA, представляет собой продукт (не являющийся табаком), который предназначен для дополнения рациона питания, который несет в себе или содержит один или несколько из следующих ингредиентов рациона питания: белки, включая ферменты, полипептиды, пептиды, витамины, минералы, травы или другие растительные компоненты, аминокислоты, питательные вещества, предназначенные для использования человеком с целью дополнить рацион питания путем увеличения общего потребления, или же концентрат, метаболит, составная часть экстракт или комбинации указанных ингредиентов.
Кроме того, пищевые добавки:
- предназначены для приема внутрь в пилюлях, капсулах, таблетках или в виде жидкости;
- не предназначены для использования в качестве обычной пищи или в качестве единственной принимаемой пищи или диеты;
- в основном имеют маркировку «пищевая добавка»;
- включают такие продукты, как утвержденные новые лекарства, сертифицированные антибиотики или лицензированные биологические продукты, которые имелись на рынке в качестве пищевых добавок или пищевых продуктов до их утверждения, сертификации или лицензирования (если министр здравоохранения и социальных служб не отказал в подобном утверждении).
Токсичные пептиды или полипептиды с высоким содержанием пролина представляют собой пептиды или полипептиды, вовлеченные в связывание с опиоидными рецепторами или же в развитие или увеличение тяжести психиатрических расстройств или целиакии.
Психиатрические расстройства включают аутизм, шизофрению, ADHD, биполярное аффективное расстройство, а также депрессию.
Расстройства, связанные с целиакией, представляют собой аутоиммунные расстройства, в особенности диабет 1 типа, герпетиформный дерматит, аутоиммунный тиреоидит, заболевания, связанные с коллагеном, аутоиммунную потерю волос и аутоиммунный гепатит.
Международно-признанные схемы классификации и номенклатура всех ферментов, утвержденная IUMB, включает протеазы. Регулярно обновляемый текст IUMB с указанием номеров EC протеаз может быть найден на Интернет сайте. В данной системе ферменты определены тем фактом, что они катализируют единственную реакцию. Система подразделяет протеазы на эндо- и экзопротеазы. К эндопротеазам относят те ферменты, которые осуществляют гидролиз внутренних пептидных связей, экзопротеазы гидролизуют пептидные связи, расположенные рядом с концевой α-аминогруппой («аминопептидазы») или пептидные связи между концевой карбоксильной группой и предпоследней аминокислотой («карбоксипептидазы»). Эндопротеазы подразделены на под-подклассы на основании каталитического механизма. Существуют под-подклассы серинэндопротеаз (EC 3.4.21), цистеинэндопротеаз (EC 3.4.22), аспарагиновых эндопротеаз (EC 3.4.23), металлоэндопротеаз (EC 3.4.24) и треонинэндопротеаз (EC 3.4.25).
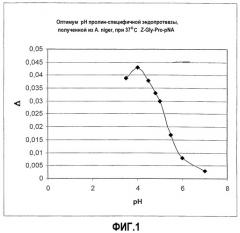
В WO 02/45524 описаны пролин-специфичные эндопротеазы, полученные из Aspergillus niger. Авторы настоящего изобретения неожиданно обнаружили, что эти ферменты Aspergillus успешно применимы в способе по настоящему изобретению в условиях кислой среды в желудке и могут гидролизовать в этих условиях поступающие с пищей интактные белки, полипептиды, а также меньшие пептидные молекулы. Помимо этого, данный фермент не разрушается в присутствии фермента пепсина в кислой среде и, вероятно, продолжает свою деятельность на протяжении всей двенадцатиперстной кишки. Авторы показали, что пролин-специфичная эндопротеаза, выделенная из A. niger, полностью отличается от известных пролин-специфичных протеаз, а также от глютеназ, описанных в WO 03/068170, с точки зрения активности, а также с эволюционной точки зрения. Последняя особенность в достаточной степени демонстрируется тем фактом, что гомология аминокислотных последовательностей между глютеназой, описанной в WO 03/068170, и ферментом, выделенным из A. niger, составляет, как правило, менее 20% при использовании общего алгоритма анализа совпадения последовательностей. Данный результат согласуется с современной точкой зрения, что пролилолигопептидазы не встречаются в таких грибках, как Aspergillus niger, из которых в соответствии с настоящим изобретением выделена пролин-специфичная эндопротеаза (Venäläinen, J.I. et al, Eur J Biochem 271, 2705-2715 (2004)).
Под пролин-специфичной эндопротеазой по настоящему изобретению или примененной по настоящему изобретению подразумевается, например, полипептид, упомянутый в пп.1-5, 11 и 13 формулы изобретения заявки WO 02/45524, которая включена в настоящую заявку в качестве ссылки. Следовательно, эта пролин-специфичная эндопротеаза представляет собой полипептид, который обладает пролин-специфичной эндопротеолитической активностью, выбранный из группы, состоящей из:
(a) полипептида, обладающего аминокислотной последовательностью, которая, по крайней мере, на 40% идентична аминокислотной последовательности, включающей аминокислоты с 1 по 526 из SEQ ID NO:2, или ее фрагменту;
(b) полипептида, кодируемого полинуклеотидом, который гибридизуется в условиях пониженной жесткости с (i) последовательностью нуклеиновых кислот SEQ ID NO:1 или ее фрагментом, который идентичен не менее чем на 80% или 90% на участке более 60, предпочтительно, более 100 нуклеотидов, более предпочтительно, идентичен не менее чем на 90% на участке более 200 нуклеотидов, или (ii) последовательностью нуклеиновых кислот, комплементарной последовательности нуклеиновых кислот SEQ ID NO:1. Последовательности SEQ ID NO:1 и SEQ ID NO:2 соответствуют приведенным в WO 02/45524. Полипептид предпочтительно присутствует в изолированной форме.
Предпочтительный полипептид имеет аминокислотную последовательность, которая не менее чем на 50%, предпочтительно, не менее чем на 60%, предпочтительно, не менее чем н