Кристаллическая форма хинолинового соединения и способ получения данного соединения в указанной форме
Иллюстрации
Показать всеИзобретение относится к новому кристаллу (кристаллическая форма А) соединения формулы (1):
который содержит от 5 до 15% воды и который, при порошковой рентгеновской дифракции, измеренной с применением CuKα-излучения, демонстрирует пик с относительной интенсивностью более 25% при угле дифракции (2θ), равном 30,16°. Изобретение также относится к способу получения кристалла (кристаллической формы А) по п.1, к способу получения лекарственной субстанции кристалла (кристаллической формы А) по п.1, а также к фармацевтической композиции. Технический результат - получение нового биологически активного соединения, обладающего способностью к ингибированию HMG-CoA-редуктазы. 4 н.п. ф-лы, 2 ил., 1 табл.
Реферат
Настоящее изобретение касается кристаллической формы питавастатинкальция, известного под химическим названием монокальций бис[(3R,5S,6E)-7-(2-циклопропил-4-(4-фторфенил)-3-хинолил)-3,5-дигидрокси-6-гептеноат], полезного для лечения гиперлипемии, в качестве ингибитора HMG-CoA-редуктазы, а также способа получения указанного соединения и фармацевтической композиции, включающей эту форму соединения и фармацевтически приемлемый носитель.
В частности, изобретение касается питавастатинкальция в кристаллической форме, характеризующейся содержанием воды от 5 до 15% (масс/масс), полезной в качестве лекарственной субстанции для фармацевтических препаратов, с точки зрения стабильности и проч., способа получения этого соединения в указанной форме и фармацевтической композиции, включающей эту форму соединения.
ОБОСНОВАНИЕ ИЗОБРЕТЕНИЯ
Питавастатинкальций (смотри патентные документы 1, 2 и 3) выпускается промышленностью в качестве антигиперлипемического лекарственного средства, а в качестве способа получения указанного соединения уже описан способ разделения оптических изомеров с применением оптически активного α-метилбензиламина (смотри патентный документ 4 и не патентный документ 1).
Известными способами получения соединения формулы (3) в качестве исходного материала являются:
•хроматографическое разделение на колонке для разделения оптических изомеров (смотри патентный документ 5),
•асимметрический синтез (смотри патентные документы 6 и 7),
•способ химического син-восстановления соединения формулы (4), которое может быть получено с применением хирального синтона (смотри патентный документ 8),
•способ биологического син-восстановления соединения формулы (4) (смотри патентный документ 9) и
•разделение оптических изомеров с использованием фермента (смотри патентный документ 10).
где R означает С1-4-алкильную группу.
где R означает С1-4-алкильную группу.
Патентный документ 1: JP-A-1-279866
Патентный документ 2: EP304063A
Патентный документ 3: патент США № 5.011.930
Патентный документ 4: JP-A-5-148237
Патентный документ 5: W095/23125
Патентный документ 6: W003/042180
Патентный документ 7: JP-A-8-092217
Патентный документ 8: JP-A-8-127585
Патентный документ 9: JP-A-2002-300897
Патентный документ 10: JP-A-13-352996
Не патентный документ 1: Bioorganic & Medicinal Chemistry Letters, 9 (1999), p. 2977
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
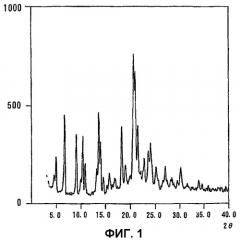
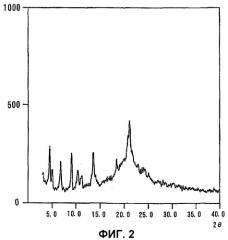
С точки зрения сохранности, необходимо, чтобы лекарственная субстанция для фармацевтических средств была высокого качества и имела устойчивую кристаллическую форму, кроме того, указанная субстанция должна характеризоваться большим сроком службы, позволяющим осуществлять производство в промышленном масштабе. Однако в числе общепринятых способов получения питавастатинкальция отсутствует описание, касающееся влагосодержание или кристаллической формы. Установлено, что если питавастатинкальций (кристаллическая форма A) высушить обычным способом, кристалличность его будет снижаться до состояния, близкого к аморфному, как свидетельствует фиг. 2, где содержание воды не превышает 4%, даже в случае питавастатинкальция, характеризовавшегося до сушки порошковой рентгеновской дифракцией, приведенной на фиг. 1.
К тому же обнаружено, что питавастатинкальций, становясь аморфным, характеризуется очень низкой устойчивостью при хранении, как показано в таблице 1.
| ТАБЛИЦА 1 Данные по устойчивости лекарственной субстанции (влияние влагосодержания воды) | |||||
| Условия хранения | Измеряемый параметр | Период хранения | |||
| Начальн.стадия | 30дней | 60дней | 90дней | ||
| Герметичнозакрытое,40°С | Содержание воды (%) | 7,89 | 7,85 | 7,88 | 7,81 |
| Аналогичнаясубстанция (%) | 0,179 | 0,208 | 0,189 | 0,211 | |
| Питавастатинкальций (%) | 99,38 | 99,42 | 99,79 | 99,64 | |
| Открытыйвоздух | Содержание воды (%) | 7,89 | 2,45 | 1,99 | 1,77 |
| Аналогичнаясубстанция (%) | 0,179 | 0,742 | 1,347 | 2,099 | |
| Питавастатинкальций (%) | 99,38 | 99,26 | 97,19 | 96,49 |
Цель настоящего изобретения состоит в получении кристаллической лекарственной субстанции питавастатинкальция, устойчивой даже без хранения в специальных условиях, и, кроме того, позволяет осуществлять производство в промышленных масштабах.
Заявителями проведено обширное исследование по изучению взаимосвязи между содержанием влаги и устойчивостью лекарственной субстанции, в результате чего установлено, что устойчивость питавастатинкальция может быть заметно улучшена путем регулирования содержания воды в лекарственной субстанции в определенных пределах. Кроме того, обнаружено, что существует три типа кристаллических форм с одним и тем же содержанием воды, и из числа этих форм кристалл (кристаллическая форма A), охарактеризованный порошковой рентгеновской дифракцией, измеренной с использованием CuKα-лучей, наиболее предпочтителен в качестве лекарственной субстанции для фармацевтических средств. Настоящее изобретение основано на указанных открытиях.
А именно настоящее изобретение обеспечивает.
1. Кристалл (кристаллическая форма A) соединения формулы (1):
который содержит от 5 до 15% воды и который дает, при порошковой рентгеновской дифракции, измеренной с применением CuKα-излучения, демонстрирует пик с относительной интенсивностью свыше 25% при угле дифракции (2θ), равном 30,16°.
2. Способ получения кристалла (кристаллической формы A) по пункту 1, который включает добавление соединения кальция к соединению формулы (2):
где M+ означает ион щелочного металла, растворенного в воде или С1-4-спирте, содержащем, по меньшей мере, 60% воды.
3. Способ получения лекарственной субстанции кристалла (кристаллической формы A) по пункту 1, который включает регулирование содержания воды на уровне от 5 до 15%.
4. Фармацевтическую композицию, содержащую кристалл (кристаллическую форму A) по пункту 1.
Два типа кристаллических форм, отличных от кристаллической формы A, представлены кристаллическими формами B и C, но ни одна из указанных форм не дает пиков при углах дифракции 10,40°, 13,20° и 30,16°, характеризующих кристаллическую форму A, это служит доказательством того, что кристаллические формы являются кристаллическими полиморфами. Очевидно, что такие кристаллические формы характеризуются низкой фильтрационной способностью, требуют строгого соблюдения условий сушки (возможно, подвергаются изменению в кристаллической форме во время сушки), вероятно, включают неорганическую субстанцию, такую как NaCl, и не обязательно способны к сохранению воспроизводимости в контроле кристаллической форме. Таким образом, этим формам свойственно множество недостатков с точки зрения промышленного способа получения, и кристаллическая форма A является наилучшей лекарственной субстанцией для фармацевтических средств.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет порошковую рентгенограмму кристаллической формы A, где содержание воды равно 8,78%.
Фиг.2 представляет порошковую рентгенограмму для случая, когда кристаллы, используемые для получения фиг.1, высушены с целью доведения содержания воды до 3,76%.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение описано более подробно.
Питавастатинкальций, имеющий кристаллическую форму A, охарактеризован с помощью порошковой рентгенограммы.
| Угол дифракции(2θ)(°) | d-период решетки | Относительная интенсивность (>25%) |
| 4,966,729,0810,4010,8813,2013,6013,9618,3220,6821,5223,6424,1227,0030,16 | 17,799913,14239,73148,49918,12486,70206,50536,33874,83864,29154,12593,76043,68663,29962,9607 | 35,955,133,334,827,327,848,860,056,7100,057,441,345,028,530,6 |
Аппаратура:
Приборы для измерения порошковой рентгеновской дифракции: MXLabo (производство MacScience)
Источник излучения: Cu, длина волны: 1,54056 Å, гониометр: вертикальный гониометр
Монохроматор: используемые вспомогательные приборы: Nil, напряжение рентгеновской трубки: 50,0 кВ, Ток разряда: 30,0 мА
Способ измерения:
Перед измерением настройку рентгеновской трубки тестируют, используя кремний (стандартное вещество).
Около 100 мг образца помещают на стеклянную предметную пластину, сплющивают с последующим измерением в следующих условиях.
Диапазон данных: от 3,0400 до 40,0000 град.,
Число точек на графике: 925
Ось сканирования: 2θ/θ, угол оси θ: нет
Интервал измерения: 0,0400 град.,
Скорость сканирования: 4,800 град./мин
Настоящее изобретение также касается способа получения питавастатинкальция с контролируемой кристаллической формой А.
Исходным материалом является соль щелочного металла и питавастатина, представленная формулой (2), и щелочным металлом, например, может быть литий, натрий или калий, предпочтительно натрий.
В качестве соединения кальция хлорид кальция или ацетат кальция, например, может быть предпочтителен, и количество такого соединения изменяется в пределах от 0,3 до 3 молей, преимущественно от 0,5 до 2 молей на моль соединения формулы (2).
Соль щелочного металла и питавастатина, формулы (2), может быть необязательно выделена. Например, Ca-соль может быть получена как продолжение по реакции гидролиза, например, соединения формулы (3).
В качестве используемого растворителя предпочтительны вода или С1-4-спирт, содержащий, по меньшей мере, 60% воды. С1-4-спиртом может быть, например, метиловый спирт, этиловый спирт, н-пропиловый спирт, изопропиловый спирт, н-бутиловый спирт, изобутиловый спирт, вторбутиловый спирт или третбутиловый спирт.
Количество используемого растворителя обычно изменяется в пределах от кратного по массе, предпочтительно, в пределах от 5- до 30-кратного по массе от 3- до 100- количества соединения формулы (2).
Температура кристаллизации не имеет особых ограничений, но обычно находится в пределах от -10 до 70°C, предпочтительно в пределах от -5 до 40°C, более предпочтительно в пределах от 0 до 20°C.
Время кристаллизации не имеет особых ограничений, но обычно для кристаллизации достаточно времени приблизительно от 30 минут до 15 часов.
В качестве способа кристаллизации, например, может быть упомянут способ проведения кристаллизации при стоянии (в покое) или способ кристаллизации при перемешивании. Однако предпочтительно проводить кристаллизацию при перемешивании.
Кроме того, если требуемо, может быть использована затравка из кристаллов формы A.
Осажденные кристаллы затем фильтруют и сушат. По настоящему изобретению очень важно регулировать содержание воды. Температура сушки не имеет особых ограничений, но предпочтительно находится в пределах от 15 до 40°C.
Содержание воды регулируют таким образом, чтобы конечная величина была в пределах от 5 до 15% (масс/масс), предпочтительно в пределах от 7 до 15% (масс/масс), более предпочтительно в пределах от 7 до 13% (масс/масс), наиболее предпочтительно в пределах от 9 до 13% (масс/масс).
Полученный питавастатинкальций измельчают в порошок и затем используют в качестве лекарственной субстанции для фармацевтических средств.
Введение соединения по настоящему изобретению может быть, например, парентеральным, в форме лекарственного средства для инъекций (подкожной, внутривенной, внутримышечной или внутрибрюшинной инъекции), мази, суппозитория или аэрозоля и тому подобного, или пероральным, в форме таблеток, капсул, гранул, пилюль или лекарственного сиропа, жидкого лекарства, лекарственной эмульсии или лекарственной суспензии.
Фармацевтическая композиция или композиция для ветеринарии, содержащая соединение по настоящему изобретению, содержит приблизительно от 0,001 до 30%, предпочтительно от 0,01 до 10% соединения по настоящему изобретению в расчете на общую массу композиции.
В дополнение к соединению по настоящему изобретению или композиции, содержащей такое соединение, может быть включено другое фармацевтически или ветеринарно-активное соединение.
Клиническая доза соединения по настоящему изобретению может изменяться, например, в зависимости от возраста, массы тела, чувствительности пациента или тяжести симптома. Однако эффективная доза обычно соответствует уровню от 0,003 до 100 мг, предпочтительно от 0,01 до 10 мг в день для взрослого. Тем не менее, при необходимости, может быть использована доза, выходящая за указанные пределы.
Соединение по настоящему изобретению может быть сформулировано для введения согласно общепринятому способу получения лекарственных препаратов. А именно таблетки, капсулы, гранулы или пилюли для перорального введения могут быть сформулированы с использованием, например, наполнителя, такого как сахароза, лактоза, глюкоза, крахмал или маннит; связующего вещества, такого как гидроксипропилцеллюлоза, сироп, гуммиарабик, желатин, сорбит, трагакантовая камедь, метилцеллюлоза или поливинилпирролидон; дезинтегрирующего средства, такого как крахмал, карбоксиметилцеллюлоза или кальциевая соль карбоксиметилцеллюлозы, тонкокристаллическая целлюлоза или полиэтиленгликоль; скользящего вещества, такого как тальк, стеарат магния или кальция, или диоксид кремния; смазывающего вещества, такого как лаурат натрия или глицерин.
Лекарственное средство для инъекции, жидкое лекарственное средство, лекарственное средство в виде эмульсии, суспензии, сиропа и аэрозоля может быть получено, например, с использованием растворителя для активного ингредиента, такого как вода, этиловый спирт, изопропиловый спирт, пропиленгликоль, 1,3-бутиленгликоль или полиэтиленгликоль; поверхностно-активного вещества, такого как эфир сорбита и жирной кислоты, полиоксиэтиленовый эфир сорбита и жирной кислоты, полиоксиэтиленовый эфир гидрированного касторового масла или лецитин; суспендирующего средства, такого как карбоксиметилнатриевая соль или производное целлюлозы, такое как метилцеллюлоза, камедь трагаканта, природный каучук, такой как гуммиарабик; консерванта, такого как п-гидроксибензоат, бензалконийхлорид или соль сорбиновой кислоты.
Для мази, представляющей собой чрескожный состав абсорбционного типа, могут быть использованы, например, медицинский вазелин, жидкий вазелин, высший спирт, мазь макрогол, материалы на основе гидрофильной мази или водного геля.
Суппозиторий может быть получен с применением, например, таких веществ, как масло какао, полиэтиленгликоль, ланолин, триглицерид жирных кислот, кокосовое масло или полисорбат.
Далее настоящее соединение описано более подробно с помощью примера. Однако понятно, что рассматриваемое изобретение далеко не ограничивается этим конкретным примером.
Используемое в примере соединение (5) получают по способу, описанному в W095/23125.
ПРИМЕР 1
2,71 кг (6,03 моль) соединения (5) растворяют в 50 кг этанола при перемешивании, и после того, что раствор достоверно становится однородным, добавляют 58,5 кг воды. После охлаждения до температуры в пределах от -3 до 3°C, добавляют по каплям 3,37 литра водного раствора гидроксида натрия концентрации 2 моль/литр с последующим перемешиванием при той же температуре в течение 3 часов до завершения реакции гидролиза. С целью включения всего количества водного раствора гидроксида натрия в реакционную систему добавляют 4,70 кг воды.
Реакционную смесь перегоняют при пониженном давлении для удаления растворителя, и после удаления 52,2 кг смеси этанол/вода внутреннюю температуру регулируют в пределах от 10 до 20°C. В полученный концентрированный раствор добавляют по каплям отдельно полученный водный раствор хлорида кальция (95%-CaCl2 775 г/вода 39,3 кг, 6,63 моль) за период в 2 часа. С целью включения всего количества водного раствора хлорида кальция в реакционную систему используют 4,70 кг воды. После завершения прикапывания перемешивание при той же температуре продолжают еще в течение 12 часов, после чего осадившиеся кристаллы собирают фильтрованием. Кристаллы промывают 72,3 кг воды и затем сушат при пониженном давлении в сушильной установке при 40°C, обращая внимание на температуру продукта, пока содержание воды не достигнет 10%, что приводит к получению 2,80 кг (выход: 95%) питавастатинкальция в виде белых кристаллов.
То, что кристаллы имеют кристаллическую форму A, подтверждено порошковой рентгеновской дифракцией.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Согласно настоящему изобретению разработан промышленный способ получения кристаллической лекарственной субстанции питавастатинкальция, обладающей превосходной устойчивостью.
1. Кристалл (кристаллическая форма А) соединения формулы (1): который содержит от 5 до 15% воды и который при порошковой рентгеновской дифракции, измеренной с применением CuKα-излучения, демонстрирует пик с относительной интенсивностью более 25% при угле дифракции (2θ), равном 30,16°.
2. Способ получения кристалла (кристаллической формы А) по п.1, который включает добавление хлорида кальция или ацетата кальция к соединению формулы (2): где М+ означает ион щелочного металла, растворенному в воде или С1-4-спирте, содержащем, по меньшей мере, 60% воды.
3. Способ получения лекарственной субстанции кристалла (кристаллической формы А) по п.1, который включает доведение содержания воды до уровня от 5 до 15%, включающий сушку продукта, полученного в п.2, при температуре в пределах от 15 до 40°С.
4. Фармацевтическая композиция, которая полезна для лечения гиперлипемии или в качестве ингибитора HMG-CoA-редуктазы, содержащая кристалл (кристаллическую форму А) по п.1.