Производные n-фенил-2-пиримидинамина
Иллюстрации
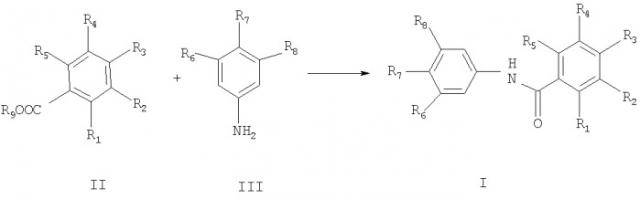
Показать всеНастоящее изобретение относится к новым соединениям формулы I
в которой R3 представляет собой (4-метилпиперазинил)метил и остальные четыре радикала R1, R2, R4, и R5 независимо представляют собой водород, циано; низший алкил; гидрокси- или аминозамещенный низший алкил; трифторметил; свободную или этерифицированную гидроксигруппу; (низший)алкокси; (низший)алканоилокси; аминогруппу - свободную, алкилированную или ацилированную; моно- или ди(низший)алкиламино; (низший)алканоиламино; бензоиламино; свободную или этерифицированную карбоксигруппу; (низший)алкоксикарбонил и галоген; R6 означает галоген, NH2, NO2, NHC(O)CF3, NHC(O)CH3 или NHC(NH)NH2, R7 означает метил и R8 означает водород, или к его соли, или к его кристаллической форме, к способу его получения, к его применению для получения соединения формулы IV, а также к фармацевтической композиции для лечения лейкемии на основе вышеописанных соединений. Технический результат: получены и описаны новые соединения, которые могут найти свое применение в получении соединений-ингибиторов тирозинкиназы рецептора эпидермального фактора роста (EGF). 5 н. и 8 з.п.ф-лы.
Реферат
Настоящее изобретение предоставляет новые амиды, способ получения этих амидов и применение этих амидов.
В частности, настоящее изобретение предоставляет новые амиды формулы I
в которой
один из радикалов R1, R2, R3, R4 и R5 представляет собой
а) радикал, выбранный из группы, состоящей из низшего алкила, амино; моно- или ди(низший)алкиламино; низшего алканоиламино; низшего алкоксикарбонила; низшего алкила, который замещен амино, моно- или ди(низший)алкиламиногруппой, или низшей алканоиламиногруппой, или
б) незамещенный или замещенный радикал, выбранный из группы, состоящей из: бензиламино; бензоиламино; пирролидинил; пиперидил; пиперазинил; пиперазинил-карбонил; морфолинил, тиоморфолинил; низший алкил, замещенный бензиламино-, бензоиламиногруппой, галогеном, пирролидинилом, пиперидилом, пиперазинилом, например, 4-метилпиперазинил-, тиоморфолинил, или морфолинил, причем заместители в указанном замещенном радикале выбраны из группы, состоящей из: циано; низший алкил; гидрокси- или аминозамещенный низший алкил; трифторметил; гидроксигруппа - свободная или этерифицированная спиртом или кислотой; низший алкокси; низший алканоилокси; аминогруппа - свободная, алкилированная или ацилированная; моно- или ди(низший)алкиламино; низший алканоиламино; бензоиламино; карбоксигруппа в свободном или этерифицированном виде; низший алкоксикарбонил и галоген, остальные четыре радикала независимо представляют собой: водород, циано; низший алкил; гидрокси- или аминозамещенный низший алкил; трифторметил; гидроксигруппа - свободная или этерифицированная спиртом или кислотой; (низший)алкокси; (низший)алканоилокси; аминогруппа - свободная, алкилированная или ацилированная; моно- или ди(низший)алкиламино; (низший)алканоиламино; бензоиламино; свободная или этерифицированная карбоксигруппа; (низший)алкоксикарбонил и галоген;
или
R1 и R2, R2 и R3, R3 и R4, или R4 и R5 вместе представляют собой замещенный или незамещенный алкиленовый радикал, имеющий 4 атома углерода, причем заместители предпочтительно выбирают из: циано, незамещенный или гидрокси-, амино- или
4-метилпиперазинилзамещенный низший алкил, конкретно такие, как метил, трифторметил, гидроксигруппа - свободная или этерифицированная спиртом или кислотой; аминогруппа - свободная, алкилированная или ацилированная; и свободная или этерифицированная карбоксигруппа; и другие три радикала независимо представляют собой: водород, циано; низший алкил; гидрокси- или аминозамещенный низший алкил; трифторметил; свободная или этерифицированная гидроксигруппа; (низший)алкокси; (низший)алканоилокси; аминогруппа - свободная, алкилированная или ацилированная; моно- или ди(низший) алкиламино; (низший)алканоиламино; бензоиламино; свободная или этерифицированная карбоксигруппа; (низший)алкоксикарбонил и галоген;
и один из радикалов R6, R7 и R8 означает галоген, NH2, NO2,
NНС(O)СF3, NНС(O)СН3, NHC(NH)NH2, а другие два радикала независимо представляют собой водород, низший алкил, низший фторированный алкил, бензил или фенил;
или их соль, или их кристаллическая форма.
Соединения формулы I могут находиться в виде соли, предпочтительно, фармацевтически приемлемой соли.
Такие соли образуются, например, как кислотно аддитивные соли, предпочтительно с органическими или неорганическими кислотами, из соединений формулы I или IV, содержащих основный атом азота, особенно фармацевтически приемлемые соли. Подходящие неорганические кислоты представляют собой, например, галогеновые кислоты, такие как хлористоводородная кислота, серная кислота или фосфорная кислота. Подходящие органические кислоты представляют собой, например, карбоновые, фосфоновые, сульфоновые или сульфаминовые кислоты, например, уксусная кислота, пропионовая кислота, октановая кислота, декановая кислота, додекановая кислота, гликолевая кислота, молочная кислота, фумаровая кислота, янтарная кислота, адипиновая кислота, пимелиновая кислота, пробковая кислота, азелаиновая кислота, яблочная кислота, винная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, циклогексанкарбоновая кислота, адамантанкарбоновая кислота, бензойная кислота, щавелевая кислота, салициловая кислота, 4-аминосалициловая кислота, фталевая кислота, фенилуксусная кислота, миндальная кислота, коричная кислота, метан- или этансульфоновые кислоты, 2-гидроксиэтансульфоновая кислота, этан-1,2-дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 1,5-нафталиндисульфоновая кислота, 2-, 3- или 4-метилбензолсульфоновые кислоты, метилсерная кислота, этилсерная кислота, додецилсерная кислота, N-циклогексилсульфаминовая кислота, N-метил, N-этил- или N-пропилсульфаминовые кислоты, или другие органические протонные кислоты, такие как аскорбиновая кислота.
С целью выделения или очистки также могут быть использованы фармацевтически неприемлемые соли, например, пикраты или перхлораты. Для терапевтического использования применяются только фармацевтически приемлемые соли или соединения - свободные основания (в виде фармацевтических препаратов, где это целесообразно), и поэтому они являются предпочтительными.
Предпочтительными солями соединений формулы I являются хлориды, бромиды, мезилаты (метилсульфонаты), ацетаты, трифторацетаты.
Термин "низший" в описании этого изобретения обозначает радикалы, содержащие до и включительно 7, предпочтительно до и включительно 4 атомов углерода, предпочтительно метил или этил.
Термин "низший фторированный алкил" в описании этого изобретения обозначает радикалы, содержащие до и включительно 7, предпочтительно до и включительно 4 атомов углерода, предпочтительно метил или этил, которые замещены фтором, такие как моно-, ди- или трифторметил, трифторэтил.
Термин "пиперазинил" в описании этого изобретения обозначает незамещенный пиперазинил или N-(низший)алкилпиперазинил, такой как 4-метилпиперазинил.
Галоген конкретно означает фтор, хлор, бром, или йод, особенно фтор, хлор, или бром.
Этерифицированная спиртом гидроксигруппа предпочтительно означает низший алкокси. Этерифицированная кислотой гидроксигруппа предпочтительно означает гидроксигруппу, этерифицированную органической карбоновой кислотой, такой как низшая алкановая кислота, или минеральной кислотой, такой как галоидоводородная кислота, например, (низший)алканоилокси или особенно галоген, такой как йод, бром или конкретно фтор или хлор.
Алкилированная аминогруппа представляет собой, например, (низший) алкиламино, такой как метиламино, или ди(низший)алкиламино, такой как диметиламино. Ацилированная аминогруппа означает, например, (низший)алканоиламино или бензоиламино.
Этерифицированная карбоксигруппа представляет собой, например, (низший)алкоксикарбонил, такой как метоксикарбонил.
Предпочтительно R3 означает низший алкил, замещенный бензиламино-группой, бензоиламино-, галогеном, пирролидинилом, пиперидилом, пиперазинилом, например, 4-метилпиперазинил- или морфолинил, тиоморфолинил, причем заместители указанного замещенного радикала выбирают из группы, состоящей из циано; низшего алкила; гидрокси- или аминозамещенного низшего алкила; трифторметила; свободной или этерифицированной (спиртом или кислотой) гидроксигруппы; (низший)алкокси; (низший)алканоилокси; свободной, алкилированной или ацилированной аминогруппы; моно- или ди(низший)алкиламино; (низший)алканоиламино; бензоиламино; свободной или этерифицированной карбоксигруппы; (низший)алкоксикарбонила и галогена.
Предпочтительно R3 означает низший алкил, замещенный пирролидинилом, пиперидилом, пиперазинилом, например, 4-метилпиперазинил-, или морфолинил, тиоморфолинил, причем заместители в указанном замещенном радикале выбирают из группы, состоящей из низшего алкила; гидрокси- или аминозамещенного низшего алкила.
Предпочтительно R1, R2, R4, R5 и R8 представляют собой водород.
Предпочтительно R7 означает низший алкил, такой как метил или фторированный алкил, такой как трифторметил.
Наиболее предпочтительно R3 представляет собой (4-метилпиперазинил)метил, R1, R2, R4, R5 и R8 означают водород, R6 означает галоген, NH2, NO2, NHC(O)CF3, NНС(O)СН3, NHC(NH)NH2, и R7 означает метил.
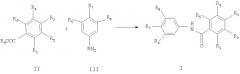
Амиды формулы I могут быть получены описанным ниже способом:
где значения радикалов R1-R8 определены выше и R9 представляет собой водород, метил, этил или арил.
Однако непосредственное превращение неактивированных карбоновых кислот или сложных эфиров в амиды, такие как соединения формулы II, путем взаимодействия с аминами затруднено, и обычно для этого требуется повышенная температура реакции, например приблизительно 200°С, или применение сильных оснований, таких как метоксид натрия, амид натрия, н-бутиллитий, гидрид натрия или реактив Гриньяра. Таким образом, существует потребность в более эффективном способе амидирования по сравнению с известными из уровня техники.
Авторы настоящего изобретения установили, что непосредственное превращение неактивированных карбоновых кислот или сложных эфиров соединений формулы II с соединениями формулы III в амиды формулы I может быть успешно осуществлено в мягких условиях:
А) когда R9 представляет собой метил, этил или арил,
в присутствии:
1) кислоты Льюиса,
2) апротонного органического растворителя, и необязательно
3) основания,
при температуре между 20 и 80°С, предпочтительно около 40°С, в течение периода между 1 ч и 1 сутками, предпочтительно 8 ч, предпочтительно в инертной атмосфере, предпочтительно при атмосферном давлении, с последующим гидролизом образовавшегося продукта; или
Б) когда R9 представляет собой водород,
в присутствии:
1) тионилхлорида,
2) апротонного органического растворителя, и необязательно
3) основания,
при температуре между 20 и 70°С, предпочтительно 45°С, в течение периода между 1 ч и 1 сутками, предпочтительно 6 ч, предпочтительно в инертной атмосфере, предпочтительно при атмосферном давлении.
Таким образом, настоящее изобретение, в другом замысле, обеспечивает способы получения соединения формулы I путем взаимодействия соединения формулы II с соединением формулы III
А) когда R9 представляет собой метил, этил или арил,
в присутствии:
1) кислоты Льюиса,
2) апротонного органического растворителя, и необязательно
3) основания
при температуре между 20 и 80°С, предпочтительно около 40°С, в течение периода между 1 ч и 1 сутками, предпочтительно 8 ч, предпочтительно в инертной атмосфере, предпочтительно при атмосферном давлении, и образовавшийся продукт подвергают гидролизу; или
Б) когда R9 представляет собой водород,
в присутствии:
1) тионилхлорида,
2) апротонного органического растворителя, и необязательно
3) основания,
при температуре между 20 и 70°С, предпочтительно 45°С, в течение периода между 1 ч и 1 сутками, предпочтительно 6 ч, предпочтительно в инертной атмосфере, предпочтительно при атмосферном давлении.
Подходящие кислоты Льюиса для способа А) включают три(низший) алкилалюминий (например, триметилалюминий, триэтилалюминий, триизобутилалюминий), АlСl3, АlВr3, этилалюминийдихлорид, метилалюминийдихлорид, диметилалюминийхлорид, диэтилалюминийхлорид и соответствующие сесквихлориды. Предпочтительно кислота Льюиса выбирается из АlCl3, этилалюминийдихлорида или диэтилалюминийхлорида, еще более предпочтителен АlСl3. Обычно кислота Льюиса присутствует в количестве от 1 до 4 молярных эквивалентов. Например, в случае триметилалюминия, триэтилалюминия и триизобутилалюминия присутствуют от 2 до 3 молярных эквивалентов, предпочтительно присутствуют около 2,5 молярных эквивалентов; в случае АlСl3,
АlВr3, этилалюминийдихлорида, метилалюминийдихлорида, диметилалюминийхлорида, диэтилалюминийхлорида и соответствующих сесквихлоридов предпочтительно присутствуют от 1,5 до 3,5, предпочтительно 2,5 молярных эквивалентов.
Предпочтительно тионилхлорид присутствует в способе В) в количестве от 1,5 до 10 молярных эквивалентов, предпочтительно 1,5 молярных эквивалента.
Подходящие апротонные органические растворители для проведения способов А) и В) включают смесь толуол/ацетонитрил, толуол, бензол, хлорбензол, дихлорбензол, ацетонитрил, мезитилен и пиридин.
Предпочтительным основанием в способах А) или В) является N,N-диизопропилэтиламин, лутидин, пиридин, или третичные амины.
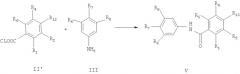
В альтернативном замысле настоящее изобретение обеспечивает способ получения соединений формулы I путем взаимодействия соединений формулы V с соединениями формулы R14-H
где
R13 означает низший алкил, замещенный галогеном,
R14 представляет собой бензиламино, бензоиламино, пирролидинил, пиперидил, пиперазинил, необязательно замещенный радикалами, выбранными из группы, состоящей из: циано; низший алкил; гидрокси- или аминозамещенный низший алкил,
R3 означает низший алкил, замещенный группами: бензиламино, бензоиламино, пирролидинил, пиперидил, пиперазинил, необязательно замещенный радикалами, выбранными из группы, состоящей из: циано; низший алкил; гидрокси- или аминозамещенный низший алкил.
Предпочтительно это взаимодействие осуществляют в присутствии органических растворителей, таких как ТГФ (тетрагидрофуран) или непосредственно в растворе амина R14-H.
Предпочтительно пиперазинил представляет собой N-(низший)алкилпиперазин, например N-метилпиперазин.
Предпочтительно радикалы R1, R2, R4 и R5 означают независимо водород, циано; низший алкил; гидрокси- или аминозамещенный низший алкил; трифторметил; гидроксигруппа - свободная или этерифицированная; (низший)алкокси; (низший)алканоилокси; аминогруппа - свободная, алкилированная или ацилированная; моно- или ди(низший)алкиламино; (низший)алканоиламино; бензоиламино; свободная или этерифицированная карбоксигруппа; (низший)алкоксикарбонил и галоген.
Соединения формулы V могут быть получены путем взаимодействия соединения формулы II′ с соединениями формулы III,
в присутствии:
1) органического растворителя, такого как ТГФ (тетрагидрофуран)
2) основания, такого как N,N-диизопропилэтиламин, лутидин, пиридин или третичные амины.
Альтернативно, амин R14-H непосредственно добавляют в реакционную смесь без дополнительной очистки, для взаимодействия с образовавшимся соединением формулы V.
Тетрагидрофуран может быть использован в чистом виде или в смеси с другими растворителями с целью повышения суммарной растворяющей способности.
Амиды формулы I могут быть получены и выделены из реакционной смеси традиционными приемами, например, путем удаления растворителя из реакционной смеси, например, путем концентрирования за счет выпаривания, например, досуха или почти досуха, например, до кристаллизации или выпадения осадка амида формулы I; или путем экстракции, например, в виде соли или экстракции другим растворителем, который может быть тем же или отличаться от использованного при амидировании; путем выпадения осадка или кристаллизации амида формулы I. Амиды формулы I могут быть очищены традиционными приемами, такими как перекристаллизация или хроматография.
Соединения формулы II или II′ могут быть получены с использованием способов, известных специалистам из уровня техники. Соединения формулы III доступны в промышленном масштабе, например, от фирм Fluka, Aldrich или Acros или они могут быть получены способами, которые известны специалистам из уровня техники.
Соединения формулы I могут быть использованы для получения соединений формулы IV, IV
где значения радикалов R1 - R5 определены выше и
один из радикалов R6′, R7′ и R8′ представляет собой
где R10 означает 4-пиперазинил, 1-метил-1H-пирролил, амино- или амино(низший)алкилзамещенный фенил, в котором аминогруппа в каждом случае является свободной, алкилированной или ацилированной, 1H-индолил или 1Н-имидазолил, связанный с атомом углерода пятичленного кольца, или незамещенный или (низший)алкилзамещенный пиридил, связанный с атомом углерода в кольце, и незамещенный или замещенный кислородом при атоме азота, и каждый радикал R11 и R12, независимо от другого, представляет собой водород или низший алкил, а два других радикала независимо представляют собой водород, низший алкил, например, метил, бензил или фенил, или их фармацевтически приемлемые соли или кристаллические формы.
Соединения формулы IV могут находиться в виде соли, предпочтительно фармацевтически приемлемой соли, как описано выше.
Предпочтительными солями являются, например, хлорид, бромид, метилсульфонат, ацетат, трифторацетат.
Соединения формулы IV ингибируют активность тирозинкиназы рецептора эпидермального фактора роста (EGF) и применяются, в числе других, для лечения доброкачественных или злокачественных опухолей. Они способны вызвать регрессию опухоли и предотвратить рапространение и рост метастаз. В частности, они могут быть использованы для лечения эпидермальной гиперпролиферации (псориаз), для лечения новообразований эпителиального характера, например мастокарциномы, и лейкемии. Кроме того, соединения формулы IV используются для лечения заболеваний иммунной системы и воспалений, зависящих от вовлечения протеинкиназ. Кроме того, соединения формулы IV могут быть использованы для лечения заболеваний центральной или периферической нервной системы, зависящих от вовлечения протеинкиназ в передачу сигнала.
Таким образом, в другом замысле настоящее изобретение обеспечивает способ получения соединений формулы IV из соединений формулы I и применение соединений формулы I для получения соединений формулы IV, в которой значения радикалов
R1-R8′ описаны выше.
Это изобретение относится к способу получения соединения формулы IV или его фармацевтически приемлемой соли или кристаллической формы, путем взаимодействия традиционными методами соединения формулы I, описанного в этом изобретении, с соединением формулы VII
в которой R10 представляет собой 4-пиразинил, 1-метил-1Н-пирролил, амино- или амино(низший)алкилзамещенный фенил, в котором аминогруппа, в каждом случае, является свободной, алкилированной или ацилированной, 1H-индолил или 1Н-имидазолил, связанный с атомом углерода пятичленного кольца, или незамещенный или (низший)алкилзамещенный пиридил, связанный с атомом углерода кольца, например 3-пиридил, и незамещенный или замещенный кислородом при атоме азота, и каждый радикал R11 и R12, независимо от другого, представляет собой водород или низший алкил.
Предпочтительно, на первой стадии, соединение формулы I получают из соединений формулы II и III, которые описаны в изобретении.
Кроме того, настоящее изобретение относится к способу получения соединения формулы IV или его фармацевтически приемлемой соли или кристаллической формы путем взаимодействия традиционными методами соединения формулы I, описанного в изобретении, в которой радикал R6 означает -NHC(NH)NH2, с соединением формулы VI
в которой R10 представляет собой 4-пиразинил, 1-метил-1H-пирролил, амино- или амино(низший)алкилзамещенный фенил, в котором аминогруппа в каждом случае является свободной, алкилированной или ацилированной, 1H-индолил или 1Н-имидазолил, связанный с атомом углерода пятичленного кольца, или незамещенный или (низший)алкилзамещенный пиридил, связанный с атомом углерода кольца, например, 3-пиридил и незамещенный или замещенный кислородом при атоме азота, и R11 представляет собой водород или низший алкил.
Предпочтительно это взаимодействие осуществляют в полярном органическом растворителе, таком как н-бутанол.
Предпочтительно R10 представляет собой 3-пиридил и R11 означает метил.
В одном варианте осуществления соединение формулы I, в которой R6 означает NHC(NH)NH2, R7 представляет собой метил и R8 означает водород, может быть обработано, например, 3-диметиламино-1-(3-пиридил)-2-пропен-1-оном, чтобы получить соединение формулы IV, в которой R6′ представляет собой 4-(3-пиридил)-2-пиримидинамино, R7′ означает метил и R8′ означает водород, в соответствии с соединением формулы IV, которое описано в примере 21 документа ЕР 564409. Соединение формулы I, в которой R6 означает Br, R7 представляет собой метил и R8 означает водород, может быть обработано, например, 4-(3-пиридил)-2-пиримидинамином, который доступен, например, от фирмы Chempacific, в присутствии Pd(0) или Pd(II), в присутствии фосфинового лиганда, чтобы получить соединение формулы IV, в которой R6′ представляет собой 4-(3-пиридил)-2- пиримидинамино, R7′ означает метил и R8′ означает водород.
В другом варианте осуществления соединения формулы I, в которой R6 представляет собой NO2, R7 означает метил и R8 означает водород, могут быть превращены, например, в соединение формулы I, в которой R6 представляет собой NH2, R7 означает метил и R8 означает водород, с использованием стандартных методов, известных специалисту в этой области техники. Соединения формулы I, в которой R6 представляет собой галоген, NНС(O)СF3 или NНС(O)СН3, предпочтительно Br, R7 означает метил и R8 означает водород, могут быть превращены, например, в соединение, в котором R6 представляет собой NH2, R7 означает метил и R8 означает водород, с использованием стандартных методов, известных специалисту в этой области техники. Соединения формулы I, в которой R6 представляет собой NH2, R7 означает метил и R8 означает водород, могут быть превращены, например, в соединение формулы I, в которой R6 представляет собой NHC(NH)NH2, R7 означает метил и R8 означает водород.
Следовательно, настоящее изобретение предоставляет способ получения соединений формулы IV, в которой на первой стадии соединение формулы I получают из соединений формулы II и III, которые описаны выше, предпочтительно в присутствии АlСl3, три(низший)алкилалюминия, например триметилалюминий, триэтилалюминий, триизобутилалюминий или SOCl2, и на второй стадии соединение формулы I взаимодействует с соединением формулы IV традиционными методами. Предпочтительно упомянутый способ предназначается для получения соединения формулы IV, в которой радикалы R1, R2, R4, R5 и R8′ представляют собой водород, R3 означает (4-метилпиперазинил)метил, R6′ означает 4-(3-пиридил)-2-пиримидинамино, и R7′ означает метил.
Способы настоящего изобретения обеспечивают синтез соединения формулы IV, предпочтительно соединения формулы IV, в которой радикалы R1, R2, R4, R5 и R8′ представляют собой водород, R3 означает (4-метилпиперазинил)метил, R6 означает 4-(3-пиридил)-2-пиримидинамино, и R7′ означает метил, который протекает более эффективно и с более высоким выходом, чем в способе, описанном в литературе, например, в документе ЕР 564409. Отсутствует необходимость применения дорогостоящих сочетающих реагентов. Повышенный выход за проход, в сочетании с меньшей стадийностью, по сравнению со способами уровня техники, могут привести к существенному снижению производственных затрат. В описанных ранее синтезах могут образоваться мутагенные промежуточные соединения. В способах настоящего изобретения все промежуточные соединения дали отрицательную пробу AMES (специфическая проба на мутагенность; которую проводят в соответствии с Рекомендациями по испытанию химикатов (OECD Guideline for Testing of Chemicals, 471: Bacterial Reverse Mutation Test, принят 21 июля 1997)); это является строгим доказательством того, что мутагенные промежуточные соединения не образуются, что привело бы к существенному улучшению гигиены производства. Более того, используя эти способы, можно синтезировать, например, соединения с радиоактивной меткой.
Ниже следует описание способа настоящего изобретения только с помощью примера.
| АlМе3 | триметилалюминий | от фирмы FLUKA |
| Аl(iВu)3 | триизобутилалюминий | от фирмы FLUKA |
| АlСl3 | трихлорид алюминия | от фирмы Merck |
| платина на сульфидном углероде | от фирмы Acros | |
| тионилхлорид | от фирмы FLUKA | |
| Блок целитного фильтра | от фирмы FLUKA | |
| Соль Rochelle виннокислый калий-натрий | от фирмы FLUKA | |
| платина на углероде | от фирмы Engelhardt | |
| цианамид | от фирмы FLUKA | |
| 3-диметиламино-1-пиридин-3-илпропенон | от фирмы FLUKA | |
| трет-бутилат натрия | от фирмы FLUKA |
rac-BINAP 2,2′-бис-(дифенилфосфино)-1,1′-бинафталин синтезирован по методике, известной из литературы
Pd2(dba)3*CHCl3 комплекс хлороформ*трис(дибензилиденацетон)-дипалладий от фирмы FLUKA
Особое предпочтение отдается прежде всего соединению формулы IV, которое представляет собой N-{5-[4-(4-метилпиперазинометил)бензоиламидо]-2-метилфенил}-4-(3-пиридил)-2-пиримидинамин. N-{5-[4-(4-Метилпиперазинометил)бензоиламидо]-2-метилфенил}-4-(3-пиридил)-2-пиримидинамин (также известен как "Imatinib" [международное непатентованноеназвание]) и его применение, особенно в качестве противоопухолевого средства, описаны в примере 21 заявки на Европатент ЕР-А-0564409, которая опубликована 6 октября 1993 г., и в эквивалентных заявках и патентах во многих других странах, например, в патенте США 5521184 и в патенте JP 2706682. Предпочтение также отдается β-кристаллической форме 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамид-метансульфоната, который описан в заявке на Европатент №998473, опубликованной 10 мая 2000 г.
Термин "4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамид" включает β-кристаллическую форму, которая описана в заявке на Европатент №998473.
Весьма предпочтительно, чтобы соединение формулы IV находилось в виде фармацевтически приемлемой соли, особенно в виде монометилсульфонатной соли соединения.
Соединения формулы IV обобщенно и конкретно раскрыты в заявках на патенты EP 0564409 A1 и WO 99/03854, в том числе в формуле изобретения на соединение и в конечных продуктах примеров осуществления изобретения; таким образом, предмет конечных продуктов, фармацевтические приемлемые препараты и формула изобретения включены в состав настоящего изобретения посредством ссылки на эти публикации. Более того, включены соответствующие стереоизомеры, а также соответствующие полиморфные формы, например кристаллические модификации, которые раскрыты в этих публикациях.
Таким образом, дополнительный замысел этого изобретения относится к применению соединений формулы I для синтеза соединений формулы IV, особенно 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамида или его фармацевтически приемлемой соли, или его кристаллической формы.
Более того, это изобретение также относится к фармацевтической композиции, содержащей:
а) один или несколько фармацевтически приемлемых наполнителей,
б) по меньшей мере, одно фармацевтически активное соединение формулы IV,
в) по меньшей мере, одно соединение формулы I в количестве между 0,00001% и 5% мас., предпочтительно между 0,00001% и 0,1%, наиболее предпочтительно между 0,0001% и 0,1%.
Настоящее изобретение конкретно относится к фармацевтическим композициям, особенно к таблеткам, содержащим 4-(4-метилпиперазин-1-илметил)-N-[4-метил-3-(4-пиридин-3-ил)пиримидин-2-иламино)фенил]бензамид или его фармацевтически приемлемую соль или его кристаллическую форму.
Предпочтительно в с) используется соединение формулы I, в которой R3 представляет собой (4-метилпиперазинил)метил, радикалы R1, R2, R4, R5 и R8 означают водород, R6 представляет собой Br, Cl, NH2, NO2, NНС(O)СF3,
NНС(O)СН3 или NHC(NH)NH2, и R7 означает метил, или его соль.
В композиции может присутствовать один или несколько фармацевтически приемлемых наполнителей, например таких, которые используются традиционно, например (1.1), по меньшей мере, одно связующее вещество, например, микрокристаллическая целлюлоза, гидроксипропилметилцеллюлоза (1.2), по меньшей мере, один измельчитель, например, сшитый поливинилпирролидон, например, Crospovidone® (1.3), по меньшей мере, один агент, улучшающий скольжение, например, коллидный диоксид кремния, (1.4) по меньшей мере, один смазочный материал, например, стеарат магния и/или (1.5) основное покрытие. Согласно изобретению в таблетках в качестве связующего вещества применяется микрокристаллическая целлюлоза.
Пример А. Капсулы с Imatinib - (4-[(4-метил1-пиперазин-1-илметил)-N-[4-метил3-[[4-(3-пиридинил)-2-пиримидинил]амино]фенил]бензамид)-метансульфонатом формулы IV, β-кристаллической формы.
Капсулы, содержащие в качестве активного вещества 119,5 мг соединения, указанного в заголовке (т.е. СОЛЬ I), что соответствует 100 мг Imatinib (свободное основание), готовят в композиции, указанной ниже. Эта композиция также содержит соединения формулы I, в которой R3 представляет собой (4-метилпиперазинил)метил,
R1, R2, R4, R5 и R8 означают водород, R6 означает Br, Cl, NH2, NO2, NHC(O)CF3, NHC(O)CH3, NHC(NH)NH2, и R7 представляет собой метил.
| Композиция СОЛЬ I | 119,5мг |
| Соединения формулы I | 0,0005 мг |
| Целлюлоза | МК GR 92 мг |
| Crospovidone XL | 15 мг |
| Аэросил Aerosil 200 | 2 мг |
| Стеарат магния | 1,5мг |
| _________ | |
| 230,0005 мг |
Капсулы получают путем смешивания компонентов с последующим заполнением твердых желатиновых капсул (размер 1) этой смесью. Пример 1.
Получение N-(4-метил-3-бромфенил)-4-(4-метилпиперазин-1-илметил)бензамида
Раствор триметилалюминия (2М, в толуоле, 15,0 мл) добавляют в течение 30 мин к раствору 3-бром-4-метиланилина (2,15 г, 11,5 ммоль) и метилового эфира 4-(4-метилпиперазин-1-илметил)бензойной кислоты (2,87 г, 11,5 ммоль) в толуоле (20 мл) при 40°С в атмосфере аргона. После прекращения выделения газа реакционную смесь перемешивают 30 мин, затем ее охлаждают до 0°С и распределяют между холодным водным раствором 1N NaOH (100 мл) и толуолом (100 мл). Органический слой экстрагируют водным насыщенным раствором NH4Cl (100 мл) и водным насыщенным раствором NaCl (100 мл). Органический слой концентрируют в вакууме, чтобы получить 4,69 г (97% по площади на хроматограмме ЖХВД) соединения, указанного в заголовке, в виде бледно-желтых кристаллов.
Метиловый эфир 4-(4-метилпиперазин-1-илметил)бензойной кислоты получают следующим образом.
Раствор метилового эфира 4-формилбензойной кислоты (10,0 г, 61 ммоль) в метаноле (100 мл) последовательно обрабатывают 1-метилпиперазином (6,7 г, 67 ммоль) и катализатором - 5% платины на сульфидированном углероде (0,5 г). Затем образовавшийся раствор нагревают при 90°С и обрабатывают водородом под давлением 5 бар (0,51 МПа) в течение 4 часов, пока не закончится поглощение водорода. Реакционную смесь охлаждают до комнатной температуры и фильтруют через слой Целита. Метанол удаляют при пониженном давлении и заменяют его толуолом (100 мл). Образовавшийся органический раствор экстрагируют водным раствором НСl (2 н., 2 раза по 50 мл). Водный слой обрабатывают концентрированным водным раствором NaOH (30%), доводя значение pH до 12, и экстрагируют обратно толуолом (2 раза по 50 мл). Объединенные органические слои концентрируют в вакууме, чтобы получить 12,9 г (85%) метилового эфира 4-(4-метилпиперазин-1-илметил)бензойной кислоты в виде бледно-желтого масла, которое может быть дополнительно очищено путем дистилляции при пониженном давлении.
Пример 2А. Получение N-(4-метил-3-нитрофенил)-4-(4-метилпиперазин-1-илметил)бензамида
Раствор триметилалюминия (2М в толуоле, 1,3 мл, 2,6 ммоль) добавляют в течение 5 мин к раствору 3-нитро-4-метиланилина (152 мг, 1,00 ммоль) и метилового эфира 4-(4-метилпиперазин-1-илметил)бензойной кислоты (248 мг, 1,00 ммоль) в толуоле (3,0 мл) при 45°С в атмосфере аргона. После прекращения выделения газа темно-коричневую реакционную смесь перемешивают 30 мин, затем охлаждают до 0°С. Последовательно добавляют насыщенный водный раствор виннокислого калий-натрия (20 мл), метил трет-бутиловый эфир (15 мл) и хлористый метилен (10 мл).
Органическую фазу отделяют и промывают насыщенным водным раствором NaНСО3 (10 мл) и насыщенным водным раствором NaCl (10 мл). Водную фазу обратно экстрагируют метил-трет-бутиловым эфиром (2 раза по 15 мл). Органические фазы объединяют, сушат над MgSO4 и концентрируют в вакууме, чтобы получить 383 мг (96% по площади ЖХВД) соединения, указанного в заголовке, в виде бледно-желтых кристаллов.
Пример 2Б. Получение N-(4-метил-3-нитрофенил)-4-(4-метилпиперазин-1-илметил)бензамида
К раствору 10,95 г (72 ммоль)3-нитро-4-метиланилина в 80 мл толуола добавляют 66,5 мл раствора триизобутилалюминия (28 % в гексане, 61 ммоль) в течение 30 мин при 0°С и затем в течение 1 часа добавляют раствор метилового эфира 4-(4-метилпиперазин-1-илметил)бензойной кислоты (14,9 г, 60 ммоль) в толуоле (30 мл) при 0°С в атмосфере аргона. После перемешивания в течение 12 ч при комнатной температуре в темно-коричневую реакционную смесь добавляют другую порцию триизобутилалюминия (66,5 мл, 61 ммоль). Смесь дополнительно перемешивают в течение 6 ч, затем добавляют еще две небольшие порции триизобутилалюминия (каждая по 18 мл, 18 ммоль), и перемешивание продолжается в течение нескольких часов при комнатной температуре. После кислотной и щелочной обработки серной кислотой и NaOH объединенные органические фазы (в толуоле) выпаривают в вакууме, чтобы получить коричневый неочищенный продукт, который кристаллизуется из метил-трет-бутилового эфира, с образованием соединения, указанного в заголовке, в виде желто-коричневых кристаллов: первая фракция (11,65 г), вторая фракция (3,8 г) и третья фракция (1,2 г), в сумме 16,65 г (75,3%).
Пример 2В. Получение N-(4-метил-3-нитрофенил)-4-(4-метилпиперазин-1-илметил)бензамида
Добавляют 4-метил-3-нитроанилин (30,0 г, 0,197 моль) к смеси тетрагидрофурана (120 мл) и N-этил-N,N-диизопропиламина при 23-25°С в течение периода от 5 до 10 мин. К этому раствору в течение 60-65 мин добавляют хлорметилбензоилхлорид (38,4 г, 0,20 моль), растворенный в тетрагидрофуране (35 мл), поддерживая температуру равной 25-30°С. Реакционную смесь перемешивают при этой температуре в течение 30 мин и затем добавляют к N-метилпиперазину (138,2 г, 1,38 моль) в течение 60-90 мин, поддерживая температуру при 25-30°С. Образовавшуюся суспензию перемешивают при этой температуре в течение 60 мин. Тетрагидрофуран отгоняют при 50°С и пониженном давлении. В конце дистилляции устанавливают температуру равной 45-48°С, и при этой температуре добавляют воду (300 мл) в течение 45-60 мин. Образовавшуюся суспензию охлаждают до 23°С и перемешивают 60 мин. Суспензию фильтруют, остаток на фильтре промывают водой (225 мл) и сушат в вакууме, чтобы получить 69,2 г соединения, указанного в заголовке (выход 95% от теоретического), в виде беловатого порошка (99,5% по площади ЖХВД).
Альтернативно, промежуточное соединение, N-метил-3-нитрофенил)-4-хлорметилбензамид, может быть выделено путем дистилляции половины тетрагидрофурана при пониженном давлении и добавления остатка к воде (300 мл) при температуре 20-25°С в течение 30 мин. После дополнительного перемешивания в течение 30 мин при 0-5°С, суспензию фильтруют, промывают водой (200 мл) и сушат в вакууме. Промежуточное соединение растворяют в тетрагидрофуране (150 мл) и добавляют к N-метилпиперазину (138,2 г, 1,38 моль) в течение 60-90 мин, поддерживая температуру равной 25-30°С. Соединение, указанное в заголовке,