Оптимизированная экспрессия hpv 58 l1 в дрожжах
Иллюстрации
Показать всеИзобретение относится к области генетической инженерии и вирусологии. Представлена синтетическая молекула ДНК, кодирующая белок L1 HPV58, где кодоны оптимизированы для высокого уровня экспрессии в дрожжевой клетке. Предложены также экспрессирующий вектор, дрожжевая клетка-хозяин, вирусоподобная частица HPV58 и способ ее получения, а также фармацевтическая композиция, включающая такие VLP. Изобретение может быть использовано в медицине для обеспечения эффективной иммунопрофилактики против папилломавирусной инфекции посредством нейтрализующих антител и опосредованного клетками иммунитета, а также для лечения имеющихся HPV инфекций. 6 н. и 4 з.п. ф-лы, 14 ил.
Реферат
В основном настоящее изобретение относится к профилактике и/или лечению папилломавирусной инфекции человека (HPV). Более конкретно настоящее изобретение относится к синтетическим полинуклеотидам, кодирующим белок L1 HPV58, и к рекомбинантным векторам и хозяевам, содержащим указанные полинуклеотиды. Это изобретение также относится к HPV58 вирусоподобным частицам (VLP), где VLP получают посредством экспрессии рекомбинантных LI или LI и L2 HPV58 в клетках дрожжей и их применению в вакцинах и фармацевтических композициях для профилактики и лечения HPV инфекций.
Предпосылки изобретения
Существует более 80 типов вирусов папилломы человека (HPV), многие из которых связаны с широким спектром биологических фенотипов, от доброкачественных пролиферативных разрастаний до злокачественных карцином (для обзора см. McMurray et al., Int. J. Exp. Pathol. 82(1): 15-33(2001)). HPV6 и HPV11 представляют собой типы, наиболее часто связанные с доброкачественными разрастаниями, незлокачественной остроконечной кондиломой и/или слабовыраженной дисплазией генитальной или дыхательной слизистых оболочек. HPV16 и HPV18 представляют собой типы с высокой степенью риска, наиболее часто связанные с in situ и инвазивными карциномами шейки матки, влагалища, вульвы и анального канала. Более 90% карцином шейки матки связаны с инфекциями HPV16, HPV18 или менее распространенными онкогенными типами HPV31, -33, -45, -52 и -58 (Schiffman et al., J. Natl. Cancer Inst. 85(12): 958-64 (1993)). Наблюдение, что ДНК HPV обнаруживают в более чем в 90% случаев карцином шейки матки представляет серьезное эпидемиологическое доказательство, что HPV вызывают карциному шейки матки.
Вирусы папилломы представляют собой небольшие (50-60 нм) вирусы, безоболочечные ДНК-содержащие вирусы икосаэдрической формы, кодирующие до восьми ранних и двух поздних генов. Открытые рамки считывания (ORF) вирусных геномов обозначают от E1 до E7 и L1 и L2, где «E» обозначает ранний и «L» обозначает поздний. L1 и L2 кодируют белки вирусного капсида, тогда как гены E ассоциированы с такими функциями, как вирусная репликация и трансформация клеток.
Белок L1 представляет собой основной белок капсида и имеет молекулярную массу 55-60 кДа. Белок L2 представляет собой минорный белок капсида. Иммунологические данные свидетельствуют о том, что большая часть белка L2 в капсиде вируса располагается с внутренней стороны от белка L1. Оба белка и L1 и L2 у различных папилломавирусов высококонсервативны.
Экспрессия белка L1 или сочетания белков L1 и L2 в дрожжах, клетках насекомых, клетках млекопитающих или бактерий приводит к самосборке вирусоподобных частиц (VLP) (для обзора см. Schiller and Roden, в Papillomavirus Reviews: Current Research on Papillomaviruses; Lacey, ed. Leeds, UK: Leeds Medical Information, pp 101-12 (1996)). VLP являются морфологически сходными с аутентичными вирионами и способны индуцировать высокие титры нейтрализующих антител при введении животным или людям. Они представляют собой безопасную альтернативу применению живого вируса при разработке вакцины к HPV, так как VLP не содержат потенциально онкогенного вирусного генома (для обзора см. Schiller and Hidesheim, J. Clin. Virol. 19: 67-74 (2000)). По этой причине гены L1 и L2 идентифицировали как иммунологические мишени для развития профилактических и терапевтических вакцин против инфекции и заболевания HPV.
Разработке и внедрению вакцины к HPV препятствовали трудности, связанные с получением высоких уровней экспрессии капсидных белков в успешно трансформированных организмах хозяев, ограничивающие продукцию очищенного белка. Таким образом, несмотря на идентификацию нуклеотидных последовательностей дикого типа, кодирующих белки L1 HPV, таких как белок L1 HPV58, было бы очень желательно разработать быстро возобновляемый источник незрелого белка L1 HPV, который использует кодирующие L1 HPV58 нуклеотидные последовательности, оптимизированные для экспрессии в планируемой клетке-хозяине. Кроме того, было бы полезно получать большие количества VLP L1 HPV58 с иммунными свойствами нативных белков для применения в разработке вакцин.
Сущность изобретения
Настоящее изобретение относится к композициям и способам для установления или повышения иммунитета к белковым продуктам, экспрессируемым генами L1 HPV58. Конкретно, настоящее изобретение относится к полинуклеотидам, кодирующим белок L1 HPV58, где полинуклеотиды кодон оптимизированы для высокого уровня экспрессии в дрожжевой клетке. Кроме того, настоящее изобретение относится к HPV58 вирусоподобным частицам (VLP), где указанные VLP получают посредством экспрессии рекомбинантных LI или Ll и L2 HPV58 в дрожжевых клетках, и в нем описано применение HPV58 VLP в фармацевтических композициях и вакцинах для профилактики и/или лечения рака, ассоциированного с HPV.
Настоящее изобретение относится к синтетическим молекулам ДНК, кодирующим белок L1 HPV58. Кодоны синтетических молекул сконструированы таким образом, чтобы применять кодоны предпочтительно в дрожжевой клетке. Синтетические молекулы можно применять в качестве источника белка L1 HPV58, способного к самосборке в VLP. Указанные VLP можно применять в вакцине на основе VLP.
Иллюстративный вариант осуществления настоящего изобретения представляет собой молекулу синтетической нуклеиновой кислоты, кодирующую белок L1 HPV58, как указано в SEQ ID №: 2, где указанная молекула нуклеиновой кислоты содержит последовательность нуклеотидов с кодонами, оптимизированными для высокого уровня экспрессии в дрожжевой клетке. В предпочтительном варианте осуществления нуклеиновая кислота содержит последовательность нуклеотидов, как указано в SEQ ID №: 1 (обозначенная здесь "последовательность L1 58 R").
Также изобретение относится к рекомбинантным векторам и рекомбинантным прокариотическим и эукариотическим клеткам-хозяевам, содержащим молекулы нуклеиновых кислот, раскрытые по всему этому описанию. В предпочтительном варианте осуществления настоящего изобретения клетка-хозяин представляет собой дрожжевую клетку.
Настоящее изобретение также относится к способу экспрессии белка L1 HPV58 в рекомбинантной клетке-хозяине, включающему в себя: (a) введение в дрожжевую клетку-хозяина вектора, содержащего нуклеиновую кислоту, кодирующую белок L1 HPV58; и (b) культивирование дрожжевых клеток-хозяев в условиях, допускающих экспрессию указанного белка L1 HPV58.
Кроме того, настоящее изобретение относится к способу экспрессии белка L1 HPV58 в рекомбинантной клетке-хозяине, включающему в себя: (a) введение в дрожжевую клетку-хозяина вектора, содержащего нуклеиновую кислоту, кодирующую белок L1 HPV58, где молекула нуклеиновой кислоты представляет собой молекулу с кодонами, оптимизированными для оптимальной экспрессии в дрожжевой клетке-хозяине; и (b) культивирование дрожжевых клеток-хозяев в условиях, допускающих экспрессию указанного белка L1 HPV58.
По предпочтительным вариантам осуществления этого аспекта изобретения нуклеиновая кислота содержит последовательность нуклеотидов, как указано в SEQ ID №: 1.
Это изобретение также относится к продуцируемым в дрожжевых клетках HPV58 вирусоподобным частицам (VLP), способам продукции VLP HPV58 и способам применения VLP HPV58.
По предпочтительному варианту осуществления изобретения дрожжи выбирают из группы, состоящей из: Saccharomyces cerevisiae, Hansenula polymorpha, Pichia pastoris, Kluyveromyces fragilis, Kluyveromyces lactis и Schizosaccharomyces pombe.
Еще один аспект настоящего изобретения представляет собой VLP HPV58, где VLP получают посредством экспрессии рекомбинантных L1 HPV58 или L1 и L2 HPV58 в дрожжевой клетке.
Еще один аспект настоящего изобретения представляет собой VLP HPV58, включающую в себя белок L1 HPV58, полученный посредством кодон-оптимизированного гена L1 HPV58. В иллюстративном варианте осуществления данного аспекта изобретения ген L1 HPV58 с оптимизированными кодонами содержит последовательность нуклеотидов, как указано в SEQ ID №: 1.
Данное изобретение также относится к способу индукции иммунного ответа у животного, включающему в себя введение животному вирусоподобных частиц HPV58. По предпочтительному варианту осуществления VLP HPV58 продуцируются посредством гена с оптимизированными кодонами.
Еще один аспект настоящего изобретения представляет собой способ профилактики или лечения ассоциированного с HPV рака шейки матки, включающий в себя введение млекопитающему вакцины, содержащей VLP HPV58. По предпочтительному варианту осуществления этого аспекта изобретения VLP HPV58 продуцируются в дрожжах.
Настоящее изобретение также относится к вакцине, содержащей вирусоподобные частицы (VLP) HPV58, где VLP HPV58 продуцируются в дрожжах.
По альтернативному варианту осуществления этого аспекта изобретения вакцина, кроме того, содержит VLP, по меньшей мере, один дополнительный тип HPV. По меньшей мере, одним дополнительным типом HPV может являться любой представляющий интерес тип HPV, включающий в себя любой описанный в способе тип HPV или определенный далее тип HPV. По предпочтительному варианту осуществления тип HPV представляет собой тип, ассоциированный с клиническим фенотипом, таким как разрастания или рак шейки матки. Кроме того, по предпочтительному варианту осуществления, по меньшей мере, один дополнительный тип HPV выбран из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV55, HPV56, HPV59 и HPV68.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим вирусоподобные частицы HPV58 и фармацевтически приемлемый носитель, где VLP HPV58 продуцируются в дрожжах. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим VLP HPV58 и VLP, по меньшей мере, одного дополнительного типа HPV. По предпочтительному варианту осуществления, по меньшей мере, один дополнительный тип HPV выбран из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV55, HPV56, HPV59 и HPV68.
Как применяют по всему описанию и в прилагаемой формуле изобретения, единственные числа включают в себя форму множественного числа, если из контекста явно не следует иначе.
Как применяют по всему описанию и в прилагаемой формуле изобретения, употребляют следующие определения и аббревиатуры:
Термин «промотор» относится к сайту узнавания на цепи ДНК, с которой связывается РНК-полимераза. Промотор формирует с РНК-полимеразой комплекс инициации для инициации и управления транскрипционной активностью. Комплекс можно модифицировать посредством активирующих последовательностей, называемых «энхансеры» или «прилегающие активирующие последовательности», или ингибирующих последовательностей, названных «сайленсеры».
Термин «вектор» относится к некоторым средствам, посредством которых фрагменты ДНК можно вводить в организм хозяина или ткань хозяина. Существуют различные типы векторов, включающие в себя плазмиды, вирусы (включая аденовирусы), бактериофаги и космиды.
Термин «кассета» относится к нуклеотидной или генной последовательности, которую следует экспрессировать из вектора, например, нуклеотидная или генная последовательность, кодирующая белок L1 HPV58. Обычно кассета содержит генную последовательность, вставленную в вектор, который, по некоторым вариантам осуществления, предоставляет регуляторные последовательности для экспрессии нуклеотидной или генной последовательности. По другим вариантам осуществления нуклеотидная или генная последовательность предоставляет регуляторные последовательности для ее экспрессии. По дополнительным вариантам осуществления, вектор предоставляет некоторые регуляторные последовательности, и нуклеотидная или генная последовательность предоставляет другие регуляторные последовательности. Например, вектор может предоставлять промотор для транскрибирования нуклеотидной или генной последовательности, а нуклеотидная или генная последовательность предоставляют последовательность терминации транскрипции. Регуляторные последовательности, которые можно предоставлять посредством вектора, включают в себя в качестве не ограничивающих примеров энхансеры, последовательности терминации транскрипции, акцепторные и донорные последовательности сплайсинга, интроны, последовательности связывания рибосом и дополнительные поли(A) последовательности.
Определения «последовательность дикого типа L1 58» и «последовательность wt L1 58» относятся к последовательности L1 HPV58, указанной здесь, как SEQ ID №: 3. Хотя последовательность дикого типа L1 HPV58 описана ранее, нередко находят незначительные вариации последовательностей между ДНК, полученными из клинических изолятов. Таким образом, репрезентативную последовательность дикого типа L1 58 выделяют из клинических образцов, для которых ранее показано, что они содержат ДНК HPV58 (см. пример 1). Последовательность дикого типа L1 58 применяют в качестве контрольной последовательности для сравнения с описанными здесь последовательностями L1 58 с оптимизированными кодонами (см. фиг.1).
Определения «L1 HPV58 R» и «L1 58 R» относятся к описанной здесь примерной синтетической нуклеотидной последовательности L1 HPV58 (SEQ ID №: 1), где последовательность перестраивают таким образом, чтобы она содержала кодоны, предпочтительные для высокого уровня экспрессии дрожжевой клеткой.
Термин «эффективное количество» означает, что введено достаточное количество композиции вакцины для получения адекватных уровней полипептида, чтобы вызвать иммунный ответ. Специалист в данной области поймет, что этот уровень может варьировать.
«Замена консервативных аминокислот» относится к замещению одного аминокислотного остатка другим химически сходным аминокислотным остатком. Примеры таких консервативных замен представляют собой: замену одного гидрофобного остатка (изолейцина, лейцина, валина или метионина) на другой; замену одного полярного остатка на другой полярный остаток того же заряда (например, аргинин на лизин; глутаминовую кислоту на аспарагиновую кислоту).
Термин «млекопитающие» относится к любым млекопитающим, включая человека.
«VLP» означает(ют) вирусоподобную частицу или вирусоподобные частицы.
«Синтетический» означает, что ген L1 HPV58 разработали таким образом, что он содержит последовательность нуклеотидов, не являющуюся такой же, как последовательность нуклеотидов, представленная в указанном встречающемся в природе гене дикого типа L1 HPV58 (58 LI wt, SEQ ID №: 3). Как установлено выше, представленные здесь синтетические молекулы содержат предпочтительную для экспрессии дрожжевыми клетками последовательность кодонов. Представленные здесь синтетические молекулы кодируют такие же аминокислотные последовательности, как ген дикого типа L1 HPV58 (SEQ ID №: 2).
Краткое описание чертежей
На фиг.1 показано выравнивание последовательности, сравнивающее замененные нуклеотиды в синтетическом гене L1 HPV58 по настоящему изобретению (SEQ ID №: 1, указана как «L1 58 R») (см. пример 2). Эталонная последовательность представляет собой последовательность дикого типа L1 58 (SEQ ID №: 3, указана как «L1 58 wt»; см. пример 1). Замененные нуклеотиды указаны в соответствующем положении. Нуклеотидный номер содержится в скобках. Идентичные нуклеотиды в перестроенной последовательности L1 58 указаны точками.
На фиг.2 показаны перестроенная синтетическая двухцепочечная нуклеиновая кислота L1 HPV58, а сверху однобуквенная аминокислотная последовательность. Нуклеотидный номер указан слева.
На фиг.3 показан нозерн-блоттинг транскриптов L1 HPV58 wt и L1 58 R (см. пример 4). Блоттинг выполняли со смесью одинаковых количеств меченых DIG проб ДНК L1 HPV58 wt и L1 58 R. Общее количество подвергавшейся электрофорезу РНК на дорожку указано. Стрелка справа указывает предсказанный размер полноразмерного транскрипта L1 58.
На фиг.4 показан вестерн-блоттинг белков L1 HPV58 wt (58) и L1 58 R (58R). В качестве стандарта включили L1 HPV16 (16). Десять, пять и два с половиной микрограмм общего дрожжевого белкового экстракта подвергали денатурации и вносили в гель, содержащий 10% SDS. Белок L1 HPV58 определяли с применением абсорбированной на дрожжах козьей поликлональной антисыворотки к L1 trpE-HPV31, которая перекрестно связывает L1 58 и L1 16. Маркерная молекулярная масса указана в кДа слева.
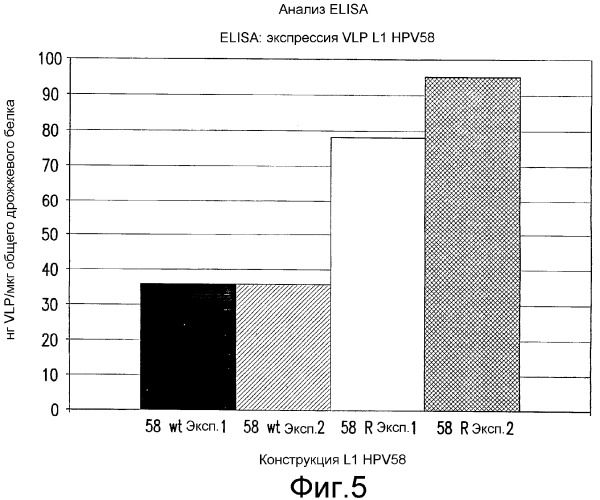
На фиг.5 изображены количество (нг) захваченных и определенных посредством ELISA интактных VLP L1 HPV58 на микрограмм общего дрожжевого белка (см. пример 7). Приведены результаты двух экспериментов, проведенных в дуплетах. Экспрессия VLP L1 HPV58 wt (черный и серый прямоугольники) составила 36 нг/мкг общего дрожжевого белка. Экспрессия VLP L1 HPV58 R (белый и заштрихованный прямоугольники) перестроенного дрожжевого L1 58 с оптимизированными кодонами приблизительно в 2-3 раза выше, чем экспрессия L1 HPV58 wt, и достигает 95 нг/мкг общего дрожжевого белка в эксперименте № 2.
На фиг.6 показан репрезентативный образец VLP HPV58, составленных из описанных здесь белковых молекул HPV58 L1 R, визуализированных посредством трансмиссионной электронной микроскопии (см. пример 8). Черта изображает приблизительно 100 нм.
Подробное описание изобретения
Большинство карцином шейки матки связаны с инфекциями конкретными онкогенными типами папилломавирусов человека (HPV). Настоящее изобретение относится к композициям и способам для установления или повышения иммунитета к белковым продуктам, экспрессируемым генами онкогенных типов HPV. Конкретно, настоящее изобретение относится к полинуклеотидам, кодирующим L1 HPV58, где у полинуклеотидов кодоны оптимизированы для высокого уровня экспрессии в дрожжах. Настоящее изобретение также относится к HPV58 вирусоподобным частицам (VLP), получаемым у дрожжей и описывает применение указанных полинуклеотидов и VLP в фармацевтических композициях и вакцинах для профилактики и/или лечения рака, ассоциированного с HPV.
Описана нуклеотидная последовательность дикого типа L1 HPV58 (Genbank инвентарный номер № NC_001443, см. Kirii et al. Virology 185(1): 424-427 (1991)). Настоящее изобретение относится к синтетическим молекулам ДНК, кодирующим белок L1 HPV58. Синтетические молекулы по настоящему изобретению содержат последовательность кодонов, где, по меньшей мере, некоторые из кодонов заменили с использованием кодонов, предпочтительных для высокого уровня экспрессии, в дрожжевой клетке. Синтетические молекулы можно применять в качестве кодирующей последовательности для экспрессии белка L1 HPV58, способного к самосборке в VLP. Указанные VLP можно применять в вакцине на основе VLP для предоставления эффективной иммунопрофилактики против папилломавирусной инфекции посредством нейтрализующего антитела и опосредованного клетками иммунитета. Такие вакцины на основе VLP также полезны для лечения уже установленных HPV инфекций.
Экспрессия VLP HPV в дрожжевых клетках предлагает преимущества, являющиеся экономически выгодными и легкоадаптируемыми к наращиванию больших количеств в ферментерах. Кроме того, геном дрожжей можно быстро изменять для гарантии отбора рекомбинантных, трансформированных дрожжей с повышенным потенциалом роста и экспрессии. Однако многие белки L1 HPV, включающие в себя L1 HPV58, экспрессируются в дрожжевых клетках на более низких уровнях, чем это желательно для коммерческого масштаба.
Таким образом, настоящее изобретение относится к последовательностям генов L1 HPV58, «оптимизированным» для высокого уровня экспрессии в клеточном окружении дрожжей.
«Триплетный» кодон из четырех возможных нуклеотидных оснований может существовать более чем в 60 вариантах форм. Так как эти кодоны кодируют только 20 различных аминокислот (а также инициацию и терминацию транскрипции), некоторые аминокислоты могут быть кодированы одним или более кодоном, явление, известное как вырожденность генетического кода. По не совсем понятным причинам, альтернативные кодоны неравномерно представлены в эндогенной ДНК различных типов клеток. Действительно, полагают, что существует непостоянная природная иерархия или «предпочтение» определенных кодонов в определенных типах клеток. В качестве одного примера аминокислота лейцин соответствует любому из шести кодонов ДНК, включающих в себя CTA, CTC, CTG, CTT, TTA и TTG. Полный анализ частот использования кодона генома для микроорганизмов показал, что эндогенная ДНК E. coli обычно содержит кодирующий лейцин кодон CTG, в то время как ДНК дрожжей и слизистой плесени чаще всего включает в себя кодирующий лейцин кодон TTA. В свете такой иерархии полагают, что вероятность получения высоких уровней экспрессии богатого лейцином полипептида посредством хозяина E. coli будет зависеть в некоторой степени от частоты использования кодона. Например, вероятно, что богатый кодонами TTA ген будет низкоэкспрессирован в E. coli, тогда как богатый CTG ген, по-видимому, будет высокоэкспрессирован у данного хозяина. Сходным образом, предпочтительным кодоном для экспрессии богатого лейцином полипептида в дрожжевых клетках-хозяевах является TTA.
Значение феномена предпочтения кодона для способов рекомбинантных ДНК является очевидным, а феномен может служить для объяснения многих предыдущих неудач в получении высоких уровней экспрессии экзогенных генов в успешно трансформированных организмах-хозяевах - менее «предпочтительный» кодон может быть многократно представлен во вставленном гене, и механизм для экспрессии клетки-хозяина, возможно, не работает эффективно. Этот феномен означает, что синтетические гены, сконструированные для включения запланированных предпочитаемых клетками-хозяевами кодонов, представляют оптимальную форму чужеродного материала для осуществления экспрессии рекомбинантных белков. Таким образом, один из аспектов по данному изобретению представляет собой ген L1 HPV58 с оптимизированными кодонами для высокого уровня экспрессии в дрожжевой клетке. По предпочтительному варианту осуществления данного изобретения обнаружили, что применение альтернативных кодонов, кодирующих такую же белковую последовательность, может снимать ограничения на экспрессию белков L1 HPV58 дрожжевыми клетками.
По данному изобретению сегменты гена L1 HPV58 конвертировали в последовательности с идентично транслируемыми последовательностями, но с применением альтернативных кодонов, как описано у Sharp and Cowe (Synonymous Codon Usage in Saccharomyces cerevisiae. Yeast 7: 657-678 (1991)), которая включена сюда в качестве ссылки. В общих чертах, принцип состоит в идентификации кодонов в последовательности дикого типа, которые обычно не связаны с высокоэкспрессированными генами дрожжей, и замещение их оптимальными кодонами для высокой экспрессии в дрожжевых клетках. Затем новую последовательность гена проверяют на образованные такими заменами кодонов нежелательные последовательности (например, последовательности «ATTTA», случайное образование участков узнавания сплайсинга интронов, нежелательных участков рестрикционных ферментов, высокого содержания GC, присутствия сигналов терминации транскрипции, узнаваемых дрожжами и т.д.). Нежелательные последовательности элиминируют посредством замещения имеющихся кодонов различными кодонами, кодирующими ту же аминокислоту. Затем сегменты синтетических генов тестируют на повышенную экспрессию.
Описанные выше способы применяли для создания сегментов синтетического гена L1 HPV58, получая ген, содержащий кодоны, оптимизированные для высокого уровня экспрессии. Хотя указанная выше процедура предоставляет описание способа конструирования генов с оптимизированными кодонами для применения в вакцинах против HPV, специалист в данной области поймет, что подобной эффективности вакцины или повышенной экспрессии генов можно достичь посредством незначительных изменений способа или посредством незначительных изменений в последовательности.
Таким образом, настоящее изобретение относится к синтетическому полинуклеотиду, содержащему последовательность нуклеотидов кодирующую белок L1 HPV58, или биологически активному фрагменту или мутантной форме белка L1 HPV58, полинуклеотидной последовательности, содержащей оптимизированные для экспрессии в дрожжевой клетке-хозяине кодоны. Указанные мутантные формы белка L1 HPV58 включают в себя в качестве неограничивающих примеров: замены консервативных аминокислот, укорочения на N-конце, укорочения на карбоксильном конце, делеции или добавления. Любой такой биологически активный фрагмент и/или мутант кодирует белок либо фрагмент белка, который, по меньшей мере, в значительной степени воспроизводит иммунологические свойства белка L1 HPV58, как указано в SEQ ID №: 2. Синтетические полинуклеотиды по настоящему изобретению кодируют молекулы мРНК, экспрессирующие функциональный белок L1 HPV58, так что являются полезными в разработке терапевтической или профилактической вакцины к HPV.
Один из аспектов данного изобретения представляет собой молекула нуклеиновой кислоты с оптимизированными кодонами, кодирующая белок L1 HPV58, как указано в SEQ ID №: 2, указанная молекула нуклеиновой кислоты содержит последовательность нуклеотидов, как указано в SEQ ID №: 1.
Настоящее изобретение также относится к рекомбинантным векторам и рекомбинантным прокариотическим и эукариотическим клеткам-хозяевам, содержащим молекулы нуклеиновых кислот, описанные по всему этому описанию. По предпочтительному варианту осуществления этого изобретения клетка-хозяин представляет собой дрожжевую клетку-хозяина.
Синтетическую ДНК HPV58 или ее фрагменты, сконструированные посредством описанных здесь способов, можно рекомбинантно экспрессировать посредством молекулярного клонирования в экспрессирующий вектор, содержащий пригодный промотор и другие соответствующие регуляторные элементы транскрипции и трансфецированный в прокариотические или эукариотические клетки-хозяева для получения рекомбинантного L1 HPV58. Способы для таких манипуляций полностью описаны у Sambrook et al. (Molecular Cloning: A Laboratory Manual; Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, (1989); Current Protocols in Molecular Biology, Ausubel et al., Green Pub. Associates and Wiley-Interscience, New York (1988); Yeast Genetics: A Laboratory Course Manual, Rose et al., Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, (1990)), которые полностью включены сюда в качестве ссылки.
Таким образом, настоящее изобретение относится к способу экспрессии белка L1 HPV58 в рекомбинантной клетке-хозяине, включающему в себя: (a) введение вектора, содержащего кодирующую белок L1 HPV58 нуклеиновую кислоту, в дрожжевую клетку-хозяина; и (b) культивирование дрожжевых клеток-хозяев в условиях, допускающих экспрессию указанного белка L1 HPV58.
Кроме того, настоящее изобретение относится к способу экспрессии белка L1 HPV58 в рекомбинантной клетке-хозяине, включающему в себя: (a) введение вектора, содержащего кодирующую белок L1 HPV58 нуклеиновую кислоту, в дрожжевую клетку-хозяина; где молекула нуклеиновой кислоты представляет собой молекулу с оптимизированными кодонами для оптимальной экспрессии в дрожжевых клетках-хозяевах; и (b) культивирование дрожжевых клеток-хозяев в условиях, допускающих экспрессию указанного белка L1 HPV58.
Кроме того, данное изобретение относится к способу экспрессии белка L1 HPV58 в рекомбинантной клетке-хозяине, включающему в себя: (a) введение вектора, содержащего нуклеиновую кислоту, как указано в SEQ ID №: 1 в дрожжевую клетку-хозяина; и (b) культивирование дрожжевых клеток-хозяев в условиях, допускающих экспрессию указанного белка L1 HPV58.
Синтетические гены по настоящему изобретению можно собирать в экспрессирующую кассету, содержащую последовательности, сконструированные для обеспечения эффективной экспрессии белка L1 HPV58 в клетке-хозяине. Предпочтительно кассета содержит синтетический ген со связанными последовательностями, контролирующими транскрипцию и трансляцию, функционально связанными с ним, такими как промотор и терминирующие последовательности. По предпочтительному варианту осуществления промотор представляет собой промотор S. cerevisiae GAL1, хотя специалист в данной области поймет, что можно применять любой из ряда других известных дрожжевых промоторов, таких как промоторы GAL10, GAL7, ADH1, TDH3 или PGK, или другие промоторы эукариотических генов. Предпочтительный терминатор транскрипции представляет собой терминатор S. cerevisiae ADH1, хотя также можно применять другие известные терминаторы транскрипции. Особенно предпочтительным является сочетание промотора GAL1 и терминатора ADH1.
Кроме того, данное изобретение относится к выделенному и очищенному полипептиду L1 HPV58, содержащему аминокислотную последовательность, как указано в SEQ ID №: 2.
Еще один аспект данного изобретения представляет собой HPV58 вирусоподобные частицы (VLP), полученные посредством экспрессии в дрожжевой клетке рекомбинантных генов L1 HPV58 или Ll и L2, способам получения HPV58 VLP и способам применения HPV58 VLP. VLP способны к самосборке, когда L1, основной белок капсида папилломавирусов человека и животных, экспрессирован в дрожжах, клетках насекомых, клетках млекопитающих или бактерий (для обзора см. Schiller and Roden, in Papillomavirus Reviews: Current Research on Papillomaviruses; Lacey, ed. Leeds, UK: Leeds Medical Information, pp 101-12 (1996)). Морфологически неотличимые HPV VLP также можно получать посредством экспрессии сочетания капсидных белков L1 и L2. VLP состоят из 72 пентамеров L1 в Т=7 икосаэдрической структуре (Baker et al., Biophys. J. 60(6): 1445-56 (1991)).
VLP морфологически сходны с аутентичными вирионами и способны индуцировать высокие титры нейтрализующих антител при введении животному. Иммунизация VLP кроликов (Breitburd et al., J. Virol. 69(6): 3959-63 (1995)) и собак (Suzich et al., Proc. Natl. Acad. Sci. USA 92(25): 11553-57 (1995)) продемонстрировала индукцию нейтрализующих антител и защиту против экспериментальной папилломавирусной инфекции. Кроме того, так как VLP не содержат потенциально онкогенного вирусного генома и способны к самосборке при экспрессии с одного гена, они представляют безопасную альтернативу применению живого вируса при разработке вакцины к HPV (для обзора см. Schiller and Hidesheim, J. Clin. Virol. 19: 67-74 (2000)).
Таким образом, настоящее изобретение относится к вирусоподобным частицам, содержащим рекомбинантный белок L1 или рекомбинантные белки LI и L2 HPV58, где рекомбинантный белок экспрессирован в дрожжевой клетке.
Как указано выше, по предпочтительному варианту осуществления изобретения VLP HPV58 получают в дрожжах. По дополнительному предпочтительному варианту осуществления дрожжи выбирают из группы, состоящей из: Saccharormyces cerevisiae, Hansenula polymorpha, Pichia pastoris, Kluyveromyces fragilis, Kluyveromyces lactis и Schizosaccharomyces pombe.
Еще один аспект данного изобретения представляет собой VLP HPV58, содержащие белок L1 HPV58, продуцированный с гена L1 HPV58 с оптимизированными кодонами. По предпочтительному варианту осуществления данного аспекта изобретения ген L1 HPV58 с оптимизированными кодонами включает в себя последовательность нуклеотидов, как указано в SEQ ID №: 1.
Еще один аспект данного изобретения представляет собой способ получения VLP HPV58, включающий в себя: (a) трансформацию дрожжей молекулой рекомбинантной ДНК, кодирующей белок L1 HPV58 или белки Ll и L2 HPV58; (b) культивирование трансформированных дрожжей в условиях, допускающих экспрессию молекулы рекомбинантной ДНК, для продукции рекомбинантного белка HPV58; и (c) выделение рекомбинантного белка HPV58 для получения VLP HPV58.
По предпочтительному варианту осуществления данного аспекта изобретения дрожжи трансформируют геном L1 HPV58 с оптимизированными кодонами для получения VLP HPV58. По особенно предпочтительному варианту осуществления ген L1 HPV58 с оптимизированными кодонами содержит последовательность нуклеотидов, как указано в SEQ ID №:1.
Данное изобретение также относится к способу индукции иммунного ответа у животного, предусматривающему введение животному вирусоподобных частиц HPV58. По предпочтительному варианту осуществления VLP HPV58 получают с гена с оптимизированными кодонами.
Еще один аспект данного изобретения представляет собой способ профилактики и/или лечения рака шейки матки, ассоциированного с HPV, включающий в себя введение млекопитающему содержащей VLP HPV58 вакцины. По предпочтительному варианту осуществления данного аспекта изобретения VLP HPV58 получают в дрожжах.
Данное изобретение также относится к содержащей вирусоподобные частицы (VLP) HPV58 вакцине.
По альтернативному варианту осуществления данного аспекта изобретения вакцина дополнительно содержит VLP, по меньшей мере, одного дополнительного типа HPV. По предпочтительному варианту осуществления, по меньшей мере, один дополнительный тип HPV выбирают из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV55, HPV56, HPV59 и HPV68.
По предпочтительному варианту осуществления данного аспекта изобретения вакцина дополнительно содержит VLP HPV16.
По еще одному предпочтительному варианту осуществления изобретения вакцина дополнительно содержит VLP HPV16 и VLP HPV18.
По еще одному предпочтительному варианту осуществления изобретения вакцина дополнительно содержит VLP HPV16, VLP HPV11, VLP HPV16 и VLP HPV18.
Данное изобретение также относится к фармацевтическим композициям, содержащим вирусоподобные частицы HPV58. Кроме того, данное изобретение относится к фармацевтическим композициям, содержащим вирусоподобные частицы HPV58 и VLP, по меньшей мере, одного дополнительного типа HPV. По предпочтительному варианту осуществления, по меньшей мере, один дополнительный тип HPV выбирают из группы, состоящей из: HPV6, HPV11, HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV55, HPV56, HPV59 и HPV68.
Композиции вакцин по настоящему изобретению можно применять по отдельности в соответствующих дозах, допускающих оптимальное ингибирование инфекции HPV58 с минимальной потенциальной токсичностью. Кроме того, желательным может быть совместное введение или последовательное введение других средств.
Количество вирусоподобных частиц, вводимых в вакцинного реципиента, зависит от иммуногенности продукта экспрессированного гена. Обычно иммунологически или профилактически эффективную дозу приблизительно от 10 мкг до 100 мкг, и предпочтительно от 20 мкг до 60 мкг VLP, вводят прямо в мышечную ткань. Также предусматривают подкожную инъекцию, внутрикожное введение, чрескожное внедрение и другие способы введения, такие как внутрибрюшинная, внутривенная или ингаляционная доставка. Также предусматривают, что можно выполнять повторные иммунизации. Также предпочтительно парентеральное введение, такое как внутривенное, внутримышечное, подкожное и другие способы введения с адъювантами, такими как квасцы или алюминиевый адъювант Merck, одновременно с подкожным или парентеральным введением вакцины по данному изобретению.
Все указанные здесь публикации включены в качестве ссылки с целью описания и сообщения способов и материалов, которые можно применять в связи с настоящим изобретением. Ничего здесь не следует понимать как признание того, что изобретение не имеет право на противопоставление такому описанию на основании предшествующего изобретения.
Имея предпочтительные варианты осуществления изобретения со ссылкой на сопровождающие чертежи, необходимо понимать, что изобретение не ограничено точно такими вариантами осуществления, и что в них можно проводить различные изменения и модификации при помощи специалиста в данной области, не отступая от возможностей или смысла изобретения, определенного в прилагаемой формуле изобретения.
Следующие ниже примеры иллюстрируют, но не ограничивают изобретение.
Пример 1
Определение репрезентативной последовательности L1 HPV58
Последовательность L1 HPV58 была описана ранее (Genbank инвентарный номер № NC_001443). Однако нередко находят незначительные вариации последовательности между ДНК, полученными из клинических изолятов. Для определения репрезентативной последовательности дикого типа L1 HPV58, ДНК выделяли из трех клинических образцов, содержащих, как показано ранее, ДНК HPV58. Последовательности L1 HPV58 амплифицировали посредством полимеразной цепной реакции (GWH) с применением Taq ДНК полимеразы и следующих праймеров: L1 HPV58 F 5'-ATGTCCGTGTGGCGGCCTAG-3' (SEQ ID №: 4)и 58 3'11 BgIII 5'-GAGAT CTGTGTAAGTACCACAACAATTA-3'(SEQ ID №: 5). Амплифицированные продукты подвергали электрофорезу в агарозных гелях и визуализировали посредством окрашивания бромистым этидием.
Полосы L1 ≈1500 п.н. вырезали, а ДНК очищали с применением Geneclean Spin Kit (Q-Bio Gene, Carlsbad, CA). Затем ДНК лигировали в клонирующий вектор TA pCR2.1 (Invitrogen). TOP10F' E. Coli трансформировали лигазной смесью и высевали на агар LB с ампициллином совместно с IPTG и X-gal для бело/голубой селекции колоний. Чашки переворачивали и инкубировали в течение 16 часов при 37°C. Для экстракции плазмидной ДНК применяли минипреп.
Чтобы продемонстрировать присутствие гена L1 в плазмидах, проводили расщепление рестрикционными эндонуклеазами. Фрагменты рестрикции изучали посредством электрофореза в агарозном геле и окрашивания бром