Замещенные 2-ацил-2-аминотиазолы
Иллюстрации
Показать всеИзобретение относится к замещенным N-ацил-2-аминотиазолам формулы (I) и их фармацевтически приемлемым солям в качестве антагониста аденозинового рецептора А2В и к фармацевтической композиции на их основе. Соединения могут найти применение для лечения и профилактики заболеваний, опосредованных рецепторами аденозина А2В, таких как диабет, диабетическая ретинопатия, астма и диарея. В общей формуле (I)
Х представляет собой -СН2-, -СН2СН2-, -(СН2)3- и O(СН2)-; R представляет собой 5- или 6-членную насыщенную или ненасыщенную карбоциклическую или гетероциклическую кольцевую систему, которая необязательно может содержать один или более гетероатомов, выбранных из N, О и S, причем указанная кольцевая система необязательно замещена одним или более заместителями, выбранными из группы, которая состоит из галогена, гидрокси, низшего алкила, нитрильной группы, сульфонамидо, аминосульфонила, низшего алкоксикарбонила, низшего алкилсульфонила, бензила, бензоила, фенилсульфонила, и указанный бензил, бензоил или фенилсульфонил необязательно замещены галогеном, группой тригалогено-низший алкил; R1 выбирают из группы, состоящей из водорода, галогена или низшей алкоксигруппы. 5 н. и 6 з.п. ф-лы.
Реферат
Настоящее изобретение относится к новым замещенным N-ацил-2-аминотиазолам формулы (I)
или их фармацевтически приемлемым солям, где X, R и R1 являются такими, как описано в тексте настоящей заявки. Эти соединения, как полагают, в первую очередь являются антагонистами аденозинового 2В рецептора и, таким образом, эффективны при лечении диабета, диабетической ретинопатии, астмы и диареи.
Аденозин представляет собой физиологически активное вещество, которое продуцируется во множестве тканей и является медиатором различных функций, встречаясь в виде четырех рецепторных подтипов, A1, A2A, А2В и A3. Все четыре рецептора относятся к классу рецепторов, слитых с G-белком (GPCR), которые содержат несколько спиралеобразных гидрофобных доменов, располагаются в клеточной мембране, соединяясь посредством гидрофильного внеклеточного и гидрофильного внутриклеточного участков петель. А1 и A3 рецепторы слиты с Gi и Go белками, в то время как А2А- и А2В-рецепторы слиты с Gs белками. Вследствие этих различий аденозин подает сигнал о повышении содержания цАМФ (циклического аденозинмонофосфата) внутри клетки посредством воздействия на А2А- и А2В-рецепторы и подает сигнал о понижении через А1 и A3-рецепторы. Дополнительно аденозин повышает внутриклеточное содержание ионов кальция посредством воздействия на А2В-рецептор, вследствие того, что слит с Gq-белками.
Соединения формулы I обладают значительной антагонистической активностью в отношении А2В-рецептора человека, что подтверждается измерениями при проведении исследования на клетках СНО-А2В-цАМФ. Эти соединения также обладают остаточной антагонистической активностью в отношении рецепторов А1 человека и А2А человека, что подтверждается измерениями при проведении радиологического исследования связывания с лигандами.
Исследование роли функциональной активности А2В-рецептора с использованием различных типов клеток осложняется отсутствием селективных А2В агонистов и антагонистов в отношении этих трех рецепторов. Обычно о функциональной активности в отношении А2В-рецепторов делают вывод по отсутствию эффекта селективных агонистов и антагонистов в отношении других трех аденозиновых рецепторов, наряду с проявлением реакции на NECA, сильный и неселективный агонист аденозинового рецептора. Обычно роль в отношении А2В-рецептора для данного типа клеток идентифицируют в том случае, когда наблюдается следующий однозначно определяемый порядок агонистической активности: NECA (неселективный)>РIА (А1-селективный агонист) > IВ-МЕСА (A3-селективный агонист)>СGS-21680 (А2А-селективный агонист).
Относительную эффективность аденозина в отношении четырех рецепторов определяют следующим образом: А1(ЕС50-0,31 мкМ)>А3(ЕС50-0,29 мкМ)>А2А(EC50-0,7)>А2В(ЕС50-24 мкМ), что предполагает особое значение А2В-рецептора в случае хронических, стрессовых состояний при интенсивных окислительных процессах, включая, но не ограничиваясь указанным, гипергликемию, активацию тучных клеток и воспалительные состояния желудочно-кишечного тракта. Несмотря на низкую антагонистическую эффективность аденозина по отношению к А2В-рецепторам, сообщалось о множестве соединений с высокой антагонистической эффективностью по отношению к А2В-рецепторам.
Используя специфические агонисты и антагонисты, исследователи компании «Eisai» показали ключевую роль антагонизма в отношении А2В-рецепторов при ингибировании продуцирования глюкозы печенью, а также показали, что эффективный антагонист А2В-рецептора и ингибитор продуцирования глюкозы первичными непатоцитами мыши приводят к снижению уровня глюкозы натощак и после приема пищи у мышей линии КК-Ау, на хорошо известной модели диабета типа 2. Таким образом, соединения согласно настоящему изобретению могут быть использованы для профилактики и/или лечения диабета типа 2.
А2В-рецепторы также располагаются в плазматических мембранах эндотелиальных клеток и, как было обнаружено, стимулируют их рост. Следовательно, это приводит к росту новых кровеносных сосудов (к ангиогенезу). Объектом настоящего изобретения является профилактика и/или лечение заболеваний, которые характеризуются аномальным ростом сосудов, например, таких как диабетическая ретинопатия.
Анализ иммунофлуоресцентными методами с использованием специфических анти-А2В антител человека свидетельствует о наличии А2В-рецепторов в тучных клетках легкого человека, полученных от астматиков посредством бронхоальвеолярного лаважа. Таким образом, использование соединения формулы I позволяет создать способ профилактики и/или лечения астмы, бронхоспастических и аллергических заболеваний, а также других обструктивных заболеваний воздушных путей.
А2В-рецепторы обнаружены в толстой кишке в базолатеральных доменах эпителиальных клеток кишечника, что приводит к повышению секреции хлорид-иона как реакции на воспаление желудочно-кишечного тракта при таких заболеваниях как, например, диарея. Таким образом, соединения формулы I позволяют создать способ лечения воспалительных заболеваний желудочно-кишечного тракта, включая диарею.
Соединения согласно настоящему изобретению также обладают значительной антагонистической активностью в отношении А1- и А2А-рецепторов, в дополнение к А2В-рецепторам. Таким образом, соединения формулы I позволяют разработать способы лечения заболеваний, при которых имеет значение антагонистическое воздействие на аденозиновые A1, A2A и А2В-рецепторы, например разработать способ лечения такого заболевания как депрессия, болезнь Паркинсона и повышенное артериальное давление (гипертензия).
Некоторые замещенные N-ациламинотиазолы известны из предшествующего уровня техники, например, инденотиазолилфосфонаты описаны в патенте США 5480874; 2-амино-6-гидроксибензотиазолы в патенте США 4929623; 2-бензоиламинонафто[1,2-d]тиазолы - в статье в Synthetic Communications (1993), 23(17), 2347-53; бензамидо- и 2-ацетамидопроизводные бензотиазолов - в Indian Drugs, (1985), 23(3), 146-51, а некоторые производные ациламинотиазолов - в патенте США 5189049. В патенте США 4877876 описаны производные 2-замещенных 8Н-индено[1,2-d]тиазолов, которые близки по своей структуре к соединениям согласно настоящему изобретению.
Более конкретно, настоящее изобретение относится к соединениям формулы (I)
или их фармацевтически приемлемым солям, где
Х представляет собой -СН2-, -CH2CH2-, -СНСН-, -(CH2)3- и -O(СН2)-;
R представляет собой алкильную группу, алкенильную группу, -NHR' или 5- или 6-членную насыщенную или ненасыщенную карбоциклическую или гетероциклическую кольцевую систему, которая необязательно может содержать один или более гетероатомов, причем указанная кольцевая система необязательно замещена одним или более заместителями, выбранными из группы, которая состоит из галогена, гидрокси, низшего алкила, ацетамидометила, алкоксикарбониламидометила, нитрильной группы, группы сульфонамидо, алкилсульфонила, алкокси, бензила, бензоила, арилсульфонила и ацила, указанный бензил, бензоил или арилсульфонил необязательно замещены галогеном, группой тригалоген-низший алкил, низшим алкилом, алкокси, алкилсульфонилом или циано;
R1 выбирают из группы, состоящей из водорода, галогена, низшего алкила, алкокси или нитрильной группы;
R' представляет собой алкильную группу или 5- или 6-членную насыщенную или ненасыщенную карбоциклическую или гетероциклическую кольцевую систему, которая необязательно может содержать один или более гетероатомов, причем указанная кольцевая система необязательно замещена одним или более заместителями, выбранными из группы, которая состоит из галогена, низшего алкила, нитрильной группы, алкилсульфонила, алкокси и ацила.
Соединения согласно настоящему изобретению проявляют исходную активность в качестве агонистов аденозиновых А2В рецепторов и таким образом могут быть использованы для лечения заболеваний, опосредованных таким рецептором. Соединения согласно настоящему изобретению могут быть использованы в качестве активных агентов при профилактике и лечении таких заболеваний, как, например, диабет, диабетическая ретинопатия, астма и диарея. Вторичный антагонизм аденозиновых А1 и А2А рецепторов позволяет использовать соединения согласно настоящему изобретению в случае депрессии, болезни Паркинсона и повышенного артериального давления (гипертензии).
Объектами настоящего изобретения являются соединения формулы I и их фармацевтически приемлемые соли, а также их энантиомерные формы, получение вышеуказанных соединений, лекарственные средства, содержащие эти соединения, и их получение, а также способы применения вышеуказанных соединений для контроля или профилактики заболеваний, в особенности заболеваний, нарушений и расстройств, указанных выше, или для приготовления соответствующих лекарственных средств.
Соединения формулы (I) по отдельности являются предпочтительными, также по отдельности предпочтительны их физиологически приемлемые соли, причем соединения формулы (I) являются особенно предпочтительными.
Соединения формулы (I) могут содержать один или более асимметричных атомов С и таким образом могут существовать в виде смеси энантиомеров, смеси диастереомеров или в виде оптически чистых соединений.
Предпочтительные соединения формулы (I), которые описаны выше, характеризуются формулой (IA)
или представляют собой фармацевтически приемлемые соли этого соединения, где
Х представляет собой -СН2-, -СН2СН2-, -СНСН-, -(СH2)3- и O(СН2)-;
R представляет собой алкильную группу, -NHR' или 5- или 6-членную насыщенную или ненасыщенную карбоциклическую или гетероциклическую кольцевую систему, которая необязательно может содержать один или более гетероатомов, причем указанная кольцевая система необязательно замещена одним или более заместителями, выбранными из группы, которая состоит из галогена, низшего алкила, нитрильной группы, алкилсульфонила, алкокси и ацила, и
R' представляет собой алкильную группу или 5- или 6-членную насыщенную или ненасыщенную карбоциклическую или гетероциклическую кольцевую систему, которая необязательно может содержать один или более гетероатомов, причем указанная кольцевая система необязательно замещена одним или более заместителями, выбранными из группы, которая состоит из галогена, низшего алкила, нитрильной группы, алкилсульфонила, алкокси и ацила.
Предпочтительными являются такие соединения формулы (I), как описано выше, где R представляет собой алкильную группу, алкенильную группу или 5- или 6-членную насыщенную или ненасыщенную карбоциклическую или гетероциклическую кольцевую систему, которая необязательно может содержать один или более гетероатомов, причем указанная кольцевая система необязательно замещена одним или более заместителями, выбранными из группы, которая состоит из галогена, гидрокси, низшего алкила, ацетамидометила, алкоксикарбониламидометила, нитрильной группы, группы сульфонамидо, алкилсульфонила, алкокси, бензила, бензоила, арилсульфонила и ацила; указанный бензил, бензоил или арилсульфонил необязательно замещены галогеном, группой тригалоген-низший алкил, низшим алкилом, алкокси, алкилсульфонилом или циано.
Кроме того, предпочтительными являются такие соединения, где Х представляет собой -СН2-. Другими предпочтительными соединениями являются такие соединения, где R1 представляет собой водород, галоген или низший алкокси. Водород, галоген и низший алкокси по отдельности образуют предпочтительный вариант осуществления изобретения в отношении R1.
Другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы (I), как описано выше, где R представляет собой низший алкил, низший алкенил, фенил или гетероциклическую кольцевую систему, выбранную из группы, которая состоит из тиенила, пиридинила, пиразолила, имидазолила, фурила или пиперидинила; указанный фенил или гетероциклическая кольцевая система необязательно замещены заместителями в количестве от 1 до 3, выбранными из группы, которая состоит из галогена, гидрокси, нитрила, низшего алкила, сульфонамидо, низшего алкилсульфонила, низшего алкоксикарбонила, низшего алкокси-С(O)-NH-СН2-, бензила, который необязательно замещен радикалом CF3, бензоила, который необязательно замещен радикалом CF3, или фенилсульфонила, который необязательно замещен радикалом CF3.
Другие предпочтительно соединения, как указано выше, являются такими соединениями, где R представляет собой низший алкенил или гетероциклическую кольцевую систему, выбранную из группы, которая состоит из тиенила, пиридинила, пиразолила, имидазолила, фурила или пиперидинила, указанная гетероциклическая кольцевая система необязательно замещена заместителями в количестве от 1 до 3, выбранными из группы, которая состоит из галогена, гидрокси, нитрила, низшего алкила, сульфонамидо, низшего алкилсульфонила, низшего алкоксикарбонила, низшего алкокси-С(O)-NH-СН2-, бензила, который необязательно замещен радикалом CF3, бензоила, который необязательно замещен радикалом CF3, или фенилсульфонила, который необязательно замещен радикалом CF3.
В случае соединений формулы (I), как определено выше, предпочтительно R не представляет собой фенил, 4-NO2-фенил или 4-Cl-фенил, в особенности в том случае, когда Х означает -СН2- и R1 представляет собой водород. Кроме того, в случае соединений формулы (I), как определено выше, предпочтительно, если R не представляет собой фенил, 4-NO2-фенил или 4-Cl-фенил, в особенности, если Х означает -СН2СН2- и R1 представляет собой водород или алкокси. Кроме того, в случае соединений формулы (I), как определено выше, предпочтительно, если R не представляет собой алкил, в особенности, в том случае, когда Х представляет собой -СН2СН2- и R1 представляет собой водород.
Каждый из приведенных в качестве примера заместителей X, R и R1, как в соединениях, упомянутых ниже и в примерах, по отдельности и в каждой из комбинаций, представляет предпочтительный вариант осуществления изобретения, предпочтительно в конкретных комбинациях, которые указаны выше и в примерах.
Особенно предпочтительные соединения включают следующие соединения:
N-(8Н-индено[1,2-d]тиазол-2-ил)бензамид,
4-фтор-N-(8Н-индено[1,2-d]тиазол-2-ил)бензамид,
4-циано-N-(8Н-индено[1,2-d]тиазол-2-ил)бензамид,
N-(8Н-индено[1,2-d]тиазол-2-ил)-4-метилбензамид,
тиофен-2-карбоновой кислоты (8Н-индено[1,2-d]тиазол-2-ил)амид,
N-(8Н-индено[1,2-d]тиазол-2-ил)никотинамид,
N-(8Н-индено[1,2-d]тиазол-2-ил)изоникотинамид,
(8Н-индено[1,2-d]тиазол-2-ил)амид 2-метил-2Н-пиразол-3-карбоновой кислоты,
N-(6-хлор-8Н-индено[1,2-d]тиазол-2-ил)изоникотинамид,
1Н-пиразол-4-карбоновой кислоты (8Н-индено[1,2-d]тиазол-2-ил)амид,
N-(4,5-дигидронафто[1,2-d]тиазол-2-ил)изоникотинамид,
N-(5,6-дигидро-4Н-3-тиа-1-азабензо[е]азулен-2-ил)изоникотинамид,
N-(4Н-хромено[4,3-d]тиазол-2-ил)изоникотинамид,
N-нафто[1,2-d]тиазол-2-илизоникотинамид,
трифторацетат (8Н-индено[1,2-d]тиазол-2-ил)амида 3-метил-3H-имидазол-4-карбоновой кислоты,
трет-бутиловый эфир 4-(8Н-инденол[1,2-d]тиазол-2-илкарбамоил)-
пиперидин-1-карбоновой кислоты,
(8Н-индено[1,2-d]тиaзoл-2-ил)aмид 3-(трифторметилбензоил)пиперидин-4-карбоновой кислоты,
(9H-индeнo[l,2-d]тиaзoл-2-ил)aмид 1-(3-трифторметилбензил)пиперидин-4-карбоновой кислоты,
(8Н-индено[1,2-d]тиaзoл-2-илaмид 1-(3-трифторметилбензолсульфонил)пиперидин-4-карбоновой кислоты,
N-(8Н-индено[1,2-d]тиазол-2-ил)-3-фторбензамид,
N-(8Н-индено[1,2-d]тиазол-2-ил)-3-гидроксибензамид,
N-(8H-индeнo[1,2-d]тиaзoл-2-ил)-2-мeтилпeнт-5-eнoилaмид,
N-(8Н-индено[1,2-d]тиaзoл-2-ил)-2-мeтилбyтaнoилaмид,
N-(8H-индeнo[1,2-d]тиaзoл-2-ил)-5-мeтилcyльфoнилтиoфeн-2-карбоксиамид,
N-(8H-индeнo[l,2-d]тиaзoл-2-ил)-2-фуpoилaмид,
N-(6-фтор-8Н-индено[1,2-d]тиaзoл-2-ил)-4-гидpoкcиникoтинaмид,
N-(6-фтор-8Н-индено[1,2-d]тиазол-2-ил)(4-аминосульфонил)бензамид,
N-(6-фтор-8Н-индено[1,2-d]тиазол-2-ил)-(4-трет-бутоксикарбонилметил)бензамид,
N-(6-фтор-8Н-индено[1,2-d]тиaзoл-2-ил)тиoфeн-3-кapбoкcиaмид,
N-(4,5-дигидpoнaфтo[1,2-d]тиaзoл-2-ил)-4-гидpoкcиникoтинaмид,
N-(4,5-дигидронафто[1,2-d]тиазол-2-ил)тиофен-3-карбоксиамид,
N-(4,5-дигидpo-7-мeтoкcинaфтo[1,2-d]тиaзoл-2-ил)-4-гидpoкcиникoтинамид,
N-(4,5-дигидpo-7-мeтoкcинaфтo[1,2-d]тиaзoл-2-ил)-5-мeтилcyльфoнилтиофен-2-карбоксиамид,
N-(5,6-дигидро-4Н-3-тиа-1-азабензо[е]азулен-2-ил)-4-гидроксиникотинамид,
N-(5,6-дигидро-4Н-3-тиа-1-азабензо[е]азулен-2-ил)тиофен-3-карбоксиамид,
N-(8Н-индено[1,2-d]тиазол-2-ил) 3-хлор-4-гидроксибензамид и
N-(8Н-индено[1,2-d]тиазол-2-ил) (4-аминосульфонил)бензамид.
Каждое из соединений, указанных выше, по отдельности представляет собой предпочтительный вариант осуществления настоящего изобретения.
Предпочтительные соединения формулы (I), как описано выше, представляют собой соединения, выбранные из группы, которая состоит из следующих соединений:
N-(8Н-индено[1,2-d]тиазол-2-ил)бензамид,
4-фтор-N-(8Н-индено[1,2-d]тиазол-2-ил)бензамид,
4-циано-N-(8Н-индено[1,2-d]тиазол-2-ил)бензамид,
N-(8Н-индено[1,2-d]тиазол-2-ил)-4-метилбензамид,
(8Н-индено[1,2-d]тиазол-2-ил)амид тиофен-2-карбоновой кислоты,
N-(8Н-индено[1,2-d]тиазол-2-ил)никотинамид,
N-(8Н-индено[1,2-d]тиазол-2-ил)изоникотинамид,
(8Н-индено[1,2-d]тиазол-2-ил)амид 2-метил-2Н-пиразол-3-карбоновой кислоты,
N-(6-хлор-8Н-индено[1,2-d]тиазол-2-ил)изоникотинамид,
1Н-пиразол-4-карбоновой кислоты (8Н-индено[1,2-d]тиазол-2-ил)амид,
N-(4,5-дигидронафто[1,2-d]тиазол-2-ил)изоникотинамид,
N-(5,6-дигидро-4Н-3-тиа-1-азабензо[е]азулен-2-ил)изоникотинамид,
N-(4H-xpoмeнo[4,3-d]тиaзoл-2-ил)изoникoтинaмид,
N-нафто[1,2-d]тиaзoл-2-илизoникoтинaмид и
трифторацетат (8Н-индено[1,2-d]тиазол-2-ил)амида 3-метил-3Н-имидазол-4-карбоновой кислоты трифторацетат.
Другие предпочтительные соединения формулы (I), как описано выше, представляют собой соединения, выбранные из группы, которая состоит из следующих соединений:
трет-бутиловый эфир 4-(8Н-инденол[1,2-d]тиазол-2-илкарбамоил)пиперидин-1-карбоновая кислота,
(8Н-индено[1,2-d]тиазол-2-ил)амид 3-(трифторметилбензоил)пиперидин-4-карбоновая кислота,
(9Н-индено[1,2-d]тиазол-2-ил)амид 1-(3-трифторметилбензил)пиперидин-4-карбоновая кислота,
(8Н-индено[1,2-d]тиазол-2-иламид 1-(3-трифторметил-
бензолсульфонил)пиперидин-4-карбоновой кислоты,
N-(8Н-индено[1,2-d]тиазол-2-ил)-3-фторбензамид,
N-(8Н-индено[1,2-d]тиaзoл-2-ил)-3-гидpoкcибeнзaмид,
N-(8Н-индено[1,2-d]тиазол-2-ил)-2-метилпент-5-еноиламид,
N-(8Н-индено[1,2-d]тиазол-2-ил)-2-метилбутаноиламид,
N-(8Н-индено[1,2-d]тиазол-2-ил)-5-метилсульфонилтиофен-2-карбоксиамид,
N-(8H-индeнo[l,2-d]тиaзoл-2-ил)-2-фypoилaмид и
N-(6-фтор-8Н-индено[1,2-d]тиазол-2-ил)-4-гидроксиникотинамид.
Другие предпочтительные соединения формулы (I), как описано выше, представляют собой соединения, выбранные из группы, которая состоит из следующего:
N-(6-фтор-8Н-индено[1,2-d]тиазол-2-ил)(4-аминосульфонил)бензамид,
N-(6-фтор-8Н-индено[1,2-d]тиазол-2-ил)(4-трет-бутоксикарбонилметил)бензамид,
N-(6-фтор-8Н-индено[1,2-d]тиазол-2-ил)тиофен-3-карбоксиамид,
N-(4,5-дигидpoнaфтo[1,2-d]тиaзoл-2-ил)-4-гидpoкcиникoтинaмид,
N-(4,5-дигидронафто[1,2-d]тиазол-2-ил)тиофен-3-карбоксиамид,
N-(4,5-дигидpo-7-мeтoкcинaфтo[1,2-d]тиaзoл-2-ил)-4-гидpoкcиникотинамид,
N-(4,5-дигидpo-7-мeтoкcинaфтo[1,2-d]тиaзoл-2-ил)-5-мeтилcyльфoнилтиофен-2-карбоксиамид,
N-(5,6-дигидро-4Н-3-тиа-1-азабензо[е]азулен-2-ил)-4-гидроксиникотинамид,
N-(5,6-дигидpo-4H-3-тиa-l-aзaбeнзo[e]aзyлeн-2-ил)тиoфeн-3-карбоксиамид,
N-(8Н-индено[1,2-d]тиазол-2-ил)-3-хлор-4-гидроксибензамид и
N-(8Н-индено[1,2-d]тиазол-2-ил)(4-аминосульфонил)бензамид.
Необходимо отметить, что соединения общей формулы (I) согласно настоящему изобретению могут быть подвергнуты дериватизации по функциональной группе с получением при этом производных, которые способны к обратному превращению в материнское соединение in vivo.
Другой вариант осуществления настоящего изобретения относится к способу получения соединений формулы (I), как определено выше, указанный способ включает взаимодействие соединения формулы (II)
с соединением R-C(O)Cl, в которых R, R1 и Х являются такими, как указано выше.
Подходящие условия реакции указаны на схемах 1 и 2, а также в примерах.
Кроме того, настоящее изобретение относится к соединениям формулы (I), как определено выше, которые получают способом по п.9.
Если не указано иное, то для определения и иллюстрации значения и объема различных терминов, используемых в тексте настоящей заявки, применяются следующие определения.
В тексте настоящей заявки термин "низший" используется для обозначения группы, содержащей от одного до шести атомов углерода, предпочтительно от одного до четырех атомов углерода.
Термин "алкил" означает насыщенную алифатическую углеводородную группу с линейной или разветвленной цепью. Алкильные группы предпочтительно содержат от 1 до 20 атомов углерода, более предпочтительно от 1 до 16 атомов углерода, еще более предпочтительно от 1 до 10 атомов углерода. Низшие алкильные группы, описанные ниже, также являются предпочтительными алкильными группами.
Термин "низшие алкильные" группы означают С1-С6 алкильные группы и включают метил, этил, пропил, изопропил, бутил, трет-бутил, 2-бутил, пентил, гексил и т.п. Как правило, низший алкил предпочтительно представляет собой C1-C4 алкил и более предпочтительно C1-С3 алкил.
Термин "тригалоген-низший алкил" означает низшую алкильную группу, которая является замещенной 3 атомами галогена. CF3 является предпочтительной группой тригалоген-низший алкил.
Термин "алкокси" означает -O-алкил. "Низший алкокси" означает -O-низший алкил.
Термин "алкенил" относится к углеводородной группе с линейной или разветвленной цепью, включающей олефиновую связь и вплоть до 7, предпочтительно до 4, атомов углерода, например к такой группе, как 2-пропенил.
Термин "карбоциклическая" относится к 5- или 6-членной насыщенной или ненасыщенной углеродсодержащей кольцевой системе, например, такой как арильная кольцевая система.
Термин "гетероциклическая" относится к 5- или 6-членной кольцевой системе, которая может включать 1, 2 или 3 атома, выбранных из азота, кислорода и/или серы, например к такой кольцевой системе, как тетрагидропиридин, дигидрофуран, дигидропиран, фурил, пирролил, пиридил, 1,2-, 1,3- и 1,4-диазинил, тиенил, оксазолил, оксадиазолил, изоксазолил, тиазолил, изотиазолил или имидазолил. Гетероциклическая группа может быть необязательно замещенной арильной группой. Как указывалось выше, гетероциклическая группа может быть замещенной различными заместителями, и в случае бензильного, бензоильного и арилсульфонильного заместителей указанные заместители могут быть дополнительно замещены галогеном, тригалогензамещенным низшим алкилом, низшим алкилом, алкокси, алкилсульфонилом или циано.
Термин "галоген" означает атом, выбранный из хлора, фтора и брома.
Термин "эффективное количество" означает такое количество, которое является эффективным для профилактики, ослабления или устранения симптомов заболеваний или продления жизни субъекта, который получает лечение.
Термин "гетероатом" означает атом, выбранный из N, О и S.
Термин "IC50" относится к такой концентрации конкретного соединения, которая необходима для ингибирования 50% конкретной измеряемой активности. IC50 может быть измерена, в частности, таким образом, как описано далее.
Термин "арил" означает моновалентный, моноциклический или бициклический, ароматический карбоциклический углеводородный радикал, предпочтительно, 5- - 6-членную ароматическую кольцевую систему. Примером такого радикала является фенил.
Термин "ацил" означает -С(O)-С1-С6-алкил, -С(O)Н или С(O)-O алкил.
Термин "фармацевтически приемлемый сложный эфир" относится к этерифицированному обычным образом соединению формулы I, содержащему карбоксильную группу, указанный сложный эфир сохраняет биологическое действие и свойства соединений формулы I и расщепляется in vivo (в организме) с образованием при этом соответствующей активной карбоновой кислоты.
Информацию, касающуюся сложных эфиров, а также информацию относительно применения сложных эфиров для доставки фармацевтически активных соединений, можно найти в Design of Prodrugs. Bundgaard H ed. (Elsevier, 1985), и в H. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Ed. 1995), pp.108-109; Krogsgaard-Larsen et al., Textbook of Drug Design and Development (2d Ed. 1996), pp.152-191.
Термин "фармацевтически приемлемая соль" относится к общеизвестным аддитивным солям с кислотами или основаниями, которые сохраняют биологическое действие и свойства соединений согласно настоящему изобретению и которые образованы из подходящих нетоксичных органических или неорганических кислот или органических или неорганических. Примеры аддитивных солей с кислотами включают такие соли, полученные с использованием неорганических кислот, например, таких как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота и азотная кислота, и аддитивные соли с кислотами, полученные с использованием органических кислот, например, таких как п-толуолсульфоновая кислота, салициловая кислота, метансульфоновая кислота, щавелевая кислота, янтарная кислота (бутандикислота), лимонная кислота, яблочная кислота, молочная кислота, фумаровая кислота и т.п. Примеры аддитивных солей с основаниями включают соли, полученные с использованием гидроксидов аммония, калия, натрия и четвертичных аммониевых гидроксидов, например, таких как гидроксид тетраметиламмония. Химическая модификация фармацевтически активного соединения (т.е. лекарственного средства) с получением при этом соли представляет собой методику, хорошо известную в области фармацевтической химии и используемую для повышения физической и химической стабильности, гигроскопичности, сыпучести и растворимости соединений. См., например, H.Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Ed. 1995), pp.196, 1456-1457.
Термин "фармацевтически приемлемый", например фармацевтически приемлемый носитель, наполнитель и т.п., относится к агенту, фармакологически приемлемому и по существу нетоксичному для пациента, которому вводят конкретное соединение.
Термин "замещенный" означает, что замещение может быть осуществлено в одном или более положений и, если не указано иное, что заместители в каждом случае замещения независимо выбирают из конкретных возможностей замещения.
Соединения формулы (I) могут быть получены с использованием способов, приведенных ниже, с использованием способов, приведенных в примерах, или аналогичными способами. Подходящие условия реакции для проведения конкретной стадии взаимодействия известны специалисту в данной области из предшествующего уровня техники. Исходные вещества являются либо коммерчески доступными, либо могут быть получены с использованием способов, приведенных ниже или в примерах, или с использованием способов, известных из предшествующего уровня техники.
Соединения формулы I и/или их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств, например, в виде фармацевтических препаратов для энтерального, парентерального или местного введения. Они могут быть введены, например, перорально, например, в виде таблеток, таблеток с оболочкой, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий, ректально, например, в виде суппозиториев, парентерально, например, в виде растворов для инъекций или инфузий, или местно, например, в виде мазей, кремов или масел. Пероральное введение является предпочтительным.
Получение фармацевтических препаратов может быть осуществлено с использованием способов, которые известны специалисту в данной области, посредством введения описанных соединений формулы (I) и/или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически значимыми соединениями, в состав фармацевтического препарата вместе с подходящим нетоксичным, инертным, терапевтически совместимым твердым или жидким носителем, если необходимо, с обычными фармацевтическими вспомогательными лекарственными веществами.
Подходящие вещества-носители представляют собой не только неорганические вещества, но также и органические вещества. Так, например, в качестве веществ-носителей для таблеток, таблеток с оболочкой, драже и твердых желатиновых капсул могут быть использованы лактоза, кукурузный крахмал или его производные, тальк, стеариновая кислота или ее соли. Подходящие вещества-носители для мягких желатиновых капсул представляют собой, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (однако в зависимости от природы активного ингредиента в случае мягких желатиновых капсул носитель может и не потребоваться). Подходящие вещества-носители для получения растворов и сиропов представляют собой, например, воду, полиолы, сахарозу, инвертный сахар и т.п. Подходящие носители для приготовления растворов для инъекций представляют собой, например, воду, спирты, полиолы, глицерин и растительные масла. Подходящие носители для суппозиториев представляют собой, например, природные или отвержденные масла, воски, жиры и полутвердые или жидкие полиолы. Подходящие носители для местных препаратов представляют собой глицериды, полусинтетические и синтетические глицериды, гидрированные масла, жидкие воски, жидкие парафины, жидкие жирные спирты, стеролы, полиэтиленгликоли и производные целлюлозы. В качестве фармацевтически пригодных вспомогательных лекарственных веществ следует рассматривать обычные стабилизаторы, консерванты, смачивающие и эмульгирующие агенты, агенты, улучшающие консистенцию, агенты, улучшающие вкус и запах, соли для регулирования осмотического давления, буферные вещества, солюбилизаторы, подкрашивающие вещества, маскирующие агенты и антиоксиданты.
Дозировка соединений формулы I может варьироваться в широких пределах в зависимости от заболевания, которое подлежит контролю, возраста, конкретного состояния пациента и способа введения, и безусловно, должна соответствовать индивидуальным потребностям в каждом отдельном случае. Для взрослых пациентов дневная дозировка составляет приблизительно от 1 до 1000 мг, в особенности приблизительно от 1 до 100 мг. В зависимости от степени выраженности симптомов заболевания и конкретного фармакокинетического профиля соединения соединение можно вводить в виде дозированных единиц один или несколько раз в день, например, в виде от 1 до 4 единичных дозированных форм.
Как указано выше, новые соединения согласно настоящему изобретению, как было обнаружено, являются антагонистами аденозинового А2В-рецептора. Соединения согласно настоящему изобретению, таким образом, могут быть использованы для лечения и/или профилактики заболеваний, которые опосредованы антагонизмом аденозинового А2В-рецептора, в частности диабета, диабетической ретинопатии, астмы и диареи, в особенности диабета.
Настоящее изобретение также относится к фармацевтическим композициям, включающим соединение, как указано выше, и фармацевтически приемлемый носитель и/или вспомогательное вещество.
Настоящее изобретение также включает соединения, как указано выше, для применения в качестве терапевтически активных соединений, в особенности для применения в качестве терапевтически активных соединений для лечения и/или профилактики заболеваний, которые опосредованы антагонизмом аденозинового А2В-рецептора, в частности в качестве терапевтически активных соединений для лечения и/или профилактики диабета, диабетической ретинопатии, астмы и диареи, в особенности диабета.
В соответствии с другим предпочтительным вариантом осуществления настоящее изобретение относится к способу терапевтического и/или профилактического лечения заболеваний, которые опосредованы антагонизмом аденозинового А2В-рецептора, в частности для терапевтического и/или профилактического лечения диабета, диабетической ретинопатии, астмы и диареи, в особенности диабета, указанный способ включает введение соединения, которое указано выше, человеку или животному.
Настоящее изобретение включает применение соединений, которые указаны выше, для терапевтического и/или профилактического лечения заболеваний, которые опосредованы антагонизмом аденозинового А2В-рецептора, в частности для терапевтического и/или профилактического лечения диабета, диабетической ретинопатии, астмы и диареи, в особенности диабета.
Настоящее изобретение также относится к применению соединений, как указано выше, для получения лекарственных средств для терапевтического и/или профилактического лечения заболеваний, которые опосредованы антагонизмом аденозинового А2В-рецептора, в частности для терапевтического и/или профилактического лечения диабета, диабетической ретинопатии, астмы и диареи, в особенности диабета. Такие лекарственные средства включают соединение, которое указано выше.
Профилактика и/или лечение диабета является предпочтительным показанием. Приведенная ниже схема реакций и сопровождающие пояснения относятся к общему методу синтеза новых соединений согласно настоящему изобретению.
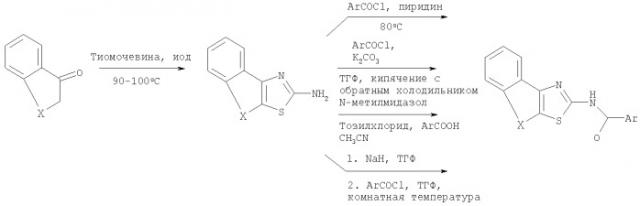
Схема 1
Пояснения к схеме 1
Нагревание смеси соответствующего кетона I с тиомочевинной и иодом до 90-100°С в отсутствие растворителя позволяет получить производные тиазола II. Ацилирование соединений II ароил- или гетероароилхлоридом в присутствии основания, например, такого как карбонат калия или пиридин, при нагревании приводит к ацилированным продуктам III. В качестве альтернативы, депротонирование соединения II с использованием сильного основания, например, такого как гидрид натрия, с последующим ацилированием с использованием ароил- или гетероароилхлорида также позволяет получить ацилированные продукты III.
Соединения структуры III также могут быть получены посредством конденсации амина II с арилкарбоновой кислотой с использованием O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфата (HATU) или комбинации п-толуолсульфонилхлорида и N-метилимидазола в качестве конденсирующих агентов.
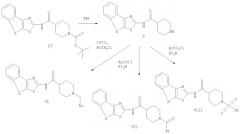
Схема 2
Пояснения к схеме 2
Удаление защиты соединения IV с использованием трифторуксусной кислоты позволяет получить промежуточное соединение - производное пиперидина V. Соединение V затем может быть подвергнуто взаимодействию с подходящим арилгалогенидом, бензоилгалогенидом или арилсульфонилгалогенидом в присутствии основания, например, такого как триэтиламин, с получением при этом соединений VI, VII и VIII.
Условия проведения вышеуказанного взаимодействия могут в некоторой степени варьироваться. Способы проведения описанных выше реакций и осуществления таких способов известны из предшествующего уровня техники или могут быть аналогичны способам, описанным в примерах. Исходные вещества являются или коммерчески доступными, или могут быть получены способами, которые аналогичны способам, приведенным в примерах.
Приведенные ниже примеры иллюстрируют предпочтительные варианты осуществления настоящего изобретения, но не ограничивают объем настоящего изобретения.
Пример 1
N-(8Н-Индено[1,2-d]тиазол-2-ил)бензамид
Стадия 1: 8Н-индено[1,2-d]тиазол-2-иламин гидроиодид
Смесь 1-инданона (6,00 г; 45,4 ммоль), тиомочевины (6,92 г; 90,8 ммоль) и иод (11,52 г; 45,4 ммоль) нагревают до 95°С при перемешивании. Через 3 часа полученной смеси дают остыть до комнатной температуры. Неочищенное твердое вещество растирают с абсолютным этанолом и фильтруют. Светло-желтое твердое вещество промывают два раза, используя абсолютный этанол, затем высушивают на воздухе, получая при этом 9,13 г 8Н-индено[1,2-d]тиазол-2-иламина гидроиодида 1а.
Стадия 2: 8Н-индено[1,2-d]тиазол-2-иламин
Индено[1,2-d]тиазол-2-иламина гидроиодид 1а (9,13 г) перемешивают с 100 мл 1 н. раствора гидроксида натрия в течение 1 часа при комнатной температуре, затем фильтруют. Твердое вещество промывают водой (3×20 мл) и затем высушивают на воздухе, получая при этом 5,30 г 8Н-индено[1,2-d]тиазол-2-иламина 1b.
Стадия 3: N-(8Н-индено[1,2-d]тиазол-2-ил)бензамид