Способ получения энантиомерных форм производных 1,3-циклогександиола в цис-конфигурации
Иллюстрации
Показать всеИзобретение относится к вариантам способа получения хирального нерацемического соединения формулы I
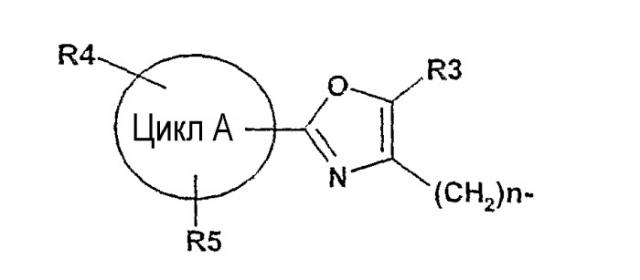
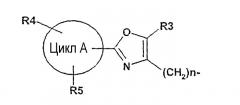
где R1 обозначает .
Значения остальных радикалов указаны в формуле изобретения. Соединение формулы I получают в несколько стадий, в качестве исходного вещества используют цис-1,3-циклогександиол. Одной из ключевых стадий является ферментативное образование сложного эфира или ферментативное расщепление сложного эфира. 4 н. и 4 з.п. ф-лы.
Реферат
Изобретение относится к способу получения хиральных, нерацемических 1,3-дизамещенных циклогексанoлов формулы (I) в цис-конфигурации
Различно замещенные, имеющие цис-конфигурацию 1,3-дизамещенные производных циклогексана (соединения формулы (I) при R1≠R2,) являются центральными структурными элементами или предшественниками описанных в WO 03/020269 лекарственных активных веществ, которые в целом подходят для лечения нарушений липидного обмена, например, диабета II типа, синдрома X и др.
Описанные в патентной заявке WO 03/020269 способы синтеза нерацемических, имеющих цис-конфигурацию производных 1,3-циклогексана, не годятся в качестве технологического процесса: так, например, алкилирование посредством NaH/ДМФ в многокилограммовом масштабе с надежностью не осуществимо (C&EN, 13 сентября, 1982,5). Кроме того, алкилирование по способу Bu2SnO в масштабе опытной установки требует недопустимо высоких затрат; отделение соединений олова от желаемого продукта с применением хроматографических методов разделения также очень затруднительно и чаще всего неполное. Утилизация соединений цинка является следующей проблемой или экономическим фактором. Разделение энантиомеров (расщепление рацематов) путем хроматографии на хиральной фазе также является трудоемким и слишком дорогим. Помимо этого, для хроматографического разделения энантиомеров требуется, чтобы рацемическое соединение имело хорошую химическую чистоту, что часто можно достичь только путем дополнительной, заранее проводимой хроматографии.
Другие описанные в литературе методы синтеза цис-1,3-циклогександиольных структурных элементов или производных, как, например, раскрытие эпоксициклогексана (P.Crotti, V. Di Bussolo, L.Favero, M.Pineschi, F.Marianucci, G.Renzi, G.Amici, G.Roselli, Tetrahedron 2000, 56, 7513-7524 и цитированная литература) или катализированное металлами гидроборирование производных циклогексена (J.A.Brinkmann, T.T.Nguyen, J.R.Sowa, J., Org. Lett. 2000, 2, 981-983; C.E.Garrett, G.C.Fu, J. Org. Chem. 1998, 63, 1370-1371), являются в отношении регио- и стереоселективности в подавляющем большинстве неудовлетворительными. Помимо этого, общее количество стадий заметно более высокое. Поэтому в качестве промышленных способов они не годятся.
Синтез производных цис-1,3-циклогександиола из цис,цис-1,3,5-циклогексантриола или производных цис,цис-1,3,5-циклогексантриола (L.Dumortier, M.Carda, J. Van der Eycken, G.Snatzke, M. Vandewalle, Tetrahedron: Asymmetry 1991, 2, 789-792; H.Suemune, K.Matsuno, M.Uchida, K.Sakai, Tetrahedron: Asymmetry 1992, 3, 297-306) из-за большого числа этапов также очень затратен и неэкономичен и поэтому не подходит для промышленного применения.
Ферментативная реакция цис/транс смесей 1,3-циклогександиола с S-этилтиооктаноатом также не годится в качестве промышленного способа. Помимо практически неизбежной загазованности при обращении с соединениями серы и того факта, что для достижения требуемой степени превращения высвобождающийся этантиол должен непрерывно удаляться, описанная реакция приводит к смеси 9 изомерных форм или производных циклогександиола, а именно: непрореагировавшим изомерам (S,S)-диол, (R,R)-диол и (R,S)-диол, кроме того, моноацилированным продуктам (S,S)-монооктаноат, (R,R)-монооктаноат и (R,S)-монооктаноат, и в-третьих, группе диацилированных продуктов (S,S)-диоктаноат, (R,R)-диоктаноат и (R,S)-диоктаноат. Оптически активный, моноацилированный (R,S)-монооктаноат, имеющий цис-конфигурации, составляет во фракции моноацилированных циклогександиолов долю всего примерно 12%. Проводимое в препаративном масштабе получение и выделение этого продукта не описано, однако ввиду количественного соотношения и описанных проблем разделения не может быть экономичным. Кроме того, известно, что частично ацилированные ди- или полигидроксисоединения склонны к миграции ацильных групп. Если этот случай имеет место, например, в ходе очистки (R,S)-монооктаноата (например, при хроматографии на силикагеле или при водной экстракции) или в ходе последующей реакции (например, при алкилировании свободных гидроксильных групп), то это ведет к заметному уменьшению оптической чистоты, или к рацемизации.
Имеющие цис-конфигурирацию (R,S)-диолы или диацилированные (R,S)-соединения оптически не активны и поэтому не представляют интереса.
Поэтому задачей настоящего изобретения является разработка способа, который не имеет указанных недостатков.
Задачей настоящего изобретения является способ получения хиральных, нерацемических соединений формулы I
с R1
в которой означают:
| цикл А | фенил, 5-12-звенный гетероароматический цикл, который может содержать от одного до четырех гетороатомов из группы N, O или S, 8-14-звенный ароматический цикл, (C3-C8)-циклоалкил; |
| R3 | H, F, Cl, Br, OH, NO2, CF3, OCF3, (C1-C6)-алкил, (C3-C8)-циклоалкил, фенил; |
| R4, R5 | H, F, Cl, Br, OH, NO2, CF3, OCF3, OCF2H, OCF2-CF3, OCF2-CHF2, SCF3, O-фенил, (C1-C6)-алкил, O-(C1-C6)-алкил, O-(C1-C6)-алкил-O-(C1-C3)-алкил; |
| n | от 1 до 3; |
и
| R2 | (C1-C8)-алкил, причем в алкильных группах одна или несколько CH2-групп может быть замещена O, CO, S, SO или SO2, и алкил может быть от одного до трех раз замещен F, Cl, Br, CF3, CN, NO2, NHAc, NHBoc, NH-CO-C(CH3)3, гидроксилом, OCF3, O-(C1-C6)-алкилом, COOH, CO-бензокси, CO-O(C1-C6)-алкилом, тетразолом, тиазолидин-2,4-дионом, индолом и (C6-C10)-арилом, причем тиазолидин-2,4-дион и арил в свою очередь могут быть замещены F, Cl, Br, CF3, CN, NO2, NHAc, NHTs, NHBoc, NHCbz, NH-CO-C(CH3)3, гидроксилом, OCF3, O-(C1-C6)-алкилом, COOH, CO-бензокси, CO-O(C1-C6)-алкилом, (C1-C6)-алкилом, O-(C1-C6)-алкилом или тетразолом, или |
| R2 | OH-защитная группа (SG), как например, бензилоксиметил, бензил, пара-метоксибензил или трет-бутил-диметилсилил; |
отличающийся тем, что проводят:
A)
a) алкилирование (Alk-R 2 /Alk-SG)
Цис-1,3-циклогександиол формулы (II)
подвергают взаимодействию с соединением формулы (III)
где
R2 определен выше, и
X1 означает Cl, Br, I, OMs (O-мезил), OTs (O-тозил), OTf (O-трифлат);
в присутствии основания в подходящем растворителе, с получением рацемического соединения формулы (IV)
в которой R2 определен выше,
b1) ферментативное образование сложного эфира (EB)+разделение (T)
полученное соединение формулы (IV) подвергают стереоселективному ферментативному образованию сложного эфира (EB), причем спирты в органическом растворителе, как например, дихлорметан, смешивают с донором ацильных групп, как например, виниловым эфиром R6-O-CH=CH2 или ангидридом кислоты R6-O-R6, где R6 определен выше, и ферментом, и полученную смесь перемешивают при температуре от -20 до 80°C, и по окончании реакции один стереомер присутствует в виде сложного эфира формулы (V)
где
R6 означает C(=O)-(C1-C16)-алкил, C(=O)-(C2-C16)-алкенил, C(=O)-(C3-C16)-алкинил, C(=O)-(C3-C16)-циклоалкил, причем один или несколько атомов углерода могут быть заменены атомами кислородa и могут быть замещены 1-3 заместителями из группы F, Cl, Br, CF3, CN, NO2, гидрокси, метокси, этокси, фенил и CO-O(C1-C4)-алкил, CO-O(C2-C4)-алкенил, которые в свою очередь могут быть замещены 1-3 заместителями из группы F, Cl, Br, CF3 , и
R2 определен выше,
и другой стереомер остается в неизмененном виде, как спирт формулы (IV), и поэтому за счет использования их различающихся химических или физико-химических свойств (например, значения Rf или разницы растворимости в воде или других растворителях) они могут быть отделены друг от друга (разделение T), например, путем простой хроматографии на силикагеле, экстракцией (например, смесью гептан/метанол или органический растворитель/вода) или также путем проводимых далее химических последовательных реакций, например, спирта, в которых сложный эфир не участвует,
или
b2) ферментативное расщепление сложного эфира [=химическая этерификация (CV)+ферментативное расщепление (ES)]+разделение (T)
полученные соединения формулы (IV) подвергают стереоселективному ферментативному расщеплению сложного эфира, причем рацемические спирты сначала путем химической этерификации (CV), например, посредством хлорангидрида кислоты R6-Cl или ангидрида кислоты R6-O-R6, в присутствии основания, как например, триэтиламин, преобразуют в рацемический сложный эфир формулы (V)
где R6 и R2 определены выше,
который затем путем проведения стереоселективного ферментативного расщепления сложного эфира (ES) вводят в гомогенную или гетерогенную, водную, водно-органическую или органическую среду и при температуре 10-80°C в присутствии фермента вводят в реакцию, в случае гидролиза - с водой, а в случае алкоголиза - со спиртом, как например, н-бутанолом, по завершении которой один стереомер присутствует как спирт формулы (IV), а другой остается неизмененным в виде сложного эфира формулы (V), и тем самым они могут быть отделены друг от друга как описано в пункте b1), причем
энантиомеры формулы (IV), получающиеся как спирт, перерабатываются далее как описано в пункте d),
или
c) химический гидролиз (CH)
энантиомеры формулы (V), получающиеся как сложный эфир, могут быть омылены с получением химически энантиомерных спиртов по известному способу, и
d) алкилирование (Alk-R 1 )
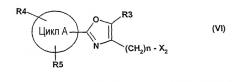
далее подвергают взаимодействию с соединениями формулы (VI)
где
цикл А, R3, R4, R5 и n определены выше и
X2 означает Cl, Br, I, OTs, OMs, OTf;
в присутствии основания в подходящем растворителе с получением соединения формулы (I), и
e) отщепление защитной группы SG (AbSG)
если R2 означает OH-защитную группу (SG), и R2 определен, как описано выше, соединения формулы (Ia)
где R1 и SG определены выше,
путем отщепления защитной группы по известному способу, как например, в случае отщепления SG=бензилоксиметил или SG=бензил-гидрированием на Pd/C, или в случае отщепления SG=пара-метоксибензил - например, посредством DDQ (2,3-дихлор-5,6-дицианобензохинон), или в случае отщепления SG=трет-бутил-диметилсилил - например, посредством Bu4NF, переводят в соединения формулы (VII)
где R1 определен выше,
f) алкилирование (Alk-R 2 )
которое затем подвергают взаимодействию с соединениями формулы (III),
где X1 и R2 определены выше,
в присутствии основания в подходящем растворителе с получением соединения формулы (I), продукта или энантиомерной формы,
причем возможно также последовательность отдельных стадий реакции, которые описаны выше в пункте A):
A) Alk-R2→EB+T/CV+ES+T [→CH]→Alk-R1 [→AbSG→Alk-R2]→
продукт/энантиомерная форма
изменить на
B) Alk-R1→EB+T/CV+ES+T [→CH]→Alk-R2 [→AbSG→Alk-R2]→
продукт/энантиомерная форма
или на
C) Alk-SG→EB+T/CV+ES+T→CH→Alk-R2→AbSG→Alk-R1→
продукт/энантиомерная форма
или
D) Alk-SG→EB+T/CV+ES+T→Alk-R1→AbSG→Alk-R2→
продукт/энантиомерная форма.
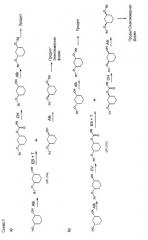
Далее на схемах I-IV представлены возможные варианты способа:
Способ согласно изобретению является экономичным, простым и быстрым. Способ полностью предотвращает риск миграции ацильных групп, он не требует эквимолярных количеств оптически чистых исходных или вспомогательных веществ, дорогих реагентов, разделения рацематов путем хроматографии на хиральных фазах, непропорционально больших количеств растворителя и дорогостоящих стадий обработки.
Типичные для отщепления рацематов потери 50% могут быть уменьшены применением обоих энантиомеров и изменением последовательности алкилирования. Предпочтителен так называемый энантиоконвергентный способ (смотри схему IV или способы C) и D)), при котором действуют, например, следующим образом: алкилирование цис-1,3-циклогександиола формулы (II) соединением формулы (III), причем R2 в качестве SG выбирают так, чтобы SG в ходе дальнейшего синтеза можно было опять легко и селективно удалить, таким образом, SG является, например, бензилом, или пара-метоксибензилом, или трет-бутил-диметилсилилом; полученное соединение формулы (IV) подвергают стереоселективному ферментативному образованию или расщеплению сложного эфира (см. выше) и после прошедшего разделения оба: непрореагировавший спирт и сложный эфир, - по отдельности и различными путями переводят в одинаковый оптически чистый продукт, тем, что спирт (как описано в первой части) преобразуют, например, соединением формулы (VI), в соединение формулы (Ia), которое затем путем отщепления SG-группы преобразуют в соединение формулы (VII), и его затем с помощью соединения формулы (III) с R2, какой желателен в продукте, преобразуют в соединение формулы (I), а изомерный сложный эфир, напротив, путем простого расщепления сложного эфира переводят в соединение формулы (IV), которое затем сначала с помощью соединения формулы (III) с R2, какой желателен в продукте, преобразуют в соединение формулы (VIII),
которое, в свою очередь, отщеплением SG-группы преобразуют в соединение формулы (IV)
а его затем с помощью соединения формулы (VI) преобразуют в соединение формулы (I).
Предпочтительно используют соединения формулы (III)
в которых
X1 означает Cl, Br, I, OMs или OTs,
Особенно предпочтительны такие соединения, в которых
X1 означает Cl, Br, или I.
Предпочтителен способ получения соединений формулы (I),
в которой:
R1 является
где
| цикл А | фенил, 5-12-звенный гетероароматический цикл, который может содержать один или несколько гетороатомов из группы N, O или S, конденсированный/бициклический 8-14-звенный ароматический цикл, (C3-C8)-циклоалкил; |
| R3 | H, CF3, (C1-C6)-алкил, (C3-C8)-циклоалкил, фенил; |
| R4, R5 | H, F, Br, CF3, OCF3, (C1-C6)-алкил, O-(C1-C6)-алкил; |
| n | 1 или 2; |
| R2 | (C1-C8)-алкил, причем в алкильных группах одна или несколько CH2-групп может быть заменена на O, CO, S, SO или SO2, и алкил может быть от одного до трех раз замещен F, Cl, Br, CF3, CN, NO2, NHAc, NHBoc, NH-CO-C(CH3)3, гидроксилом, OCF3, O-(C1-C6)-алкилом, COOH, CO-бензокси, CO-O(C1-C6)-алкилом, тетразолом, тиазолидин-2,4-дионом, индолом и (C6-C10)-арилом, причем тиазолидин-2,4-дион и арил в свою очередь могут быть замещены F, Cl, Br, CF3, CN, NO2, NHAc, NHTs, NHBoc, NHCbz, NN-CO-C(CH3)3, гидроксилом, OCF3, O-(C1-C6)-алкилом, COOH, CO-бензокси, CO-O(C1-C6)-алкилом, (C1-C6)-алкилом, O-(C1-C6)-алкилом или тетразолом |
Особенно предпочтителен способ получения соединения формулы (I),
в которой:
R1 является
где
| цикл А | фенил; |
| R3 | (C1-C4)-алкил; |
| R4, R5 | H, (C1-C4)-алкил, O-(C1-C4)-алкил; |
| n | 1; |
| R2 | (C1-C8)-алкил, причем в алкильных группах одна или несколько CH2-групп может быть заменена на O, CO, S, SO или SO2, и алкил может быть от одного до трех раз замещен F, Cl, Br, CF3, CN, NO2, NHAc, NHBoc, NH-CO-C(CH3)3, гидроксилом, OCF3, O-(C1-C6)-алкилом, COOH, CO-бензокси, CO-O(C1-C6)-алкилом, тетразолом, тиазолидин-2,4-дионом, индолом и (C6-C10)-арилом, причем тиазолидин-2,4-дион и арил в свою очередь могут быть замещены F, Cl, Br, CF3, CN, NO2, NHAc, NHTs, NHBoc, NHCbz, NH-CO-C(CH3)3, гидроксилом, OCF3, O-(C1-C6)-алкилом, COOH, CO-бензокси, CO-O(C1-C6)-алкилом, (C1-C6)-алкилом, O-(C1-C6)-алкилом или тетразолом. |
Алкильные остатки в заместителях R2, R3, R4 и R5 могут быть как линейными, так и разветвленными.
Под гетероароматическим циклом понимаются как моно-, так и бициклические кольца максимум с 4 гетероатомами, в частности, такие, которые содержат до 4 атомов азотa и/или 1 кислород или 1 атом серы, как, например: фуран, тиофен, тиазол, оксазол, тиадиазол, триазол, пиридин, триазин, хинолин, изохинолин, индол, бензотиофен, бензофуран, бензотриазол. Ароматические циклы могут быть моно- или бициклическими, а также конденсированными, как, например, нафтил, бензо[1,3]диоксол, дигидро-бензо[1,4]-диоксин.
Рацемические, имеющие цис-конфигурацию 1,3-производные циклогексана формулы (IV) и формулы (VII) получают моноалкилированием цис-циклогександиола (соединения формулы II), но оно может быть получено также восстановительным раскрытием соответствующего ацеталя (R.Hunter et al., J. Org. Chem. 1993, 85, 6756), кроме того, так называемым восстановительным образованием простого эфира исходя из простых силиловых эфиров и альдегидов или кетонов (J.S.Bajwa, X.Jiang, J.Slade, K.Prasad, O.Repic, T.J.Blacklock, Tetrahedron Lett. 2002, 43, 6709-6713).
Реагенты алкилирования формулы III имеются в продаже или могут быть получены по известным из литературы методам, например, путем радикального галогенирования боковых цепей (см. литературный обзор R.C.Larock, Comprehensive Organic Transformations, S. 313, 1989 VCH Publishers, Inc.) или из спиртов или получаемых из них производных (см. литературный обзор R.C.Larock, Comprehensive Organic Transformations, S. 353-363, 1989 VCH Publishers, Inc.).
Далее, известно (см. J. Chem.Soc. 1925, 127, 2275-2297; J. Chem. Soc. 1922, 121, 2202-2215) получение различных бромидов 2-бромометилбензойной кислоты путем радикального бромирования, которые затем могут быть переведены путем последующих реакций со спиртами в сложный эфир бромометилбензойной кислоты, относящийся к группе реагентов алкилирования формулы (III).
Реагенты алкилирования формулы (VI) или спирты X2=OH, которые могут служить в качестве предшественников, имеются в продаже или могут быть получены по известным из литературы методам [a) The Chemistry of Heterocyclic Compounds (Ed.: A.Weissberger, E.C.Taylor): Oxazoles (Ed.: I.J.Turchi); b) Methoden der Organischen Chemie, Houben-Weyl 4. Auflage, Hetarene III, Teilband 1; c) I.Simit, E. Chindris, Arch. Pharm. 1971, 304, 425; d) Y.Goto, M.Yamazaki, M.Hamana, Chem. Pharm. Bull. 1971, 19(10), 2050-2057].
Реагенты алкилирования формул III и VI в присутствии основания приводят в реакцию с 1,3-циклогександиолом или производными 1,3-циклогександиола. Подходящими основаниями являются, например, гидроксиды, как KOH, карбонаты, как Cs2CO3, алкоголяты, как KOtBu, а также такие соединения, как LDA, BuLi, LiHMDS, KH, NaH и NaHMDS. Подходящими растворителями являются, например, ТГФ, MTBE, DME, NMP, ДМФ и хлорбензол.
Для разделения рацематов спиртов их вводят в органические растворители, как например, диметоксиэтан (DME), метил-трет-бутиловый эфир (MTBE), диизопропиловый эфир (DIPE), ТГФ, н-гексан, циклогексан, толуол, хлорбензол, ацетон, диметилформамид (ДМФ), дихлорметан, 1,2-дихлорэтан и трет-бутанол, добавляют ацильные доноры, как винилацетат, винилпропионат, винилбутират, 2,2,2-трифторэтил-2H,2H-перфтордеканоат, этоксивинилацетат, п-нитро- или п-хлорфенилацетат, сложный эфир оксима, ацетангидрид, ангидрид пропионовой кислоты, ангидрид янтарной кислоты, ангидрид глутаровой кислоты, ангидрид изо-валериановой кислоты, 2,2,2-трихлорэтилбутират, 2,2,2-трифторэтил-2H,2H-перфтордеканоат, и затем реакционную смесь смешивают с подходящим ферментом и перемешивают при температуре от -20 до 80°C. Доля сорастворителей в растворе составляет предпочтительно 10-90%, но при необходимости ферментативная реакция проводится также предпочтительно в чистом доноре ацильных групп, например винилацетате, без сорастворителей.
Для разделения рацематов производных сложного эфира, например, ацетила, пропионила, бутирила или глутарила, эти производные в однородной или гетерогенной, водной, водно-органической или органической среде в присутствии подходящего фермента подвергают стереоселективному гидролизу или алкоголизу (например, н-бутанолом) при температуре 10-80°C, при необходимости в присутствии сорастворителей (см. выше) и буфера, причем реакционная смесь предпочтительно содержит 2-50 вес.% сложного эфира.
Получение вышеназванных производных сложного эфира может проводиться по известным из литературы методам, например путем взаимодействия спирта с хлорангидридами кислоты, как ацетилхлорид, или ангидридами, как ацетангидрид, в присутствии амина, как например, триэтиламина или пиридина (см. литературный обзор R.C. Larock, Comprehensive Organic Transformations, S. 978, 1989 VCH Publishers, Inc.).
По окончании реакции продукты или энантиомеры можно разделить простыми способами, например путем экстракции по известным из литературы методам [a) T.Yamano, F.Kikumoto, S.Yamamoto, K.Miwa, M.Kawada, T.Ito, T.Ikemoto, K.Tomimatsu, Y.Mizuno, Chem. Lett. 2000, 448; b) B.Hungerhoff, H.Sonnenschein, F.Theil, J. Org. Chem. 2002, 67, 1781] или путем применения хроматографических методов.
Следующие методы состоят в том, чтобы по окончании ферментативной реакции заметно повысить водорастворимость оставшихся спиртов путем дериватизации, например, ацилированием циклическими ангидридами, как, например, ангидридом глутаровой кислоты, или переводом в холиновый эфир [a) H.Kunz, M.Buchholz, Chem. Ber. 1979, 112, 2145; b) M.Schelhaas, S.Glomsda, M.Hänsler, H.-D.Jakubke, H.Waldmann, Angew. Chem. 1996, 108, 82], и таким образом достичь разделения водонерастворимых или плохо растворимых сложных эфиров путем экстракции. После разделения дериватизацию спиртов можно опять прекратить путем химического или ферментативного омыления.
Особенно интересная возможность разделения энантиомеров состоит в том, чтобы в случае ферментативного ацилирования так выбрать ацильные доноры, чтобы ацилированный энантиомер был заметно лучше растворим в воде, чем непрореагироваший спирт. Подходящими донорами ацильных групп являются, например, циклические ангидриды, как ангидрид янтарной кислоты. По окончании ферментативного ацилирования продукт ацилирования имеет свободную карбоксильную группу, которая делает возможным быстрое разделение продукта путем водной экстракции в основных растворах, например, в насыщенном водном растворе NaHCO3.
При ферментативном разделении рацематов путем отщепления сложного эфира действуют предпочтительно так, что сложный эфир формулы (I), например, при R1=COCH3, COCH2CH3 или COCH2CH2CH2COOH, смешивают в водо- или спиртосодержащем растворе с эстеразой или липазой и перемешивают.
Может быть благоприятным добавлять в указанный раствор буфер, например фосфатный буфер или TRIS[=трис-(гидроксиметил)-метиламин]-буфер. Добавка может быть, например, 0,01-1,0 молярной. Благоприятный диапазон буфера составляет pH 5-10.
В качестве фермента предпочтительно применяются гидролазы из печени млекопитающих, как например, липаза из поджелудочной железы свиней (Fluka) или из микроорганизмов, как например, липаза B из Candida antarctica (Roche Diagnostics), липаза OF из Candida rugosa (Meito Sangyo), липаза SL из Pseudomonas cepacia (Meito Sangyo), липаза L-10 из Alcaligenes spec. (Roche Diagnostics) и липаза QL из Alcaligenes spec. (Meito Sangyo). Если под применяемыми сложными эфирами имеются в виду производные глутаровой кислоты, как например, моно-(3-бензилоксициклогексиловый)-эфир глутаровой кислоты, может быть выгодным вместо вышеуказанных липаз применять глутарил-7-ACA-ацилазу (Roche Diagnostics).
Особенно предпочтительна липаза B из Candida antarctica (Roche Diagnostics), причем может предпочтительно применяться свободный фермент или иммобилизованная форма фермента, например, один из трех имеющихся в настоящее время в продаже продуктов.
Каждый из указанных ферментов может применяться в свободной или иммобилизованной форме (Immobilized Biocatalysts, W.Hartmeier, Springer Verlag Berlin, 1988). Количество фермента выбирается произвольно в зависимости от скорости реакции или от желаемого времени реакции и типа фермента (например, свободный или иммобилизованный) и легко устанавливается простым предварительным испытанием.
Повторное извлечение фермента можно проводить путем сушки вымораживанием. Разделение (и при необходимости последующее извлечение) фермента можно облегчить иммобилизацией.
Путем подходящего проведения реакции всегда удается получить оптически чистым по меньше мере один энантиомер. Если желательно получить оптически чистый сложный эфир, степень превращения в случае ферментативного образования сложного эфира быть ниже (или равной) 50%, а в случае ферментативного гидролиза или алкоголиза - выше (или равной) 50%. Если желателен оптически чистый спирт, то степень превращения в случае катализованного ферментами образования сложного эфира должна быть выше (или равной) 50%, а в случае гидролиза или алкоголиза должна быть ниже (или равной) 50%.
Определение степени превращения ферментативной реакции проводится или по ВЭЖХ непосредственно из реакционной смеси или путем расчета из оптической чистоты продуктов реакции (сложного эфира и кислоты), которую определяли непосредственно из реакционной смеси по ВЭЖХ на хиральной фазе.
Нижеследующими примерами настоящее изобретение поясняется более подробно.
Примеры:
Все выделенные продукты или смеси сырых продуктов идентифицировали посредством 1H-ЯМР и масс-спектроскопией или по ВЭЖХ.
Оптическую чистоту сложных эфиров и спиртов определяли по ВЭЖХ, например, на Chiralpak AD 250×4,6 (Daicel) или Chiracel OD 250×4,6.
К схеме Ia:
Пример 1
Синтез рацемического метилового эфира цис-2-(3-гидроксициклогексилоксиметил)-6-метилбензойной кислоты
500 г (4,3 моль) цис-1,3-циклогександиола растворяют в 5 л NMP и смешивают с 336 г (3,0 моль) трет-бутилата калия (KOtBu). Внутреннюю температуру повышают до 28°C. Перемешивают 30 мин, затем охлаждают до -5°C и по каплям смешивают с 370 г (приблизительно 94%-ным, примерно 1,4 моль) метилового эфира 2-бромометил-6-метилбензойной кислоты, который можно получить, например, метанолизом бромида 2-бромометил-6-метилбензойной кислоты или бромированием метилового эфира 2,6-диметилбензойной кислоты, перемешивают 30 мин и затем разбавляют 5 л воды. После трехкратной промывки, используя по 3 л н-гептана, и отвода раствора н-гептана, оставшуюся водную фазу экстрагируют четыре раза, используя по 2,5 л MTBE. Очищенные MTBE-фазы один раз промывают 5 л воды, сушат Na2SO4 и затем выпаривают при пониженном давлении. Получают 234 г желаемого соединения в виде желтоватого масла, которое без дальнейшей очистки применяют на следующей реакции (например, разделения рацематов); 1H-ЯМР (CDCl3), δ=1,27 (м, 1H), 1,45 (м, 1H), 1,55 (м, 1H), 1,74 (м, 1H), 1,83 (м, 1H), 2,05 (м, 1H), 2,34 (с, 3H), 3,47 (м, 1H), 3,72 (м, 1H), 3,91 (с, 3H), 4,58 (дд, 2H), 7,15 (д, 1H), 7,20 (д, 2H), 7,27 (м, 1H).
Пример 2
Разделение рацематов метилового эфира цис-2-(3-гидроксициклогексилоксиметил)-6-метилбензойной кислоты
490 г сырого рацемического метилового эфира цис-2-(3-гидроксициклогексилоксиметил)-6-метилбензойной кислоты (см. пример 1) растворяют в 3,1 л метиленхлорида и 850 мл винилацетата, смешивают с 18 г Novozym 435 и перемешивают при 21-24°C. Через 28 ч добавляют еще 2 г Novozym 435. Через полных 44 ч реакцию заканчивают отфильтровыванием фермента, и фильтрат выпаривают при пониженном давлении, получают 540 г. Хроматография остатка на примерно 6 кг силикагеля (этиловый эфир уксусной кислоты/н-гептан 1:1) дает 184 г (1R,3S)-метилового эфира 2-(3-гидроксициклогексилоксиметил)-6-метилбензойной кислоты; чистота>98% (ВЭЖХ на Chiralpak AD-H 250×4,6; 1 мл/мин, гептан/EtOH/CH3CN 25:1:0,5+0,1% TFA); 1H-ЯМР (CDCl3), δ=1,27 (м, 1H), 1,45 (м, 1H), 1,55 (м, 1H), 1,74 (м, 1H), 1,83 (м, 1H), 2,05 (м, 1H), 2,34 (с, 3H), 3,47 (м, 1H), 3,72 (м, 1H), 3,91 (с, 3H), 4,58 (дд, 2H), 7,15 (д, 1H), 7,20 (д, 2H), 7,27 (м, 1H)), и 239 г (1S,3R)-ацетата (чистота 93%, ВЭЖХ на Chiralcel OD/20 250×4,6, 1 мл/мин, гептан/EtOH/CH3CN 100:1:0,5).
Пример 3
Синтез 4-йодметил-2-(3-метоксифенил)-5-метилоксазола
150,0 г (0,63 моль) 4-хлорметил-2-(3-метоксифенил)-5-метилоксазола растворяют в 2,7 л ТГФ и смешивают с 106 г (0,71 моль) NaI. Перемешивают 4 ч и оставляют на ночь, отсасывают соли, фильтрат концентрируют в вакууме. Через примерно 1-2 часа желаемый йодид становится твердым, выход: 216 г, т.пл. 58-59°C. 1H-ЯМР (CDCl3): δ=2,30 (с, 3H), 3,88 (с; 3H), 4,34 (с, 2H), 6,97 (дд, 1H), 7,34 (т, 1H), 7,52 (д, 1H), 7,58 (д, 1H).
Пример 4
Синтез (1R,3S)-метилового эфира 2-{3-[2-(3-метоксифенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты
184 г (0,66 моль) (1R,3S)-метилового эфира 2-(3-гидроксициклогексилоксиметил)-6-метилбензойной кислоты (см. пример 2) растворяют в 2,2 л t-BuOMe. К этому добавляют 88,0 г (примерно 55%, 1,8 ммоль) NaH и перемешивают 45 минут при 20-22°C. Добавляют 282 г (83,8 ммоль) 4-йодметил-2-(3-метоксифенил)-5-метилоксазола (см. пример 3), перемешивают 8 часов при 22°C и оставляют на ночь. Перемешивают еще 4 ч и затем при охлаждении осторожно добавляют сначала 200 мл, позднее еще 1,5 л воды. Органическую фазу отделяют, сушат (Na2SO4) и концентрируют при пониженном давлении. Получают 383 г сырого продукта, который выделяют путем хроматографии на примерно 6 кг силикагеля (дихлорметан/ацетон 19:1), выход: 199 г желтоватого масла; 1H-ЯМР
(CDCl3), δ=1,15-1,32 (м, 4H), 1,81 (м, 1H), 2,00 (м, 1H), 2,07 (м, 1H), 2,34 (с, 3H), 2,40 (с, 3H), 2,51 (м, 1H), 3,27 (м, 1H), 3,37 (м, 1H), 3,87 (с, 3H), 3,90 (м, 3H), 4,48 (с, 2H), 4,60 (с, 2H), 6,96 (м, 1H), 7,12-7,35 (м, 4H), 7,53 (с, 1H), 7,58 (д, 1H).
Пример 5
Синтез (1R,3S)-2-{3-[2-(3-метоксифенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты
199 г (0,41 моль) (1R,3S)-метилового эфира 2-{3-[2-(3-метоксифенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты (см. пример 4) растворяют в 2 л этанола. Добавляют 250 мл 33%-ного NaOH и кипятят 15 часов с обратным холодильником. Этанол отгоняют в вакууме, остаток растворяют примерно в 2 л воды и дважды промывают метил-трет-бутиловым эфиром, используя по 500 мл. Водную фазу при охлаждении подкисляют концентрированной соляной кислотой до pH 1 и получаемый маслянистый продукт экстрагируют 1,5 л этилового эфира уксусной кислоты. Раствор этилового эфира уксусной кислоты сушат и концентрируют в вакууме. Остаток растворяют в 1,2 л DIPE при примерно 40°C. После кристаллизации и сушки в вакууме при 60°C получают 132,5 г желаемой карбоновой кислоты; т.пл. 103-105°C; чистота>98% (ВЭЖХ на Chiralpak AD-H 250x4,6; 1 мл/мин, гептан/EtOH/CH3CN 90:7:1+0,1% TFA); 1H-ЯМР (CDCl3), δ=1,14-1,38 (м, 4H), 1,80 (м, 1H), 1,93 (м, 2H), 2,41(с, 3H), 2,44 (с, 3H), 2,61 (м, 1H), 3,40 (м, 2H), 3,86 (с, 3H), 4,53 (с, 2H), 4,68 (дд, 2H), 6,98 (дд, 1H), 7,17-7,36 (м, 4H), 7,55 (с, 1H), 7,61 (д, 1H).
Пример 6
Синтез 4-йодметил-2-(4-метилфенил)-5-метилоксазола
6,0 г 4-хлорметил-2-(4-метилфенил)-5-метилоксазола растворяют в 120 мл ТГФ и смешивают с 4,18 г (27,9 ммоль) NaI. Перемешивают 3,5 ч, добавляют еще 1,5 г NaI и нагревают до 35°C. Через 30 минут отсасывают соли и фильтрат концентрируют в вакууме; выход: 10,1 г, т.пл. 104-105°C; 1H-ЯМР (CDCl3): δ=2,29 (с, 3H), 2,39 (с, 3H), 4,34 (с, 2H), 7,24 (д, 2H), 7,88 (д, 2H).
Пример 7
Синтез (1R,3S)-метилового эфира 2-{3-[2-(4-метилфенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты
36,0 г (0,129 моль) (1R,3S)-метилового эфира 2-(3-гидроксициклогексилоксиметил)-6-метилбензойной кислоты (см. пример 2) растворяют в 430 мл tBuOMe. Добавляют 17,2 г (примерно 55%, 0,35 моль) NaH и перемешивают 30 минут при 23°C. Добавляют 55,1 г (0,166 моль) 4-йодметил-2-(4-метилфенил)-5-метилоксазола (пример 6). После 6 часов перемешивания и выстаивания в течение 2 дней добавляют при охлаждении 400 мл воды и отделяют органическую фазу. После сушки (Na2SO4) и концентрирования сырой продукт (75 г) выделяют путем хроматографии на силикагеле (примерно 1 кг) (дихлорметан/ацетон 19:1), выход: 42 г диалкилированного производного 1,3-циклогександиола в виде желтоватого масла; 1H-ЯМР (CDCl3), δ=1,16-1,31 (м, 4H), 1,80 (м, 1H), 1,97-2,1 (м, 2H), 2,34 (с, 3H), 2,39 (с, 3H), 2,40 (с, 3H), 2,52 (м, 1H), 3,27 (м, 1H), 3,37 (м, 1H), 3,89 (с, 3H), 4,47 (с, 2H), 4,59 (с, 2H), 7,13 (д, 1H), 7,20-7,28 (м, 4H), 7,88 (д, 1H).
Пример 8
Синтез (1R,3S)-2-{3-[2-(4-метилфенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты
42,0 г (0,09 моль) (1R,3S)-метилового эфира 2-{3-[2-(4-метилфенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты (см. пример 7) растворяют в 420 мл этанола. Добавляют 45 мл 33%-ного NaOH и нагревают примерно 20 часов с обратным холодильником. Этанол отгоняют в вакууме, остаток растворяют в 500 мл воды и раствор четыре раза промывают простым эфиром MTB, используя по 100 мл. Водную фазу при охлаждении подкисляют концентрированной соляной кислотой (pH 1) и получаемый маслянистый продукт экстрагируют этиловым эфиром уксусной кислоты. Раствор этилового эфира уксусной кислоты сушат и концентрируют в вакууме. Остаток растворяют в 250 мл DIPE в тепле. При охлаждении начинается кристаллизация. По окончании кристаллизации и сушки в вакууме при 60°C получают 28,4 г желаемой карбоновой кислоты; т.пл. 117-119°C; чистота>98% (ВЭЖХ на Chiralpak AD-H 250×4,6; 1 мл/мин, гептан/EtOH/CH3CN 90:7:1+0,1% TFA); 1H-ЯМР (CDCl3), δ=1,14-1,36 (м, 4H), 1,80 (м, 1H), 1,91 (м, 2H), 2,39 (с, 3H), 2,40 (с, 3H), 2,46 (с, 3H), 2,64 (м, 1H), 3,40 (м, 2H), 4,54 (с, 2H), 4,68 (дд, 2H), 7,17-7,30 (м, 5H), 7,91 (д, 2H).
Пример 9
Синтез 4-йодметил-2-(3-метилфенил)-5-метилоксазола
6,0 г 4-хлорметил-2-(4-метилфенил)-5-метилоксазола растворяют в 120 мл ТГФ и смешивают с 4,5 г (30 ммоль) NaI. Перемешивают 5 ч и оставляют на ночь. Отделение твердой фазы и концентрирование фильтрата в вакууме дает 10,2 г желаемого йодида; т.пл. 32°C; 1H-ЯМР (CDCl3): δ=2,30 (с, 3H), 2,40 (с, 3H), 4,34 (с, 2H), 7,24 (д, 1H), 7,32 (т, 1H), 7,77 (д, 1H), 7,83 (д, 1H).
Пример 10
Синтез (1R,3S)-метилового эфира 2-{3-[2-(3-метилфенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты
36,0 г (0,129 моль) (1R,3S)-метилового эфира 2-(3-гидроксициклогексилоксиметил)-6-метилбензойной (см. пример 2), растворяют в 430 мл tBuOMe. Добавляют 17,19 г (примерно 55%, 0,35 моль) NaH и перемешивают 30 минут при 20-22°C. Добавляют 55,1 г (0,166 моль) 4-йодметил-2-(3-метилфенил)-5-метилоксазола (см. пример 9). После 6 часов перемешивания и выдерживания в течение 2 суток добавляют при охлаждении 400 мл воды и отделяют органическую фазу. После сушки (Na2SO4) и концентрирования сырой продукт (75 г) выделяют путем хроматографии на силикагеле (1,2 кг) (дихлорметан/ацетон 19:1), выход: 49 г (1R,3S)-метилового эфира 2-{3-[2-(3-метилфенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты; 1H-ЯМР (CDCl3), δ=1,13-1,31 (м, 4H), 1,80 (м, 1H), 1,97-2,1 (м, 2H), 2,34 (с, 3H), 2,40 (с, 3H), 2,41 (с, 3H), 2,52 (м, 1H), 3,27 (м, 1H), 3,37 (м, 1H), 3,90 (с, 3H), 4,48 (с, 2H), 4,59 (с, 2H), 7,12-7,33 (м, 4H), 7,78 (д, 1H), 7,84 (с, 1H).
Пример 11
Синтез (1R,3S)-2-{3-[2-(3-метилфенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты
49,0 г (0,09 моль) (1R,3S)-метилового эфира 2-{3-[2-(3-метилфенил)-5-метилоксазол-4-илметокси]-циклогексил-1-оксиметил}-6-метилбензойной кислоты (см. пример 10) растворяют в 500 мл этанола. Добавляют 50 мл 33%-ного NaOH и нагревают примерно 14 часов с обратным холодильником. Этанол отгоняют в вакууме, остаток растворяют в 500 мл воды и раствор трижды промывают метил-трет-бутиловым эфиром, используя по 150 мл. Водную фазу при охлаждении подкисляют концентрированной соляной кислотой (pH 1) и масля