Эукариотическая клетка-хозяин для экспрессии витамин к-зависимого белка, вектор экспрессии в эукариотических клетках, способ получения гамма-карбоксилированного витамин к-зависимого белка и способ получения фармацевтической композиции для индукции свертывания крови или стимулирования повышения или понижения коагуляции
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению гамма-карбоксилированного белка, и может быть использовано в медицине. Витамин К-зависимый белок получают путем выделения после культивирования эукариотической клетки, содержащей экспрессирующий вектор, который содержит молекулу нуклеиновой кислоты, кодирующую витамин К-зависимый белок и ассоциированные последовательности, контролирующие экспрессию. Ассоциированные последовательности содержат первый промотор и молекулу нуклеиновой кислоты, кодирующую гамма-глутамилкарбоксилазу, и второй промотор. В качестве первого промотора используют предранний промотор цитомегаловируса человека (hCMV), а в качестве второго промотора - предранний промотор SV40. При этом соотношение экспрессии витамин К-зависимого белка и гамма-глутамилкарбоксилазы составляет от 10:1 до 250:1. Изобретение позволяет получить гамма-карбоксилированный витамин К-зависимый белок в промышленных масштабах. 4 н. и 25 з.п. ф-лы, 3 ил., 6 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к клетке-хозяину, содержащей экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор. Кроме того, изобретение относится к способу получения белка, требующего гамма-карбоксилирования, с высоким выходом продукта.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Кровотечение представляет собой общую клиническую проблему. Оно является следствием заболевания, травмы, хирургического вмешательства и медикаментозного лечения. Крайне важно механически остановить это кровотечение. Это может оказаться трудным или даже невозможным из-за местоположения кровотечения или из-за того, что оно происходит из многочисленных (мелких) сосудов. Поэтому пациентам с кровотечением может потребоваться лечение агентами, которые поддерживают гемостаз. Эти агенты могут представлять собой продукты, происходящие из крови (гемотерапия), агенты, которые вызывают высвобождение эндогенных гемостатических агентов, рекомбинантные факторы свертывания крови (F) или агенты, которые замедляют растворение сгустков крови.
Происходящие из крови продукты первой линии обработки, часто получаемые из местной больницы, представляют собой цельную кровь для замещения объема крови и поддержки гемостаза, эритроцитарную массу для улучшения способности транспортировать кислород, концентраты тромбоцитов для увеличения количества тромбоцитов (если их мало или они дефектные) и свежезамороженную плазму для поддержки гемостаза (свертывания крови и агрегации тромбоцитов). Происходящие из плазмы продукты второй линии, которые поддерживают гемостаз, представляют собой криопреципитат плазмы, концентраты протромбинового комплекса, концентраты активированного протромбинового комплекса и очищенные факторы свертывания крови. В настоящее время имеется несколько факторов свертывания крови в виде рекомбинантных белков человека, неактивных (факторы свертывания крови VIII и IX) и активированных (фактор свертывания крови Vila).
Гемофилия представляет собой наследственное или приобретенное нарушение кровотечения, характеризующееся либо аномальным фактором свертывания крови, либо дефицитом фактора свертывания крови, либо антителами против фактора свертывания крови, который ингибирует прокоагулирующую функцию. Большинство часто встречающихся гемофилий представляют собой гемофилию А (дефицит фактора свертывания крови VIII) и гемофилию В (дефицит фактора IX). Очищенные или рекомбинантные одиночные факторы свертывания крови представляют собой основной способ лечения пациентов с гемофилией. Пациенты с ингибиторными антителами имеют проблемы в лечении, так как эти антитела могут нейтрализовать также фактор свертывания крови, который вводят такому пациенту. Активная форма белка С (АРС) представляет собой ингибитор коагуляции плазмы путем деградации активированных факторов свертывания крови Va и VIlla. Показано, что рекомбинантный АРС представляет собой эффективный способ лечения чрезмерной коагуляции плазмы у пациентов с сепсисом.
Факторы свертывания крови для терапевтического применения могут быть получены из плазмы человека, хотя процесс очистки не является простым и требует многих стадий, из которых некоторые направлены на элиминацию контаминирующих вирусов. Но даже при расширенных мерах безопасности и тестировании продуктов, происходящих из крови, контаминация инфекционными вирусами или прионами не может быть исключена. Из-за этого риска крайне желательно получать терапевтические белки человека из рекомбинантных клеток, выращенных в среде, не содержащей компонентов животного происхождения. Это не всегда является эффективным, так как для многих белков необходим хозяин-млекопитающее для того, чтобы продуцироваться в полностью функциональной форме, то есть правильно посттрансляционно модифицироваться. К факторам свертывания крови, получаемым в рекомбинантных клетках в промышленных масштабах, относятся FVII (NovoSeven), FVIII (Kogenate, Recombinate, Refacto) и FIX (BeneFix) (Roddie and Ludlam. Blood Rev. 11: 169-177,1997), и активный белок С (Xigris). Одно из основных препятствий при получении больших количеств полностью функциональных рекомбинантных факторов свертывания крови человека заключается в Gla-домене, присутствующем в FII, FVII, FIX, FX и белке С. Этот домен содержит остатки глутаминовой кислоты, которые подвергаются посттрансляционной модификации путем присоединения карбоксильных групп. Получению этих факторов препятствует тот факт, что их сверхэкспрессия приводит к недокарбоксилированному и, следовательно, неактивному белку. Модификации Gla являются результатом действия витамин К-зависимого фермента, известного как γ-глутамилкарбоксилаза (GGCX). Этот фермент подробно изучали многие исследователи, в частности те, которые занимались изучением факторов свертывания крови (WO-A-8803926; Wu et al., Science 254 (5038): 1634-1636, 1991; Rehemtulla et al., Proc NatI Acad Sci USA 90: 4611-4615, 1993; Stanley J. Biol. Chem. 274 (24): 16940-16944, 1999; Vo et al., FEBS letters 445: 256-260, 1999; Begley et al., The Journal of Biological Chemistry 275 (46): 36245-36249, 2000; Walker et al., The Journal of Biological Chemistry 276 (11): 7769-7774, 2001; Bandyopadhyay et al., Proc Natl Acad Sci USA 99 (3): 1264-1269, 2002; Czerwiec et al., Eur J Biochem 289: 6162-6172, 2002; Hallgren et al., Biochemistry 41 (50): 15045-15055, 2002; Harvey et al., The Journal of Biological Chemistry 278 (10): 8363-8369, 2003). По меньшей мере двумя научными группами предприняты попытки увеличить выход продукции путем совместной экспрессии GGCX и фактора коагуляции FIX, но они оказались безуспешными (Rehemtulla et al., 1993, там же; Hallgren et al., 2002, там же). Принимая во внимание большой интерес к γ-карбоксилированым белкам, можно предположить, что гораздо больше попыток совместной экспрессии окончились неудачей и поэтому не были описаны.
В случае человеческого FII (протромбина), по меньшей мере 8 из 10 Glu-остатков должны быть правильно модифицированы для получения полностью функционального протромбина (Malhotra et al., J. Biol. Chem. 260: 279-287, 1985; Seegers and Walz 'Prothrombin and other vitamin К proteins', CRC Press, 1986). Для получения высоких уровней выхода rhFII были предприняты экстенсивные попытки с использованием нескольких различных систем, таких как клетки СНО, клетки ВНК, клетки 293, и системы экспрессии на основе вируса осповакцины, но все они закончились неудачей или имели результатом недокарбоксилированный продукт, и соответственно функционально неактивный протромбин (Jorgensen et al., J. Biol. Chem. 262: 6729-6734, 1987; Russo et al., Biotechnol AppI Biochem 14 (2): 222-233, 1991; Fischer et al., J Biotechnol 38 (2): 129-136, 1995; Herlitschka et al., Protein Expr. Purif. 8 (3): 358-364, 1996; Russo et al., Protein Expr. Purif. 10: 214-225, 1997; Vo et al., 1999, там же; Wu and Suttie Thromb Res 96 (2): 91-98, 1999). Ранее описанные продуктивности карбоксилированного рекомбинантного протромбина человека являются низкими; 20 мг/л - для мутантного протромбина (Côte et al., J. Biol. Chem 269: 11374-11380, 1994), 0,55 мг/л - для протромбина человека, экспрессированного в клетках СНО (полностью карбоксилированного, Jorgensen et al., 1987, там же), 25 мг/л - в клетках СНО (степень карбоксилирования не показана, Russo et al., 1997, там же).
В WO 92/19636 раскрыто клонирование и идентификация последовательности витамин К-зависимой карбоксилазы человека и крупного рогатого скота. В этой заявке для получения витамин К-зависимого белка предложена совместная экспрессия витамин К-зависимой карбоксилазы и витамин К-зависимого белка в подходящей клетке-хозяине. Никаких примеров совместной экспрессии карбоксилазы и витамин К-зависимого белка не приведено.
Существует необходимость в улучшенных способах получения активированных факторов свертывания крови с высоким выходом продукта. Настоящее изобретение направлено на решение этой потребности.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно первому аспекту изобретения предложена клетка-хозяин, содержащая экспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор, где первый промотор значительно сильнее второго промотора, так что белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза экспрессируются в соотношении по меньшей мере 10:1.
Согласно другому аспекту изобретения предложена клетка, которая создана для экспрессии (1) белка, который требует гамма-карбоксилирования, и (2) γ-глутамилкарбоксилазы, где белки (1) и (2) экспрессируются в соотношении от 10:1 до 500:1.
Согласно другому аспекту изобретения предложена генетически модифицированная эукариотическая клетка-хозяин, содержащая:
(1) полинуклеотидную последовательность, кодирующую белок γ-глутамилкарбоксилазу, где указанная последовательность, кодирующая белок γ-глутамилкарбоксилазу, функциональным образом связана с последовательностями, контролирующими экспрессию и позволяющими указанной клетке экспрессировать белок γ-глутамилкарбоксилазу; и
(2) полинуклеотид, кодирующий белок, требующий карбоксилирования белком γ-глутамилкарбоксилазой, функциональным образом связанным с последовательностями, контролирующими экспрессию и позволяющими указанной клетке экспрессировать указанный белок, требующий карбоксилирования;
где данная клетка способна экспрессировать белок γ-глутамилкарбоксилазу и белок, требующий карбоксилирования, в соотношении 1:10.
Согласно другому аспекту изобретения предложен вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор, где первый промотор значительно сильнее второго промотора, так что белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза экспрессируются в соотношении по меньшей мере 10:1.
Согласно еще одному аспекту изобретения предложен способ получения гамма-карбоксилированного белка, включающий: (1) культивирование клетки, адаптированной для экспрессии белка, который требует гамма-карбоксилирования, и γ-глутамилкарбоксилазы в соотношении по меньшей мере 10:1, при условиях, подходящих для экспрессии обоих белков, и (2) выделение гамма-карбоксилированного белка. В одном воплощении данный способ используют для получения гамма-карбоксилированного фактора IX человека, а в другом воплощении данный способ используют для получения гамма-карбоксилированного протромбина человека. В другом воплощении полученный гамма-карбоксилированный белок представляет собой гамма-карбоксилированный фактор Х человека.
Согласно другому аспекту изобретения предложен способ получения гамма-карбоксилированного белка в линии клеток млекопитающих, включающий этап совместной экспрессии указанного белка, требующего гамма-карбоксилирования, и γ-глутамилкарбоксилазы в линии клеток млекопитающих, где количество экспрессирующегося белка, требующего гамма-карбоксилирования, по меньшей мере в 10 раз выше, чем количество экспрессирующейся γ-глутамилкарбоксилазы, и (2) выделение гамма-карбоксилированного белка. В одном воплощении данный способ используют для получения гамма-карбоксилированного фактора IX человека, а в другом воплощении данный способ используют для получения гамма-карбоксилированного протромбина человека. В другом воплощении полученный гамма-карбоксилированный белок представляет собой гамма-карбоксилированный фактор Х человека.
Согласно другому аспекту изобретения предложен выделенный гамма-карбоксилированный белок, получаемый согласно вышеизложенным способам, и применение выделенного гамма-карбоксилированного белка, получаемого согласно вышеизложенным способам, в коагулянтной терапии или применение выделенного гамма-карбоксилированного белка, получаемого согласно вышеизложенным способам, для изготовления лекарства для применения в коагулянтной терапии.
Согласно еще одному аспекту изобретения предложен способ получения фармацевтической композиции, подходящей для индукции свертывания крови или стимуляции повышенной или пониженной коагуляции, включающий очистку активного карбоксилированного белка, экспрессирующегося в клетке-хозяине, адаптированной для экспрессии белка, требующего гамма-карбоксилирования, и γ-глутамилкарбоксилазы в соотношении от 10:1 до 500:1, и смешивание очищенного карбоксилированного белка с одним или более фармацевтически приемлемыми носителями или эксципиентами, и фармацевтическая композиция, получаемая этим способом. В одном воплощении активный карбоксилированный белок представляет собой гамма-карбоксилированный фактор IX человека, а в другом воплощении активный карбоксилированный белок представляет собой гамма-карбоксилированный протромбин человека. В другом воплощении активный карбоксилированный белок представляет собой гамма-карбоксилированный фактор Х человека.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1а приведена плазмидная карта вектора PN32 для совместной экспрессии (протромбин + GGCX).
На Фиг.1б представлена плазмидная карта экспрессирующего вектора Ptext5 (протромбин).
На Фиг.2 представлена плазмидная карта вектора РР6 для совместной экспрессии (протромбин + GGCX).
На Фиг.3а представлена плазмидная карта вектора F9NopA для совместной экспрессии (фактор IX+GGCX).
На Фиг.3б представлена плазмидная карта вектора F9hglx для совместной экспрессии (фактор IX+GGCX).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы изобретения разработали другой подход к экспрессии соответствующим образом карбоксилированных рекомбинантных витамин К-зависимых факторов свертывания крови, который включает совместную экспрессию витамин К-зависимого фактора свертывания крови и γ-глутамилкарбоксилазы (GGCX) в различных соотношениях. В качестве примера авторы изобретения экспрессировали протромбин человека (rhFII) и GGCX человека. Вместо использования сильных промоторов как для rhFII, так и для GGCX, как это уже пытались делать другие (Rehemtulla et al., 1993, там же; Hallgren et al., 2002, там же), авторы изобретения использовали стратегию, направленную на сильную экспрессию FII в комбинации со слабой или очень слабой экспрессией GGCX, при которой количество экспрессирующейся GGCX составляло менее 1/10 от экспрессирующегося rhFII. Неожиданно эта стратегия привела к высоким уровням секретируемого правильно модифицированного rhFII и хорошей жизнеспособности клеток-хозяев даже в том случае, когда эти клетки выращивали в среде с установленным химическим составом, не содержащей компонентов животного происхождения.
Авторы изобретения клонировали GGCX и протромбин человека в экспрессирующем векторе таким образом, что уровень мРНК протромбина превышает уровень мРНК GGCX по меньшей мере в 10 раз. Это приводит к большому избытку в продукции протромбинового белка по сравнению с GGCX-белком.
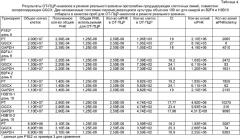
В качестве другого примера авторы изобретения экспрессировали rhFIX, используя те же самые векторы для совместной экспрессии с GGCX. Это привело к тому, что в одном случае клеточные линии продуцировали мРНК фактора IX на уровнях, превышающих уровни мРНК GGCX по меньшей мере в 10 раз. В другой клеточной линии соотношение мРНК фактора IX и мРНК GGCX составляло приблизительно 4-5:1. Существенно возросшую продуктивность rhFIX показала только клеточная линия, дающая соотношение по меньшей мере 10:1 (Таблица 1).
| Таблица 1. | ||||
| Сводные данные по продуктивности и соотношению мРНК карбоксилированного белка и мРНК GGCX | ||||
| клон НАЗВАНИЕ/КОНСТРУКЦИЯ | Продуцируе-мый белок | Получение* полностью активного белка (мг/л) | Карбоксилиро-ванный белок :GGCX,приблизит. соотношение мРНК | Источник данных |
| P1E2/PN32 | Протромбин человека | 40 | 250:1 | Пример 3 |
| B2F4/PP6 | 26 | 50:1 | Пример 5 | |
| Н3В10/РР6 | 30 | 30:1 | Пример 5 | |
| E1A9/PText5 | 3,5 | Отсутств. GGCX | Пример 3 | |
| N4D5/F9NopA | FIX человека | 7,3 | 45:1 | Пример 7 |
| P1G9/F9hglx | 1,3 | 4:1 | Пример 7 | |
| IC4 | 1 | отсутствует GGCX | Rehemtulla 1993, US 5460950 | |
| * Продуктивность измеряли для постоянно перемешивающихся культур при сходных условиях роста.¤ Данные из Rehemtulla 1993 и патента США №5460950. |
Можно ожидать, что витамин К-зависимые факторы свертывания крови (FII, FVII, FIX, FX и их активированные формы FIIa или тромбин, FVIIa, FIXa, FXa), полученные настоящим способом совместной экспрессии с GGCX, окажутся полезными в предупреждении и лечении кровотечения, являющегося следствием травмы, хирургического вмешательства или заболеваний печени, почек, тромбоцитов или факторов свертывания крови (гемофилии). Аналогично можно ожидать, что фактор свертывания крови белок С и его активированная форма АРС окажутся полезными в предупреждении и лечении расстройств, связанных с повышенной коагуляцией с уменьшением или без уменьшения уровней белка С. Данный способ является подходящим также для других белков, которые требуют посттрансляционного карбоксилирования.
Согласно первому аспекту изобретения предложена клетка-хозяин, содержащая зкспрессирующий вектор, содержащий молекулу нуклеиновой кислоты, кодирующую белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, содержащие первый промотор, и молекулу нуклеиновой кислоты, кодирующую γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, содержащие второй промотор, где первый промотор значительно сильнее второго промотора, так что белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза экспрессируются в соотношении по меньшей мере 10:1.
В предпочтительном воплощении соотношение данных экспрессирующихся белков находится в диапазоне от 10:1 до 1000:1, более предпочтительно в диапазоне от 10:1 до 500:1 и еще более предпочтительно в диапазоне от 25:1 до 250:1. Особенно подходящее соотношение составляет приблизительно 200:1.
В отдельных воплощениях соотношение этих двух экспрессирующихся белков может составлять по меньшей мере 10:1, 30:1, 45:1, 50:1, 100:1, 200:1, 250:1, 300:1, 400:1, 500:1 и 1000:1.
В одном конкретном воплощении как молекула нуклеиновой кислоты, кодирующая белок, требующий гамма-карбоксилирования, и ассоциированные последовательности, контролирующие экспрессию, так и молекула нуклеиновой кислоты, кодирующая γ-глутамилкарбоксилазу, и ассоциированные последовательности, контролирующие экспрессию, расположены в одном и том же экспрессирующем векторе. В другом воплощении эти две молекулы нуклеиновой кислоты расположены в отдельных экспрессирующих векторах.
Согласно другому аспекту изобретения предложена нуклеиновая кислота, соответствующая SEQ ID NO:14 и SEQ ID NO:15.
Согласно другому аспекту изобретения предложена клетка-хозяин, трансфицированная или трансформированная вектором, содержащим последовательность SEQ ID NO:14 или SEQ ID NO:15 для экспрессии фактора IX человека.
Согласно другому аспекту изобретения предложена клетка-хозяин, способная экспрессировать ферменты фактор свертывания крови IX человека и γ-глутамилкарбоксилазу человека, где нуклеиновая кислота, кодирующая фактор свертывания крови IX человека, и нуклеиновая кислота, кодирующая γ-глутамилкарбоксилазу, функциональным образом связаны с регуляторными последовательностями, которые способны экспрессировать эти два белка в соотношении по меньшей мере 10:1 соответственно.
Согласно другому аспекту изобретения предложена эукариотическая клетка-хозяин из организма, не являющегося человеком, адаптированная для экспрессии ферментов фактора свертывания крови IX человека и γ-глутамилкарбоксилазы человека в соотношении по меньшей мере 10:1. В конкретном воплощении нуклеиновая кислота, кодирующая фактор свертывания крови IX человека, и нуклеиновая кислота, кодирующая γ-глутамилкарбоксилазу, функциональным образом связаны с регуляторными последовательностями, которые способны экспрессировать эти два белка в соотношении по меньшей мере 10:1 соответственно.
Согласно другому аспекту изобретения предложена клетка-хозяин, содержащая экзогенную нуклеиновую кислоту, содержащую нуклеиновую кислоту, кодирующую фактор свертывания крови IX человека, под контролем промотора hCMV, и нуклеиновую кислоту, кодирующую карбоксилазу человека, под контролем промотора SV40.
Согласно другому аспекту изобретения предложена нуклеиновая кислота, соответствующая SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3.
Согласно другому аспекту изобретения предложены клетки-хозяева, трансфицированные или трансформированные вектором, содержащим последовательность SEQ ID NO:1, SEQ ID NO:2 или SEQ ID NO:3 для экспрессии протромбина человека.
Согласно другому аспекту изобретения предложены клетки-хозяева, способные экспрессировать ферменты протромбин человека и гамма-карбоксилазу человека, где нуклеиновая кислота, кодирующая протромбин человека, и нуклеиновая кислота, кодирующая гамма-карбоксилазу, функциональным образом связаны с регуляторными последовательностями, которые способны экспрессировать эти два белка в соотношении по меньшей мере 10:1 соответственно.
Согласно другому аспекту изобретения предложена эукариотическая клетка-хозяин из организма, не являющегося человеком, адаптированная для экспрессии ферментов протромбина человека и гамма-карбоксилазы человека в соотношении по меньшей мере 10:1. В конкретном воплощении нуклеиновая кислота, кодирующая протромбин человека, и нуклеиновая кислота, кодирующая гамма-карбоксилазу, функциональным образом связаны с регуляторными последовательностями, которые способны экспрессировать эти два белка в соотношении по меньшей мере 10:1 соответственно.
Согласно другому аспекту изобретения предложена клетка-хозяин, содержащая экзогенную нуклеиновую кислоту, содержащую нуклеиновую кислоту, кодирующую протромбин человека, под контролем промотора hCMV и нуклеиновую кислоту, кодирующую карбоксилазу человека, под контролем промотора SV40.
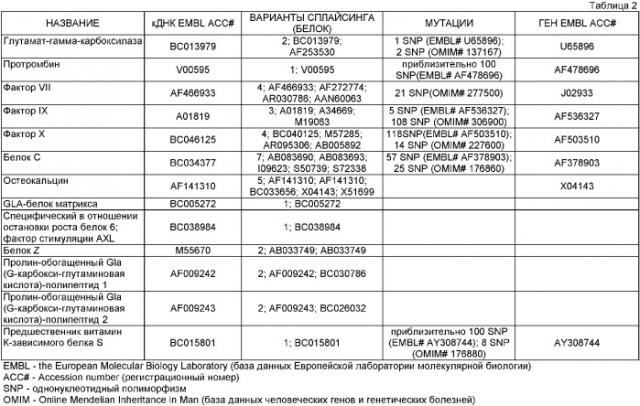
Данное изобретение подтверждено примером, где в качестве белков, требующих карбоксилирования, использованы протромбин и фактор свертывания крови IX. Однако и у некоторых других белков, отличных от протромбина и фактора IX, полная биологическая активность зависит от правильного γ-карбоксилирования. К этим известным специалисту белкам принадлежит фактор свертывания крови FVII, который в настоящее время в промышленном масштабе получают только в рекомбинантных клетках млекопитающих с относительно низкими уровнями (приблизительно 10 мг/л или менее). Настоящее изобретение можно использовать для улучшения продуктивности любого белка, который зависит от γ-карбоксилирования, такие белки включают, но не ограничены ими, протромбин, фактор свертывания крови II (FII), фактор свертывания крови VII (FVII), фактор свертывания крови IX (FIX), фактор свертывания крови Х (FX), белок С, белок S, белок Z, костный Gla-белок (также известный как BGP или остеокальцин), Gla-белок матрикса (MGP), пролин-обогащенный Gla-полипептид 1 (PRRG1), пролин-обогащенный Gla-полипептид 2 (PRRG2), белок 6, специфический в отношении остановки роста (Gas 6). Другие подходящие белки представляют собой FXa-подобный белок из яда змей элапид (подсемейство Acanthophiina) и яда улиток-конусов (Conus textile).
Каждый из этих белков, включая их нуклеотидные и аминокислотные последовательности, хорошо известен. В таблице 2 идентифицированы типичные последовательности различных белков дикого типа и мутантных форм, которые могут быть использованы по настоящему изобретению.
Следует принимать во внимание, что данное изобретение не ограничено конкретным белком или белок-кодирующей последовательностью одного из тех белков, которые должны быть совместно экспрессированы. Более того, и в особенности это касается факторов свертывания крови, в данной области раскрыты многочисленные мутантные формы этих белков. Настоящее изобретение применимо в равной степени и к этим мутантным формам, включая природные аллельные варианты, данных белков, а также к последовательности дикого типа. В одном воплощении изобретение можно применять к любому белку дикого типа или белку, который по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентичен последовательности белка дикого типа.
Идентичность двух последовательностей может быть определена путем анализа попарного выравнивания с использованием таких компьютерных программ, как BestFit, PILEUP, Gap или FrameAlign. Предпочтительная программа выравнивания представляет собой BestFit. На практике при поиске сходных/идентичных последовательностей на запрос о поиске в базе данных обычно необходимо выполнить первичную идентификацию сходных последовательностей, используя подходящие алгоритмы, такие как Blast, Blast2, NCBI Blast2, WashU Blast2, FastA или Fasta3, и матрицу весовых коэффициентов, такую как Blosum 62. Такие алгоритмы стремятся к близкой аппроксимации алгоритма выравнивания "золотого стандарта" по Смиту-Уотерману (Smith-Waterman). Таким образом, предпочтительное программное обеспечение/программа реализации поиска для использования при определении схожести, то есть насколько две исходные полипептидные последовательности выровнены, представляет собой алгоритм Смита-Уотермана. Идентичность относится к прямым совпадениям, сходство допускает консервативные замены.
Термин "γ-глутамилкарбоксилаза", или "GGCX", в контексте данного описания относится к витамин К-зависимому ферменту, который катализирует карбоксилирование остатков глутаминовой кислоты.
GGCX-ферменты широко распространены и клонированы из многих разных видов, таких как кит белуха Delphinapterus leucas, рыба-жаба Opsanus tau, курица (Gallus gallus), миксина (Myxine glutinosa), мечехвост (Limulus polyphemus) и улитка-конус Conus textile (Begley et al., 2000, там же; Bandyopadhyay et al., 2002, там же). Карбоксилаза улитки-конуса сходна с карбоксилазой крупного рогатого скота и экспрессировалась в клетках COS (Czerwiec et al., 2002, там же). Дополнительные белки, сходные с GGCX, можно обнаружить у насекомых и прокариот, таких как Anopheles gambiae, Drosophila melanogaster и Leptospira (регистрационные номера NCBI: gi 31217234, gi 21298685, gi 24216281, gi 24197548 и (Bandyopadhyay et al., 2002, там же) соответственно). Фермент карбоксилаза проявляет значительную эволюционную консервативность. Показано или может быть прогнозировано, что некоторые ферменты из организма, не являющегося человеком, проявляют активность, сходную с активностью GGCX человека, которую использовали авторы изобретения, и поэтому могут быть использованы в качестве альтернативы данному человеческому ферменту.
В таблице 3 идентифицированы типичные последовательности предсказанных белков, гомологичных GGCX человека (сортированы по видовому происхождению), которые могут быть использованы по настоящему изобретению.
| Таблица 3. | |
| Вид | Регистрационный # в базе данных/ID |
| Homo sapiens (человек) | NM_000821.2 HUMGLUCARB |
| HUMHGCA | |
| BC004422 | |
| HSU65896 | |
| AF253530.1 | |
| Papio hamadryas (павиан-гамадрил) | AC116665.1 |
| Delphinapterus leucas (белуха) | AF278713 |
| Bos taurus (крупный рогатый скот) | NM_174066.2 |
| BOVCARBOXG | |
| BOVBGCA | |
| Ovis aries (домашняя овца) | AF312035 |
| Rattus norvegicus (серая крыса) | NM_031756.1 |
| AF065387 | |
| Mus musculus (мышь) | NM_019802.1 |
| AF087938 | |
| Opsanus tau (костистые рыбы) | AF278714.1 |
| Conus textile (моллюски) | AY0044904.1 |
| AF382823.2 | |
| Conus imperials (моллюски) | AF448234.1 |
| Conus episcopatus (моллюски) | AF448233.1 |
| Conus omaria (моллюски) | AF448235.1 |
| Drosophila melanogaster (дрозофила) | NM_079161.2 |
| Anopheles gambiae (комар) | XM316389.1 |
| Secale cereale (однодольные растения) | SCE314767 |
| Triticum aestivum (пшеница мягкая) | AF280606.1 |
| Triticum urartu (однодольные растения) | AY245579.1 |
| Hordeum vulgare (ячмень) | BLYHORDCA |
| Leptospira interrogans (спирохеты) | AE011514.1 |
| Streptomyces coelicolor (грамположительные бактерии, обогащенные GC) | SC0939109 |
| SC0939124 | |
| AF425987.1 | |
| Streptomyces lividans (грамположительные бактерии, обогащенные GC) | SLU22894 |
| Streptomyces viginiae (грамположительные бактерии, обогащенные GC) | SVSNBDE |
| Micrococcus iuteus (грамположительные бактерии, обогащенные GC) | MLSPCOPER |
| Chlamydomonas reinhardtii (зеленые водоросли) | AF479588.1 |
| Dictyostelium discoideum (слизевики) | AC115612.2 |
| Coturnix coturnix (птицы) | AF364329.1 |
| Bradyrhizobium japonicum (α-протобактерии) | AP005937.1 |
| Rhodobacter sphaeroides (α-протобактерии) | RSY14197 |
| Sinorhizobium meliloti (α-протобактерии) | RME603647 |
| AF119834 | |
| Mesorhizobium loti (α-протобактерии) | AP003014.2 |
| Chromobacterium violaceum (β-протобактерии) | AE016910.1 |
| AE016918.1 | |
| Pseudomonas aeruginosa (γ-протобактерии) | AE004613.1 |
| AF165882 | |
| Xanthomonas axonopodis (γ-протобактерии) | AE011706.1 |
| Human herpesvirus 8 | KSU52064 |
| KSU75698 | |
| AF305694 | |
| AF360120 | |
| AF192756 | |
| ID - идентификатор |
Каждый из GGCX-белков, идентифицированных выше, и GGCX-белков из других видов можно применять в качестве фермента карбоксилазы в настоящем изобретении.
Один из способов осуществить дифференциальную экспрессию двух совместно экспрессирующихся белков состоит в том, чтобы использовать разные промоторы в качестве части соответствующих последовательностей, контролирующих экспрессию. Данная область техники изобилует примерами разных промоторов и других последовательностей, контролирующих экспрессию, которые способны экспрессировать гетерологичные белки на различающихся уровнях и в разной степени. Рекомбинантная технология экспрессии достаточно развита, чтобы специалист в области экспрессии белков был способен выбрать промоторы и другие регуляторные последовательности для осуществления совместной экспрессии белка, требующего карбоксилирования, и карбоксилазы в желательном соотношении. Выбор того, какие конкретные промоторы и другие последовательности, контролирующие экспрессию, должны быть использованы, зависит от личного предпочтения.
В одном воплощении регуляторные последовательности, ассоциированные с белком, требующим гамма-карбоксилирования, включают сильный промотор. В одном воплощении этот промотор представляет собой предранний промотор цитомегаловируса человека (hCMV). Сильный промотор в данном контексте определен как промотор, приводящий к образованию более 1000 транскриптов/клетку. Слабый промотор в данном контексте определен как промотор, приводящий к образованию менее 1000 транскриптов/клетку.
В другом воплощении регуляторные последовательности, ассоциированные с γ-глутамилкарбоксилазой, включают слабый промотор. В одном воплощении этот промотор представляет собой ранний промотор SV40. В другом воплощении белок, требующий гамма-карбоксилирования, и γ-глутамилкарбоксилаза находятся под контролем разных промоторных элементов, при этом промотор, контролирующий экспрессию γ-глутамилкарбоксилазы, является более слабым, чем промотор, контролирующий экспрессию белка, требующего гамма-карбоксилирования.
В другом воплощении γ-глутамилкарбоксилаза находится под контролем раннего промотора SV40, а белок, требующий гамма-карбоксилирования, находится под контролем предраннего промотора цитомегаловируса человека (hCMV). В одном воплощении в соответствии с данным конкретным аспектом изобретения белок, требующий гамма-карбоксилирования, представляет собой фактора Х человека. В другом воплощении белок, требующий гамма-карбоксилирования, представляет собой протромбин человека. В другом воплощении белок, требующий гамма-карбоксилирования, представляет собой фактор IX человека.
Данное изобретение подтверждено примером, в котором для сверхэкспресии фактора IX или протромбина используют сильный промотор CMV (Boshart et al., Cell 41: 521-530, 1985), а для контроля экспрессии GGCX более слабый промотор SV40 (Wenger et al., Anal Biochem 221: 416-418, 1994). Другие сильные промоторы, которые можно было бы использовать по настоящему изобретению, включают pEF-1α (ген субъединицы фактора-1α элонгации человека) (Mizushima and Nagata, Nuc Acids Res 18: 5322, 1990; Goldman et al., BioTechniques 21: 1013-1015, 1996), pRSV [вирус саркомы Рауса (German et al., Proc Natl Acad Sci USA 79: 6777-6781, 1982)] и pUbC [убиквитин человека (Schorpp et al., Nuc Acids Res 24: 1787-1788, 1996)], но не ограничены ими.
Важно обеспечить, чтобы белок, который должен быть получен (белок, требующий карбоксилирования), находился в избытке по сравнению с ферментом модификации с получением соотношения по меньшей мере 10:1. Способы достижения низкого уровня экспрессии фермента модификации (γ-глутамилкарбоксилазы) включают:
1) Использование слабого промотора для контроля экспрессии фермента модификации, включая, но не ограничиваясь ими, предранний промотор SV40, минимизированный промотор FIX (Rouet et al., The Journal of Biological Chemistry 267: 20765-20773, 1992) или промотор тимидинкиназы HSV (вируса простого герпеса) (Wenger et al., 1994, там же).
2) Мутирование промоторных или энхансерных последовательностей сильного промотора для уменьшения силы промотора.
3) Удаление или изменение последовательности Козака (Kozak) (сигнала инициации трансляции) для уменьшения эффективности трансляции (Kozak, Nuc Acids Res 15: 8125-8148, 1987; Kozak, Proc Natl Acad Sci USA 87: 8301-8305, 1987, 1990).
4) Клонирование нуклеиновой кислоты, кодирующей белок, который должен быть получен (белок, требующий карбоксилирования), и нуклеиновой кислоты, кодирующей GGCX, в отдельных векторах и трансфекцию большим избытком конструкции, содержащей белок, который должен быть получен, с тем чтобы получить клетку с множественными копиями конструкции, содержащей белок, который должен быть получен.
5) Клонирование ДНК, кодирующей белок, который должен быть получен, и ДНК, кодирующей GGCX-модификацию, в отдельных векторах, котрансфекцию или независимую трансфекцию и использование системы амплификации для усиления экспрессии белка, который должен быть получен.
6) Выделение стабильной клеточной линии с низкими уровнями экспрессии рекомбинантной GGCX (но превышающими эндогенные уровни) и использование ее в качестве линии клеток-хозяев для экспрессии белков, требующих γ-карбоксилирования.
7) Введение мутации(й) в GGCX для уменьшения сродства GGCX к субстрату.
Наряду с этими способами специалисту в области экспрессии рекомбинантных белков известны другие способы, которые можно было бы использовать для получения клетки-хозяина, которая экспрессирует белок, требующий карбоксилирования, и белок карбоксилазу в соотношении по меньшей мере 10:1.
Согласно другому аспекту изобретения предложена клетка, которая создана или адаптирована для экспрессии (1) белка, который требует гамма-карбоксилирования, и (2) γ-гпутамилкарбоксилазы, где белки (1) и (2) экспрессируются в соотношении от 10:1 до 500:1. В конкретном воплощении γ-глутамилкарбоксилаза экспрессируется в диапазоне, превышающем эндогенные уровни (то есть уровни γ-глутамилкарбоксилазы в нерекомбинантной или неадаптированной клетке) от 2 до 5 раз.
Согласно другому аспекту изобретения предложена рекомбинантная клетка, адаптированная для экспрессии (1) белка γ-глутамилкарбоксилазы, превышающей конститутивные уровни, обнаруженные в эквивалентной неадаптированной клетке, и (2) белка, требующего карбоксилирования, где количество экспрессирующегося белка γ-глутамилкарбоксилазы и белка, требующего карбоксилирования, находится в соотношении по меньшей мере 1:10.
Согласно другому аспекту изобретения предложена генетически модифицированная эукариотическая клетка-хозяин, содержащая:
(1) полинуклеотидную последовательность, кодирующую белок γ-глутамилкарбоксилазу, где указанная последовательность, кодирующая белок γ-глутамилкарбоксилазу, функциональным образом связана с последовательностями, контролирующими экспрессию и позволяющими указанной клетке экспрессировать белок γ-глутамилкарбоксилазу; и
(2) полинуклеотид, кодирующий белок, требующий карбоксилирования белком γ-глутамилкарбоксилазой, функциональным образом связанный с последовательностями, контролирующими экспрессию и позволяющими указанной клетке экс