Средство, стимулирующее апоптоз клеток лейкемии человека (варианты)
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам и касается применения производных О- и S-гликозидов 5-гидрокси-1,4-нафтохинона (юглона) формулы 1, где R1 и R2 имеют указанные в описании значения, в качестве средства, стимулирующего апоптоз клеток лейкемии человека. Предложенные соединения избирательно стимулируют апоптоз клеток лейкоза человека по сравнению с прототипом юглоном без воздействия на нормальные клетки иммунной системы человека (нейтрофилы). Изобретение позволяет расширить арсенал средств, способных избирательно стимулировать апоптоз лейкемических клеток. 4 н.п. ф-лы, 13 ил., 5 табл.
Реферат
Изобретение относится к медицине и касается средств, обладающих способностью стимулировать апоптоз клеток лейкемии человека.
Лейкозы представляют собой опухоли, диффузно поражающие гемопоэтическую ткань костного мозга. Уровень заболеваемости лейкозами в разных странах мира колеблется в широком диапазоне: от 3 до 10 человек на 100000 населения. При этом мужчины болеют различными формами лейкоза примерно в 1,5 раза чаще, чем женщины. Максимальный уровень заболеваемости хроническими лейкозами наблюдается у людей старше 40-50 лет, а острыми - в возрасте до 10-18 лет.
Для лейкозов характерны:
- безграничный рост, неконтролируемое размножение клеток - гиперплазия;
- морфологическая анаплазия - потеря способности клетки к дифференцировке, созреванию, незрелость;
- угнетение нормального кроветворения за счет быстрого разрастания опухолевых элементов, «вытеснения» ими нормальных ростков кроветворения (метаплазия).
Основным методом лечения лейкозов является химиотерапия [В.И.Махолкин, С.И.Овчаренко. Внутренние болезни. М., Медицина, 1999]. В качестве лекарственных средств используют как препараты, полученные химическим синтезом, так и выделенные из природных источников. По механизму действия на опухолевый процесс их можно условно разделить на две основные группы; а) антиметаболиты - вещества нарушающие метаболизм основных биохимических процессов, протекающих в быстроделящейся клетке (опухолевой), б) цитостатики - вещества, воздействующие непосредственно на процесс деления клеток.
К первым относятся такие лекарственные средства как метотрексат, меркаптопурин, тиогуанин, цитарабин, флударабин, гидроксимочевина, ко вторым - митосантрон, винкристин, винбластин, тенипозид, рубомицнн, доксорубомицин и другие [М.Д.Машковский. Лекарственные средства. Т 2, Изд. 14, М. ООО «Новая Волна». 2001. С.407].
К сожалению, химиотерапия, как правило, имеет ряд сильно выраженных побочных эффектов. Вследствие слабой избирательности цитостатические препараты воздействуют как на больные, так и на здоровые клетки крови, что приводит к быстрой гибели значительного их числа и развитию почти полной цитопении - угнетению роста всех кровяных клеток (лейкоцитов, тромбоцитов и эритроцитов).
Наиболее опасным при этом является развитие лейкопении, так как лейкоциты представляют собой один из главных компонентов естественной защиты организма против инфекции. Степень и длительность лейкоцитопении, развивающейся после химиотерапии, в значительной степени определяет количество жизнеопасных инфекционных осложнений.
Тромбоцитопения также представляет клиническую проблему, обусловливая геморрагические осложнения, нередко фатальные, особенно при наличии сопутствующей инфекции.
Тяжелым осложнением применения химиотерапии при лечении лейкозов является угнетение роста нейтрофилов - нейтропения, которая приводит к инфекционным осложнениям. Учитывая высокую вероятность развития и потенциальную тяжесть инфекционных осложнений в условиях нейтропении, проводятся меры направленные на ограничение попадания возбудителей инфекции в организм пациентов извне с воздухом, пищей и водой, а также меры по борьбе с микроорганизмами, колонизирующими организм. Последний подход включает профилактическое назначение антибиотиков и противогрибковых препаратов.
Острые лейкозы при своевременной диагностике излечиваются в 80-90% случаев. Хронические лейкозы излечиваются всего лишь в 20-40% случаев; больные лечатся годами, длительное время им необходим тщательный врачебный уход и применение разнообразных лекарственных средств, вследствие сравнительно быстрого привыкания опухолевых клеток к действию одного препарата [В.И.Махолкин, С.И.Овчаренко. Внутренние болезни. М., Медицина, 1999].
Все это свидетельствует о необходимости поиска новых препаратов для лечения лейкозов, основанных на подходах, отличных от вышеупомянутых.
В начале 70-х годов XX века биологами было введено в научный оборот новое представление - апоптоз, описывающее систему клеточной смерти, отличающуюся от некроза отсутствием воспалительных реакций и токсического отравления организма, характерного для некротического варианта распада клеток, наблюдающегося при применении традиционных противоопухолевых препаратов [Schutze-Osthoff К., Ferrari D., Los M. et all Apoptosis signaling by death receptors. Eur. J. Biochem. 1998, Vol.254. P.439-459; Blatt N.B., Glick G.D. Signaling pathways and effector mechanisms preprogrammed cell death. Bioorg. Med. Chem. 2001. Vol 9, P.1371-1384].
В ходе апоптоза клетки подвергаются характерным морфологическим изменениям, включающим конденсацию и фрагментацию ядра, сжатие цитоплазмы и образование так называемых апоптотических тел, которые содержат фрагменты ядра, окруженные цитоплазмой и клеточной мембраной. Апоптотические клетки быстро всасываются макрофагами.
Позже было осознано, что апоптоз происходит во всех тканях организма, как часть нормального круговорота клеток. Например, апоптоз протекает в ходе эмбриогенеза в котором отдельные клетки (части тела) «приговариваются» к смерти в ходе развития организма.
Апоптоз можно условно разделить на три этапа. На первом этапе клетка получает апоптотический сигнал. Большое число внутренних и внешних стимулов воздействия на клетку может активировать в ней апоптотическую последовательность реакций. Эти стимулы включают связывание с клеточными рецепторами на ее поверхности, удаление важнейших факторов роста или воздействие на нее различных химических агентов. Кроме того, окислительный стресс, облучение клетки УФ-светом либо ионизирующей радиацией, нагревание или изменение осмотического давления также являются факторами индуцирующими апоптоз.
На следующей ступени развития апоптоза клетка интегрирует поступающие отовсюду сигналы и может перейти (а может и не перейти) к процессу апоптоза, в ходе которого активируются ферментные системы, включается синтез вторичных мессенджеров липидного обмена, изменяется экспрессия генов и активируются специализированные протеазы (каспазы). Окончательное "решение" клетки на переход к апоптозу зависит от многих факторов. На финальном этапе апоптоза общий сигнальный механизм деградации одномоментно активируется таким образом, что клетка разом приобретает характерные морфологические особенности присущие апоптозу.
Одним из возможных подходов к уничтожению раковых лейкозных клеток может стать принудительная стимуляция (индукция) лейкозных клеток к апоптозу путем воздействия на них подходящими биологически активными природными соединениями [S.-Y.Sun, N.Hail, R.Lotan. Apoptosis as a novel target for cancer. J. Natl. Cancer Inst, 2004, V.96, No 9, P.662-672]. Анализ литературных данных показал, что перспективной группой природных соединений, способных вызывать апоптоз клеток, являются хиноны [Kim H.J., Mun J.Y., Chun Y.J., et all. Effects of a naphthoquinone analog on tumor growth and apoptosis induction Arch. Pharm. Res. 2003 Vol.26, No 5, P.405-410., Hussain H., Krohn K., Ahmad V.U., et all. Lapachole: an overview. Arkivoc 2007 (ii), P. 145-147].
Хиноидная структура широко распространена в природе. Согласно данным из природных источников выделено около 1500 соединений с хиноидным ядром [Thomson R.H., Naturally Occurring Quinones III, Chapman & Hall, London-New-York, 1987]. Хиноны являются важным классом природных и синтетических соединений с большим разнообразием функций. Хорошо известна их роль в биохимии живых клеток, например в переносе электронов по дыхательной цепи (убихинон Q), или в механизме свертывания крови (витамин К).
Многие хиноны, например 5-гидрокси-1,4-нафтохинон (юглон) и его 2-метилгомолог плюмбагин, выделенные из различных высших растений, ингибируют рост бактерий и грибов и используются растениями как защитные вещества [Жунгиету Г.И., Влад Л.А. Юглон и родственные 1,4-нафтохиноны, Штиинца, Кишинев, 1978]. Хиноидное ядро входит в структуру различных практически важных противоопухолевых препаратов (антрациклиновых цитостатиков и гетероциклических хинонов). К настоящему времени принято считать, что цитотоксический эффект хинонов обусловлен: а) их способностью продуцировать кислородсодержащие свободные радикалы, б) электрофильностью хиноидного ядра, легко образующего аддукты с различными бионуклеофилами [Ashe С. Antitumor quinones Mini Rev. Med. Chem, 2005, Vol.5, No 5, P.449-467].
Способность хинонов продуцировать свободные кислородные радикалы и присоединять нуклеофилы в значительной степени зависит от количества и природы заместителей присоединенных к хиноидному ядру, что открывает путь к получению новых соединений, путем модификации известных природных хинонов с уже установленной биологической активностью [Ollinger К., Brunmark A, Effect of hydroxy substituent position on 1,4-naphthoquinone toxicity to rat hepatocytes. J. Biol. Chem., 1991. Vol.256, No 32, P.21496-21503].
Наиболее близким к заявляемому средству является 5-гидрокси-1,4-нафтохинон (юглон) - нафтохиноидный природный пигмент, содержащийся в корнях, листьях, коре, древесине и кожуре орехов [Жунгиету Г.И., Влад Л.А. Юглон и родственные 1,4-нафтохиноны, Штиинца, Кишинев, 1978]. Это соединение проявляет разнообразную и высокую физиологическую активность. Юглон и его 2-метилгомолог плюмбагин, выделенные из различных высших растений, ингибируют рост бактерий и грибов и используются растениями как защитные вещества.
Известно, что юглон проявляет противоопухолевую активность, в том числе в отношении клеток лейкоза человека Противоопухолевые свойства юглона изучались различными группами исследователей. В отчете Национального института рака США сообщалось, что юглон в дозах 4.0-10 мг/кг продлевал жизнь экспериментальных мышей с карциносаркомой Уокера-256 и саркомой-180 на 73 и 43% соответственно [J.S.Driscoll, G.F.Hazard, H.B.Wood, et all. Structure-Antitumor Activity Relationships Among Quinone Derivatives. 1974, Cancer Chemother. Repts. Part 2, Vol.4, No 2, P.1-35]. Юглон также проявлял цитотоксический эффект в отношении асцитных клеток карциномы Эрлиха, препятствуя вступлению опухолевых клеток в фазу митоза [Okada Т.А., Roberts E., Brodie A.F. Mitotic abnormalities produced by juglone in Erlich ascities tumor cells. Proc. Soc. Exp.Biol Med, 1967, Vol.126, P.583-588]. Положительной стороной противоопухолевого действия юглона является его способность стимулировать опухолевые клетки к апоптозу, причем этот эффект сохраняется и для клеток, устойчивых к действию других противоопухолевых препаратов [Segura-Aguilar J., Junsson К., Tidifelt U., et all. The cytotoxic effects of 5-OH-l,4-naphthoquinone and 5,8-diOH-l,4-naphthoquinone on doxorubicin-resistant human leukemia cells (HK-60). Leuk. Res., 1992, Vol.16, No 6-7, P.631-637].
Задача изобретения - расширение арсенала средств, способных избирательно стимулировать апоптоз лейкемических клеток.
Задача решена применением производных O-гликозидов 5-гидрокси-1,4-нафтохинона (юглона) формулы 1,
где один из радикалов R1 или R2 является пер-O-ацетилированным O-монозидным или O-биозидным углеводным радикалом с 1,2-трансконфигурацией O-гликозидной связи, а второй радикал является Н, в качестве средства, стимулирующего апоптоз клеток лейкемии человека.
Во втором варианте выполнения изобретения задача решена применением производных O-гликозидов 5-гидрокси-1,4-нафтохинона (юглона) формулы 1, где оба радикала R1 и R2 одновременно являются пер-O-ацетилированными O-монозидными или O-биозидными углеводными радикалами с 1,2-трансконфигурацией O-гликозидной связи, в качестве средства, стимулирующего апоптоз клеток лейкемии человека.
В третьем варианте выполнения изобретения задача решена применением производных S-гликозидов 5-гидрокси-1,4-нафтохинона (юглона) или их алкилзамещенных производных формулы 1, где один из радикалов R1 или R2 является пер-O-ацетилированным S-монозидным или S-биозидным углеводным радикалом с 1,2-трансконфигурацией S-гликозидной связи, а второй является Н либо линейным алкильным радикалом с углеводородной цепью с 1-8 атомами углерода, в качестве средства, стимулирующего апоптоз клеток лейкемии человека.
В четвертом варианте выполнения изобретения задача решена применением производных S-гликозидов 5-гидрокси-1,4-нафтохинона (юглона) или их алкилзамещенных производных формулы 1, где оба радикала одновременно являются пер-O-ацетилированными S-монозидными или S-биозидными углеводными радикалами с 1,2-трансконфигурацией S-гликозидной связи, в качестве средства, стимулирующего апоптоз клеток лейкемии человека.
Производные O-гликозидов 5-гидрокси-1,4-нафтохинона (юглона) формулы 1, где
R1 является O-монозидным (O-биозидным) пер-O-ацетилированным радикалом, a R2=Н, либо R1=H, a R2 является O-монозидным (O-биозидным) пер-O-ацетилированным радикалом, получают путем автокаталитической конденсации эквимольных количеств 1,2-ортоэфиров D-глюкозы и мальтозы с соответствующими 2,5-дигидрокси- и 3,5-дигидрокси-1,4-нафтохинонами согласно патенту [SU 1088346 A1, 30.12.1986].
Соединения формулы 1, где оба R1 и R2 являются O-монозидным (O-биозидным) пер-O-ацетилированным радикалом, получают аналогично, путем конденсации 2,3,5-тригидрокси-1,4-нафтохинона с 2 молями 1,2-ортоэфиров D-глюкозы или мальтозы [Примеры 1,2]
Производные S-гликозидов формулы 1, в которых один из радикалов R1 или R2, является S-монозидным (S-биозидным) пер-O-ацетилированным радикалом, а другой водородом, либо линейным алкильным радикалом с углеводородной цепью с 1-8 атомами углерода, либо оба радикала R1, R2 являются S-монозидными (S-биозидными) пер-O-ацетилированными радикалами получают путем конденсации пер-O-ацетилированных 1-меркаптосахаров с соответствующими 2,3-замещенными галогеналкилюглонами (2,3-дигалогенюглонами) [Полоник С.Г., Толкач A.M., Шенцова Е.Б., Уварова Н.И. Синтез и цитостатическая активность 2-бром-3-алкилюглонов и родственных тиоглюкозидов на их основе. Хим.-фарм. журнал. 1995, №10, с.9-10. Примеры 3-6].
Соединения формулы 1, в которых R1=Н, a R2 является S-монозидным (S-биозидным) пер-O-ацетилированным радикалом, также могут быть получены региоизбирательным присоединением пер-O-ацетилированного 1 -меркаптомонозида (1-меркаптобиозида) к С=С-С=O системе связей юглона, с последующим окислением образующегося интермедиата кислородом воздуха [Отчет о НИР ТИБОХ ДВО РАН. 2001-2005 гг., тема: «Изучение новых морских природных соединений. Выделение, структуры, биосинтез и биологическая активность. Всеросс. научно-техн. информ. центр (ВНТИЦ), инв. №022006 06359. Пример 7].
Сведения, подтверждающие возможность получения гликозидов формулы 1.
Пример 1. 2,3-Бис(2',3',4',6'-тетра-O-ацетил-β-D-глюкопиранозилокси)-5-гидрокси-1,4-нафтохинон. 2,3,5-Тригидрокси-1,4-нафтохинон, 103 мг (0.5 ммоль), 3,4,6-три-O-ацетил-1,2-O-(1-третбутоксиэтилиден)-α-D-глюкопираноза, 404 мг (1.0 ммоль) и 10 мл абс. хлорбензола кипятили 1 час в колбе с обратным холодильником, защищенным хлоркальциевой трубкой. Растворитель упарили в вакууме, из остатка препаративной тонкослойной хроматографией (ПТСХ) на стеклянной пластине размерами 20×20 см на незакрепленном слое SiO2 в системе растворителей гексан-бензол-ацетон (2:1:1 v/v), двухкратное проявление, выделили кристаллический продукт реакции желтого света с Rf=0.41. После перекристаллизации из смеси бензол-МеОН получили желтые иглы с т.пл. 163-164°С. Вес 176 мг (40%). Спектр ЯМР 1Н (300 МГц, CDCl3, δ, м.д.): 2.01, 2.03, 2.04(2), 2.05(2), 2.09, 2.10 (8 × АсО), 3.83 м. (2Н, 2Н5'), 4.12 м, (2Н, 2Н6'), 4.28 м, (2Н, 2Н6'), 5.20-5.35 м, (6Н, 2Н2', 2Н3, 2Н4'), 5.76 д,
(1Н, H1', J=7.4 Гц), 5.91 д, (1Н, Н1', J=7.2 Гц), 7.29 м, (1Н, Н6), 7.62 (м, 2Н, Н8 и Н7, 11.75 с, (1 Н, С5-ОН). ИК-спектр (CHCl3, ν, см-1): 1756 (СН3СООR), 1668 (С=O), 1637 (С=O), 1458, 1370, 1249, 1191, 1089, 1041. Найдено, %: С 52.56; Н 5.03. С38Н42O23. Вычислено, %: С 52.66; Н 4.88.
Пример 2. 2,3-Бис-[2',3',6'-три-O-ацетил-4'-O-(2'',3'',4'',6''-тетра-O-ацетил-α-D-глюкопиранозил)-β-D-глюкопиранозилокси)]-5-гидрокси-1,4-нафтохинон. 2,3,5-Тригидрокси-1,4-нафтохинон, 42 мг (0.2 ммоль), 3,6-ди-O-ацетил-1,2-O-(1-метокси-этилиден)-4-O-(2,3,4,6-тетра-O-ацетил-α-D-глюкопиранозил)-α-D-глюкопиранозу, 260 мг (0.4 ммоль) и 6 мл абс. хлорбензола кипятили 1 час в колбе с обратным холодильником, защищенным хлоркальциевой трубкой. Растворитель упарили в вакууме, из остатка ПТСХ на стеклянной пластине размерами 20×20 см на незакрепленном слое SiO2 в системе растворителей гексан-бензол-ацетон (2:1:1 v/v), двухкратное проявление, выделили продукт реакции с Rf=0.21, светло желтый аморфный порошок, вес 212 г (86%), Спектр 1Н ЯМР (300 МГц, СDСl3, δ, м.д., J/Гц): 2.01(2), 2.02(3), 2.06(7), 2.11(2), все с, 3Н (14 × ОАс); 3.82 м, (2Н, углеводные протоны), 3.94-4.13 м, (6Н, углеводные протоны), 4.19-4.31 м, (4Н, углеводные протоны), 4.50 м, (2Н, углеводные протоны), 4.87 м, (2Н, углеводные протоны), 5.03-5.17 м, (4Н, углеводные протоны), 5.23-5.40 мд, (4Н, углеводные протоны), 5.43 д, (1Н, Н1'', J1'',2''=3.7 Гц), 5.44 д, (1Н, Н1'', J1'',2''=3.8 Гц), 5.65 д, (1Н, Н1', J1',2'=6.9 Гц), 5.81 д, (1Н, Н1', J1',2'=6.9 Гц), 7.29 м, (1Н, Н6), 7.62 м, (2Н, Н8 и Н7), 11.74 с, (1Н, С5-ОН). ИК-спектр (СНСl3), ν/см-1: 1754(COOR), 1672(C=O). 1456. Найдено (%): С, 51.87; Н, 5.12. С62Н74O39. Вычислено (%): С, 51.60; Н, 5.17.
Пример 3. 3-(Тетра-O-ацетил-β-D-глюкопиранозил-1-тио)-2-этил-5-гидрокси-1,4-нафтохинон. К смеси 2-этил-3-бром-5-гидрокси-1,4-нафтохинона 120 мг (0.42 ммоль), тетра-O-ацетил-1-тио-β-D-глюкопиранозы, 153 мг (0.42 ммоль), в 5 мл сухого ацетонитрила прибавляли 140 мг (1.0 ммоль) тонкорастертого К2СО3 и перемешивали 40 мин при 25°С, контролируя ход реакции ТСХ. Неорганические соли отфильтровали, осадок промыли толуолом, фильтрат упарили. Остаток кристаллизовали из смеси бензол - абс. МеОН и получили светло-коричневые иглы с т.пл. 189-191°С. Вес 143 мг (61%). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.87 т (3Н, СН2СН 3, J=7.5 Гц), 1.87, 2.02, 2.03, 2.12 (4 × АсО), 2.89 кв, (2Н, СH 2СН3), 3.67 ддд, (1Н, Н5', J4',5'=9.8 Гц, J5',6a'=1.9 Гц, J5',6b'=5.0 Гц), 4.04 дд, (1Н, 1Н6', J6а',6b'=12.0 Гц), 4.12 дд. (2Н, 2Н6'), 5.08 т, (1Н, Н4', J3',4'=9.2 Гц), 5.12 т (1Н, H2', J2',3'=9.2 Гц), 5.27 т, (1Н, Н3'), 5.46 д. (1Н, Н1', J1',2'=10.0 Гц), 7.60 д, (1Н, Н6, J6,7=7.7 Гц), 7.66 м, (2Н, Н8 и Н7), 11.97 с, (1Н, C5-OH). ИК-спектр (СНСl3, ν, см-1): 1755 (СН3СООR), 1660 (С=O), 1633. Найдено, %: С 55.21; Н 5.03; S 5.62. C26H28O12S. Вычислено, %: С 55.31; Н 5.00; S 5.68.
Пример 4. 2-[2',3',6'-Три-O-ацетил-4'-O-(2'',3'',4'',6''-тетра-O-ацетил-α-D-глюкопиранозил)-β-D-глюкопиранозил-1'-тио)]-3-метил-5-гидрокси-1,4-нафтохинон. К суспензии 90 мг (0.33 ммоль) 2-бром-3-метил-5-гидрокси-1,4-нафто-хинона, 217 мг (0.33 ммоль) 2',3',6'-три-O-ацетил-4'-O-(2'',3'',4'',6''-тетра-O-ацетил-α-D-глюкопиранозил)-1-тио-β-D-глюкопиранозы в 5 мл сухого ацетона прибавляли 47 мг (0.33 ммоль) тонкорастертого К2СО3 и перемешивали 1 час при 25°С. Неорганические соли отфильтровали, осадок промыли ацетоном, фильтрат упарили. Остаток кристаллизовали из абс. МеОН и получили желтые кристаллы. Вес 206 мг (75%). Т. пл. 185-187°С. Спектр 1Н ЯМР (300 МГц, CDCl3, δ, м.д., J/Гц): 1.94, 2.00, 2.01, 2.02, 2.05, 2.06, 2.01 (7 × ОАс), 2.32 с, (3Н, АrСН3), 3.92 дцд, (1Н, Н5'', J4'',5''=9.2.0 Гц, J5'',6''=2.4 Гц, J5'',6''=2.0 Гц), 3.69 ддд, (1Н, Н5', J4',5'=10.0 Гц, J5',6'=4.0 Гц, J5',6'=5.0 Гц, 3.96 т (1Н, Н4'', J3'',4''=5.3 Гц), 4.03 дд, (1Н, Н6'', J6'',6''=10.7 Гц), 4.11 дд, (1Н Н6', J6',6'=12.5), 4.24 дд, (1Н, Н6'), J=9.7 Гц, J=8.7 Гц); 4.35 дд, (1Н, Н6''), 4.85 д.д, (1Н, Н2'', J2'',3''=10.5 Гц), 4.97 дд, (Н2', J2',3'=10.5 Гц), 5.04 т, (1Н, Н4', J3',4'=9.0 Гц), 5.31 дд, (1Н, Н3'), 5.33 д, (1Н, Н3''), 5.39 д (1Н, Н1'', J1'',2''=4.2 Гц), 5.62 д (1Н, Н1', J1',2'=10.0 Гц), 7.25 дд, (1Н, Н6, J6,7=7.5 Гц, J6,8=2.0 Гц), 7.51 т (1Н8, J7,8=7.5 Гц), 7.65 дд, (1Н7); 12.05 с, (1Н, С5-ОН). ИК-спектр (СНСl3), ν/см-1: 1755 (COOR), 1667(СО), 1635, 1593, 1457, 1368, 1274, 1248, 1044. Найдено (%): С, 53.95; Н, 4.90; S, 4.01. C37H41O19S. Вычислено (%): С, 54.08; Н, 5.03; S, 3.90.
Пример 5. 2,3-Бис(2',3',4'-три-O-ацетил-β-D-ксилопиранозил-1-тио)-5-гидрокси-1,4-нафтохинон. К суспензии 243 мг (1.0 ммоль) 2,3-дихлор-5-гидрокси-1,4-нафтохинона, 582 мг (2 ммоль) три-O-ацетил-1-тио-β-D-ксилопиранозы в 20 мл сухого ацетона прибавляли 420 мг (3 ммоль) тонкорастертого К2СО3 и перемешивали 0.5 час при 25°С, контролируя ход реакции ТСХ. Неорганические соли отфильтровали, осадок промыли ацетоном, фильтрат упарили. Остаток кристаллизовали из смеси бензол - абс. МеОН и получили светло-коричневые иглы с т.пл. 138-140°С. Вес 540 мг (72%), Спектр 1Н ЯМР (300 МГц, СDСl3, δ, м.д., J/Гц): 2.04, 2.06, 2.08, 2.09, 2.11 (2) (6 × ОАс), 3.45 д.д, (1Н, Н5a', J4',5а'=7.8 Гц, J5a',5b'=11.9 Гц), 3.47 д.д, (1 Н, H5a', J4',5a'=7.38 Гц, J5a',5b'=11.9 Гц), 4.19 д.д, (1H, Н5b', J4',5b'=4.9 Гц), 4.27 д.д, (1H, H5b', J4',5b'=4.4 Гц), 4.95 м, (2Н, 2Н4'); 5.07 т, (1H, H2', J1'2'=8.1 Гц; J2'3'=7.9 Гц), 5.09 т, (1H, H2', J1'2'=7.0 Гц, J2'3'=7.9 Гц), 5.19 т,
(1Н, Н3'), 5.22 т, (1Н, Н3'); 5.69 д, (1Н, Н1' J1'2=7.0 Гц); 5.89 д, (1Н, H1' J1'2'=8.1 Гц), 7.29 м, (1Н, Н6), 7.62 м, (2Н, Н8 и Н7), 11.83 с, (1Н, С5-ОН). ИК-спектр (СНСl3), ν/см-1: 1753 (COOR), 1670 (CO), 1594 (C-C), 1558. Найдено (%): С, 51.10; Н, 4.72; S, 8.61. С32Н34O17S2. Вычислено (%): С, 50.93; Н, 4.54; S, 8.50.
Пример 6. 2,3-Бис-[2',3',6'-три-O-ацетил-4'-O-(2'',3'',4'',6''-тетра-O-ацетил-α-D-глюкопиранозил)-β-D-глюкопиранозил-1-тио)]-5-гидрокси-1,4-нафтохинон. К суспензии 24 мг (0.1 ммоль) 2,3-дихлор-5-гидрокси-1,4-нафтохинона, 130 мг (0.2 ммоль) 2',3',6'-три-O-ацетил-4'-O-(2'',3'',4'',6''-тетра-O-ацетил-α-D-глюкопиранозил)-1-тио-β-D-глюкопиранозы в 5 мл сухого ацетонитрила прибавляли 25 мг (0.2 ммоль) тонкорастертого К2СО3 и перемешивали 40 мин при 25°С, контролируя ход реакции ТСХ. Неорганические соли отфильтровали, осадок промыли толуолом, фильтрат упарили в вакууме, из остатка ПТСХ на стеклянной пластине размерами 20×20 см на незакрепленном слое SiO2 в системе растворителей гексан-бензол-ацетон (2:1:1 v/v), двухкратное проявление, выделили продукт реакции с Rf=0.15, желтый аморфный порошок, вес 102 мг (69%). Спектр 1Н ЯМР (300 МГц, СDСl3, δ, м.д., J/Гц): 2.01(2), 2.02(3), 2.06(7), 2.11(2), все с, 3Н (14 × ОАс); 3.73 м, (2 Н, углеводные протоны), 3.89-4.15 м, (6Н, углеводные протоны), 4.25 м, (4Н, углеводные протоны), 4.87 м, (3Н, углеводные протоны), 5.15 м, (3Н, углеводные протоны), 5.24-5.46 м, (6Н, углеводные протоны), 5.52 д,
(1Н, Н1'', J1'',2''=4.1 Гц), 5.55 д, (1Н, Н1'', J1'',2''=3.1 Гц), 5.60 д, (1Н, Н1', J1',2'=10.1 Гц), 5.85 д, (1Н, Н1', J1',2'=10.1 Гц), 7.29 м, (1Н, Н6), 7.64 м, (2Н, Н8 и Н7), 11.84 с, (1 Н, С5-ОН). ИК-спектр (СНСl3), ν/см-1: 1755(COOR), 1670(C=0), 1632, 1454. Найдено (%): С, 50.50; Н, 4.92; S, 4.56. C62H74O37S2. Вычислено (%): С, 50.47; Н, 5.06; S, 4.35
Пример 7. 3-(2',3',4',6'-Тетра-O-ацетил-β-D-галактопиранозил-1'-тио)-5-гидрокси-1,4-нафтохинон. К раствору 364 мг (1.0 ммоль) тетра-O-ацетил-1-тио-β-D-галактопиранозы в 40 мл теплого (40-45°С) спирта добавили 174 мг (1.0 ммоль) тонкорастертого юглона и перемешивали в открытой колбе. Наблюдали быстрое изменение цвета реакционной смеси от светло-желтой до темно-коричневой. Спустя 15-20 мин началось выпадение желтого осадка 3-ацетилтиогалактозида юглона. Реакционную смесь перемешивали 4 час в открытом сосуде для окисления промежуточно образующегося гидрохинонового интермедиата, выдерживали ночь в открытом сосуде при комнатной температуре, выпавший осадок отфильтровали, промыли холодным этанолом и получили 3-ацетилтиогалактозид юглона. Выход 414 мг (79%). Т.пл. 226-228°С. Спектр 1Н ЯМР (500 МГц, СDСl3, δ, м.д., У/Гц): 2.01, 2.08, 2.12, 2.24 (4 × ОАс); 3.85 м, (1Н, Н5'), 4.01 м, (1Н, Н6'), 4.20 д.д, (1Н6', J5',6a'=4.5 Гц; J6a',5b'=11.3 Гц), 4.88 д. (1Н, Н1', J1'2'=10.0 Гц). 14 д.д, (1Н, Н3', J3'4'=3.3 Гц, J2'3'=9.9 Гц), 5.52 д, (1Н, Н4'), 5.56 т, (1Н, Н2'), 7.06 с, 1Н, Н2), 7.25 д.д, (1Н, Н6, J6,7=8.1 Гц, J6,8=1.5 Гц), 7.61 д.д, (1H8, J7,8=7.5 Гц), 7.65 т, (1Н7); 11.56 с, (1Н, С5-ОН). ИК-спектр (СНСl3), ν/см-1: 1754 (COOR), 1655, 1634 (СО), 1567 (С=С), 1456, 1370, 1270. Найдено (%): С, 52.51; Н, 4.53; S, 6.05. C23H24O12S. Вычислено (%): С, 52.67; Н, 4.61; S, 6.11.
Полученные вышеописанными способами, исследованные и заявляемые по новому назначению ацетилированные О- и S-гликозиды ряда 5-гидрокси-1,4-нафтохинона (юглона) сведены в таблицу 1.
| Таблица 1 | |||
| Исследованные О- и S-гликозиды ряда 5-гидрокси-1,4-нафтохинона (юглона) | |||
| № соединения | Заместители | Структуры заместителей | |
| 1 | R1=R2=Н (юглон) | ||
| 2 | R1=Ac4GlcO; R2=Н | ||
| 3 | R1=Н; R2=Ac4GlcO | ||
| 4 | R1=R2=Ac4GlcO | ||
| 5 | R1=Ac7MaltO; R2=H | ||
| 6 | R1=H; R2=Ac7MaltO | ||
| 7 | R1=Ac4GlcS; R2=H | ||
| 8 | R1=H; R2=Ac4GlcS | ||
| 9 | R1=R2=Ac4GlcS | ||
| 10 | R1=Ac4GlcS; R2=Me | ||
| 11 | R1=H; R2=Ac4GalS | ||
| 12 | R1=H; R2=Ac4ManS | ||
| 13 | R1=H; R2=Ac3XylS | ||
| 14 | R1=H; R2=Ас3-L-AraS | ||
| 15 | R1=H; R2=Ac7MaltS |
Известно, что ацетилированные O-гликозиды юглона обладают антигрибковой активностью [Полоник С.Г., Толкач A.M., Стехова С.И. и др. Синтез и изучение противогрибковой активности ацетилированных гликозидов гидроксиюглонов. Хим.-фарм. журнал. 1992, №6, с.31-32]. Для этих соединений и ацетилированных S-гликозидов юглона также характерна противоопухолевая и иммуностимулирующая активность [Полоник С.Г., Прокофьева Н.Г., Агафонова И.Г. и др. Противоопухолевая и иммуностимулирующая активность О- и S-гликозидов 5-гидрокси-14-нафтохинона (юглона). Хим.-фарм. журн., 2003, Т. 37, №8, с.3-4].
Однако новое назначение ацетилированных О- и S-гликозидов ряда 5-гидрокси-1,4-нафтохинона (юглона) в качестве средства, обладающего способностью избирательно стимулировать апоптоз клеток лейкемии человека, не вытекает с очевидностью из их известных свойств и обнаружено авторами впервые.
Технический результат заключается в более выраженной способности (в 2-3 раза более высокая активность и меньший временной промежуток, необходимый для стимуляции апоптоза) ацетилированных О- или S-гликозидов юглона избирательно стимулировать апоптоз клеток лейкоза человека по сравнению с прототипом юглоном без воздействия на нормальные клетки иммунной системы человека (нейтрофилы). Это снижает риск возникновения нейтропении, сопровождающий лечение лейкемии традиционными противораковыми препаратами. Изобретение расширяет арсенал средств, стимулирующих апоптоз клеток лейкемии человека.
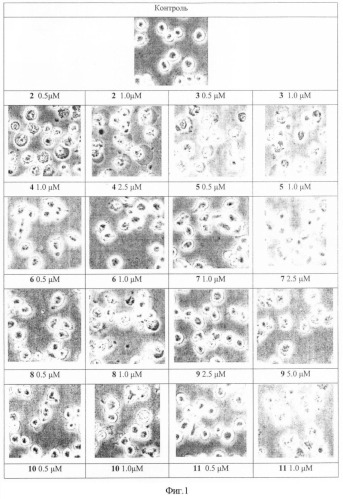
На фиг.1 представлена цитотоксическая активность гликозидов юглона 2-15 в отношении клеток лейкемии человека HL-60, определенная методом микроскопии - цифровой фотографии. Представлен один из трех независимых экспериментов.
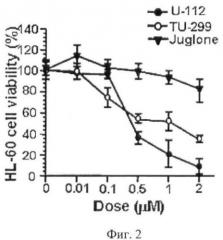
На фиг.2 представлен дозозависимый цитотоксический эффект юглона 1 (Juglone) и его гликозидов 3 (U-112) и 11 (TU-299) в отношении клеток лейкемии человека HL-60, определенный методом МТТ после 24 часов инкубирования клеток с веществами. Каждая точка на графике соответствует усредненному числу живых клеток, выраженному в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых опытов, по три образца на каждую концентрацию вещества в каждом из опытов.
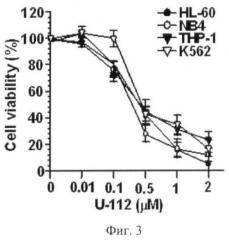
На фиг.3 представлен дозозависимый цитотоксический эффект O-глюкозида юглона 3 (U-112) в отношении различных видов клеток лейкемии, полученный методом МТТ после 24 часов инкубирования клеток с веществами. Каждая точка на графике соответствует усредненному числу живых клеток, выраженному в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых опытов, по три образца на каждую концентрацию вещества в каждом из опытов.
На фиг.4 представлен эффект индукции апоптоза юглоном 1 (Juglone) и его гликозидами 3 (U-112) и 11 (TU-299), взятыми в концентрации 1 µM, через 24 часа инкубирования с клетками лейкемии HL-60, полученный методом проточной цитометрии с окрашиванием апоптотических клеток флуоресцентными красителями Annexin V-FITC и PI. Эффект представлен в виде числа апоптотических клеток, выраженного в процентах (правый нижний квадрант - ранний апоптоз; правый верхний квадрант - поздний апоптоз). Представлен один из трех независимых экспериментов.
На фиг.5 представлено влияние юглона 1 (Juglone) и его гликозидов 3 (U-112) и 11 (TU-299), взятыми в концентрации 1 µM на величину самопроизвольного апоптоза нейтрофилов крови человека, полученное методом проточной цитометрии через 24 часа инкубирования клеток с веществами. Каждый "столбик" соответствует усредненному количеству апоптотических клеток, выраженному в процентах ± SD стандартное отклонение от среднего), полученному из трех независимых опытов.
На фиг.6 представлен эффект индукции апоптоза юглоном 1 (Juglone) и его гликозидами 3 (U-112) и 11 (TU-299), взятыми в концентрации 1 µМ, в лейкемических клетках различных типов, определенный методом проточной цитометрии через 24 часа инкубирования клеток с веществами. Каждый "столбик" соответствует усредненному количеству апоптотических клеток в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых опытов.
На фиг.7 представлена дозозависимая индукция апоптоза юглоном 1 и его гликозидами 3 и 11 в клетках лейкемии HL-60, определенная методом проточной цитометрии через 24 часа инкубирования веществ с клетками. Каждая точка на графике соответствует усредненному количеству апоптотических клеток в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых экспериментов.
На фиг.8 представлена времязависимая индукция апоптоза юглоном 1 и его гликозидами 3 и 11, взятыми в концентрации 1 µМ, в клетках лейкемии HL-60, определенная методом проточной цитометрии. Каждая точка на графике соответствует усредненному количеству апоптотических клеток в процентах ± SD (стандартное отклонение от среднего), полученному из трех независимых экспериментов.
На фиг.9 представлен эффект юглона 1 (Juglone) и его гликозидов 3 (U-112) и 11 (TU-299), взятых в концентрации 1 µМ, на клеточный цикл клеток лейкемии HL-60, определенный методом проточной цитометрии через 24 часа инкубирования клеток с веществами. Эффект представлен в виде числа клеток, находящихся в той или иной фазе клеточного цикла, выраженного в процентах. Наличие клеток в фазе Sub-G1 является характерным признаком апоптоза. Представлен один из трех независимых экспериментов.
На фиг.10 представлен тест TUNEL на индукцию апоптоза в клетках лейкемии HL-60, обработанных юглоном 1 (Juglone) и его гликозидами 3 (U-112) и 11 (TU-299) в концентрации 1 µМ. Представлен один из трех независимых экспериментов.
На фиг.11 представлено влияние юглона 1 (Juglone) и гликозидов юглона 3 (U-112) и 11 (TU-299), взятых в концентрации 1 µМ, на уровень глутатиона в клетках лейкемии HL-60. Концентрация глутатиона выражена в µМ/106 клеток. Каждый "столбик" соответствует усредненному значению концентрации глутатиона ± SD (стандартное отклонение от среднего), полученному из трех независимых опытов.
На фиг.12 представлены эффекты юглона 1 (Juglone) и гликозидов юглона 3 (U-112) и 11 (TU-299), взятых в концентрации 1 µМ, а также глутатиона, ацетилцистеина (NAC) и дифенилениодониум хлорида (DPI) - ингибитора флавинсодержащей NADPH-оксидазы на проницаемость митохондриальных мембран в клетках HL-60. Представлен один из трех независимых экспериментов.
На Фиг.13 представлен эффект 1 µM концентрации гликозидов 3 (U-112) и 11 (TU-299), а также юглона 1 (Juglone) на внутриклеточные уровни прокаспаз-3, -8 и -9 в клетках HL-60. Представлен один из трех независимых экспериментов.
Исследование биологической активности
I. Материалы и методы.
1. Принятые сокращения.
U-112- гликозид юглона, соединение 3 (см. таблицу 1); TU-299- гликозид юглона, соединение 11 (см. таблицу 1); mM - миллимоль/литр; µM - микромоль/литр; µл - микролитр; SD - стандартное отклонение от среднего; МТТ - метод определения цитотоксичности веществ (см. пункт.4. Определение цитотоксичности); Annexin V-FITC - флуоресцентный краситель; PI - пропидиум иодид, флуоресцентный краситель; TUNEL - метод определения апоптоза (см. пункт. 6. Анализ методом TUNEL); Sub-G1 - одна из фаз клеточного цикла, характерная для клеток, находящихся в апоптозе; PBS - фосфатно-солевой буферный раствор; FBS - сыворотка крови бычьих эмбрионов; ДМСО - диметилсульфоксид; GSH-глутатион, GSSG-диглутатион, дисульфид глутатиона; ЭДТА - этилендиаминтетрауксусная кислота.
2. Культивирование клеток.
HL-60, THP-1, NB4 или К562 клетки из коллекции АТТСС (American Type Tissue Culture Collection, Rockville, MD) культивировали в среде RPMI-1640, содержащей 10% FBS, 100 ед/мл пенициллина и 100 µг/мл стрептомицина, в атмосфере, содержащей 5% СО2, при 37°С, и пересеивали каждые 2 дня.
Нейтрофилы, клетки иммунной системы человека, выделяли из свежей человеческой крови.
3. Приготовление растворов веществ.
Базовые (стоковые) растворы гликозидов с концентрацией вещества 20 mM готовили в диметилсульфоксиде (ДМСО) (Fisher, USA), из которого получали растворы нужной концентрации разбавлением в культуральной среде. Содержание ДМСО в разбавленных растворах не превышало 0,5% во всех опытах.
4. Определение цитотоксичности веществ методом цифровой фотографии - микроскопии.
Цитотоксические свойства гликозидов 5-гидрокси-1,4-нафтохинонов изучались на опухолевых клетках человека с использованием метода микроскопии - цифровой фотографии. В работе использовали микроскоп Axiovert 200 (Zeiss, Germany), снабженный цифровьм фотоаппаратом Hamamatsu Orca ER C4742-95 (Hamamatsu Photonics K.K., Japan). Клетки лейкоза человека HL-60 (3×105 клеток на лунку) выращивали в 6-луночном планшете в течение 24 час в 3 мл среды 10% FBS/RPMI. В лунку с клетками добавляли рассчитанное количество разбавленного раствора гликозида и инкубировали планшет в течение 24 час. Обработанные клетки фотографировали и сравнивали их фотографии с фотографией необработанных контрольных клеток. Цитотоксический эффект гликозидов проявлялся в характерных морфологических изменениях клеток (округление клетки, сморщивание и нарушение целостности мембраны, распад клетки на апоптотические тела). Концентрация исследуемого вещества считалась цитотоксической при наличии более 50% клеток, имеющих характерные морфологические изменения.
5. МТТ колориметрический тест оценки жизнеспособности клеток и цитотоксичности веществ.
3-(4,5-этилтиазол-2-ил)-2,5-дифенилтетразол бромид (МТТ) (Sigma, St. Louis, МО, U.S.A.) был использован для определения цитотоксичности веществ. Клетки лейкемии HL-60 (NB4, THP-1, К562) были высеяны в 96-луночный планшет (1×104 клеток на лунку в 50 мкл среды) и затем обработаны растворами (в 50 мкл среды) юглона 1 или его гликозидов 3 или 11 различной концентрации. Затем раствор МТТ (5 мг/мл) был добавлен в каждую лунку и клетки инкубировали при 37 С и 5% СО2 в течение 4 часов. Клеточную суспензию центрифугировали при 1000 об/мин в течение 5 мин и клетки в каждой лунке экстрагировали затем 100 мкл диметилсульфоксида. Затем определяли оптическую плотность растворов в каждой лунке на планшетном ридере-спектрофотометре (Bio-Teck Instruments. Inc., США) при 550 нм. Процентное содержание живых клеток затем вычисляли по формуле (ОПэксп/ОПктрл)×100, где
ОПэксп - оптическая плотность экспериментальной лунки, ОПктрл - оптическая плотность контрольной лунки.
6. Тест на апоптоз с использованием цитометрического анализа.
Клетки (1×106) обрабатывали юглоном или гликозидами в указанных концентрациях, инкубировали в течение указанного промежутка времени, затем промывали фосфатным буфером (PBS) путем центрифугирования при 1000 об/мин в течение 5 мин. Затем клетки обрабатывали для обнаружения раннего и позднего апоптоза флуоресцентными красителями Аннексин V-FITC и пропидиум иодид (PI) в соответствии с рекомендациями фирмы-производителя. Клетки (1×105 - 5×105) ресуспендировали в 500 µл связывающего буфера (Annexin V-FITC Apoptosis Detection kit. Medical & Biological Laboratories), добавляли 5 µл Annexin V-FITC и 5 µл PI и инкубировали в течение 15 мин в темноте при комнатной температуре. Затем клетки (1×104) анализировали на проточном цитометре производства США (Beckton Dickinson, Franklin Lakes, NJ) для обнаружения раннего и позднего апоптоза.
7. Изучение клеточного цикла.
Клетки (1×106) обрабатывали юглоном или гликозидами в указанных концентрациях, инкубировали в течение 24 часов, затем промывали фосфатным буфером (PBS) путем центрифугирования при 1000 об/мин в течение 5 мин. После этого клетки были суспендированы в PBS и зафиксированы холодным 70% этанолом в течение 3 часов. Фиксированные клетки были прокрашены 50 µг/мл PI (пропидиум-иодида), содержащим 50 µг/мл РНКазы А, при 37°С в течение 30 мин. ДНК клеток (10,000 клеток на экспериментальную группу) была затем проанализирована с помощью клеточного цитометра с использованием лизирующего буфера Lysis II и программного обеспечения CELL-FIT (BD).
8. Н