Фармацевтические композиции
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается формы и композиции, содержащих аморфный VX-950, а также их применения для лечения вирусного гепатита С. Заявленное изобретение обеспечивает высокую биодоступность VX-950, а также хорошую стабильность композиции при хранении. 12 н. и 58 з.п. ф-лы, 10 табл., 10 ил.
Реферат
Данная заявка имеет приоритет согласно 35 USC § 119(e) по заявке на патент США № 60/578043, поданной 8 июня 2004 г., полное содержание которой включено сюда в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к фармацевтическим композициям.
УРОВЕНЬ ТЕХНИКИ
Заражение вирусом гепатита С («ВГС») представляет собой непреодолимую общественную медицинскую проблему. ВГС признается как причинный агент для большинства случаев не-А, не-В гепатитов при предполагаемой серо-распространенности у человека 3% в мировом масштабе [A.Alberti et al., “Natural History of Hepatitis C”, J.Hepatology, 31., (Suppl. 1), pp. 17-24 (1999)]. Почти четыре миллиона человек могут быть инфицированы только в Соединенных Штатах [M.J. Alter et al., “The Epidemiology of Viral Hepatitis in the United States, Gastroenterol. Clin. North Am. 23, pp. 437-455 (1994); M. J. Alter "Hepatitis С Virus Infection in the United States," J. Hepatology. 31., (Suppl. 1), pp. 88-91 (1999)].
При первом заражении ВГС только у около 20% инфицированных человек развивается острый клинический гепатит, в то время как у других кажется, что инфекция пропадает спонтанно. Однако практически в 70% случаев вирус вызывает хроническую инфекцию, которая сохраняется десятилетиями [S. Iwarson, “The Natural Course of Chronic Hepatitis,” FEMS Microbiology Reviews, 14, pp. 201-204 (1994); D. Lavanchy, "Global Surveillance and Control of Hepatitis C," J. Viral Hepatitis, 6, pp. 35-47 (1999)]. Это обычно приводит к рецидивному и прогрессивно ухудшающемуся воспалению печени, которое часто вызывает более тяжелые болезненные состояния, такие как цирроз и гепатоцеллюлярный рак [M.C. Kew, "Hepatitis C and Hepatocellular Carcinoma", FEMS Microbiology Reviews, 14, pp. 211-220 (1994); I. Saito et. al., "Hepatitis C Virus Infection is Associated with the Development of Hepatocellular Carcinoma." Proc. Natl. Acad. Sci. USA. 87, pp. 6547-6549 (1990)]. Предполагают, что ВГС инфицировано 170 миллионов человек во всем мире. В течение следующих десяти лет, так как большая часть зараженных в настоящее время пациентов вступит в третью декаду инфекции, ожидается, что количество смертей, вызванных гепатитом С, значительно увеличится. К сожалению, не существует распространенного способа лечения подрывающего здоровье развития хронического ВГС.
В настоящее время не существует полностью удовлетворительных анти-ВГС агентов или способов лечения. Для лечения ВГС применяют интерферон, а также ПЭГилированный интерферон, который также может назначаться в сочетании с Рибавирином. Известно, что любой режим лечения, включающий интерферон, имеет значительные побочные эффекты, и поэтому существует значительная неудовлетворенная медицинская потребность в безопасной, эффективной пероральной терапии для лечения вируса гепатита С. Более того, перспективы эффективных анти-ВГС вакцин остаются неопределенными.
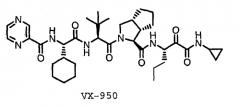
VX-950 является конкурентоспособным обратимым пептидомиметическим ингибитором ВГС NS3/4A протеазы с устойчивым коэффициентом связывания (ki*) 3 нМ (и с Ki 8 нМ) [WO02/018369].
VX-950 практически нерастворим в воде.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном изобретении описаны формы и композиции VX-950, имеющие улучшенную биодоступность по отношению к кристаллическому VX-950. Эти формы и композиции применяются для лечения инфекции ВГС.
Следовательно, в одном аспекте данное изобретение относится к получению аморфного VX-950, например композиции VX-950, которая практически не содержит примесей и/или кристаллического VX-950. Например, в одном варианте данное изобретение относится к композициям, содержащим VX-950 в аморфной форме, которая улучшает метастабильную растворимость VX-950 по отношению к кристаллической форме, обеспечивая таким образом улучшенную биодоступность. Данное изобретение включает множество возможных композиций, которые все содержат VX-950 в аморфной форме.
В одном аспекте данное изобретение относится к композиции, включающей аморфный VX-950 и второй компонент. Второй компонент может быть выбран из множества компонентов, включая, например, поверхностно-активное вещество, полимер или инертное фармацевтически приемлемое вещество. В некоторых предпочтительных вариантах композиция включает твердую дисперсию, смесь или жидкую дисперсию. В некоторых вариантах композиция имеет форму твердого вещества (например, таблетки или капсулы).
В другом аспекте данное изобретение относится к твердой дисперсии аморфного VX-950.
В некоторых вариантах твердая дисперсия включает менее чем около 40% кристаллического VX-950 (например, менее чем около 35%, менее чем около 30%, менее чем около 20%, менее чем около 10%, менее чем около 5% или менее чем около 1%). Например, в некоторых вариантах твердая дисперсия практически не содержит кристаллический VX-950.
В некоторых вариантах твердая дисперсия также включает поверхностно-активное вещество, полимер или инертное фармацевтически приемлемое вещество. Например, твердая дисперсия может включать полимер, и полимер может включать один или более одного растворимого в воде полимера или частично растворимого в воде полимера.
В некоторых вариантах VX-950 имеет улучшенную физическую или химическую стабильность по отношению к аморфному VX-950 без присутствия полимера. В некоторых вариантах твердая дисперсия имеет более высокую температуру стеклования по сравнению с температурой стеклования чистого аморфного VX-950. В некоторых вариантах VX-950 имеет скорость релаксации ниже, чем скорость релаксации чистого аморфного VX-950.
В некоторых вариантах твердая дисперсия включает полимер, который присутствует в достаточном количестве, таком, чтобы после введения твердой дисперсии уровень VX-950 в крови крысы был на около 20% выше, чем при введении VX-950, который не включает полимер, например, по крайней мере, на около 50% выше, по крайней мере, на около 100% выше, по крайней мере, на около 200% выше, по крайней мере, на около 300% выше или, по крайней мере, на около 400% выше.
В некоторых вариантах твердая дисперсия включает целлюлозный полимер, например полимер ГПМЦ или полимер САГПМЦ.
В некоторых вариантах полимер присутствует в твердой дисперсии в количестве от около 10% мас. до около 80% мас., например, от около 30% мас. до около 75% мас., например, около 70% мас., около 50% мас. или около 49,5% мас.
В некоторых вариантах VX-950 присутствует в твердой дисперсии в количестве от около 10% мас. до около 80% мас., например, от около 30% мас. до около 75% мас., например около 70% масс, около 50% масс или около 49,5% мас. В некоторых вариантах VX-950 присутствует в твердой дисперсии в количестве более около 80%.
В некоторых вариантах твердая дисперсия включает поверхностно-активное вещество, например, лаурилсульфат натрия или витамин Е TPGS.
Количество поверхностно-активного вещества в твердой композиции зависит от множества факторов, включая, например, химическую природу поверхностно-активного вещества. В некоторых вариантах поверхностно-активное вещество присутствует в количестве от около 0,1 до около 15%, например от около 0,1% до около 5%, предпочтительно, около 1%.
В некоторых вариантах практически весь VX-950 присутствует в твердой дисперсии в аморфной форме.
В некоторых вариантах VX-950 является смесью L-изомера и D-изомера.
В некоторых вариантах VX-950 является практически чистым L-изомером.
В некоторых вариантах твердую дисперсию получают распылительной сушкой.
В одном варианте в данном изобретении представлена твердая дисперсия VX-950, такая как аморфная твердая дисперсия. Например, представлена аморфная твердая дисперсия, включающая VX-950, по крайней мере, один полимер и, необязательно, одно или более улучшающее растворимость поверхностно-активное вещество. Дисперсия может улучшать растворимость в воде и биодоступность VX-950 при пероральном введении твердой дисперсии млекопитающему (например, крысе, собаке или человеку). В определенных аспектах, по крайней мере, часть VX-950 в твердой дисперсии находится в аморфном состоянии (например, по крайней мере, около 50%, по крайней мере, около 55%, по крайней мере, около 60%, по крайней мере, около 65%, по крайней мере, около 70%, по крайней мере, около 75%, по крайней мере, около 80%, по крайней мере, около 85%, по крайней мере, около 90%, по крайней мере, около 95%, по крайней мере, около 98% или, по крайней мере, около 99%). В предпочтительных вариантах твердая дисперсия полностью или практически свободна от кристаллического VX-950.
В определенных твердых дисперсиях VX-950 (например, аморфный VX-950) присутствует в количестве вплоть до около 99%, например вплоть до около 98%, вплоть до около 95%, вплоть до около 90%, вплоть до около 85%, вплоть до коло 80%, вплоть до около 70%, предпочтительно, вплоть до около 70%, вплоть до около 65%, вплоть до около 60%, вплоть до около 55% и более предпочтительно, вплоть до около 50% от общей массы твердой дисперсии. В других вариантах VX-950 присутствует в количестве, по крайней мере, около 1% от массы твердой дисперсии, например, по крайней мере, около 2%, по крайней мере, около 3%, по крайней мере, около 4%, предпочтительно, по крайней мере, около 5%, по крайней мере, около 6%, по крайней мере, около 7%, по крайней мере, около 8%, по крайней мере, около 9%, более предпочтительно, по крайней мере, 10%, и даже более предпочтительно, по крайней мере, около 50%. Как показано в примерах, твердая дисперсия, в которой VX-950 присутствует в количестве около 50% мас. (более конкретно, около 49,5%) включена в объем данного изобретения.
В некоторых вариантах, когда VX-950 присутствует в твердой дисперсии, по крайней мере, около 60% мас. VX-950 имеет аморфную форму, например, по крайней мере, около 65%, по крайней мере, около 70%, по крайней мере, около 75%, предпочтительно, по крайней мере, около 80%, по крайней мере, около 85%, по крайней мере, около 90%, по крайней мере, около 95%, по крайней мере, около 98% или по крайней мере, около 99%. Дисперсии, в которых весь или практически весь VX-950 имеет аморфную форму, также включены.
В некоторых вариантах дисперсия, включающая VX-950, включает смесь L-изомера и D-изомера (например, 1:1) VX-950, или VX-950 может быть в практически чистой форме любого изомера. Например, включены смеси около 60:40 L:D (±5%). В определенных вариантах VX-950 содержится в количестве около 95%, около 98% или более чем около 98% L-изомера.
Аморфная твердая дисперсия обычно имеет температуру стеклования, при которой дисперсия превращается из стекловидного твердого вещества в резиноподобную композицию. В общем, чем выше температура стеклования, тем больше физическая стабильность дисперсии. Существование температуры стеклования обычно указывает на то, что, по крайней мере, большая часть композиции (например, дисперсии) существует в аморфном состоянии. Температура стеклования (Tg) твердой дисперсии, подходящей для фармацевтического применения, обычно составляет, по крайней мере, около 50°С. В некоторых вариантах предпочтительны более высокие температуры. Поэтому в некоторых вариантах твердая дисперсия в соответствии с данным изобретением имеет Tg, по крайней мере, около 100°С (например, по крайней мере, около 100°С, по крайней мере, около 105°С, по крайней мере, около 110°С, по крайней мере, около 115°С, по крайней мере, около 120°С, по крайней мере, около 125°С, по крайней мере, около 130°С, по крайней мере, около 135°С, по крайней мере, около 140°С, по крайней мере, около 150°С, по крайней мере, около 160°С, по крайней мере, около 170°С, по крайней мере, около 175°С, по крайней мере, около 180°С или, по крайней мере, около 190°С). В некоторых предпочтительных вариантах Tg составляет вплоть до 200°С. Если не указано иначе, температуру стеклования, описанную здесь, измеряют в сухих условиях.
В другом аспекте в данном изобретении представлен аморфный VX-950. Аморфный VX-950, без добавления или присутствия любых полимеров или других наполнителей, улучшает растворимость в воде и биодоступность VX-950 (по сравнению с кристаллическим VX-950) при пероральном дозировании млекопитающим.
В другом аспекте в данном изобретении представлены фармацевтические композиции аморфного VX-950. В некоторых вариантах аморфный VX-950 практически не содержит кристаллический VX-950.
В другом аспекте данное изобретение относится к фармацевтической композиции, включающей аморфный VX-950 в виде твердой дисперсии и одно или более поверхностно-активное вещество, полимер, инертное фармацевтически приемлемое вещество или фармацевтически приемлемый носитель.
В некоторых вариантах композиция включает полимер, и полимер представляет собой один или более чем один растворимый в воде полимер или частично растворимый в воде полимер.
В некоторых вариантах VX-950 имеет улучшенную физическую или химическую стабильность по сравнению с кристаллическим VX-950. В некоторых вариантах твердая дисперсия имеет более высокую температуру стеклования по сравнению с температурой стеклования чистого аморфного VX-950. В некоторых вариантах VX-950 имеет скорость релаксации ниже, чем скорость релаксации чистого аморфного VX-950.
В некоторых вариантах фармацевтическая композиция включает полимер в достаточном количестве, таком, чтобы после введения твердой дисперсии уровень VX-950 в крови крысы был на около 20% выше, чем при введении VX-950, который не включает полимер, например, по крайней мере, на около 50% выше, по крайней мере, на около 100% выше, по крайней мере, на около 200% выше, по крайней мере, на около 300% выше или, по крайней мере, на около 400% выше.
В некоторых вариантах полимер является целлюлозным полимером, таким как ГПМЦ или САГПМЦ.
В некоторых вариантах данное изобретение относится к фармацевтической композиции, включающей аморфную твердую дисперсию VX-950, где указанный VX-950 составляет 30-75% мас./мас. фармацевтической композиции, один или более полимер, выбранный из группы ГПМЦ и САГПМЦ, где указанный полимер составляет 30-75% мас./мас. фармацевтической композиции, и поверхностно-активное вещество, где поверхностно-активное вещество 0,5-2% мас./мас. фармацевтической композиции. Как описано, массовый процент компонентов относится к массе твердой дисперсии, которая далее может быть сформирована в жидкую суспензию или таблетку.
В некоторых вариантах полимером является ГПМЦ или САГПМЦ.
В некоторых вариантах поверхностно-активным веществом является лаурилсульфат натрия или витамин Е TPGS.
В некоторых вариантах фармацевтическая композиция включает следующие компоненты: указанный VX-950 составляет 49,5% мас./мас. фармацевтической композиции, указанным полимером является ГПМЦ и он составляет около 49,5% мас./мас. фармацевтической композиции, и указанное поверхностно-активное вещество является лаурилсульфатом натрия или витамином Е TPGS и составляет около 1% мас./мас. фармацевтической композиции. Как описано, массовый процент компонентов относится к массе твердой дисперсии, которая далее может быть сформирована в жидкую суспензию или таблетку.
В некоторых вариантах фармацевтическая композиция включает следующие компоненты: указанный VX-950 составляет около 49,5% мас./мас. фармацевтической композиции, указанным полимером является САГПМЦ и он составляет около 49,5% мас./мас. фармацевтической композиции, и указанное поверхностно-активное вещество является лаурилсульфатом натрия или витамином Е TPGS и составляет около 1% мас./мас. фармацевтической композиции. Как описано, массовый процент компонентов относится к массе твердой дисперсии, которая далее может быть сформирована в жидкую суспензию или таблетку.
В некоторых вариантах фармацевтическая композиция включает следующие компоненты, где указанный VX-950 составляет около 70% мас./мас. фармацевтической композиции, указанным полимером является ГПМЦ или САГПМЦ и он составляет около 29% мас./мас. фармацевтической композиции, и указанное поверхностно-активное вещество является лаурилсульфатом натрия или витамином Е TPGS и составляет около 1% мас./мас. фармацевтической композиции. Как описано, массовый процент компонентов относится к массе твердой дисперсии, которая далее может быть сформирована в жидкую суспензию или таблетку.
В другом аспекте данное изобретение относится к фармацевтической композиции, включающей водную суспензию, включающую частицы аморфного VX-950 и полимер в растворе, выбранный из группы ГПМЦ и САГПМЦ.
В некоторых вариантах аморфный VX-950 в виде твердой дисперсии.
В некоторых вариантах фармацевтическая композиция также включает поверхностно-активное вещество либо в растворе, либо в качестве компонента частиц VX-950, или оба варианта. Поверхностно-активным веществом может быть, например, ЛСН или витамин Е TPGS.
В некоторых вариантах полимер находится либо в растворе, либо в виде компонента частиц VX-950, или оба варианта.
В некоторых вариантах водная суспензия включает от около 0,1% до около 20% мас. поверхностно-активного вещества. В некоторых вариантах водная суспензия включает от около 1 мг/мл до около 100 мг/мл мас. аморфного VX-950. В некоторых вариантах водная суспензия включает от около 0,1% до около 2,0% мас. полимера, например около 1% мас. полимера.
В некоторых вариантах данное изобретение включает способы получения формы, дисперсии, композиции или фармацевтической композиции, описанной здесь.
Следовательно, описан способ получения аморфной формы VX-950, включающий распылительную сушку. В одном варианте представлен способ получения аморфной формы VX-950 объединением VX-950 и подходящего растворителя с получением смеси и затем распылительной сушкой смеси с получением аморфной формы VX-950. Смесь может быть либо раствором, либо суспензией.
В другом аспекте данное изобретение относится к способу получения аморфной формы VX-950, включающему распылительную сушку VX-950 с получением аморфной формы VX-950.
В некоторых вариантах способ включает объединение VX-950 и подходящего растворителя с получением смеси и последующую распылительную сушку смеси с получением аморфной формы VX-950.
В некоторых вариантах способ включает
а) получение смеси VX-950, полимера и растворителя; и
b) распылительную сушку смеси с получением твердой дисперсии, содержащей VX-950.
В некоторых вариантах полимером является ГПМЦ или САГПМЦ.
В некоторых вариантах полимер присутствует в количестве от около 30% до около 70% мас. в твердой дисперсии.
В некоторых вариантах смесь также включает поверхностно-активное вещество, например лаурилсульфат натрия (ЛСН) или витамин Е TPGS.
В некоторых вариантах растворитель включает метиленхлорид. В некоторых вариантах растворитель включает ацетон. В некоторых вариантах растворитель включает смесь метиленхлорида и ацетона. Например, растворитель может включать от около 0% до коло 30% ацетона и от около 70% до около 100% метиленхлорида, или растворитель может включать от около 0% до около 40% ацетона и от около 60% до около 100% метиленхлорида. Другие типовые соотношения метиленхлорида к ацетону включают 80:20, 75:25 и 70:30.
В другом аспекте данное изобретение относится к твердой дисперсии, полученной описанным здесь способом.
В данном изобретении также представлен способ получения твердой дисперсии VX-950, включающий:
а) получение раствора VX-950, полимера (например, ингибирующего кристаллизацию или стабилизирующего полимера) и растворителя;
b) быстрое удаление раствора из растворителя с получением твердой аморфной дисперсии, содержащей VX-950 и ингибирующий кристаллизацию полимер. В определенных вариантах растворитель удаляют распылительной сушкой.
Понятно, что распылительная сушка может проводиться в присутствии инертного газа. В определенных вариантах способы, которые включают распылительную сушку, могут проводиться в присутствии сверхкритической жидкости, содержащей двуокись углерода или смесь двуокиси углерода.
Следовательно, в другом варианте данное изобретение относится к способу получения твердой дисперсии VX-950, включающему:
а) получение смеси VX-950, полимера (например, полимера подложки, ингибирующего кристаллизацию или стабилизирующего полимера) и растворителя; и
b) распылительную сушку смеси с получением твердой дисперсии, содержащей VX-950.
Эти способы могут применяться для получения композиции в соответствии с данным изобретением. Количества и характеристики компонентов, применяемых в способах, являются такими, как указано в данном описании.
В другом аспекте изобретение относится к способу лечения инфекции ВГС у млекопитающего. В одном варианте способ включает введение аморфного VX-950, как определено в данном описании. В другом варианте способ включает введение твердой дисперсии, представленной в данном описании.
В другом варианте способ включает введение дополнительного агента, выбранного из иммуномодулирующего агента; противовирусного агента; другого ингибитора NS3/4A протеазы ВГС; другого ингибитора IMPDH; ингибитора мишени в жизненном цикле ВГС, отличной от NS3/4А протеазы; ингибитора внутреннего рибосомального входа, ингибитора вирусов широкого спектра действия; ингибитора цитохрома Р-450; или их сочетаний.
В другом аспекте данное изобретение относится к фармацевтическим упаковкам или наборам, включающим композицию VX-950, представленную в данном описании, или аморфный VX-950.
Аморфная форма лекарственного средства может демонстрировать свойства, отличные от кристаллической формы (см. патент США 6627760). Варианты данного изобретения включают аморфный VX-950, который термодинамически имеет более высокий уровень энергии по сравнению с соответствующей кристаллической формой. Поэтому он более активен энергетически и поэтому часто демонстрирует более высокую метастабильную растворимость, более быстрое растворение, а также менее стабильные физические свойства. Первые два свойства улучшают растворимость в воде и биодоступность лекарственного средства, в то время как последнее свойство может быть нежелательным для достижения данной цели, давая менее стабильную композицию, где биодоступность может изменяться вследствие перекристаллизации лекарственного средства из аморфного состояния во время хранения, или при введении человеку или животным.
Для улучшения стабильности аморфного твердого вещества (которое обычно менее стабильно, чем кристаллическая форма) может применяться полимер или полимерная смесь для получения аморфной твердой диспергированной системы вместе с лекарственным средством. В некоторых вариантах может быть получен «твердый раствор», который представляет собой систему, фазы которой не разделяются во в течение времени, или твердая дисперсия, в которых перекристаллизация лекарственного средства эффективно ингибируется во время фармацевтически значительного периода времени (например, два года) при температуре окружающей среды.
В предпочтительных вариантах высвобождение полимера из твердой дисперсии, где твердая дисперсия содержит VX-950 и полимер, в водный раствор может снижать опосредованную раствором кристаллизацию VX-950, который солюбилизируется в водной среде после выделения из твердой дисперсии. Например, если твердая дисперсия VX-950 введена в водную биологическую жидкость, например, содержащуюся в желудке или тонком кишечнике, совместное высвобождение или увеличенное высвобождение полимера, например HMPC или HMPCAS, с аморфным VX-950 будет снижать кристаллизацию VX-950 в водной биологической жидкости, тем самым улучшая одно или более свойство из биодоступности, растворимости и абсорбции VX-950. Более того, включение такого полимера, либо в водной среде, либо в сочетании с VX-950 может снижать кристаллизацию VX-950 в водной среде in vitro, например, при получении жидких композиций VX-950.
Получению аморфной твердой дисперсии, содержащей VX-950, препятствуют несколько проблем. Во-первых, VX-950 не растворяется в сколько-нибудь значительном количестве в воде или большинстве других обычных органических растворителей, включая ацетон, этилацетат и ацетонитрил. Растворимость в воде VX-950 при комнатной температуре фактически неопределима ВЭЖХ, и растворимость в воде не зависит от рН. Во-вторых, VX-950 обладает химической реакционной способностью с некоторыми спиртами, например МеОН, EtOH и iPrOH, что делает эти растворители непригодными. В-третьих, температура плавления VX-950 составляет около 240°С, что делает методики погружения в расплав до некоторой степени невыполнимыми из-за потенциального разложения VX-950 при высокой температуре. Поэтому подходящий растворитель или смесь растворителей является критической для оптимизации обработки и получения твердой дисперсии.
Аморфные твердые дисперсии в соответствии с данным изобретением могут значительно улучшать пероральную биодоступность VX-950. В присутствии подходящего поверхностно-активного вещества или смеси поверхностно-активных веществ (например, ЛСН или витамин Е сукцинат d-альфа-токоферил полиэтиленгликоля 1000 (витамин Е TPGS)), биодоступность также может быть улучшена.
Аморфные твердые дисперсии в соответствии с данным изобретением могут обеспечивать улучшенную биодоступность VX-950 при пероральном введении по сравнению с введением кристаллического VX-950. В некоторых вариантах такие твердые дисперсии находятся в твердом состоянии и могут удобным образом храниться и вводиться. Получение твердых дисперсий может успешно проводиться и постепенно увеличиваться выбором органического растворителя или смеси растворителей (например, метиленхлорид, ацетон и т.д.) или сверхкритической жидкости (например, включающей двуокись углерода). В некоторых вариантах твердые дисперсии могут иметь улучшенную химическую и физическую стабильность. Например, в некоторых случаях твердые дисперсии могут быть химически и/или физически стабильны а течение, по крайней мере, двух лет при соответствующих условиях хранения (комнатная температура).
Более подробное описание одного или более вариантов данного изобретения представлено в описании ниже. Другие характеристики, объекты и преимущества данного изобретения станут очевидны из дальнейшего описания и формулы изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
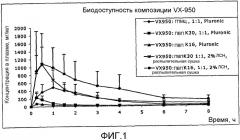
На фиг.1 представлено сравнение различных композиций VX-950.
На фиг.2 представлено сравнение рК крысы для различных композиций, включающих VX-950.
На фиг. 3-6 представлено сравнение данных стабильности для различных суспензий, включая VX-950 и витамин Е TPGS.
На фиг. 7-10 представлено сравнение кинетических данных растворимости для различных суспензий, включающих VX-950 и витамин Е TPGS.
ПОДРОБНОЕ ОПИСАНИЕ
В общем, было обнаружено, что абсолютная биодоступность после перорального введения микронизированного кристаллического лекарственного порошка VX-950 крысам составляет менее 0,5%. Простые смеси VX-950 с обычными фармацевтическими наполнителями демонстрируют похожую низкую биодоступность при пероральном введении млекопитающим. Композиции, включающие VX-950 в кристаллической форме (т.е., где значительная смесь VX-950 находится в кристаллической форме), обычно не обеспечивают такую степень абсорбции лекарственного средства, которая дает значительный терапевтический эффект VX-950. Описанные здесь композиции обеспечивают сравнительно улучшенную биодоступность. Следовательно, в некоторых вариантах представлено получение аморфного VX-950. Примером является очищенный препарат, который практически не содержит примесей, включая кристаллический VX-950. В некоторых вариантах данное изобретение включает фармацевтическую композицию в виде твердой дисперсии, содержащей VX-950. Композиции в соответствии с данным изобретением являются стабильными, легки при введении и обладают высокой биодоступностью VX-950 при введении.
В определенных вариантах VX-950 присутствует в количестве от около 5% до около 90% мас., например от около 5% до около 70%, предпочтительно вплоть до около 50% мас. VX-950 представляет смесь D-изомера и L-изомера, или практически чистый продукт любого изомера. Предпочтительно, VX-950 является практически аморфным (например, по крайней мере, около 50% VX-950 является аморфным, по крайней мере, около 55% VX-950 является аморфным, по крайней мере, около 60% VX-950 является аморфным, по крайней мере, около 65% VX-950 является аморфным, по крайней мере, около 70% VX-950 является аморфным, по крайней мере, около 75% VX-950 является аморфным, по крайней мере, около 80% VX-950 является аморфным, по крайней мере, около 85% VX-950 является аморфным, по крайней мере, около 90% VX-950 является аморфным, по крайней мере, около 95% VX-950 является аморфным, по крайней мере, около 98% VX-950 является аморфным, по крайней мере, около 99% VX-950 является аморфным или практически весь VX-950 является аморфным).
В данном описании термин «аморфный» относится к твердому материалу, не имеющему дальнего порядка в положении его атомов. Аморфные твердые вещества обычно представляют собой переохлажденные жидкости, в которых молекулы расположены случайным образом так, что не имеют определенного расположения и дальнего порядка атомов. Аморфные твердые вещества обычно являются изотропными, т.е. обладают сходными свойствами во всех направлениях и не имеют определенных температур плавления. Например, аморфный материал представляет собой твердый материал, не имеющий острых характеристических кристаллических пиков в порошковой дифракционной рентгенограмме (ПДР) (т.е. кристаллы не определяются ПДР). Вместо этого в ПДР видны один или несколько широких пиков (т.е. ореолов). Широкие пики являются характерными для аморфного твердого вещества. См. патент США 2004/0006237 для сравнения ПДР аморфного материала и кристаллического материала.
В данном описании «кристаллическое твердое вещество» относится к соединениям или композициям, в которых структурные единицы расположены в фиксированном геометрическом порядке или матрице таким образом, что кристаллические твердые вещества имеют жесткий дальний порядок. Единицы, которые составляют кристаллическую структуру, могут быть атомами, молекулами или ионами. Кристаллические твердые вещества имеют определенные температуры плавления.
В данном описании «дисперсия» относится к диспергированной системе, в которой одно вещество, диспергированная фаза, распределено отдельными единицами, во второй структуре (однородная фаза или носитель). Размер диспергированной фазы может значительно варьироваться (например, коллоидные частицы размером от нанометра до нескольких микронов). В общем, диспергированные фазы могут быть твердыми веществами, жидкостями или газами. В случае твердой дисперсии диспергированная и однородная фазы обе являются твердыми веществами. В фармацевтических применениях твердая дисперсия может включать кристаллическое лекарственное средство (диспергированная фаза) в аморфном полимере (однородная фаза), или, альтернативно, аморфное лекарственное средство (диспергированная фаза) в аморфном полимере (однородная фаза). В некоторых вариантах аморфная твердая дисперсия включает полимер, составляющий диспергированную фазу, и лекарственное средство, составляющее однородную фазу.
Термин «аморфная твердая дисперсия» обычно относится к твердой дисперсии двух или более компонентов, обычно лекарственного средства и полимера, но, возможно, содержащей другие компоненты, такие как поверхностно-активные вещества или другие фармацевтические эксципиенты, где лекарственное средство находится в аморфной фазе, а физическая стабильность и/или растворение и/или растворимость аморфного лекарственного средства улучшается другими компонентами.
Представленная здесь твердая дисперсия является особенно предпочтительным вариантом данного изобретения. Твердые дисперсии обычно включают соединение, диспергированное в подходящем носителе, таком как твердый носитель. В одном варианте носитель в соответствии с данным изобретением включает полимер, предпочтительно, растворимый в воде полимер или частично растворимый в воде полимер. Должно быть понятно, что один или более чем один растворимый в воде полимер может применяться в твердой дисперсии в соответствии с данным изобретением.
Типовой твердой дисперсией является совместно осажденный или совместно расплавленный VX-950 с, по крайней мере, одним полимером. «Совместно осажденным» является продукт, полученный после растворения лекарственного средства и полимера в растворителе или смесь растворителей с последующим удалением растворителя или смеси растворителей. Иногда полимер может быть суспендирован в растворителе или смеси растворителей. Растворитель или смесь растворителей включает органические растворители и сверхкритические жидкости. «Совместно расплавленным» является продукт, полученный после нагревания лекарственного средства и полимера до расплава, необязательно в присутствии растворителя или смеси растворителей, с последующим смешиванием, удалением, по крайней мере, части растворителя, если применяется, и охлаждением до комнатной температуры при определенной скорости. В некоторых случаях твердые дисперсии получают добавлением раствора лекарственного средства и твердого полимера с последующим смешиванием и удалением растворителя. Для удаления растворителя применяют вакуумную сушку, распылительную сушку, лотковую сушку, лиофилизацию и другие методики сушки. Применение любого из этих способов с применением подходящих параметров обработки, в соответствии с данным изобретением, дает VX-950 в аморфном состоянии в конечной твердой дисперсии.
Получение аморфного VX-950
Любой метод получения аморфных форм и твердых дисперсий может применяться в данном изобретении, включая, например, методы, описанные в US 2003/0186952 (см. документы, представленные в параграфе 1092) и US 2003/0185891). В общем, применяемые методы включают такие, в которых применяется быстрое удаление растворителя из смеси или охлаждение расплавленного образца. Такие методы включают, но не ограничиваются ими, ротационное выпаривание, сушку сублимацией (например, лиофилизацию), вакуумную сушку, отверждение расплава и экструзию расплава. Однако предпочтительный вариант данного изобретения включает аморфную твердую дисперсию, полученную распылительной сушкой. Следовательно, в другом варианте данное изобретение относится к сушке продукта, осуществляемой распылительной сушкой для удаления растворителя.
Описанные здесь препаративные формы, например фармацевтические композиции, могут быть получены распылительной сушкой смеси, содержащей VX-950, подходящий полимер и соответствующий растворитель. Распылительная сушка представляет собой метод, который включает распыление жидкой смеси, содержащей, например, твердое вещество и растворитель, и удаление растворителя. Распыление может проводиться, например, через сопло или на вращающемся диске.
Распылительная сушка представляет собой процесс, который превращает жидкий поток в высушенные частицы. Необязательно, вторичный метод сушки, такой как сушка с псевдоожиженным слоем или вакуумная сушка, может применяться для уменьшения количества остаточных растворителей до фармацевтически приемлемых уровней. Обычно распылительная сушка включает контактирование сильно диспергированной жидкой суспензии или раствора и достаточного объема горячего воздуха, что вызывает испарение и сушку жидких капель. Композиция, подвергающаяся распылительной сушке, может включать любой раствор, грубодисперсную суспензию, суспензию, коллоидную дисперсию или пасту, которые могут быть распылены с применением выбранного аппарата распылительной сушки. Согласно стандартной методике композицию распыляют в поток теплого фильтрованного воздуха, который выпаривает растворитель и направляет высушенный продукт в сборник (например, циклон). Использованный воздух затем выпускают с растворителем или, альтернативно, использованный воздух посылают в конденсатор для сбора и последующего повторного применения растворителя. Коммерчески доступные типы аппаратов могут применяться для проведения распылительной сушки. Например, коммерческие распылительные сушки производства Buchi Ltd. и Niro (например, линия распылительных сушек PSD производства Niro) (см. US 2004/0105820; US 2003/0144257).
В распылительных сушках обычно применяется загрузка твердых веществ материала от около 5% до около 30% (т.е. лекарственное средство плюс наполнители), предпочтительно, по крайней мере, около 10%. В некоторых вариантах загрузка менее 10% может привести к плохому выходу и неожиданно длительному периоду обработки. В общем, верхний предел загрузки твердых веществ определяется вязкостью (т.е. способностью к накачиванию) полученного раствора и растворимостью компонентов в растворе. Обычно вязкость раствора может определять размер частиц в полученном порошковом продукте.
Методики и методы распылительной сушки можно найти в Perry's Chemical Engineering Handbook, 6th Ed., R.H. Perry, D.W. Green & J.O. Maloney, eds.), McGraw-Hill book со. (1984); и Marshall "Atomi