Способ получения промежуточных соединений
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения соединения формулы VII
и промежуточных соединений для его получения. Значения Y, R1, R2, R3, R4, R5, X, n приведены в пункте 1 формулы. 3 н. и 21 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к способу получения промежуточных соединений, которые полезны для получения определенных антибактериальных N-формилгидроксиламиносоединений.
Пептиддеформилаза - это металлопептидаза, обнаруженная в прокариотических организмах, таких как бактерии. Синтез белка в прокариотических организмах начинается с N-формилметионина (fMet). После инициирования синтеза белка формильная группа удаляется ферментом пептиддеформилазой (ПДФ); эта активность необходима для созревания белков. Было показано, что ПДФ требуется для роста бактерий (см. Chang и др., J. Bacteriol., Vol.171, pp.4071-4072 (1989); Meinnel и др., J. Bacteriol, Vol.176, No.23, pp.7387-7390 (1994); Mazel и др., ЕМВО J., Vol.13, No.4, pp.914-923 (1994)). Поскольку синтез белка в эукариотических организмах не зависит от fMet для инициирования, агенты, которые будут ингибировать ПДФ, являются привлекательными кандидатами для разработки новых антимикробных и антибактериальных лекарственных средств.
Совместно поданная заявка №10/171,706 от 14.06.2002 (целиком включенная здесь в качестве ссылки) и WO 02/102790, описывают новые N-формил гидроксиламиносоединения, которые ингибируют ПДФ и поэтому являются полезными в качестве антибактериальных агентов. Соединения, описываемые там, являются определенными N-[1-оксо-2-алкил-3-(N-гидроксиформамидо)-пропил]-(карбониламино-арил или -гетероарил)-азацикло4-7алканами или тиазацикло4-7алканами, которые более детально описываются далее в данном изобретении. Был открыт улучшенный способ получения промежуточных соединений, полезных для получения этих N-[1-оксо-2-алкил-3-(N-гидроксиформамидо)-пропил]-(карбониламино-арил или -гетероарил)-азацикло4-7алканов или тиазацикло4-7алканов, который использует определенные β-лактамные промежуточные соединения.
Настоящее изобретение относится к новому способу получения определенных промежуточных соединений, полезных для получения определенных N-формилгидроксиламиносоединений, полезных для ингибирования бактерий.
Более конкретно, настоящее изобретение относится к способу получения соединения формулы (VIII)
включающий стадию А:
контактирование соединения формулы (I)
с соединением формулы (II)
в присутствии агента, активирующего карбоксильную группу, в подходящем растворителе
в условиях, подходящих для образования соединения формулы (III)
следующую стадию Б:
контактирование соединения (III) с соединением формулы (XIII)
в присутствии основания в подходящем растворителе, в условиях, подходящих для образования соединения формулы (IV)
следующую стадию В:
контактирование соединения (IV) с основанием в подходящем растворителе в условиях, подходящих для образования соединения формулы (V)
следующую стадию Г:
контактирование соединения (V) с соединением формулы (VI)
в подходящем растворителе, необязательно в присутствии активатора в условиях, подходящих для образования соединения формулы (VII)
следующую стадию Д:
контактирование соединения (VII) с формилирующим агентом в подходящем растворителе в условиях, подходящих для образования соединения (VIII);
где
Y представляет собой защитную группу для гидроксигруппы;
каждый из R2, R3, R4 и R5 независимо представляет собой водород или алифатическую группу, или (R2 и R3) и/или (R4 и R5) вместе образуют C4-7 циклоалкил;
Х представляет собой -СН2-, -S-, -СН(ОН)-, -CH(OR)-, -CH(SH)-, -CH(SR)-, -CF2-, -C=N(OR)- или -CH(F);
где
R представляет собой алкил;
G представляет собой -ОН или -O⊝M⊕, где М представляет собой металл или остаток аммония;
R1 представляет собой арил или гетероарил;
X' представляет собой галоген;
R' представляет собой алкил или арил; и
n - имеет значение от 0 до 3, при условии, что когда n=0, Х представляет собой -СН2-.
Когда желаемый продукт является N-оксидом ароматического остатка, имеющего азот в качестве гетероатома, например, когда R1 представляет собой соединение формулы (X), (ХIа) или (Хb), обычно производное пиридина, необходимо осуществлять дополнительную стадию после стадии Д, то есть окислять N в ароматическом кольце (стадия Е). Поэтому настоящее изобретение включает стадию Е, которая заключается в контактировании соединения формулы (VIII), где R1 представляет собой гетероарил, имеющий гетероатом N, с окисляющим агентом для образования соответствующего N-оксидного производного.
Кроме описанного выше способа, включающего стадии от А до Д или Е, настоящее изобретение относится к каждой из стадий в отдельности и на любые две или несколько последовательных стадий.
Раскрытие изобретения
В особенности, настоящее изобретение обеспечивает способ получения промежуточных соединений, полезных для получения N-[1-оксо-2-алкил-3-(N-гидроксиформамидо)-пропил]-(карбониламино-арил или -гетероарил)-азацикло4-7алкана или тиазацикло4-7алкана, например, соединения формулы (IX)
где R1, R2, R3, R4, R5, Х и n определены выше.
Для превращения соединения формулы (VIII) в соединение формулы (IX) защитную группу с гидроксигруппы удаляют традиционной процедурой гидролиза, известной из уровня техники, например контактированием соединения формулы (VIII) с палладиевым катализатором, таким как Pd/BaSO4.
Остаток R1 может быть гетероарилом, например азацикло4-7алканом, тиазацикло4-7алканом или имидазацикло4-7алканом. Характерными примерами остатков R1 в описываемых здесь соединениях являются гетероарилы формулы (X)
или или
где каждый из R6, R7, R8 и R9 независимо представляет собой водород, алкил, замещенный алкил, гидрокси, алкокси, ацил, ацилокси, SCN, галоген, циано, нитро, тиоалкокси, фенил, гетероалкиларил, алкилсульфонил или формил.
Более специфичным остатком R1 является гетероарил формулы (ХIа)
где R6, R7, R8 и R9 имеют те же значения, что определены выше для формулы (X), например,
где
а) R6 представляет собой нитро, алкил, замещенный алкил, фенил, гидрокси, формил, гетероалкиларил, алкокси, ацил или ацилокси; предпочтительно алкил, особенно С1-7алкил; гидроксил; или алкокси, особенно С1-7алкокси; и
R7, R8 и R9 представляют собой водород; или
б) R6, R8 и R9 представляют собой водород; и
R7 представляет собой алкил, замещенный алкил, фенил, галоген, алкокси или циано, предпочтительно алкил, особенно С1-7алкил; замещенный алкил, особенно замещенный С1-7алкил, такой как -СF3; или алкокси, особенно C1-7алкокси; или
в) R6, R7 и R9 представляют собой водород; и
R8 представляет собой алкил, замещенный алкил, галоген, нитро, циано, тиоалкокси, ацилокси, фенил, алкилсульфонил или карбоксиалкил, предпочтительно алкил, особенно С1-7алкил; замещенный алкил, особенно -СF3; галоген, такой как хлор, бром или фтор; или карбоксиалкил; или
г) R6, R7 и R8 представляют собой водород; и
R9 представляет собой алкил, галоген или гидрокси; или
д) R7 и R9 представляют собой водород; и
каждый из R6 и R8 независимо представляет собой галоген, алкил, замещенный алкил, фенил или циано; или
е) каждый из R7 и R9 представляет собой алкил или замещенный алкил; и
R6 и R8 представляют собой водород; или
ж) R6 и R9 представляют собой водород;
R7 представляет собой алкил или замещенный алкил; и
R8 представляет собой нитро; или
з) R8 и R9 представляют собой водород;
R6 представляет собой циано; и
R7 представляет собой алкокси; или
и) R7 и R8 представляют собой водород; и
R6 представляет собой алкил, замещенный алкил, алкокси или SCN; и
R9 представляет собой алкил или замещенный алкил; или
к) R6 и R7 представляют собой водород;
R8 представляет собой нитро или галоген; и
R9 представляет собой алкил или замещенный алкил; или
л) R6, R7, R8 и R9 представляют собой водород; или
м) R6 и R7 вместе с атомами углерода, к которым они присоединены, образуют фенильную группу, предпочтительно замещенную гидроксигруппой; и
R8 и R9 представляют собой водород; или
н) R6 и R7 представляют собой водород; и
R8 и R9 вместе с атомами углерода, к которым они присоединены, образуют фенильную группу; или
о) n=0; или
п) n=0;
каждый из R6, R7, R8 и R9 независимо представляет собой водород, алкил или галоген; и
в особенности R6, R7, R8 и R9 представляют собой водород; или
p) n=0;
R6, R8 и R9 представляют собой водород; и
R7 представляет собой алкил; или
с) n=0;
R6, R7 и R9 представляют собой водород; и
R8 представляет собой алкил или галоген.
В другом варианте осуществления R1 соответствует формуле (Хb)
где
R6, R7, R8 и R9 имеют те же значения, что определены выше для формулы (X); в особенности R7 и R8 вместе с атомами углерода, к которым они присоединены, образуют фенильную группу; и
R6 и R9 представляют собой водород.
В еще одном варианте осуществления R1 соответствует формуле (XI)
или или
где каждый из R6, R7, R8 и R9 независимо представляет собой водород, алкил, замещенный алкил, фенил, галоген, гидрокси или алкокси, например,
где
а) R6 и R8 представляют собой водород;
R9 представляет собой водород или алкил; и
R7 представляет собой алкил, замещенный алкил или фенил; или
б) R6, R7 и R9 представляют собой водород; и
R8 представляет собой галоген, алкил или замещенный алкил; или
в) R7, R8 и R9 представляют собой водород; и
R6 представляет собой гидрокси.
В особенно полезном варианте осуществления гетероарил соответствует формуле (ХIа)
где R6, R7, R8 и R9 имеют те же значения, что определены выше для формулы (XI), в особенности, где R6, R7, и R9 представляют собой водород и R8 представляет собой фтор.
В другом варианте осуществления R1 является незамещенным фенилом или фенилом, замещенным алкоксигруппой, например, метокси; или арилалкоксигруппой, например фенокси.
В другом варианте осуществления R1 соответствует формуле (XII)
где каждый из R10 и R11 независимо представляет собой водород или галоген. В особенности R10 и R11 одновременно являются либо водородом, либо галогеном.
В соединении формулы (I) M представляет собой металл, обычно моно- или бивалентный металл или остаток аммония. Типичные металлы включают Mg, Ca, Na, К, Li и другие подобные. Остаток аммония соответствует формуле
где R'' представляет собой водород, алкил, замещенный алкил, арил или замещенный арил.
Остаток аммония может быть рацемическим или хиральным. Примером остатка аммония является R-α-метилбензиламмоний. Примеры групп R” включают водород, метил, этил, пропил, бутил, фенил, бензил, метилбензил и подобные.
Если не указано обратное, следующие термины, используемые в описании, имеют следующие значения.
"Циклоалкан" или "циклоалкил" содержит от 3 до 7 атомов углерода в кольце и представляет собой, например, циклопропил, циклобутил, циклопентил и циклогексил.
"Азацикло4-7алкан" содержит в кольце 1 гетероатом, представляющий собой азот. Он содержит от 4 до 7, и особенно 4 или 5 атомов в кольце, включая гетероатом.
"Тиазацикло4-7алкан" содержит в кольце 2 гетероатома, азот и серу. Он содержит от 4 до 7 и особенно 5 атомов в кольце, включая гетероатомы.
"Имидазацикло4-7алкан" содержит в кольце 2 гетероатома, оба из которых являются азотами. Он содержит от 4 до 7 и особенно 5 атомов в кольце, включая гетероатомы.
Термин "алифатическая группа" относится к насыщенным или ненасыщенным алифатическим группам, таким как алкил, алкенил или алкинил, циклоалкил или замещенный алкил, включая неразветвленные, разветвленные и циклические группы, имеющие от 1 до 10 атомов углерода. Предпочтительно "алкил" или "алк", где бы он ни встретился, представляет собой насыщенную алифатическую группу или циклоалкил, более предпочтительно С1-7алкил, особенно С1-4алкил. Примеры "алкил" или "алк" включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, неопентил, н-гексил или н-гептил, циклопропил и особенно н-бутил.
Термин "замещенный алкил" относится к алкильной группе, замещенной одним или несколькими заместителями, предпочтительно 1-3 заместителями, включая, но, не ограничиваясь ими, такие заместители, как галоген, низший алкокси, гидрокси, меркапто, карбокси, циклоалкил, арил, гетероарил и другие подобные. Примеры замещенных алкильных групп включают, но не ограничиваются ими, -СF3, -СF2-СF3, гидроксиметил, 1- или 2-гидроксиэтил, метоксиметил, 1- или 2-этоксиэтил, карбоксиметил, 1- или 2-карбоксиэтил и другие подобные.
Термин "арил" или "Аr" относится к ароматической карбоциклической группе из 6-14 атомов углерода, имеющей одно кольцо, включая, но не ограничиваясь, такие группы, как фенил; или несколько конденсированных колец, включая, но не ограничиваясь ими, такие группы, как нафтил или антрил; и в особенности представляет собой фенил.
Термин "гетероарил" или "HetAr" относится к 4-7-членному моноциклическому ароматическому гетероциклу или бициклу, который состоит из 4-7-членного моноциклического ароматического гетероцикла и конденсированного бензольного кольца. Гетероарил имеет, по меньшей мере, один гетероатом, предпочтительно один или два гетероатома, включая, но не ограничиваясь ими, такие гетероатомы, как N, О и S, в кольце. Предпочтительными гетероарильными группами являются пиридинил, пиримидинил или бенздиоксоланил.
Арил или гетероарил могут быть незамещенными или замещенными одним или несколькими заместителями, включая, но не ограничиваясь, С1-7алкил, особенно С1-4алкил, такой как метил, гидрокси, алкокси, ацил, ацилокси, SCN, галоген, циано, нитро, тиоалкокси, фенил, гетероалкиларил, алкилсульфонил и формил.
Термин "карбониламин" в том значении, в котором он используется здесь, относится к -NHC(O)-группе, в которой аминогруппа соединена с арилом/гетероарилом, а карбонильная часть группы соединена с азацикло4-7алканом, тиазацикло4-7алканом или имидазацикло4-7алканом.
Термин "гетероалкил" относится к насыщенному или ненасыщенному C1-10алкилу, определение которому было дано выше, и в особенности C1-4гетероалкилу, которые содержат один или несколько гетероатомов, являющихся частью главной, боковой или циклической цепей в группе. Гетероатомы могут быть независимо выбраны из группы, состоящей из -NR-, где R представляет собой водород или алкил, -S-, -О- и -Р-; предпочтительно -NR-, где R представляет собой водород или алкил; и/или -О-. Гетероалкильные группы могут быть присоединены к остатку молекулы либо по гетероатому (если есть доступная валентность), либо по атому углерода. Примеры гетероалкильных групп включают, но не ограничиваются ими, такие группы как -O-СН3, -СН2-O-СН3, -СН2-СН2-О-СН3, -S-СН2-СН2-СН3, -СН2-СН(СН3)-S-СН3 и -CH2-CH2-NH-СН2-СН2-.
Гетероалкильная группа может быть незамещенной или замещенной одним или несколькими заместителями, предпочтительно 1-3 заместителями, включая, но не ограничиваясь, алкил, галоген, алкокси, гидроксил, меркапто, карбокси и особенно фенил. Могут быть замещены как гетероатом (гетероатомы), так и атомы углерода. Гетероатом (гетероатомы) также могут быть в окисленной форме.
Термин "алкокси" в том значении, в котором он используется здесь, относится к C1-10алкилу, присоединенному к атому кислорода, или предпочтительно С1-7алкокси, более предпочтительно С1-4алкокси. Примеры алкокси групп включают, но не ограничиваются ими, такие группы как метокси, этокси, н-бутокси, трет-бутокси и аллилокси.
Термин "ацил" в том значении, в котором он используется здесь, относится к группе -(O)CR, где R представляет собой алкил, особенно С1-7алкил, например метил. Примеры ацильных групп включают, но не ограничиваются, ацетил, пропаноил и бутаноил.
Термин "ацилокси" в том значении, в котором он используется здесь, относится к группе -OC(O)R, где R представляет собой водород, алкил, особенно С1-7алкил, например метил, или этил, или фенил, или замещенный алкил, определение которому было дано выше.
Термин "алкоксикарбонил" в том значении, в котором он используется здесь, относится к группе -COOR, где R представляет собой алкил, особенно C1-7алкил, например метил или этил.
Термин "галоген" или "гало" в том значении, в котором он используется здесь, относится к хлору, брому, фтору, йоду, особенно к фтору.
Термин "тиоалкокси" в том значении, в котором он используется здесь, обозначает группу -SR, где R представляет собой алкил, определение которому было дано выше, например метилтио, этилтио, пропилтио, бутилтио и другие подобные.
Термин "гетероалкиларил" в том значении, в котором он используется здесь, обозначает гетероалкильную группу, например -O-CH2-, замещенную арильной группой, в особенности фенилом. Сама фенильная группа может также быть замещена одним или несколькими заместителями, такими как галоген, в особенности фтор и хлор; и алкокси, например метокси.
Термин "алкилсульфонил" в том значении, в котором он используется здесь, обозначает группу -SO2R, где R представляет собой алкил, особенно C1-7алкил, например метилсульфонил.
"Защитная группа" относится к химической группе, которая проявляет следующие характеристики: 1) селективно реагирует с желаемой функциональной группой с хорошим выходом, давая защищенный субстрат, стабильный в условиях предполагаемых реакций, для которых желаема защита; 2) селективно удаляется с защищенного субстрата, давая желаемую функциональную группу; и 3) с хорошим выходом удаляется реагентами, совместимыми с другой функциональной группой (группами), присутствующей в молекуле или создаваемой в ходе таких предполагаемых реакций. Примеры подходящих функциональных групп могут быть найдены в Greene и др., "Protective Groups in Organic Synthesis", 3rd Ed., John Wiley & Sons, Inc., NY (1999). Предпочтительные защитные группы для защиты гидроксильной группы включают бензил, Fmoc, TBDMS, фотолабильные защитные группы, такие как Nvom, Mom и Mem. Другие предпочтительные защитные группы включают NPEOC и NPEOM.
Соединения, описываемые здесь, могут существовать в форме оптических изомеров, рацематов или диастереомеров. В особенности, в соединениях, описываемых здесь, в которых радикалы R4 и R5 различны, атом углерода, к которому присоединены группы R4 и R5, является хиральным центром, и такие соединения могут существовать в форме R, S изомеров или рацемической форме. Является предпочтительным то, что способ, описываемый в изобретении, приводит к получению оптически чистого R изомера. Под "оптически чистым" подразумевается то, что энантиомерная чистота составляет более 50%, предпочтительно более 80%, более предпочтительно более 90%, и наиболее предпочтительно более 95%. Может быть использован оптически чистый R изомер соединения (I), в этом случае все последующие соединения в синтезе будут оставаться в виде оптически чистой R формы по отношению к тому же самому хиральному атому углерода. Если в качестве исходного материала используется оптически чистый изомер, можно избежать очистки от нежелательного диастереомера на последующих стадиях. Такая R форма соединения (I) представлена ниже
где R2, R3, R4 и R5 определены выше. Оптически чистая форма соединения (I) является новой при условии, что когда либо R4, либо или R5 представляет собой водород, другой заместитель, то есть R4 или R5, не является водородом или метилом. В предпочтительном варианте осуществления нового соединения формулы (I) R5 представляет собой водород, a R4 представляет С2-10алкил, в более предпочтительном варианте осуществления С2-7алкил, и в еще более предпочтительном - С4алкил.
В дальнейшем варианте осуществления оптически чистого соединения формулы (I)
R2, R3 и R5 представляют собой водород, а R4 представляет собой алкил; такое соединение имеет структуру (Iа)
В другом варианте осуществления соединения (I) R4 представляет собой н-бутил, такое соединение имеет структуру (Ib)
В другом варианте осуществления R2, R3 и R5 представляют собой водород, а R4 представляет собой н-бутил; такое соединение имеет структуру (Iс)
Более конкретными примерами оптически чистого соединения формулы (I) являются следующие соединения:
Альтернативным путем является использование рацемической формы соединения (I), расщепление на оптические изомеры R формы на последующих стадиях и затем использование R формы на последующих стадиях. Например, соединение, образующееся после раскрытия β-лактамного кольца, то есть соединение (VII), продукт стадии Г, может быть расщеплено на его RS и SS диастереомеры и только RS диастереомер использован на последующих стадиях. RS диастереомер соединения (VII) изображен ниже
где R2, R3, R4, R5, Y, X, R1 и n определены выше, при условии, что R4 и R5 являются различными заместителями.
Диастереомеры расщепляют с использованием стандартных приемов, известных из уровня техники, например, методом колоночной хроматографии на силикагеле с использованием в качестве растворителя системы этилацетат/гексан (см., например, методы, описанные в Главе 4 "Advanced Organic Chemistry", 5th edition, J.March, John Wiley и Sons, NY (2001)).
В соединениях, описываемых здесь, следующие обозначения являются конкретными вариантами осуществления, индивидуально или в любой субкомбинации:
1. R1 представляет собой гетероарил формулы (IIа), где R6, R7 и R9 представляют собой водород и R8 представляет собой метил или трифторметил; или R6, R7 и R8 представляют собой водород и R9 представляет собой фтор; или R6, R8 и R9 представляют собой водород и R7 представляет собой этил или метокси; или R7, R8 и R9 представляют собой водород и R6 представляет собой гидрокси; или R7 и R8 представляют собой водород, R6 представляет собой метокси и R9 представляет собой метил; или R1 представляет собой гетероарил формулы (IIIa), где R6, R7 и R9 представляют собой водород и R8 представляет собой фтор или трифторметил; или R6, R8 и R9 представляют собой водород и R7 представляет собой этил; предпочтительно R1 представляет собой гетероарил формулы (IIа), где R6, R8 и R9 представляют собой водород и R7 представляет собой этил или гетероарил формулы (IIIa), где R6, R7 и R9 представляют собой водород и R8 представляет собой фтор.
2. Х представляет собой -СН2-, -СН(ОН)-, -CH(OR)-, -CF2- или -CH(F)-, предпочтительно Х представляет собой -СН2-;
3. R4 представляет собой алкил, предпочтительно С1-7алкил, такой как н-бутил;
4. n=1.
Нет данных о том, что температура и давление являются критичными для осуществления любой из стадий изобретения, то есть стадий от А до Д. В общем, для любой из стадий обычно используется температура приблизительно от -10°С приблизительно до 150°С, предпочтительно приблизительно от 0°С приблизительно до 80°С. Обычно для удобства используется давление, близкое к атмосферному; однако нет данных о том, что отклонения от атмосферного давления являются неприемлемыми. Нет данных о том, что кислород является неприемлемым для способа, поэтому для удобства различные стадии могут быть осуществлены в атмосфере окружающего воздуха, хотя при желании может быть использована инертная атмосфера, такая как азот или аргон. Для удобства обычно используют эквимолярные количества реагентов, однако мольные отношения могут варьироваться приблизительно от 1 до 2 эквивалентов по отношению к другому реагенту. Значение рН для различных стадий обычно находится в диапазоне приблизительно от 2 приблизительно до 12. Растворители, используемые для различных стадий, обычно являются органическими растворителями, хотя в некоторых случаях могут быть использованы водно-органические растворители. Примеры таких подходящих растворителей включают диоксан; метиленхлорид; дихлорметан; толуол, ацетон; метилэтилкетон; ТГФ; изопропилацетат; ДМФА; спирты, особенно высшие разветвленные спирты, такие как трет-бутанол и подобные.
Для стадии А типичной является температура приблизительно от 0°С приблизительно до 50°С, предпочтительно приблизительно от 5°С приблизительно до 35°С; и типичным является время реакции приблизительно от 1 часа приблизительно до 10 часов, предпочтительно приблизительно от 2 часов приблизительно до 5 часов. Типично используется значение рН приблизительно от 2 приблизительно до 7, преимущественно приблизительно от 3 приблизительно до 5, более предпочтительно приблизительно 4. Агент, активирующий карбоксильную группу, может быть, например, таким как ДЦК, CDMT, EDCl и подобные. Обычно используется приблизительно от 0,5 приблизительно до 2 мольных эквивалентов агента, активирующего карбоксильную группу, по отношению к соединению (I). Растворителем является вода или смесь воды и одного или нескольких органических растворителей, таких как ТГФ, диоксан, спирты, такие как метанол, этанол и подобные. Конкретные примеры растворителей включают ТГФ/воду и воду. В случае использования в способе аммонийной соли соединения (I) соль растворяется в воде, содержащей, по крайней мере, мольный эквивалент основания, такого как гидроксид щелочного металла, такой как NaOH и КОН; основание используется для получения свободного амина, который экстрагируют в органическую фазу, водная фаза используется для реакции конденсации.
Для стадии Б типичной является температура приблизительно от -20°С приблизительно до 25°С, более типичной приблизительно от -5°С приблизительно до 5°С; и типичным является время реакции приблизительно от 1 часа приблизительно до 2 часов, более типичным приблизительно от 2 часов приблизительно до 5 часов. Для стадии Б не должен использоваться спиртовой растворитель. Для реагента (XIII), X' предпочтительно является хлором и R' предпочтительно является низшим алкилом или фенилом, наиболее типичными являются СН3SО2Сl и тозилхлорид. Значение рН для стадии Б является щелочным и типично находится в диапазоне приблизительно от 9 приблизительно до 10. Основанием, используемым для стадии Б, может быть любое подходящее основание, известное из уровня техники, которое будет активировать гидроксигруппу соединения (III), и такое основание будет использоваться в гидроксил-активирующем количестве, которое составляет, по крайней мере, 1 мольный эквивалент по отношению к соединению (III). Основание также может действовать как растворитель, в этом случае оно будет присутствовать в сольватирующем количестве, что превышает указанное выше количество. Примеры оснований, которые могут быть использованы, включают пиридин; DMAP; триалкиламин, например триметиламин; основания, связанные со смолой; основания Hunig; и подобные. Предпочтительными растворителями являются пиридин, ТГФ или EtOAc.
Для циклизации стадии В типичной является температура приблизительно от 20°С приблизительно до 150°С, более типичной приблизительно от 40°С приблизительно до 80°С; и типичным является время реакции приблизительно от 1 часа приблизительно до 20 часов, более типичным приблизительно от 2 часов приблизительно до 4 часов. Значение рН для стадии В является щелочным и типично находится в диапазоне приблизительно от 8 приблизительно до 12. Основанием, используемым на стадии В, может быть любое основание, известное из уровня техники, способное депротонировать амидную группу соединения (IV). Примеры таких подходящих оснований включают неорганические или органические основания, такие как карбонат калия, карбонат лития, карбонат натрия, бикарбонат лития, бикарбонат натрия, алкиллитий, например бутиллитий и подобные. Количеством используемого основания является депротонирующее количество, которое обычно представляет мольный избыток по отношению к количеству соединения (IV), например, приблизительно 1-5 эквивалентов по отношению к соединению (IV). Для определенных растворителей, таких как ТГФ, диоксан, диметоксиэтан и подобные, может быть необходимым использование каталитических количеств межфазного катализатора, такого как триалкилариламмониевой соли или тетраалкиламмониевой слои, например тетрабутиламмоний хлорида или тетрабутиламмоний бромида. Примерами растворителей являются кетоны, такие как ацетон или метилэтилкетон.
Для стадии Г типичной является температура приблизительно от 30°С приблизительно до 150°С, более типичной приблизительно от 60°С приблизительно до 80°С; и типичным является время реакции приблизительно от 3 часов приблизительно до 20 часов, более типичным приблизительно от 5 приблизительно до 10 часов. Значение рН для стадии Г типично в диапазоне приблизительно от 5 приблизительно до 11. Активатором для стадии Г является соединение, которое протонирует атом кислорода кетогруппы β-лактама; такие активаторы включают, например, мягкие (слабые) органические кислоты, такие как разветвленные или неразветвленные карбоновые кислоты, например 2-этилгексановую кислоту, уксусную кислоту, изобутановую кислоту и подобные. Если используется водно-спиртовой растворитель, активатор не нужен, примеры водно-спиртовых растворителей включают МеОН·Н2O, EtOH·Н2О и подобные. В случае использования активатора типичным растворителем является ТГФ, диоксан или диметоксиэтан. В случае использования активатора он используется в протонирующем количестве, которое обычно составляет приблизительно от 0,1 мольного эквивалента приблизительно до 2 мольных эквивалентов по отношению к соединению (V).
Для стадии Д типичной является температура приблизительно от -30°С приблизительно до 50°С, более типичной приблизительно от 0°С приблизительно до 25°С; и типичным является время реакции приблизительно от 10 минут приблизительно до 5 часов, более типичным приблизительно от 20 минут приблизительно до 1 часа. Значение рН для стадии Д не является критичным и может варьироваться в широком диапазоне. Для стадии растворитель не должен быть спиртовым. Формилирующий агент, которым может быть, например, НСО2Н/Ас2О, трифторэтилформиат и подобные, и присутствует в формилирующем количестве, которое составляет обычно приблизительно от 1 мольного эквивалента приблизительно до 2 мольных эквивалентов по отношению к соединению (VII). Типичным растворителем является EtOAc, изопропилацетат, трет-бутилацетат или ТГФ.
Для стадии Е типичной является температура приблизительно от 10°С приблизительно до 35°С, более типичной приблизительно от 20°С приблизительно до 22°С; и типичным является время реакции приблизительно от 60 минут приблизительно до 18 часов, более типичным приблизительно от 4 часов приблизительно до 8 часов. Значение рН для стадии типично приблизительно от 4 приблизительно до 8. Растворителем для стадии Е обычно является органический растворитель, то есть этилацетат, изопропилацетат, метиленхлорид и подобные. Окисляющим агентом может быть подходящий агент, известный из уровня техники, например, как описано в March, "Advanced Organic Chemistry", Chapter 19, 5th edition, Wiley Interscience, NY, включенном сюда в качестве ссылки. Типичные окисляющие агенты включают мочевину/пероксид водорода с фталевым ангидридом; монопероксифталат магния (ММРР); МСРВА, Охоnе (коммерческий продукт Aldrich), и подобные.
Если получение исходных соединений не описано отдельно, эти соединения являются известными из уровня техники, или могут быть получены аналогично методам, известным из уровня техники, или как это изложено в примерах, приведенных ниже.
Используются следующие сокращения (аббревиатуры):
Ас = ацетил
CDMT = хлородиметокситриазин
DIEA = диизопропилэтиламин
ДЦК = дициклогексилкарбодиимид
DMAP = диметиламинопиридин
ДМФА = диметилформамид
EDC1 = гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида
2-ЕНА = 2-этилгексановая кислота
EtOAc = этилацетат
EtOH = этанол
Fmoc = 9-флуоренилметил-оксикарбонил
ВЭЖХ = высокоэффективная жидкостная хроматография
МеОН = метанол
Моm = метоксиметиловый эфир
Mem = метоксиэтоксиметиловый эфир
NPEOC = 4-нитрофенэтилоксикарбонил
NPEOM = 4-нитрофенэтилоксиметилоксикарбонил
Nvom = нитровератрилоксиметиловый эфир
TBDMS = трет-бутилдиметилсилил,
TMSC1 = триметилсилил хлорид
комнатной температуре = комнатная температура
ТГФ = тетрагидрофуран
Следующие примеры иллюстрируют способ изобретения, но не должны рассматриваться как его ограничение.
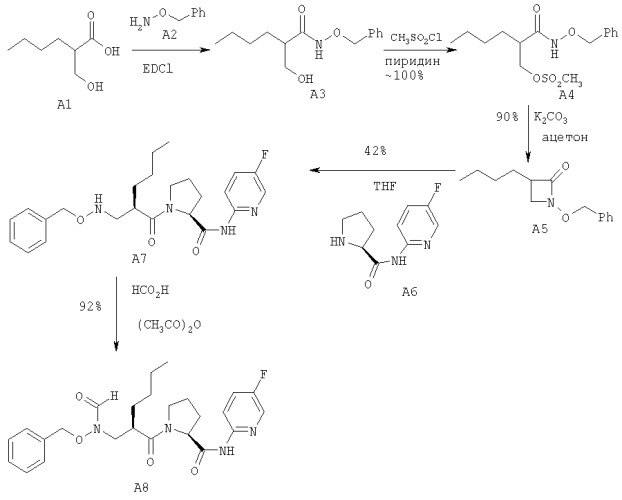
Реакционная схема I
Номера продуктов в следующих примерах относятся к реакционной схеме I, представленной выше.
Продукт A3
В колбу помещали 2,80 г (19,2 ммоль) А1, 80 мл ТГФ, 20 мл воды и 4,73 г (38,4 ммоль) А2. Полученный раствор перемешивали при комнатной температуре и значение рН раствора доводили до 4,2-4,5 добавлением 2 н. раствора НСl.
В течение 15 минут тремя порциями (2,12 г, 2,26 г, 1,14 г) добавляли 5,52 г (28,8 ммоль) EDCl. Полученный раствор перемешивали при комнатной температуре в течение 2 часов, в ходе реакции значение рН раствора поддерживали в районе 4,2-4,5. Контроль за ходом реакции осуществляли методом ВЭЖХ. После завершения реакции ТГФ упаривали при пониженном давлении, остаток экстрагировали этилацетатом 3×70 мл, объединенные органические фракции последовательно промывали 10% раствором лимонной кислоты 2×50 мл, 50 мл воды, 5% раствором бикарбоната натрия 2×50 мл и 50 мл насыщенного раствора хлорида натрия, затем высушивали над MgSO4. Упаривание органического растворителя привело к получению 2,4 г A3 (выход 94%).
Продукт А4
В колбу помещали 7,53 г (30 ммоль) A3 и 30 мл пиридина. Полученный раствор охлаждали до 0±2°С на соляно-ледяной бане. Затем медленно добавляли 2,78 мл (36 ммоль) метансульфонилхлорида, температуру поддерживали в районе 0±2°С в течение 1,5 часов. После завершения реакции по данным ВЭЖХ смесь выливали в 120 мл холодного 1 н. раствора НСl и экстрагировали этилацетатом 2×100 мл. Органич