Необратимые светочувствительные органические системы на основе производных хромона для фотоники
Иллюстрации
Показать всеИзобретение относится к новым светочувствительным органическим системам на основе хромонов, предназначенным для применения в различных фотоуправляемых устройствах фотоники. Описываются новые замещенные или незамещенные производные 2-фурил-3-ацетилхромонов, обладающие фотоиндуцированной флуоресценцией. Способ их получения заключается в том, что 2-гидроксиацетофенон или его соответствующее производное подвергают ацилированию хлорангидридом карбоновой кислоты с последующей обработкой продукта реакции трет-бутоксидом калия. Образующееся при этом производное β-дикетона подвергают кротоновой конденсации с альдегидом при пониженной температуре от (-)10 до 15°С и далее - окислению диоксидом селена. Описываются также светочувствительный полимерный материал с фотоиндуцированной флуоресценцией на основе указанных производных хромона, его получение и использование в светочувствительной регистрирующей среде для трехмерной архивной оптической памяти. Использование предложенных производных хромона в полимерном слое обеспечивает необратимое фотоуправление их люминесцентными свойствами и решает проблему несовпадения полос поглощения светочувствительных материалов с излучением полупроводниковых лазеров за счет батохромного сдвига полос поглощения светочувствительных материалов на 10-50 нм. 5 н. и 1 з.п. ф-лы, 2 ил., 2 табл.
Реферат
Настоящее изобретение относится к новым светочувствительным органическим системам на основе хромонов и методам их получения, предназначенным для применения в различных фотоуправляемых устройствах фотоники, в том числе в качестве новых регистрирующих сред для многослойных оптических дисков (ОД) и устройств трехмерной (3D) оптической памяти архивного типа сверхвысокой информационной емкости. Данное изобретение посвящено синтезу светочувствительных соединений и полимерных систем, также испытывающих необратимые фотохимические превращения с образованием фотопродуктов, отличающихся от исходных соединений фотоиндуцированной флуоресценцией, и касается, в частности, не описанных в литературе тиофеновых производных хромонов, способа их получения и светочувствительных полимерных материалов на их основе, способа получения этих полимерных материалов и применения. (2) Уровень техники
Анализ современного состояния разработки и применения носителей информации показывает, что в настоящее время на магнитных дисках и дискетах сохраняется и обрабатывается только 10% информации. Перспективы дальнейшего развития носителей информации связываются с совершенствованием ОД. Информационная емкость выпускаемых промышленностью однослойных ОД не удовлетворяет требованиям развивающейся информационной техники, поскольку она близка к насыщению. В связи с этим перспективы дальнейшего их совершенствования связываются с созданием многослойных ОД с информационной емкостью до 10 Тбайт, что обеспечит создание трехмерной побитовой оптической памяти архивного (WORM) и оперативного (WERM) типа при двухфотонном возбуждении фотохромных превращений.
В настоящее время несмотря на успехи разработки многослойных ОД на основе фотохромных регистрирующих сред для оперативной оптической памяти (Dvomikov A.S., Coggor I., Wang M., McCormick F.B., Esner S.C., Rentzepis P.M. Materials and systems for two photon 3D ROM Devices. IEE Transaction. Part A., vol.20, 203-212, 1997; Irea M., Diarylethenes for Memories and switches. Chem. Rew., vol.100, 1685-1716, 2000; Barachevsky V.A., Krayushkin M.M. Thermal Irreversible Organic Photochromes for Imaging Systems. Final program and Proceeding. 21st International Conference on Digital printing Technology. September 18-23, 2005. Baltimore. Maryland, USA, 2005, 24-27; Barachevsky V.A., Krayushkin M.M. Photochromic organic recording media for 3D optical memory. 2005 Beijing International Conference on Imaging: Technology & Applications for the 21st Century. Beijing, China, May 23-26, 2005, 30-31; Barachevsky V.A. Light-sensitive organic recording media for 3D optical memory. Final Program and Proceedings. ICIS′06. International Congress of Imaging Science. May 7-11, 2006, Rochester, New York, USA. 2006. p.435-438), наиболее востребованными являются 3D ОД для архивной (WORM) оптической памяти. К сожалению, разработке регистрирующих сред для этого типа оптической памяти уделяется неоправданно незначительное внимание.
К небольшому числу исследований в этом наравлении следует отнести разработку органических фотолюминесцентных слоев фирмой Constellation, США (C3D, White paper. Tech. Rep., Constellation 3D, 2000, http://www.c-3d.net/whitepaper.html), а также фирмы Call/Recall, США (Dvomikov A.S., Rentzepis P.M. Novel organic ROM materials for optical 3D memory devices. Opt. Commun., vol.136, 1-6, 1997; Dvomikov A.S., Taylor C.M., Liang Y.C., Rentzepis P.M. Photorearrangement mechanism of 1-nitro-naphthaldehyde and application to three-dimensional optical storage devices. J.Photochem. Photobiol. A.Chemistry, vol.112, 39-46, 1998).
Необратимые светочувствительные регистрирующие среды с фотоиндуцированной флуоресценцией разрабатывались на основе необратимых фотохимических реакций ароматических азидов, диариламина и тетрабромметана, а также галогенакридина, производных нафтаценхинонов. (Alfimov M.V., Nazarov V.B. Luminescent photography. Disp.Technol., vol.1, 119-140, 1986; Barachevsky V.A., Alfimov M.V., Nazarov V.B. Photoluminescent organic recording media Photoluminescent organic recording media. Proc. SPIE, vol.3468, 293-301, 1998; Barachevsky V.A., Alfimov M.V., Nazarov V.B. Light-sensitive organic recording media for luminescent readout of optical information. Opt. Memory Neur.Networks, vol.7, N 3, 205-212, 1998; Барачевский В.А., Алфимов М.В., Назаров В.Б. Органические регистрирующие среды с фотоиндуцированной люминесценцией. Ж. научн. и прикл. фотогр., т.44, №3, 66-74, 1999).
Указанные выше соединения и системы могут служить аналогами изобретения.
Известен также и принят за прототип патент США №3719571, от 1973 г., где описаны производные 2-фурил-3-ацетил хромонов общей формулы
где R - водород, гидрокси, алкилокси или фуроилокси группа, R1 - фурил, метокси, диметокси или триметоксифенил, R2 - алкил, карбонил, карбокси, гидрокси метил, бромметил и обладающих фотоиндуцированной флуоресценцией (J. Am. Chem. Soc.; 92; 1970; 599. 604 и James P.; Kraift, Grant A.; TELEAY; Tetrahedron Lett.; EN; 29; 1; 1988; 69-72).
Недостатками известных фотофлуоресцентных соединений и систем на их основе являются свойства, неприемлемые для создания фотофлуоресцентных ОД, а именно недостаточная светочувствительность при записи оптической информации лазерными источниками света, неудовлетворительная светостойкость при считывании оптической информации, несовпадение полос поглощения с излучением используемых полупроводниковых лазеров, недостаточная интенсивность флуоресценции.
(3) Цель изобретения
Задача настоящего изобретения состоит в создании новых светочувствительных хромоносодержащих систем с оптимальным сочетанием таких физико-химических свойств, как светочувствительность, устойчивость, интенсивность фотоиндуцированной флуоресценции, диапазоном поглощения волн и флуоресценции, сдвинутым в более длинноволновую область, а также испытывающих необратимые фотохимические превращения и обеспечивающих визуализацию фотопродуктов за счет фотоиндуцированного изменения их флуоресцентных свойств; в создании полимерных слоев для ОД на их основе, предназначенных для использования в побитовой нереверсивной трехмерной оптической памяти типа WORM.
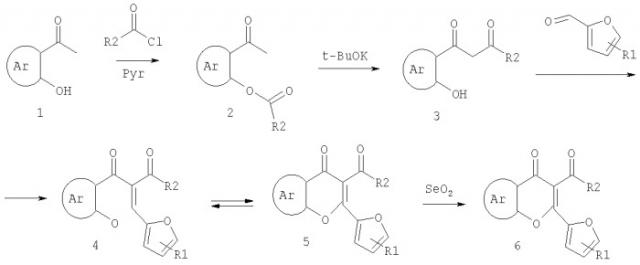
Поставленная цель достигается тем, что в качестве фоточувствительных молекул для получения необратимых светочувствительных регистрирующих сред используются следующие новые функциональные соединения из класса хромонов общей формулы:
Где R и Rl=H, и/или Alk, и/или Ph, и/или COOAlk, и/или N(Alk)2, и/или NO2 и/или OAlk,
а также способом их получения, заключающимся в том, что производные 2-ацетилфенолов подвергают ацилированию хлорангидридами карбоновых кислот с последующей обработкой продуктов реакции трет-бутоксидом калия и образующиеся при этом производные β-дикетонов подвергают кротоновой конденсации с альдегидами при пониженных температурах в интервале от -10 до 15°С с последующим окислением продуктов кротоновой конденсации диоксидом селена по следующей схеме:
Предлагаемый способ отличается проведением кротоновой конденсации при пониженных температурах, что позволяет синтезировать тиофеновые, бензотиофеновые, бензоимидазольные, бензооксазольные, бензотиозольные, индольные производные 2-фурил-3-ацетил хромонов, которые невозможно получить или получающиеся с низкими выходами в условиях кипячения, а также нафталиновые производные с высокими выходами.
Предлагаемые соединения обладают фотоиндуцированной флуоресценцией, могут быть использованы для создания светочувствительных полимерных материалов с фотоиндуцированной флуоресценцией.
Способ получения такого полимерного материала заключается в том, что хлороформный раствор предлагаемых производных хромонов и полимера, например, в массовых отношениях 1:4 соответственно наносят, например на лавсанововую пленку, выдерживают в закрытом состоянии в темноте в течение 20-24 часов и в открытом состоянии до полного высыхания полученной пленки.
Сущность изобретения иллюстрируется примерами, фиг.1 и 2 и таблицами 1 и 2
Пример 1.
3-(Тиофен-2-карбонил)-2-(фуран-2-ил)-4Н-хромен-4-он (6а) синтезирован следующим методом.
Синтез 2-Ацетилфенилтиофен-2-карбоксилата (2а).
К 0,025 моль о-гидроксиацетофенона добавляют 5 мл свежеперегнанного осушенного пиридина при охлаждении проточной водой. Затем по каплям при температуре <25°С добавляют 0,03 моль хлорангидрида тиофен карбоновой кислотыкислоты. После окончания прибавления смесь оставляют на 40 минут, после чего выливют в 3%-ный охлажденный раствор соляной кислоты. Выпавший осадок отфильтровывают, высушивают и перекристаллизовывают из этанола.
Выход 86%. Т.пл. 114°С. Спетр ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 8,05 д (1Н, J=3,24); 7,87 м (1Н); 7,70 д (1Н, J=4,51); 7,60 м (1Н); 7,38 м (1Н); 7,17-7,20 м (2Н); 2,59 с (3Н). Масс спектр: 246. Найдено, %: С 63.50; Н 3.98; S 13.13. Вычислено, %: С 63.40; Н 4.09; S 13.02.
Синтез 1-(2-Гидроксифенил)-3-(тиофен-2-ил)пропан-1,3-диона (3а)
Раствор 2а (0,0125 моль) в 10 мл ДМФА добавляют в атмосфере аргона в течение 10 минут к раствору 2,8 г t-BuOK в ДМФА при комнатной температуре. Смесь выдерживают в течение часа, затем выливают в охлажденный льдом 3%-ный раствор соляной кислоты, выпавший продукт отфильтровывают, высушивают на воздухе. Продукт перекристаллизовают из этанола или метанола. Выход 67%. Т.пл. 90-92°С. Спектр ЯМР Н (CDCl3), δ, м.д. (J, Гц): 11,30 с (1Н); 11,00 с (1Н); 7,80-8,10 м (3Н); 7,50 м (1Н); 7,3 м (1Н); 6,90-7,00 м (2Н) 4,80 с (1Н). Масс спектр: 246. Найдено, %: С 63.50; Н 4.02; S 13.13. Вычислено, %: С 63.40; Н 4.09; S 13.02
Синтез 1-(2-Гидроксифенил)-3-(тиофен-2-ил)2-(фуран-2-илметилен)-пропан-1,3-дион (4а).
Раствор 0,005 моль, 3а 0,0055 моль фурфурола и каплю пиперидина в 15 мл этанола мешают при охлаждении -(10-15)°С в течение 6 часов. при этом в начале нерастворяющийся дикетон медленно переходит в раствор. В конце реакции выпавший продукт отфильтровывают, промывают ледяным этанолом, перекристаллизовывают из этанола или метанола и высушивают на воздухе. Выход 48%. Т.пл. 128-130°С. Спектр ЯМР Н1 (DMSO-d6), δ, м.д. (J, Гц): 8,23 д (1Н, J=3,69); 8,06 м (1Н); 7,82 д (1Н, J=7,08); 7,66 м (2Н); 7,29 м (1Н); 7,15 м (2Н); 6,59 (1H, J=3,19); 6,40 м (1Н); 5,97 д (1Н, J=11,79); 5,73 д (1Н, J=8,76). Масс спектр: 324. Найдено, %: С 66.52; Н 3.64; S 10.04. Вычислено, %: С 66.65; Н 3.73; S 9.89
Синтез 3-(Тиофен-2-карбонил)-2-(фуран-2-ил)-4Н-хромен-4-она (6а)
Смесь 0,001 моль продукта альдольной конденсации 4а, 220 мг диоксида селена и 10 мл диоксана кипятят в течение 2 часов (т.с.х. контроль) до исчезновения исходного продукта. Растворитель отгоняют на роторном испарителе, остаток растворяют в хлористом метилене, фильтруют от металлического селена и непрореагировавшего диоксида селена и пропускают через слой силикагеля. Полученный прозрачный светлый раствор упаривают на роторном испарителе. Остаток отмывают этанолом. Выход: 67%. Т.пл. 217-218°С. Спектр ЯМР Н1 (DMSO-d6), δ, м.д. (J, Гц): 8,06 м (2Н); 7,90 м (2Н); 7,80 м (2Н); 7,56 м (1Н); 7,35 м (1Н); 7,17 м (1Н); 6,25 м (1Н). Масс спектр: М 322, 309, 294. Найдено, %: С 67.19; Н 3.00; S 10.02. Вычислено, %: С 67.07; Н 3.13; S 9.95.
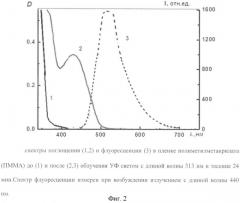
Полученное соединение 6а растворяли в толуоле фирмы «Aldrich». Концентрация соединения 6а в растворе составляла С=2·10-4 М. Для измерения использовалась кварцевая кювета толщиной 0,2 см. Спектрофотометрические измерения (фотостационарные спектры поглощения) проводились с использованием волоконно-оптического спектрометра «USB2000» фирмы «Ocean Optics». Спектры флуоресценции снимались на спектрофлуориметре «CARY ECLIPSE» (Varian). Облучение растворов осуществлялось фильтрованным светом лампы ДРШ-250. Результаты спектрофотометрических и флуоресцентных исследований представлены на фиг.1 и 2, а также в таблице 1. Анализ полученных результатов показывает, что первоначально бесцветное (полоса поглощения с максимумом при 306 нм) соединение 6а под действием УФ-излучения испытывает необратимое фотохимическое превращение с образованием окрашенного фотопродукта, поглощающего в видимой области спектра с максимумом при 370 и 440 нм и обладающего флуоресценцией (фиг.1). Это соединение после облучения не возвращается в исходную бесцветную форму. Следовательно, полученное соединение является светочувствительным и обеспечивает получение необратимого флуоресцирующего фотопродукта.
Пример 2.
6-Метил-3-(тиофен-2-карбонил)-2-(фуран-2-ил)-4Н-хромен-4-он синтезирован следующим методом.
2-Ацетил-4-метилфенил тиофен-2-карбоксилата (2b).
Получен аналогично соединению 2а. Выход 84%. Т.пл. 90-91°С. ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 8,0 д (1Н, J=3,58); 7,67 м (2Н); 7,37 м (1Н); 7,1-7,2 м (2Н); 2,55 с (3Н); 2.42 с (3Н). Масс спектр: 260. Найдено, %: С 64.50; Н 4.58; S; 12.45. Вычислено, %: С 64.60; Н 4.65; S; 12.32
Синтез 1-(2-Гидрокси-5-метилфенил)-3-(тиофен-2-ил)пропан-1,3-диона (3b)
Получен аналогично соединению 3а_. Выход 57,5%. Т.пл. 84-86°С. Спектр ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 15,75 с (1Н); 11,70 с (1Н); 7,80 м (1Н); 7,50-7,60 м (2Н); 7,20-7,35 м (2Н); 6,90 д (1Н, J-8,47); 6,70 м (1Н); 4,45 с (1Н); 2.36 с (3Н). Масс спектр: 260. Найдено, %: С 64.45; Н 4.57; S; 12.47. Вычислено, %: С 64.60; Н 4.65; S; 12.32
Синтез 1-(2-Гидрокси-5-метилфенил)-3-(тиофен-2-ил)-2-((фуран-2-ил)метилен)-пропан-1,3-диона (4b)
Получен аналогично соединению 4а_. Выход 82%. Т.пл. 150-152°С. Спектр ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 17,3 с (1Н); 7,70 с (1Н); 7,60 д (1Н, J=4,85); 7,48 с (1Н); 7,22 д (2Н, J=3,88); 7,10 м (1Н); 6,80 д (1Н, J=7,35); 6,60 с (1Н); 6,34 д (1Н, J=3,06); 6,25 д (1Н, J=1,53); 2,30 с (3Н).. Масс спектр: 338. Найдено, %: С 67.60; Н 4.27; S 9.40. Вычислено, %: С 67.44; Н 4.17; S 9.48.
Синтез 6-Метил-3-(тиофен-2-карбонил)-2-(фуран-2-ил)-4Н-хромен-4-она (6b)
Получен аналогично соединению 6а. Выход: 83%. Т.пл. 187°С. Спектр ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 8,00 с (1Н); 7,69 м (1Н); 7,60 м (1Н); 7,53 д (1Н, J=2,00); 7,49 м (2Н); 7,18 д (1Н, J=3,57); 7,03 м (1Н); 6,53 м (1Н); 2,45 с (3Н). Масс спектр: М336, 308, 282. Найдено, %: С 67.73; Н 3.75; S 9.52. Вычислено, %: С 67.85; Н 3.60; S 9.53 Спектрально-кинетические характеристики (табл.1), измеренные методом, описанным в примере 1, для раствора соединения 6b, приготовленного по методике, представленной в примере 1, свидетельствуют о том, что полученное соединение является светочувствительным и обеспечивает получение необратимого флуоресцирующего фотопродукта.
Пример 3
3-(5-Метилтиофен-2-карбонил)-2-(фуран-2-ил)-4Н-хромен-4-он синтезирован следующим методом.
Синтез 2-Ацетилфенил 5-метилтиофен-2карбоксилата (2с)
Получен аналогично соединению 2а Выход 86%. Т.пл. 106-107°С. ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 7,94 д. (1Н, J=9.25); 7.85 д. (1Н, J=3.75); 7,68 м. (1Н); 7,35 д (1Н, J=8,07); 7,45 м (1Н); 7,04 д (1Н, J=3,74); 3.39 с (3Н); 2.60 v (3Н). Масс спектр: 260. Найдено, %: С 64.78; Н 4.58; S 12.37. Вычислено, %: С 64.60; Н 4.65; S 12.32.
Синтез 1-(2-Гидроксифенил)-3-(5-метилтиофен-2-ил)-пропан-1,3-диона (3с)
Получен аналогично соединению 3а. Выход 52%. Т.пл. 81°С. Спектр ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 11,35 с (1Н); 10,93 с (1H); 7,85 м (2Н); 7,45 м (1Н); 6,99 м (3Н); 4,60 с(1Н); 2,5 с(3Н). Масс спектр: 260. Найдено, %: С 64.75; Н 4.61; S 12.26. Вычислено, %: С 64.60; Н 4.65; S 12.32.
Синтез 1-(2-Гидроксифенил)-2-((фуран-2ил)-метилен)-3-(5-метилтиофен-2-ил)-пропан-1,3-диона (4с).
Получен аналогично соединению 4а. Выход 84%. Т.пл. 148-149°С. Спектр ЯМР H1 (CDCl3), δ, м.д. (J, Гц): 17,3 с (1H); 7,90 д (1H, J-8,0); 7,35-7,45 м (2Н); 7,05 м (2Н); 6,90 м (1H); 6,75 д (1H, J=3,5); 6,62 с (1H); 6,30 д (1H); 2,52 с (3Н) Масс спектр: 338. Найдено, %: С 67.31; Н 4.10; S 9.59. Вычислено, %: С 67.44; Н 4.17; S 9.48.
Синтез 3-(5-Метилтиофен-2-карбонил)-2-(фуран-2-ил)-4Н-хромен-4-она (6с)
Получен аналогично соединению 6а. Выход: 56%. Т.пл. 178-180°С. Спектр ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 8,22 м (1H); 7,75 м (1H); 7,52 м (2Н); 7,45 м (2Н); 7,16 д (1H, J-3,6); 6,75 д (1H, J=3,69); 6,54 м (1H); 2,52 с (3Н). Масс спектр: М 336, 308, 299, 293, 291, 282. Найдено, %: С 67.99; Н 3.50; S 9.39. Вычислено, %: С 67.85; Н 3.60; S 9.53,
Спектрально-кинетические характеристики (табл.1), измеренные методом, описанным в примере 1, для раствора соединения 6 с, приготовленного по методике, представленной в примере 1, свидетельствуют о том, что полученное соединение является светочувствительным и обеспечивает получение необратимого флуоресцирующего фотопродукта.
Пример 4.
6-Метил-3-(5-метилтиофен-2-карбонил)-2-(фуран-2-ил)-4Н-хромен-4-он синтезирован следующим методом.
Синтез 2-Ацетил-4-метилфенил 5-метил-тиофен-2-карбоксилата (2d)
Получен аналогично соединению 2а. Выход 80%. Т.пл. 72°С. ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 7,80 д (1Н, J=3,72); 7,63 д (1H, J=1,72); 7,35 м (1Н); 7,12 д (1Н, J=8,25); 6,85 д (1Н, J-0,65); 2,61 с (3Н); 2.56 с (3Н); 2,40 с (3Н). Масс спектр: 274. Найдено, %: С 65.82; Н 5.07; S 11.78. Вычислено, %: С 65.67; Н 5.14; S 11.69.
Синтез 1-(2-Гидрокси-5-метилфенил)-3-(5-метилтиофен-2-ил)-пропан-1,3-диона (3d)
Получен аналогично соединению 3а. Выход 63%. Т.пл. 115-117°С. Спектр ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 15,8 с (1Н); 11,8 с (1Н); 7,7 м (1H); 7,3 м (1Н); 6,9 м (2Н); 6,6 м (1 Н); 4,5 с (1Н); 2,6 с (3Н); 2,4 с (3Н). Масс спектр: 274. Найдено, %: С 65.55; Н 5.10; S 11.85. Вычислено, %:С 65.67; Н 5.14; S 11.69.
Синтез 1-(2-Гидрокси-5-метилфенил)-2-((фуран-2ил)-метилен)-3-(5-метилтиофен-2-ил)-пропан-1,3-диона (4d)
Получен аналогично соединению 4а. Выход 67%. Т.пл. 146-147°С. Спектр ЯМР H1 (DMSO-d6), δ, м.д. (J, Гц): 17,40 с (1H); 7,70 м (1H); 7,35 м (1H); 6,7-7,3 м (Н,); 6,46 д (1H J=3.21); 6,26 д (1Н)2.56 с(3Н) 2,31 с (3Н). Масс спектр: 352 Найдено, %: С 68.08; Н 4.50; S 9.28. Вычислено, %: С 68.17; Н 4.58; S 9.10.
Синтез 6-Метил-3-(5-метилтиофен-2-карбонил)-2-(фуран-2-ил)-4Н-хромен-4-она (6d)
Получен аналогично соединению 6а. Выход: 59%. Т.пл. 174-175°С. Спектр ЯМР Н1 (CDCl3), δ м.д. (J, Гц): 8,00 с (1H); 7,43-7,55 м (4Н); 7,15 д (1H, J=3,58); 6,73 д (1H, J=3,55); 6,53 м (1H); 2,55 с (3Н); 2,45 с (3Н). Масс спектр: М 350, 322, 305, 296. Найдено, %: С 68.45; Н 4.16; S 9.33. Вычислено, %: С 68.56; Н 4.03; S 9.15.
Спектрально-кинетические характеристики (табл.1), измеренные методом, описанным в примере 1, для раствора соединения 6d, приготовленного по методике, представленной в примере 1, свидетельствуют о том, что полученное соединение является светочувствительным и обеспечивает получение необратимого флуоресцирующего фотопродукта.
Пример 5.
2-(5-Метилфуран-2-ил)-3-(тиофен-2-карбонил)-4Н-хромен-4-он синтезирован следующим методом.
Синтез 2-(5-Метилфуран-2-ил)-3-(тиофен-2-карбонил)хроман-4-она (5е)
Получен аналогично соединению 4а. Выход 43%. Т.пл. 122-124°С. Спектр ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 8,5.8,00 м (3Н); 7,00-7,30 м (3Н); 6,35 м (1Н); 5,58-6,00 м (2Н); 5,10 д (1H, J=3,3); 2,3 с (3Н). Масс спектр: 338. Найдено, %: С 67.40; Н 4.12; S 9.65
Вычислено, %: С 67.44; H 4.17; S 9.48.
Синтез 2-(5-Метилфуран-2-ил)-3-(тиофен-2-карбонил)-4Н-хромен-4-она (6е)
Получен аналогично соединению 6а. Выход: 70%. Т.пл. 192-193°С. Спектр ЯМР Н1 (CDCl3), δ, м.д. (J, Гц): 8,22 д (1Н, J=7,87); 7,66-7,77 м (2Н); 7,40-7,60 м (3Н); 7,08 м (2Н); 6,13 д (1Н, J=2,93); 2,20 с (3Н). Масс спектр: 336. Найдено, %: С 67.75; Н 3.50; S 9.70. Вычислено, %: С 67.85; Н 3.60; S 9.53
Спектрально-кинетические характеристики (табл.1), измеренные методом, описанным в примере 1, для раствора соединения 6е, приготовленного по методике, представленной в примере 1, свидетельствуют о том, что полученное соединение является светочувствительным и обеспечивает получение необратимого флуоресцирующего фотопродукта.
Пример 6.
3-(5-метилтиофен-2-карбонил)-2-(5-метилфуран-2-ил)-4Н-хромен-4-он (6f) синтезирован следующим методом.
Синтез 3-(5-метилтиофен-2-карбонил)-2-(5-метилфуран-2-ил)-4Н-хромен-4-она (6f)
Получен аналогично соединению 6а. Выход: 67%. Т.пл. 190-192°С. Спектр ЯМР Н (CDCl3), δ, м.д. (J, Гц): 8,22 д (1Н, J=7,9); 7,72 м (1Н); 7,53 д (1Н, J=8,4); 7,40-7,45 м (2Н); 7,07 д (1Н, J=3,4); 6,73 д (1Н, J=3,7); 6,13 д (1Н, J=7,3); 2,53 с (3Н); 2,42 с (3Н). Масс спектр: 350. Найдено, %: С 68.45; Н 3.90; S 9.28. Вычислено, %: С 68.56; Н 4.03; S 9.15
Спектрально-кинетические характеристики, измеренные методом, описанным в примере 1, для раствора соединения 6f, приготовленного по методике, представленной в примере 1, свидетельствуют о том, что полученное соединение является светочувствительным и обеспечивает получение необратимого флуоресцирующего фотопродукта.
Аналогично были получены хромоны формулы, где R2 является остатком нафталина, бензимидазола, бензоксазола, бензтиазола и индола, a R и R1 означают COOAlk, и/или N(Alk)2, и/или NO2, и/или Oalk с выходом 65-70%, которые также обладают высокой интенсивностью флуоресценции.
Пример 7.
С использованием соединение 6а был изготовлен полимерный светочувствительный материал в виде пленки на основе ПММА. Пленка готовилась следующим образом. Соединение 6а в количестве 0,25 мас.% от веса сухого полимера вместе с полимером растворяли в хлороформе. Полученный вязкий раствор выливали в кювету, изготовленную из лавсановой пленки, закрывали раствор лавсановой пленкой и оставляли в темном месте на сутки. Через сутки кювету открывали и оставляли в открытом виде в темном месте до полного высыхания пленки. После высыхания полимерные пленки изымались из лавсановой кюветы.
Спектрофотометрические и флуоресцентные измерения, а также фотовозбужднение полученной полимерной пленки проводились по методикам, изложенным в примере 1. В результате проведенных измерений оказалось, что для полученной пленки наблюдаются фотоиндуцированные спектральные измерения (фиг.2, табл.2), подобные тем, которые измерены для растворов этого соединении (табл.1). Основным отличием является резкое увеличение интенсивности фотоиндуцированной флуоресценции. Результаты измерений свидетельствуют о том, что материал, полученный на основе ПММА и соединения 6а, является светочувствительным и проявляет необратимую фотоиндуцированную флуоресценцию.
Пример 8
Изготовлен полимерный светочувствительный материал по методу, изложенному в примере 7, отличающийся тем, что в качестве полимерного связующего использован поливинилбутираль (ПВБ), а растворителем служил метоксипропанол. Результаты спектрально-кинетических и флуоресцентных измерений (табл.2) свидетельствуют о том, что материал, полученный на основе ПВБ и соединения 6а, является светочувствительным и проявляет необратимую фотоиндуцированную флуоресценцию.
Пример 9.
Изготовлен полимерный светочувствительный материал по методу, изложенному в примере 7, отличающийся тем, что в качестве полимерного связующего использован полистирол (ПС). Результаты спектрально-кинетических и флуоресцентных измерений (табл.2) свидетельствуют о том, что материал, полученный на основе ПС и соединения 6а, является светочувствительным и проявляет необратимую фотоиндуцированную флуоресценцию.
Пример 10.
Изготовлен полимерный светочувствительный материал по методу, изложенному в примере 7, отличающийся тем, что в качестве полимерного связующего использован поликарбонат (ПК). Результаты спектрально-кинетических и флуоресцентных измерений (табл.2) свидетельствуют о том, что материал, полученный на основе ПК и соединения 6а, является светочувствительным и проявляет необратимую фотоиндуцированную флуоресценцию.
Пример 11.
Изготовлен полимерный светочувствительный материал по методу, изложенному в примере 7, отличающийся тем, что в качестве полимерного связующего использован ацетобутират целлюлозы (АБЦ). Результаты спектрально-кинетических и флуоресцентных измерений (табл.2) свидетельствуют о том, что материал, полученный на основе АБЦ и соединения 6а, является светочувствительным и проявляет необратимую фотоиндуцированную флуоресценцию.
Пример 12.
Изготовлен полимерный светочувствительный материал по методу, изложенному в примере 7, отличающийся тем, что в качестве светочувствительного соединения использовалось соединение 6b. Результаты спектрально-кинетических и флуоресцентных измерений (табл.2) свидетельствуют о том, что материал, полученный на основе ПММА и соединения 6b, является светочувствительным и проявляет необратимую фотоиндуцированную флуоресценцию.
Таким образом, представленные в заявке соединения, не обладающие флуоресценцией в исходном состоянии, испытывают необратимые превращения под действием УФ-облучения с образованием устойчивых к фотодеградации флуорофоров. Включение хромоновых фрагментов в полимерную цепь позволяет усовершенствовать разработанные регистрирующие среды за счет увеличения концентрации фоточувствительных молекул в полимерной среде и резкого снижения их диффузионного перемещения. Результатом такого усовершенствования является значительное повышение информационной емкости регистрирующих сред на их основе.
Новизна заявленных признаков состоит в использовании в качестве светочувствительных материалов новых модифицированных молекул соединений класса хромонов как в растворенном, так и в химически связанном виде в полимерной матрице. Использование этих соединений в полимерном слое обеспечивает необратимое фотоуправление его люминесцентными свойствами за счет необратимых фотопревращений светочувствительных соединений. Введение хромоновых молекул в полимерную матрицу позволяет в несколько десятков раз улучшить люминесцентные свойства по сравнению со свойствами, проявляемыми в растворах. Использование тиофеновых, бензотиофеновых, бензотиазольных, бензооксазольных и безоимидазольных производных 2-фурил-3-ацетил-хромонов 6a-f позволяет решить проблему несовпадения полос поглощения светочувствительных материалов с излучением используемых полупроводниковых лазеров за счет батохромного сдвига полос поглощения светочувствительных материалов на 10-50 нм.
| Таблица 1.Спектрально-кинетические характеристики фотопревращений хромонов в толуоле. | ||||||||
| Соединение | R | R1 | R2 | λА макс, нм | λВ макс, нм | λВ фл,макс нм | Iфл В, отн. ед. | Выход соединения, % |
| Новые соединения | ||||||||
| 6а | Н | Н | Тиофен-2-ил | 306 | 370, 440 | 498, 520 | 40** | 67 |
| 6b | Me | Н | Тиофен-2-ил | 313 | 375, 440 | 500, 532 | 130** | 83 |
| 6с | Н | Н | 5-Метил-тиофен-2-ил | 307 | 380, 445 | 504, 536 | 100** | 56 |
| 6d | Me | Н | 5-Метил-тиофен-2-ил | 311 | 380, 450 | 506, 533 | 25** | 59 |
| 6е | Н | Me | Тиофен-2-ил | 327 | 372, 435 | 520 | 450 | 70 |
| 6f | Н | Me | 5-Метил-тиофен-2-ил | 310 | 445 | 530 | 533 | 67 |
| Известные соединения (Пат. США №3719571; JACS, 92, 1970, 599-604) | ||||||||
| 6i | Н | Н | 2-Фурил | 315 | 370, 425 | 505 | 672 | 70 |
| 6g | Н | Н | Ph | 317 | 353, 410 | 490 | 100 | 80 |
| Примечание: λА макс, λВ макс - максимумы полос поглощения исходных хромонов и фотоиндуцированой формы хромонов; λВ фл, макс - максимум полосы флуоресценции фотоиндуцированной формы. |
| Таблица 2.Спектрально-кинетические характеристики фотопревращений хромонов в полимерных матрицах. | |||||
| Соединение | Полимер | λА макс, нм | λВ макс, нм | λВ фл,макс нм | Iфл В, отн. ед. |
| 6а | ПК | 310 | 350-500 | 520 | 175 |
| ПС | 300-350 | 350-500 | 530 | 350 | |
| АБЦ | 300 | 350-490 | 520 | 35 | |
| ПВБ | 310 | 445 | 525 | 450 | |
| ПММА | 310-440 | 430 | 525 | >2000 | |
| 6b | ПММА | 270,315 | 380,440 | 530 | >1000 |
| ПК - поликарбонатПС - полистеролАБЦ - ацетобутират целлюлозыПВБ - поливинилбутиральПММА - полиметилметакрилат |
1. Замещенные или незамещенные производные 2-фурил-3-ацетилхромонов общей формулы Ar = R2 = где R и R1 = Н, Alk, Ph, COOAlk, N(Alk)2, NO2 или OAlk.
2. Соединения по п.1, обладающие фотоиндуцированной флуоресценцией.
3. Способ получения соединений по п.1 или 2, заключающийся в том, что 2-гидроксиацетофенон или его соответствующее производное подвергают ацилированию хлорангидридом карбоновой кислоты с последующей обработкой продукта реакции трет-бутоксидом калия, и образующееся при этом производное β-дикетона подвергают кротоновой конденсации с альдегидом при пониженной температуре в интервале от (-)10 до 15°С с последующим окислением продукта кротоновой конденсации диоксидом селена.
4. Светочувствительный полимерный материал с фотоиндуцированной флуоресценцией, представляющий собой раствор соединения по п.1 или 2 и полимера, нанесенный на подложку.
5. Способ получения светочувствительного полимерного материала с фотоиндуцированной флуоресценцией по п.4, заключающийся в том, что хлороформный раствор производного хромона по п.1 или 2 и полимера в массовом отношении 1:4 наносят на подложку, выдерживают в закрытом состоянии в темноте в течение 20-24 ч и в открытом состоянии до полного высыхания полученной пленки.
6. Светочувствительная регистрирующая среда для трехмерной архивной оптической памяти, включающая в качестве светочувствительного элемента полимерный материал с фотоиндуцированной флуоресценцией по п.4.