Нитрооксипроизводные лозартана, валсартана, кандесартана, телмисартана, эпросартана и олмесартана в качестве блокаторов рецепторов ангиотензина ii для лечения сердечно-сосудистых заболеваний
Иллюстрации
Показать всеНастоящее изобретение относится к новым нитропроизводным блокаторов рецепторов ангиотензина II формулы (значения радикалов R, Y и s приведены в формуле изобретения), обладающим широким фармакологическим действием и высокой переносимостью. Новые соединения могут использоваться для лечения сердечно-сосудистых заболеваний, заболеваний почек, хронических заболеваний печени и воспалительных процессов. 1 н. и 5 з.п. ф-лы, 6 табл.
Реферат
Настоящее изобретение относится к производным блокаторов рецепторов ангиотензина II (ARB). Более конкретно, настоящее изобретение относится к нитропроизводным ARB, содержащим их фармацевтическим композициям и их использованию для лечения сердечно-сосудистых заболеваний, заболеваний почек и хронических заболеваний печени, воспалительных процессов и метаболических синдромов.
Под блокаторами рецептора ангиотензина II подразумевают класс соединений, включающий, в качестве основных компонентов, лозартан, ЕХР3174, кандесартан, телмисартан, валсартан, эпросартан, ирбесартан и олмесартан.
ARB апробированы только для лечения гипертензии, при этом антигипертензивное действие обусловлено, главным образом, селективной блокадой AT1 рецепторов и последующим уменьшением прессорного эффекта ангиотензина II. Ангиотензин II стимулирует синтез и секрецию альдостерона и вызывает повышение кровяного давления из-за мощного направленного сосудосуживающего действия.
В настоящее время сообщалось, что блокаторы рецепторов ангиотензина II обладают такими побочными эффектами, как, например артериальная гипотензия, гиперкалиемия, миалгия, нарушение деятельности дыхательных путей, заболевания почек, боль в пояснице, заболевания желудочно-кишечного тракта, утомление и нейтропения (Martindale, 33 издание, стр.921).
Целью настоящего изобретения является обеспечение новых производных ARB, способных не только устранить или, по крайней мере, уменьшить побочные эффекты, характерные для их родоначального соединения, но также обладающих улучшенным фармакологическим действием. Неожиданно было обнаружено, что общий профиль нитропроизводных блокаторов рецепторов ангиотензина II значительно лучше, по сравнению с природными соединениями с точки зрения более широкого фармакологического действия и лучшей переносимости.
В частности, было обнаружено, что нитропроизводные блокаторов рецепторов ангиотензина II по настоящему изобретению демонстрируют сильное противовоспалительное, антитромботическое и антитромбоцитарное действие и, кроме того, могут быть использованы для лечения или профилактики сердечной недостаточности, инфаркта миокарда, ишемического инсульта, атеросклероза, внутриглазной и легочной гипертензии, артериальной гипертензии, диабетической нефропатии, заболеваний периферических сосудов, дисфункции и гипертрофии левого желудочка, фиброза печени, портальной гипертензии и метаболических синдромов.
Объектом настоящего изобретения являются нитропроизводные блокаторов рецепторов ангиотензина II общей формулы (I) и их фармацевтически приемлемые соли или стереоизомеры:
где
s равно 1 или 2;
R выбирают из следующих остатков блокаторов рецептора ангиотензина II формулы (II) или (III):
где
R0 представляет
или -N0, где -N0 представляет собой способную к связыванию с Y группу, имеющую одно из следующих значений:
-СОО-, -О-, -CONH-, -ОСО-, -ОСОО- или
где R' и R'' одинаковые или разные и представляют собой Н или прямой или разветвленный C1-C4 алкил;
R1 выбирают из группы, состоящей из
где m целое число, равное 0 или 1, и N0 как указано выше;
где N1 имеет значения, указанные для N0 или равно -СООН;
при условии, что по крайней мере одна из групп N1 равна -СОО- или -CONH-, то есть это группа, способная связываться с Y;
Y представляет собой двухвалентный радикал, имеющий следующие значения:
a)
- прямой или разветвленный C1-С20 алкилен, преимущественно С1-С10, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей из атомов галогена, гидрокси, -ONO2 или Т0, где Т0 представляет -CO(O)(С1-С10алкил)-ONO2 или -O(С1-С10алкил)-ONO2;
- циклоалкилен с 5-7 атомами углерода в циклоалкиленовом кольце, необязательно замещенный боковой цепью Т, где Т представляет прямой или разветвленный алкил с 1-10 атомами углерода, преимущественно СН3;
b)
c)
где n представляет целое число от 0 до 20, и n1 представляет целое число от 0 до 20;
d)
где
n1 как указано выше и n2 представляет целое число от 0 до 2;
X1=-ОСО- или -СОО- и R2 представляет собой Н или СН3;
е)
где
n1, n2, R2 и X1 как указано;
Y1 представляет собой -CH2-СН2- или -СН=СН-(СН2)n 2-;
f)
где
n1 и R2 как указано выше, R3 представляет собой Н или -СОСН3;
при условии, что когда Y выбирают их двухвалентных радикалов, указанных под b)-f), группа -ONO2 связана с группой -(СН2)n 1;
g)
где Х2 представляет -О- или -S-, n3 представляет целое число от 1 до 6, преимущественно от 1 до 4, R2 как указано выше;
h)
где
n4 целое число от 0 до 10;
n5 целое число от 0 до 10;
R4, R5, R6, R7 одинаковые или разные и представляют собой Н или прямой или разветвленный C1-C4 алкил, преимущественно R4, R5, R6, R7 представляют Н;
где группа -ONO- связана с
где n5 как указано выше;
Y2 означает гетероциклическое насыщенное, ненасыщенное или ароматическое 5-6 членное кольцо, содержащее один или более гетероатомов, выбранных из азота, кислорода, серы, и выбрано из
, , , , ,
, , , , ,
, ,
Используемый термин «С1-С20алкилен» означает прямую или разветвленную углеводородную цепь C1-C20, преимущественно содержащую от 1 до 10 атомов углерода, такую как метилен, этилен, пропилен, изопропилен, н-бутилен, пентилен, н-гексилен и тому подобное.
Используемый термин «C1-С10 алкил» означает прямые или разветвленные алкильные группы, содержащие от одного до десяти атомов углерода, включая метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил, гексил, октил и тому подобное.
Используемый термин «циклоалкилен» означает кольцо, имеющее от 5 до 7 атомов углерода, включая, но не ограничиваясь этим, циклопентилен, циклогексилен, необязательно замещенные боковыми цепями, такими как прямой или разветвленный (С1-С10)-алкил, преимущественно СН3.
Используемый термин «гетероциклил» означает насыщенное, ненасыщенное или ароматическое 5- или 6-членное кольцо, содержащее один или более гетероатомов, выбранных из азота, кислорода, серы, такое как например пиридин, пиразин, пиримидин, пирролидин, морфолин, имидазол и тому подобное.
Другим объектом настоящего изобретения является применение соединений формулы (I) в комбинации, по крайней мере, с соединением, используемым для лечения сердечно-сосудистых заболеваний, выбранным из группы, включающей ингибиторы АТФ, ингибиторы HMG-CoA редуктазы, бета-адренергические блокаторы, блокаторы кальциевых каналов, диуретики, антитромботические агенты, такой как аспирин, нитрозированные ингибиторы АТФ, нитрозированные ингибиторы HMG-CoA редуктазы, нитрозированные бета-адренергические блокаторы, нитрозированный аспирин и нитрозированные диуретики.
Подходящие ингибиторы АТФ, ингибиторы HMG-CoA редуктазы, бета-адренергические блокаторы, блокаторы кальциевых каналов, антитромботические агенты и диуретики описаны в литературе, например, The Merck Index (13th edition).
Подходящие нитрозированные соединения описаны в WO 98/21193, WO 97/16405 и WO 98/09948.
Указанные выше соединения могут назначаться одновременно или последовательно.
Настоящее изобретение также относиться к фармацевтическим наборам, включающим один или более контейнеров, заполненных одним или более соединениями и/или композициями настоящего изобретения и одним или более соединениями, используемыми для лечения указанных выше сердечно-сосудистых заболеваний.
Как указано выше, настоящее изобретение включает также фармацевтически приемлемые соли соединений формулы (I) и их стереомеры.
Примерами фармацевтически приемлемых солей являются любые соли с неорганическими основаниями, такими как гидроксиды натрия, калия, кальция и алюминия, или с органическими основаниями, такими как лизин, аргинин, триэтиламин, дибензиламин, пиперидин и другие приемлемые амины.
Соединения настоящего изобретения, содержащие в молекуле один солеобразующий атом азота, могут быть превращены в соответствующие соли реакцией с соответствующими органическими или неорганическими кислотами в органическом растворителе, таком как ацетонитрил, тетрагидрофуран.
Примерами органических кислот являются щавелевая, винная, малеиновая, янтарная, лимонная кислота. Примерами неорганических кислот являются азотная, хлористоводородная, серная, фосфорная кислота.
Предпочтительными солями являются соли с азотной кислотой.
Соединения настоящего изобретения, имеющие один или более ассиметричных атомов углерода, могут существовать как оптически чистые энантиомеры, чистые диастереоизомеры, смеси энантиомеров, смеси диастереоизомеров, энантиомерные рацемические смеси, рацематы или рацематные смеси. Настоящее изобретение также охватывает все возможные изомеры, стереоизомеры и их смеси соединений формулы (I).
Предпочтительными соединениями настоящего изобретения являются соединения формулы (I), где
s и R как указано выше;
Y представляет двухвалентный радикал, имеющий следующие значения:
a)
- прямой или разветвленный С1-С10 алкилен, необязательно замещенный Т0, где Т0 как указано выше;
b)
где n целое число, равное 0 или 1, и n1 целое число, равное 1; при условии, что группа -ONO2 связана с группой -(СН2)n 1;
c)
где Х2 представляет -О- или -S-, n3 целое число, равное 1, и R2 представляет Н;
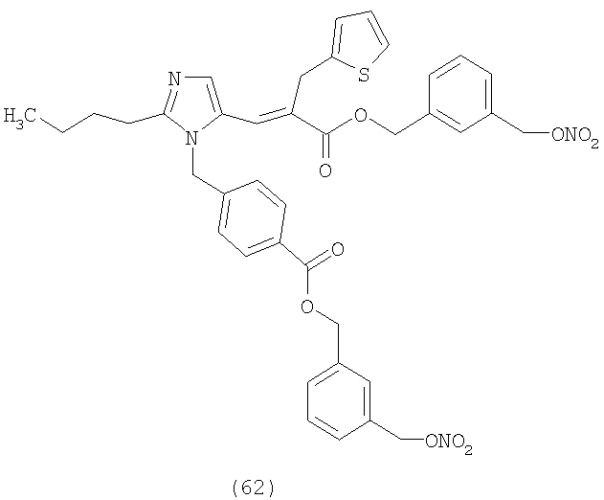
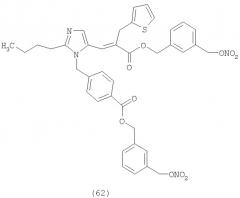
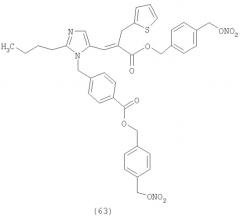
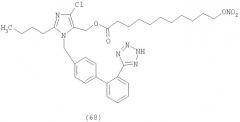
В соответствии с настоящим изобретением предпочтительными соединениями являются следующие:
Как указано выше, объектом настоящего изобретения являются также фармацевтические композиции, содержащие по крайней мере соединение настоящего изобретения формулы (I) вместе с обычно используемыми в фармацевтике нетоксичными вспомогательными веществами и/или носителями.
Ежедневно назначаемая доза активного ингредиента может представлять собой единичную дозу или может представлять собой эффективное количество активного ингредиента, разделенное на несколько небольших доз, назначаемых в течение дня. Обычно общая дневная доза составляет преимущественно от 50 до 500 мг. Режим дозировки и частота назначения для лечения указанных выше заболеваний с помощью соединений и/или фармацевтических композиций настоящего изобретения выбирают в зависимости от различных факторов, включая, например, возраст, вес тела, пол и состояние пациента, а также серьезность заболевания, путь введения, фармакологические соображения и возможную сопутствующую терапию с помощью других лекарств. В некоторых случаях уровни доз могут быть ниже или выше указанного выше интервала или чаще адекватны ему и определяются врачом в зависимости от состояния болезни.
Соединения настоящего изобретения могут назначаться орально, парентерально, ректально или местно, с помощью ингаляции или аэрозоля в составах, в конечном счете, желательно, содержащих обычные нетоксичные фармацевтически приемлемые носители, вспомогательные вещества и наполнители. Местное назначение может включать трансдермальное применение, такое как трансдермальные повязки или устройства для электрофореза. Используемый здесь термин «парентерально» включает подкожные инъекции, внутривенные, внутримышечные, внутригрудинные инъекции или технику вливания.
Инъецируемые препараты, например стерильные инъецируемые водные или масляные суспензии могут изготавливаться известными в данной области методами с использованием подходящих диспергирующих, смачивающих или суспендирующих агентов. Стерильный инъецируемый препарат может также представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе. Приемлемыми наполнителями являются вода, раствор Рингера и изотонический хлористый натрий. Кроме того, в качестве растворяющей или суспендирующей среды можно использовать традиционные стерильные нелетучие масла. Для этой цели можно использовать легкое нелетучее масло, включая синтетические моно или триглицериды, жирные кислоты, такие как олеиновая кислота, находящие применение при изготовлении препаратов для инъекций.
Суппозитории для ректального назначения лекарства можно получить смешиванием активного ингредиента с подходящим нераздражающим эксципиентом, таким как масло какао и полиэтиленгликоли.
Твердые лекарственные формы для орального назначения могут включать капсулы, таблетки, пилюли, порошки, гранулы и гели. В таких твердых лекарственных формах активное вещество может быть смешано по крайней мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут также включать дополнительные другие нежели инертные разбавители вещества, например лубриканты, такие как стеарат магния. В случае капсул, таблеток и пилюль лекарственные формы также могут включать буферные агенты. Таблетки и пилили могут быть приготовлены с энтеральным покрытием.
Жидкие лекарственные формы для орального назначения могут включать фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и элексиры, содержащие инертный, обычно используемый в данной области разбавитель, такой как вода. Такие композиции могут также включать адъюванты, такие как смачивающие агенты, эмульгирующие или суспендирующие агенты, подсластители, ароматизаторы и т.д.
Соединения настоящего изобретения можно синтезировать следующим образом.
А) Указанное выше соединение общей формулы (I) или его фармацевтически приемлемую соль:
где R остаток формулы (II), может быть получено способом, включающим:
i) реакцию соединения формулы (IV):
где s=1 и R2 остаток формулы (IIA):
,
где R3 группа формулы (VA):
где А=Н или W, W представляет собой защитную для тетразола группу, такую как тритил, трет-бутоксикарбонил (ВОС) и этилоксикарбонил, или R3 представляет -СОО- группу, способную связываться с Y;
R1 выбирают из указанных выше групп (IIa)-(IIe), где N0 представляет группу, способную связываться с Y; Y как указано выше и Hal представляет атом галогена, преимущественно Cl, Br или I;
с AgNO3 в подходящем органическом растворителе, таком как ацетонитрил или тетрагидрофуран (ТГФ), в атмосфере азота в темноте при температурном интервале 20-80°С; или же реакцию с AgNO3 можно осуществлять под воздействием микроволнового излучения в растворителе, таком как ацетонитрил или ТГФ, при температурном интервале 100-180°C в течение короткого времени (1-60 мин), и
ii) необязательный кислотный гидролиз защитной W группы тетразола известными методами, как описано, например, в Т.W.Greene "Protective groups in organic synthesis", Harvard University Press, 1980, и
iii) в случае необходимости, превращение полученного соединения формулы (I) в его фармацевтически приемлемую соль.
Соединение формулы (IV) может быть получено реакцией соединения формулы (V):
где R5 представляет указанную выше группу формулы (VA) или -СООН и R4 имеет те же значения, что и R1 с N0=-СООН или -ОН,
i.1) когда R5 представляет группу (VA), R4=R1 и R1 означает группу (IIa), где m=1 и
N0=-ОН, с соединением формулы (VI) или (VII):
где Hal и Y как указано выше и Act представляет Hal или активирующую карбоновую кислоту группу, используемую в химии пептидов, как
Реакцию в основном проводят в присутствии неорганического или органического основания в апротонном полярном/неполярном растворителе, таком как ДФА, ТГФ или CH2Cl2, при температуре 0-65°C или в двухфазной системе H2O/Et2O при температуре 20-40°C.
Соединения формулы (VI), где Act представляет Hal, являются коммерчески доступными или могут быть получены из соответствующих кислот формулы (VIII):
известными способами, например реакцией с тионил или оксалил хлоридом, галоидами PIII или PV в инертном растворителе, таком как толуол, хлороформ, ДФА и т.д. Соответствующие кислоты являются коммерчески доступными соединениями.
Соединения формулы (VI), где Act не является Hal, могут быть получены из соответствующих соединений формулы (VI), где Act является Hal, с помощью известной из литературы реакции с N-гидроксисукцинимидом или с соответствующими замещенными фенолами в присутствии основания.
Соединения формулы (VII), где Act представляет Hal, являются коммерчески доступными соединениями или могут быть получены из соответствующих спиртов формулы (IX):
реакцией с трифосгеном в присутствии органического основания; соединения формулы (VII), где Act не является Hal, могут быть получены из соответствующих соединений формулы (VII), где Act является Hal, с помощью известной из литературы реакции с N-гидроксисукцинимидом или с соответствующими замещенными фенолами в присутствии основания.
С другой стороны соединения формулы (VI) могут быть получены реакцией указанного в i.1) соединения формулы (V) с указанным выше коммерчески доступным соединением формулы (VIII), в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид (DCC), EDAC, в присутствии каталитического количества DMAP или активирующего агента, такого как N,N'-карбонилдиимидазол (CDI), в растворителе, таком как ДФА, ТГФ, хлороформ, при температуре от -5°С до 50°С;
i.2) когда R5 представляет группу (VA) или -СООН, R4=R1 и R1 выбирают из групп (IIa)-(IId), где m=0 и N0=-СООН, с указанным выше соединением формулы (IX) в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид (DCC), EDAC, в присутствии каталитического количества DMAP или активирующего карбонильную группу агента, такого как N,N'-карбонилдиимидазол (CDI), в растворителе, таком как ДФА, ТГФ, хлороформ, при температуре от -5°С до 50°С.
Соединения формулы (IX) являются коммерчески доступными.
С другой стороны превращение группы -СООН в активированную ацилхлоридную или другую пригодную для этерификации группу осуществляют в соответствии с известными из литературы методами и этерификацию проводят в присутствии органического или неорганического основания в апротонном полярном/неполярном растворителе, таком как ДФА, ТГФ или CH2Cl2, при температуре 0°С - 65°С или в двухфазной системе H2O/Et2O при температуре 20°С - 40°С.
А1) Или же указанные выше соединения формулы (I), где R представляет остаток формулы (II), могут быть получены реакцией указанных выше соединений формулы (V):
i.1.1) когда R5 представляет группу (VA), R4=R1 и R1 представляет группу (IIa), где m=1 и N0=-ОН, с соединением формулы (X):
где Y как указано выше и Z представляет ОН или определенную выше группу Act, наиболее подходящим синтетическим путем, например в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид (DCC), EDAC, или активирующего агента - N,N'-карбонилдиимидазола (CDI) в растворителе, таком как ДФА, ТГФ, хлороформ, при температуре от -5°С до 50°С и/или в присутствии органического или неорганического основания.
Соединения формулы (X) могут быть получены из соответствующих спиртов реакцией с азотной кислотой и уксусным ангидридом при температуре от -50°С до 0°С или реакцией соответствующих галоидпроизводных формулы (VI) или (VIII) с AgNO3, как уже описано.
i.2.1) Когда R5 представляет группу (VA) или -СООН, R4=R1 и R1 выбирают из групп (IIa)-(IId), где m=0 и N0=-СООН, с соединением формулы (XI):
где Y как указано выше, в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид (DCC) или EDAC, или активирующего агента, такого как N,N'-карбонилдиимидазол (CDI), в растворителе, таком как ДФА, ТГФ, хлороформ, при температуре от -5°С до 50°С.
Соединения формулы (XI) могут быть получены реакцией соединения формулы (IX) с AgNO3 в подходящем органическом растворителе, таком как ацетонитрил или ТГФ в среде азота при температуре 20°С - 80°С; или же реакция с AgNO3 может быть проведена под воздействием микроволнового излучения в растворителях, таких как ацетонитрил или ТГФ, при температуре 100-180°С в течение короткого промежутка времени (1-60 мин).
Или же, когда R5 представляет группу (VA) или -СООН, R4=R1 и R1 выбирают из групп (IIa)-(IIe), где m=0 и N0=-СООН, с соединением формулы (XI.1):
где Y и Hal как указано ранее, в присутствии неорганического или органического способного к солеобразованию с карбоксильной группой основания.
В) Соединения общей формулы (I), где R представляет собой остаток формулы (III), могут быть получены реакцией соединения формулы (XII):
где s=2, R6 представляет остаток (III) и N1 представляет -COO-, Y и Hal как указано выше, с AgNO3, как уже описано.
Соединения формулы (XII) получают реакцией соединения формулы (XIII):
с указанными выше соединениями формулы (IX) в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид (DCC) или EDAC, или активирующего агента, такого как N,N'-карбонилдиимидазол (CDI), в растворителе, таком как ДФА, ТГФ, хлороформ, при температуре от -5°С до 50°С.
С другой стороны превращение группы -СООН в активированную ацилхлоридную или другую пригодную для этерификации группу осуществляют в соответствии с известными из литературы методами и этерификацию ведут в присутствии органического или неорганического основания в апротонном полярном/неполярном растворителе, таком как ТГФ или CH2Cl2 при температуре 0°С-65°С или в двухфазной системе.
В1) Или же указанные выше соединения общей формулы (I), где R представляет собой остаток формулы (III), могут быть получены реакцией соединения формулы (XIII) с указанным выше соединением формулы (XI) в присутствии конденсирующего или активирующего агента, как уже описано.
С другой стороны, превращая группу -СООН в соль с неорганическим или органическим основанием в соответствии с известными из литературы методами и реакцией с
как описано в литературе.
С) Указанные выше соединения формулы (I), где s=1 и R представляет остаток формулы (II), где R0 представляет собой тетразольную группу и R1 представляет группу (IIa), где m=1 и N0 представляет
,
где R' и R'' как указано выше, могут быть получены реакцией соединения формулы (IVa):
где s=1, R2 и Hal как указано выше, R3 представляет группу (VA), R1 представляет группу (IIa), где m=1 и N0 представляет -ОСОО-, с указанным выше соединением формулы (X) в присутствии органического или неорганического основания в полярном растворителе, таком как ДФА, ТГФ, ацетонитрил, при температуре от -5°С до 60°С или в двухфазной системе, как известно из литературы.
Соединения (IVa) могут быть получены взаимодействием указанного выше соединения формулы (V), где R3 представляет группу (VA), R4=R1 и R1 представляет группу (IIa), где m=1 и N0=-ОН, с соединением формулы (VIIa):
где Act имеет те же значения, которые указаны выше для (VII), тем же способом, который уже описан для соединений (IV); и необязательным кислотным гидролизом указанной выше защитной группы тетразола.
D) Указанные выше соединения формулы (I), где s=1 и R представляет остаток формулы (II), где R0 представляет собой тетразольную группу и R1 выбран из групп (IIa)-(IIc), где m=0 и N0 представляет
,
где R' и R'' как указано выше, могут быть получены реакцией соединения формулы (V), где R5 представляет группу (VA), R4=R1 и R1 представляет группу (IIc), где N0=-СООН, с соединением формулы (XIV):
где Hal, Y, R' и R'' как указано выше, в присутствии органического или неорганического основания в полярном растворителе, таком как ДФА, ТГФ, ацетонитрил, при температуре от -5°С до 60°С или в двухфазной системе, как известно из литературы.
Соединения формулы (XIV) могут быть получены реакцией соединений формулы (XI) с указанными выше соединениями формулы (VIIa). Реакцию в основном ведут в присутствии основания в апротонном полярном/неполярном растворителе, таком как ТГФ или CH2Cl2, при температуре 0-65°С или в двухфазной системе H2O/Et2O при температуре 20-40°С и необязательным кислотным гидролизом указанной выше защитной группы тетразола.
Е) Указанные выше соединения формулы (I), где s=1 и R представляет остаток формулы (II), где R0 представляет собой тетразольную группу и R1 выбран из групп (IIa)-(IIc), также могут быть получены реакцией соединения формулы (XV) с коммерчески доступным соединением формулы (XVI):
где R7 представляет собой остаток (IIa)-(IIc), R3 группу (Va) и Hal как уже указано выше. Реакцию в основном ведут в присутствии основания в апротонном полярном/неполярном растворителе, таком как ДФА, ТГФ или CH2Cl2 при температуре от -15 до +80°С или в двухфазной системе H2O/Et2O при температуре от 20-40°С и необязательным кислотным гидролизом указанной выше защитной группы тетразола. Соединения формулы (XV) могут быть получены реакцией соединений формулы (XVII):
где R8 представляет остаток формулы (IIa.1), (IIb.1) или (IIc.1):
где PG означает N-защитную группу, такую как ВОС или тритил, с AgNO3, как уже описано, и необязательным гидролизом N - защитной группы. Соединения (XVII), где
R8 представляет (IIa.I), где m=1 и N0=-ОСО-, могут быть получены из соответствующих спиртов, как уже описано, реакцией с соединением формулы (VI) или (VII). Указанные выше спирты получают известными защитными и восстановительными реакциями из коммерчески доступных соединений формулы (IIa.2):
где m представляет 0 и N00 представляет -СНО.
Соединения формулы (XVII), где R8 представляет (IIa.1) с m=0 и N0=-COO- или R8 представляет (IIb.1) или (IIc.1) с N0=-COO-, могут быть получены из соответствующих кислот реакцией с соединениями формулы (IX). Указанные выше соответствующие кислоты (IIa.1) получают из соединений (IIa.2), где m представляет 0 и N00 представляет -СНО, известными защитными и окислительными реакциями. Указанные выше соответствующие кислоты (IIb.1) и (IIc.1) получают из коммерчески доступных (IIb.2) и (IIc.2):
где N0 представляет -СООН, известными методами.
Следующие примеры иллюстрируют изобретение без его ограничения.
Пример 1
Сложный эфир 4-(нитрооксиметил)бензоиной кислоты и 2-бутил-4-хлор-1-[[2'-(1Н-тетразол-5-ил)[1,1'-бифенил]-4-ил]метил]-1Н-имидазол-5-метанола (соответствует соединению (4))
К раствору натриевой соли Лазартана (7,0 г; 15,2 ммол) в ТГФ добавляют порциями трифенилметилхлорид (4,68 г; 16,8 ммол). Полученную смесь перемешивают при комнатной температуре 24 часа. Затем абсорбируют на силикагеле и очищают с помощью флешхроматографии (н-гексан/AcOEt 6:4), получая 2-бутил-4-хлор-1-[[2'-(1-трифенилметилтетразол-5-ил)[1,1'-бифенил]-4-ил]метил]-1Н-имидазол-5-метанол (6,7 г; 66%). Из этого соединения можно получить указанное в заголовке соединение двумя различными способами синтеза.
Синтетический способ А
К охлажденному до 0°С раствору 2-бутил-4-хлор-1-[[2'-(1-трифенилметилтетразол-5-ил)[1,1'-бифенил]-4-ил]метил]-1Н-имидазол-5-метанола (1,7 г; 2,6 ммол), 4-(нитрооксиметил)бензойной кислоты (0,66 г; 3,38 ммол) и N,N-диметиламинопиридина (0,049 г; 0,4 ммол) в CH2Cl2 (20 мл) и ТГФ (6 мл) медленно добавляют раствор дициклогексилкарбодиимида (0,722 г; 3,5 ммол) в CH2Cl2 (5 мл) и перемешивают при комнатной температуре 24 часа. Затем отфильтровывают образовавшуюся диклогексилмочевину и органическую фазу концентрируют. Сырой продукт очищают путем хроматографии на силикагеле (н-гексан/AcOEt 75:25), получая сложный эфир 4-(нитрооксиметил)бензойной кислоты и 2-бутил-4-хлор-1-[[2'-(1-трифенилметилтетразол-5-ил)[1,1'-бифенил]-4-ил]метил]-1Н-имидазол-5-метанола (1,2 г, 55%) в виде белого твердого вещества.
Сложный эфир 4-(нитрооксиметил)бензойной кислоты и 2-бутил-4-хлор-1-[[2'-(1-трифенилметилтетразол-5-ил)[1,1'-бифенил]-4-ил]метил]-1Н-имидазол-5-метанола (1,2 г, 1,42 ммол) растворяют в CH2Cl2 (10 мл) и через полученный раствор 20 минут барботируют HCl. Затем смесь концентрируют и очищают с помощью флешхроматографии (CH2Cl2/ацетон 8:2, затем ацетон), получая сырое соединение, которое раство