Замещенные пиразолопиридины, композиции, содержащие их, способ получения и применение
Иллюстрации
Показать всеИзобретение относится к замещенным пиразолопиридинам, представляющим собой соединение формулы (I) где: 1) Ar-L-A представляет собой: , где Х2 выбран из N и СН; 2) А представляет собой фенил, необязательно замещенный заместителями в количестве от 1 до 3, выбранных из (С1-С6)алкила, галогенированного (С1-С6)алкила, галогена, ОН, O-(С1-С6)алкила, галогенированного O-(С1-С6)алкила, 8-(С1-С6)алкила, галогенированного 8-(С1-С6)алкила, СООН, N(R8)CO(R9), где R8 представляет Н или (С1-С6)алкил и R9 представляет собой (С1-С6)алкил; при этом в случае, когда А является дизамещенным, два заместителя А совместно с бензольным кольцом образуют бензодиоксольный фрагмент; 3) L выбран из группы, которую составляют: NH-CO-NH, NH-SO2; 4) один из радикалов X, Y и Z выбран из N, а два других радикала Z, Y и Х представляют собой СН; или их фармацевтически приемлемым солям. Предложенные соединения ингибируют реакции, катализируемые киназой, выбранной из FAK, KDR и Tie2. Объектами изобретения также являются лекарственное средство и фармацевтическая композиция, предназначенные для ингибирования указанных киназ, применение, в частности, предложенных соединений для получения лекарственного средства, предназначенного для лечения рака. Кроме того, предложены промежуточные соединения для получения соединения формулы I. 7 н. и 10 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к новым химическим соединениям, в частности к новым замещенным пиразолопиридинам, композициям, содержащим их, и их применению в качестве лекарственных средств.
Более предпочтительно и в первом аспекте изобретение относится к новым специфическим пиразолопиридинам, проявляющим противораковую активность посредством модуляции активности протеинов, в частности киназ.
До настоящего времени большинство имеющихся в продаже соединений, применяемых в химиотерапии, создает значительные проблемы в отношении вторичных явлений и переносимости больными. Такие явления могли бы быть ограничены в известной мере, если бы применяемые лекарственные средства действовали на раковые клетки селективно, исключая здоровые клетки. Одно из решений для ограничения нежелательных явлений при химиотерапии может, таким образом, состоять в применении лекарственных средств, действующих на метаболические пути или элементы, составляющие такие пути, которые были бы выражены в своем большинстве в раковых клетках и не были бы выражены или были бы выражены в малой степени в здоровых клетках.
Протеинкиназы представляют собой группу ферментов, которые катализируют фосфорилирование гидроксильных групп специфических остатков протеинов, таких как остатки тирозина, серина или треонина. Такое фосфорилирование может широко изменять функцию протеинов; таким образом, протеинкиназы играют важную роль в регулировании большого числа разнообразных клеточных процессов, включающих в себя, в частности, метаболизм, клеточную пролиферацию, клеточную дифференцировку, клеточную миграцию или выживаемость клеток. Среди различных клеточных функций, в которые вовлечена активность протеинкиназы, некоторые процессы представляют собой привлекательные цели для лечения раковых заболеваний, а также других болезней.
Таким образом, одна из целей настоящего изобретения состоит в предложении композиций, обладающих противораковой активностью, проявляемой, в частности, в воздействии на киназы. Среди киназ, в отношении которых исследуется модуляция активности, предпочтительными являются FAK, KDR и Tie2.
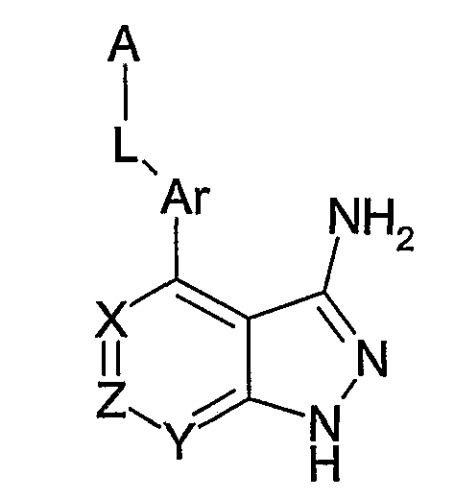
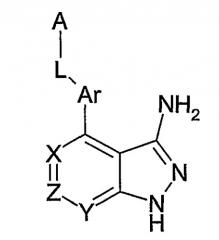
Такие соединения соответствуют следующей формуле (I):
Формула (I)
где
1) A и Ar независимо выбирают из группы, которую составляют: арил, гетероарил, замещенный арил, замещенный гетероарил, циклоалкил, замещенный циклоалкил, гетероциклил, замещенный гетероциклил;
2) L выбирают из группы, которую составляют: простая связь, CO, NH, CO-NH, NH-CO, NH-SO, NH-SO2, SO2-NH, NH-CH2, CH2-NH, CH2-CO-NH, NH-CO-CH2, NH-CH2-CO, CO-CH2-NH, NH-CO-NH, NH-CS-NH, NH-CO-O, O-CO-NH;
3) один из радикалов X, Y и Z выбирают из N и NO, а два других радикала Z, Y и X представляют собой C(R5) и C(R6);
4) R5 и R6 независимо выбирают из группы, которую составляют: H, галоген, R2, CN, O(R2), OC(O)(R2), OC(O)N(R2)(R3), OS(O2)(R2), N(R2)(R3), N=C(R2)(R3), N(R2)C(O)(R3), N(R2)C(O)O(R3), N(R4)C(O)N(R2)(R3), N(R4)C(S)N(R2)(R3), N(R2)S(O2)(R3), C(O)(R2), C(O)O(R2), C(O)N(R2)(R3), C(=N(R3))(R2), C(=N(OR3))(R2), S(R2), S(O)(R2), S(O2)(R2), S(O2)O(R2), S(O2)N(R2)(R3); где каждый из R2, R3, R4 независимо выбирают из группы, которую составляют H, алкил, алкилен, алкинил, арил, гетероарил, циклоалкил, гетероциклил, замещенный алкил, замещенный алкилен, замещенный алкинил, замещенный арил, замещенный гетероарил, замещенный циклоалкил, замещенный гетероциклил, алкилен, замещенный алкилен, замещенный алкинил; где R2 и R3 могут быть связаны между собой для образования 4-8-членного цикла, содержащего от 1 до 3 гетероатомов, выбираемых из O, N и S.
В соединениях формулы (I) Ar-L-A представляет собой предпочтительно:
где каждый из X1, X2, X3 и X4 независимо выбирают из N и C-R11, причем R11 имеет такие же значения, как и R5, определенный ранее.
Ar-L-A представляет собой предпочтительно:
где X2 выбирают из N, C-CH3, CF и CH.
Заместители R11, выбираемые из группы, которую составляют H, F, Cl, метил, NH2, OCF3 и CONH2, являются предпочтительными.
Предпочтительные заместители R5 и R6 независимо выбирают из H, галогена, OMe и метила.
R5 и R6 предпочтительно выбирают из H и F.
R5 и R6 представляют собой предпочтительно H.
Предпочтительные заместители L-A выбирают преимущественно из NH-CO-NH-A и NH-SO2-A.
Особенно эффективную комбинацию L-A получают в том случае, когда L-A представляет собой NHCONH-A.
Соединения, соответствующие настоящему изобретению, предпочтительно содержат заместитель A, выбираемый из группы, которую составляют фенил, пиридил, пиримидил, тиенил, фурил, пирролил, оксазолил, тиазолил, изоксазолил, изотиазолил, пиразолил, имидазолил, индолил, индазолил, бензимидазолил, бензоксазолил и бензотиазолил, и замещенный при необходимости.
Более предпочтительно A выбирают из фенила, пиразолила и изоксазолила, замещенных при необходимости.
Заместитель A более предпочтительно содержит заместитель, выбираемый из первой группы, которую составляют (C1-C6)алкил, (C1-C6)алкилгалогенид, (C2-C6)алкилен, (C2-C6)алкинил, арила, галогена, гетероарил, O-(C1-C6)алкил, O-aрил, O-гетероарил, S-(C1-C6)алкил, S-aрил, S-гетероарил, причем каждый из них при необходимости содержит один или несколько заместителей, выбираемых из (C1-C3)алкила, галогена, O-(C1-C3)алкила.
Заместитель A предпочтительно содержит заместитель, выбираемый из второй группы, которую составляют F, Cl, Br, I, OH, SH, SO3M, COOM, CN, NO2, CON(R8)(R9), N(R8)CO(R9), (C1-C3)алкил-OH, (C1-C3)алкил-N(R8)(R9), (C1-C3)алкил-(R10), (C1-C3)алкил-COOH, N(R8)(R9); где R8 и R9 независимо выбирают из H, (C1-C3)алкила, (C1-C3)алкил-OH, (C1-C3)алкил-NH2, (C1-C3)алкил-COOM, (C1-C3)алкил-SO3M; где R8 и R9, когда они оба отличаются от H, могут быть связаны для образования 5-7-членного цикла, содержащего от 0 до 3 гетероатомов, выбираемых из O, N и S; где M представляет собой H или катион щелочного металла, выбираемый из Li, Na и K; и где R10 представляет собой H или замещенный при необходимости неароматический гетероцикл, содержащий от 2 до 7 атомов углерода и от 1 до 3 гетероатомов, выбираемых из N, O и S.
Особо предпочтительные заместители A выбирают из фенила и изоксазолила; причем упомянутые заместители A могут содержать в качестве заместителей галоген, (C1-C4)алкил, (C1-C3)алкилгалогенид, O-(C1-C4)алкил, S-(C1-C4)алкил, O-(C1-C4)алкилгалогенид и S-(C1-C4)алкилгалогенид. В случае, когда A является двузамещенным, два заместителя A могут образовывать 5-7-членный цикл, содержащий от 0 до 3 гетероатомов.
A предпочтительно содержит один или несколько заместителей, являющихся одинаковыми или различающимися, выбираемых независимо из группы, которую составляют F, Cl, Br, I, OH, SH, SO3M, COOM, CN, NO2, CON(R8)(R9), N(R8)CO(R9), (C1-C3)алкил-OH, (C1-C3)алкил-N(R8)(R9), (C1-C3)алкил-(R10), (C1-C3)алкил-COOH, N(R8)(R9), (C1-C6)алкил, (C2-C6)алкилен, (C2-C6)алкинил, арил, гетероарил, O-(C1-C6)алкил, O-aрил, O-гетероарил, S-(C1-C6)алкил, S-aрил, S-гетероарил, причем каждый из них при необходимости содержит один или несколько заместителей, выбираемых из (C1-C3)алкила, галогена, O-(C1-C3)алкила; где R8 и R9 независимо выбирают из H, (C1-C3)алкила, (C1-C3)алкил-OH, (C1-C3)алкил-NH2, (C1-C3)алкил-COOM, (C1-C3)алкил-SO3M; где R8 и R9, когда они оба отличаются от H, могут быть связаны для образования 5-7-членного цикла, содержащего от 0 до 3 гетероатомов, выбираемых из O, N и S; где M представляет собой H или катион щелочного металла, выбираемый из Li, Na и K; и где R10 представляет собой H или замещенный при необходимости неароматический гетероцикл, содержащий от 2 до 7 атомов углерода и от 1 до 3 гетероатомов, выбираемых из N, O и S.
По предпочтительному варианту воплощения A представляет собой преимущественно 2-фтор-5-трифторметилфенил или 2-метокси-5-трифторметилфенил.
В качестве соединений, соответствующих настоящему изобретению, могут быть выбраны:
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-фтор-5-трифторметилфенил)мочевина;
1-[5-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)пиридин-2-ил]-3-(2-фтор-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-метокси-5-трифторметилфенил)мочевина;
1-[5-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)пиридин-2-ил]-3-(2-метокси-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-метилкарбониламино-5-трифторметилфенил)мочевина;
1-[5-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)пиридин-2-ил]-3-(2-метилкарбониламино-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-этокси-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-фтор-5-метилфенил)мочевина;
3-{3-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]уреидо}-4-метоксибензойная кислота;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-гидрокси-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(3,4-диметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-метокси-5-трет-бутилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(3-трифторметил-4-метилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(3-хлор-4-метилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(3-этилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-1,3-бензодиоксол-5-илмочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(3-хлор-4-метоксифенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-метокси-5-хлорфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-этоксифенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-3-(2-метокси-5-метилфенил)мочевина;
N-[4-(3-амино-1H-пиразоло[3,4-b]пиридин-4-ил)фенил]-2,3-дихлорбензолсульфонамид.
В качестве других соединений, соответствующих настоящему изобретению, могут быть выбраны:
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-{2-фтор-5-трифторметилфенил)мочевина;
1-[5-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)пиридин-2-ил]-3-(2-фтор-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-(фенил)мочевина;
1-[5-(3-амино-1H-пиразоло[4,3-с]пиридин-4-ил)пиридин-2-ил]-3-(2-метокси-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-с]пиридин-4-ил)фенил]-3-(2-метокси-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-с]пиридин-4-ил)фенил]-3-(2-метилкарбониламино-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-(2-фтор-5-метилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-(2,4-диметоксифенил)мочевина;
N-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-2,3-дихлорбензолсульфонамид;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-(2-метокси-5-трет-бутилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-(3,4-диметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-(3-трифторметил-4-метилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-
(2,5-дифторфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-(3-хлор-4-метилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-(2-метил-5-фторфенил]мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-с]пиридин-4-ил)фенил]-3-(2,4-диметокси-5-хлорфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[4,3-c]пиридин-4-ил)фенил]-3-(3-трифторметилсульфанилфенил)мочевина.
В качестве других соединений, соответствующих настоящему изобретению, могут быть выбраны:
1-[4-(3-амино-1H-пиразоло[3,4-c]пиридин-4-ил)фенил]-3-(2-фтор-5-трифторметилфенил)мочевина;
1-[4-(3-амино-1H-пиразоло[3,4-с]пиридин-4-ил)фенил]-3-(2-метокси-5-трифторметилфенил)мочевина;
N-[4-(3-амино-1H-пиразоло[3,4-c]пиридин-4-ил)фенил]-2,3-дихлорбензолсульфонамид.
Соединение, соответствующее настоящему изобретению, может находиться в форме:
нехиральной, или
рацемической, или
обогащенной одним из стереоизомеров, или
обогащенной одним из энантиомеров,
и при необходимости может быть переведено в форму соли, гидратировано и сольватировано.
Соединение, соответствующее настоящему изобретению, может быть использовано для получения лекарственного средства, являющегося полезным при лечении патологического состояния, в частности рака.
Во втором аспекте настоящее изобретение относится к лекарственному средству, содержащему соединение формулы (I) согласно первому аспекту или аддитивную соль такого соединения с фармацевтически приемлемой кислотой, или также гидрат или сольват соединения формулы (I).
В третьем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение согласно первому или второму аспекту в комбинации с фармацевтически приемлемым эксципиентом.
В четвертом аспекте настоящее изобретение относится к применению продукта согласно одному из других аспектов изобретения в качестве агента, ингибирующего реакции, катализируемые киназой. Предпочтительными киназами являются FAK, KDR и Tie2.
Настоящее изобретение относится также к терапевтическим композициям, содержащим соединение по настоящему изобретению в комбинации с фармацевтически приемлемым эксципиентом, соответствующим выбранному способу введения. Фармацевтическая композиция может находиться в виде твердого вещества, жидкости или липосом.
Среди твердых композиций можно упомянуть порошки, желатиновые капсулы, таблетки. Среди форм для перорального введения можно также отметить твердые формы, защищенные в отношении кислой среды желудка. Применяемые носители для твердых форм представляют собой, в частности, минеральные носители, такие как фосфаты, карбонаты, или органические носители, такие как лактоза, целлюлозы, крахмал или полимеры. Жидкие формы представляют собой растворы, суспензии или дисперсии. Они содержат в качестве дисперсионного носителя как воду, так и органический растворитель (этанол, NMP или другие), или смеси поверхностно-активных агентов и растворителей, или комплексообразующих агентов и растворителей.
Жидкие формы применяются, предпочтительно, для инъекций, и это обстоятельство делает композицию приемлемой для такого применения.
Приемлемое введение путем инъекции включает в себя введение внутривенно, интраперитонеально, внутримышечно и подкожно, причем внутривенное введение является традиционно предпочтительным.
Вводимая доза соединений по настоящему изобретению устанавливается лечащим врачом в зависимости от пути введения больному и состояния последнего.
Соединения по настоящему изобретению могут вводиться отдельно или в смеси с другими противораковыми средствами. Среди возможных сочетаемых средств можно упомянуть:
алкилирующие агенты и, в частности, циклофосфамид, мелфалан, ифосфамид, хлорамбуцил, бусульфан, тиотепа, преднимустин, кармустин, ломустин, семустин, стептозотоцин, декарбазин, темозоломид, прокарбазин и гексаметилмеламин;
производные платины, такие как, в частности, цисплатин, карбоплатин или оксалиплатин;
антибиотики, такие как, в частности, блеомицин, митомицин, дактиномицин;
антимикротубулярные агенты, такие как, в частности, винбластин, винкристин, виндезин, винорелбин, таксоиды (паклитаксел и доцетаксел);
антрациклины, такие как, в частности, доксорубицин, даунорубицин, идарубицин, эпирубицин, митоксантрон, лосоксантрон;
ингибиторы топоизомераз I и II групп, такие как этопозид, тенипозид, амсакрин, иринотекан, топотекан и томудекс;
фторпиримидины, такие как 5-фторурацил, UFT, флоксуридин;
аналоги цитидина, такие как 5-азацитидин, цитарабин, гемцитабин, 6-меркаптомурин, 6-тиогуанин;
аналоги аденозина, такие как пентостатин, цитарабин или фосфат флударабина;
метотрексат и фолиевая кислота;
ферменты и иные соединения, такие как L-аспарагиназа, гидроксимочевина, транс-ретиновая кислота, сурамин, дексразоксан, амифостин, герцептин, а также эстрогенные и андрогенные гормоны;
антиваскулярные агенты, такие как производные комбретастатина или колхицина и их пролекарства.
Также возможно сочетать соединения по настоящему изобретению с лечением радиотерапией. Такое лечение может проводиться одновременно, раздельно или последовательно. Курс лечения адаптируется лечащим врачом в зависимости от состояния больного, подлежащего лечению.
Соединения по настоящему изобретению являются полезными в качестве агентов, ингибирующих реакции, катализируемые киназой. FAK, KDR и Tie2 являются киназами, в отношении которых соединения по настоящему изобретению могут быть в особенности полезными в качестве ингибиторов.
Причины, по которым выбраны такие киназы, приведены далее.
FAK
FAK представляет собой цитоплазматическую тирозинкиназу, играющую важную роль в трансдукции сигнала, передаваемого интегринами, группой гетеродимерных рецепторов клеточной адгезии. FAK и интегрины колокализованы в перимембранных структурах, называемых фокальные контакты. На многих клеточных типах было показано, что активация FAK, а также ее фосфорилирование по остаткам тирозина и, в частности, ее аутофосфорилирование по тирозину 397 зависели от связи интегринов с их внеклеточными лигандами и, таким образом, индуцировались при клеточной адгезии [Kornberg L., et al., J. Biol. Chem. 267(33): 23439-442. (1992)]. Аутофосфорилирование FAK по тирозину 397 предоставляет сайт связи для другой тирозинкиназы, Src, посредством ее домена SH2 [Schaller et al., Mol. Cell. Biol. 14:1680-1688. 1994; Xing et al., Mol. Cell. Biol. 5:413-421. 1994]. Src может при этом фосфорилировать FAK по тирозину 925, рекрутируя таким образом адаптирующий протеин Grb2 и индуцируя в некоторых клетках активацию пути Ras и MAP-киназы, вовлеченной в управление клеточной пролиферацией [Schlaepfer et al., Nature; 372:786-791. 1994; Schlaepfer et al., Prog. Biophy. Mol. Biol. 71:435-478. 1999; Schlaepfer and Hunter, J. Biol. Chem. 272:13189-13195. 1997]. Активация FAK может также индуцировать путь сигнализации jun-NH2-концевой киназы (JNK) и вызывать прогрессию клеток к G1 фазе клеточного цикла [Oktay et al., J. Cell. Biol. 145:1461-1469. 1999]. Фосфатидилинозитол-3-OH-киназа (PI3-киназа) связывается также с FAK по тирозину 397, и это взаимодействие, возможно, является необходимым для активации PI3-киназ [Chen and Guan, Proc. Nat. Acad. Sci. USA. 91: 10148-10152. 1994; Ling et al., J. Cell. Biochem. 73:533-544. 1999]. Комплекс FAK/Src фосфорилирует различные субстраты, такие как паксиллин и p130CAS в фибробластах [Vuori et al., Mol. Cell. Biol. 16: 2606-2613. 1996].
Результаты многочисленных исследований подкрепляют гипотезу о том, что ингибиторы FAK могли бы быть полезными при лечении рака. Исследованиями показывается, что FAK могла бы играть важную роль в пролиферации и/или выживаемости клеток in vitro. Например, некоторые авторы доказали, что в клетках CHO сверхэкспрессия p125FAK ведет к ускорению перехода от G1 к S, указывая, что p125FAK благоприятствует клеточной пролиферации [Zhao J.-H. et al., J. Cell Biol. 143:1997-2008. 1998]. Другими авторами было показано, что опухолевые клетки, обработанные антисмысловыми олигонуклеотидами FAK, утрачивают свою адгезию и входят в стадию апоптоза (Xu et al., Cell Growth Differ. 4:413-418. 1996). Также было доказано, что FAK способствует миграции клеток in vitro. Таким образом, фибробласты, проявляющие недостаточность в экспрессии FAK (мышь, "нокаутированная" по FAK), проявляют округленную морфологию, недостаточность клеточной миграции в ответ на хемотаксические сигналы, и такие дефекты подавляются реэкспрессией FAK [D.J. Sieg et al., J. Cell Science. 112:2677-91. 1999]. Сверхэкспрессия С-концевого домена FAK (FRNK) блокирует растягивание прилегающих клеток и уменьшает клеточную миграцию in vitro [Richardson A. and Parsons J.T., Nature. 380:538-540. 1996]. Сверхэкспрессия FAK в клетках CHO, COS или в клетках астроцитомы человека благоприятствует миграции клеток. Вовлечение FAK в стимулирование пролиферации и миграции клеток во многих типах клеток in vitro указывает на потенциальную роль FAK в неоплазических процессах. В недавнем исследовании было убедительно доказано увеличение пролиферации опухолевых клеток in vivo после индуцирования экспрессии FAK в клетках астроцитомы человека [Cary L.A. et al., J. Cell Sci. 109:1787-94. 1996; Wang D. et al., J. Cell Sci. 113:4221-4230. 2000]. Более того, иммуногистохимическими исследованиями биопсийных материалов человека было доказано, что сверхэкспрессия FAK имела место при раке простаты, молочной железы, щитовидной железы, толстой кишки, меланоме, раке головного мозга и легкого, причем уровень экспрессии FAK прямо коррелировался с типами опухолей, представлявших наиболее агрессивный фенотип [Weiner T.M. et al., Lancet. 342(8878):1024-1025. 1993; Owens et al., Cancer Research. 55:2752-2755. 1995; Maung K. et al., Oncogene. 18:6824-6828. 1999; Wang D. et al., J. Cell Sci. 113:4221-4230. 2000].
KDR
KDR (Kinase insert Domain Receptor (киназный рецептор со встроенным доменом)), также называемый VEGF-R2 (Vascular Endothelial Growth Factor Receptor 2 (рецептор 2 васкулярного эндотелиального фактора роста)), экспрессируется только в эндотелиальных клетках. Такой рецептор фиксируется на факторе ангиогенного роста VEGF и служит, таким образом, медиатором трансдукционного сигнала путем активации своего внутриклеточного домена киназы. Прямое ингибирование активности киназы VEGF-R2 позволяет уменьшить феномен ангиогенеза в присутствии экзогенного VEGF (Vascular Endothelial Growth Factor: васкулярного эндотелиального фактора роста) (Strawn et al., Cancer Research, 1996, vol. 56, p. 3540-3545). Такой процесс был доказан, в частности, с помощью мутантных VEGF-R2 (Millauer et al., Cancer Research, 1996, vol. 56, p. 1615-1620). Рецептор VEGF-R2, кажется, не имеет никакой другой функции у взрослого человека, кроме связанной с ангиогенной активностью VEGF. Следовательно, селективный ингибитор активности киназы VEGF-R2 должен показывать низкую токсичность.
В дополнение к такой центральной роли в динамическом ангиогенном процессе полученные недавно результаты указывают на то, что экспрессия VEGF способствуют выживаемости опухолевых клеток после химио- и радиотерапии, подчеркивая потенциальный синергизм ингибиторов KDR с другими агентами (Lee et al., Cancer Research, 2000, vol. 60, p. 5565-5570).
Tie2
Tie-2 (TEK) представляет собой член группы рецепторов тирозинкиназы, специфичной к эндотелиальным клеткам. Tie2 является первым восприимчивым к активности тирозинкиназы рецептором, известным также как агонист (ангиопоэтин 1 или Ang1), который стимулирует аутофосфорилирование рецептора и клеточную сигнализацию [S. Davis et al., (1996) Cell 87, 1161-1169], и антагонист (ангиопоэтин 2 или Ang2) [P.C. Maisonpierre et al., (1997) Science 277, 55-6O]. Ангиопоэтин 1 может проявлять синергизм с VEGF в последних стадиях неоангиогенеза [Asahara T., Circ. Res. (1998) 233-240]. Испытания с нокаутом генов и трансгенные манипуляции экспрессии Tie2 или Ang1 проводят с животными, которые проявляют недостаточность васкуляризации [D.J. Dumont et al., (1994) Genes Dev. 8, 1897-1909, и C. Suri, (1996) Cell 87, 1171-1180]. Связь Ang1 с его рецептором ведет к аутофосфорилированию домена киназы Tie2, которая является существенной для неоваскуляризации, а также для рекрутирования и взаимодействия сосудов с перицитами и гладкими мышечными клетками; такие явления способствуют созреванию и стабильности новообразованных сосудов [P.C. Maisonpierre et al., (1997) Science 277, 55-60]. Lin et al., (1997) J. Clin. Invest. 100, 8: 2072-2078, и Lin P., (1998) PNAS 95, 8829-8834, показали ингибирование роста и опухолевой васкуляризации, а также уменьшение метастазов в легком при инфицировании аденовирусами или инъекциях внеклеточного домена Tie-2 (Tek) в моделях ксенографов опухоли молочной железы и меланомы.
Ингибиторы Tie2 могут применяться в случаях, когда неоваскуляризация происходит несоответствующим образом (то есть при диабетической ретинопатии, хроническом воспалении, псориазе, саркоме Капоши, хронической неоваскуляризации, обусловленной макулярным вырождением, ревматоидном артрите, гемангиоме детского возраста и раковых заболеваниях).
Определения
Термин "галоген" относится к элементу, выбираемому из F, Cl, Br и I.
Термин "алкил" относится к линейному или разветвленному насыщенному углеводородному заместителю, содержащему от 1 до 12 атомов углерода. Заместители метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, гексил, 1-метилпентил, 2-метилпентил, 1-этилбутил, 2-этилбутил, 3,3-диметилбутил, гептил, 1-этилпентил, октил, нонил, децил, ундецил и додецил представляют собой примеры алкильных заместителей.
Термин "алкилен" относится к линейному или разветвленному углеводородному заместителю, содержащему одну или несколько ненасыщенных двойных связей и от 2 до 12 атомов углерода. Заместители этенил, 1-метилэтенил, проп-1-енил, проп-2-енил, Z-1-метилпроп-1-енил, E-1-метилпроп-1-енил, Z-1,2-диметилпроп-1-енил, E-1,2-диметилпроп-1-енил, бут-1,3-диенил, 1-метилиденилпроп-2-енил, Z-2-метилбут-1,3-диенил, E-2-метилбут-1,3-диенил, 2-метил-1-метилиденилпроп-2-енил, ундец-1-енил и ундец-10-енил представляют собой примеры алкиленовых заместителей.
Термин "алкинил" относится к линейному или разветвленному углеводородному заместителю, содержащему по меньшей мере одну ненасыщенную тройную связь по двум вицинальным атомам углерода и от 2 до 12 атомов углерода. Заместители этинил, проп-1-инил, проп-2-инил и бут-1-инил представляют собой примеры алкинильных заместителей.
Термин "арил" относится к моно- или полициклическому ароматическому заместителю, содержащему от 6 до 14 атомов углерода. Заместители фенил, нафт-1-ил, нафт-2-ил, антрацен-9-ил, 1,2,3,4-тетрагидронафт-5-ил и 1,2,3,4-тетрагидронафт-6-ил представляют собой примеры арильных заместителей.
Термин "гетероарил" относится к моно- или полициклическому гетероароматическому заместителю, содержащему от 1 до 13 атомов углерода и от 1 до 4 гетероатомов. Заместители пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, фурил, тиенил, имидазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, 1,2,4-триазолил, оксадиазолил, тиадиазолил, тетразолил, пиридил, пиримидил, пиразинил, 1,3,5-триазинил, индолил, бензо[b]фурил, бензо[b]тиенил, индазолил, бензимидазолил, азаиндолил, хинолил, изохинолил, карбазолил и акридил представляют собой примеры гетероарильных заместителей.
Термин "гетероатом" относится в данном случае к по меньшей мере двухвалентному атому, отличающемуся от углерода. N, O, S и Se представляют собой примеры гетероатомов.
Термин "циклоалкил" относится к циклическому насыщенному или частично ненасыщенному углеводородному заместителю, содержащему от 3 до 12 атомов углерода. Заместители циклопропил, циклобутил, циклопентил, циклопентенил, циклопентадиенил, циклогексил, циклогексенил, циклогептил, бицикло[2.2.1]гептил, циклооктил, бицикло[2.2.2]октил, адамантил и пергидронафтил представляют собой примеры циклоалкильных заместителей.
Термин "гетероциклил" относится к циклическому насыщенному или частично ненасыщенному углеводородному заместителю, содержащему от 1 до 13 атомов углерода и от 1 до 4 гетероатомов. Предпочтительно циклический насыщенный или частично ненасыщенный углеводородный заместитель является моноциклом и содержит 4 или 5 атомов углерода и от 1 до 3 гетероатомов.
Термин "замещенный" относится к одному или нескольким заместителям, отличающимся от H, таким, как, например, галоген, алкил, арил, гетероарил, циклоалкил, гетероциклил, алкилен, алкинил, OH, O-алкил, O-алкилен, O-арил, O-гетероарил, NH2, NH-алкил, NH-арил, NH-гетероарил, N-алкил-алкил', SH, S-алкил, S-арил, S(O2)H, S(O2)-алкил, S(O2)-арил, SO3H, SO3-алкил, SO3-арил, CHO, C(O)-алкил, C(O)-арил, C(O)OH, C(O)O-алкил, C(O)O-арил, OC(O)-алкил, OC(O)-арил, C(O)NH2, C(O)NH-алкил, C(O)NH-арил, NHCHO, NHC(O)-алкил, NHC(O)-арил, NH-циклоалкил, NH-гетероциклил, CONH-гетероциклил, CO-гетероарил, CO-гетероциклил, NHCO-гетероарил, NHCO-гетероциклил, NHCONH-алкил.
Настоящее изобретение относится также к способу получения соединений формулы (I).
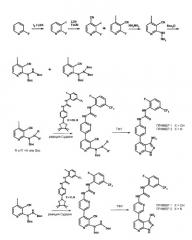
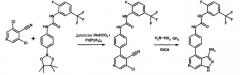
Соединения по настоящему изобретению могут быть получены, исходя из традиционных способов органической химии. Приведенная далее схема 1 представляет собой иллюстрацию к способу, использованному для получения по примеру 1, относящемуся к пиразоло[3,4-b]пиридинам. В этом качестве она не представляет собой ограничения пределов изобретения в том, что относится к способам получения соединений по настоящему изобретению.
Схема 1
Приведенная далее схема 2 представляет собой иллюстрацию к способу, использованному для получения по примерам, относящимся к пиразоло[4,3-c]пиридинам. В этом качестве она не представляет собой ограничения пределов изобретения в том, что относится к способам получения соединений по настоящему изобретению.
Схема 2
Схема 3
Способ получения пиразоло[3,4-c]пиридинов (неограничительный):
Приведенная далее схема 4 представляет собой иллюстрацию к способу, использованному для получения по примерам, относящимся к цепочкам производных боронатов.
Схема 4
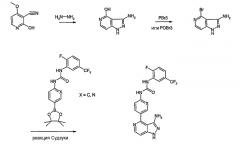
Приведенная далее схема 5 представляет собой иллюстрацию к способу, использованному для получения 4-иод-1Н-пиразоло[3,4-b]пиридин-3-иламина.
Схема 5
Приведенная далее схема 6 представляет собой иллюстрацию к способу, использованному для получения карбамидных производных 4-бром-1H-пиразоло[4,3-b]пиридин-3-иламина.
Схема 6
Приведенная далее схема 7 представляет собой иллюстрацию к альтернативному способу, использованному для получения по примерам, относящимся к пиразоло[4,3-c]пиридинам.
Схема 7
Приведенная далее схема 8 представляет собой иллюстрацию к альтернативному способу, использованному для получения пиразоло[3,4-c]пиридинов.
Схема 8
Специалисту в данной области техники понятно, что для осуществления способов по настоящему изобретению, описанных ранее, может оказаться необходимым введение групп, защищающих функциональные амино- карбокси- и спиртовую гидроксигруппы для того, чтобы избежать вторичных реакций. Такими группами являются группы, допускающие их удаление без затрагивания остальной части молекулы. В качестве примеров групп, защищающих аминогруппу, можно упомянуть трет-бутилкарбамат, который может быть восстановлен посредством трифторуксусной кислоты или иодтриметилсилана, ацетил, который может быть восстановлен в кислой среде (например, в соляной кислоте). В качестве групп, защищающих карбоксигруппу, можно упомянуть сложные эфиры (например, метоксиметиловый сложный эфир, бензиловый сложный эфир). В качестве групп, защищающих спиртовую гидроксигруппу, можно упомянуть сложные эфиры (например, бензоиловый сложный эфир), которые могут быть восстановлены в кислой среде или каталитическим гидрированием. Другие защитные группы, приемлемые для использования, описаны Т.W. GREENE et coll. в издании Protective Groups in Organic Synthesis, third edition, 1999, Wiley-Interscience.
Другим объектом настоящего изобретения являются соединения общей формулы (II):
где X, Y, Z имеют такие же значения, как и определенные ранее, а G представляет собой атом галогена, приемлемый в реакции сочетания Судзуки, в качестве промежуточных соединений для получения соединений общей формулы (I), таких как определено в п.1.
Другим объектом настоящего изобретения являются соединения общей формулы (III):
где
X, Y, Z имеют такие же значения, как и определенные ранее;
X3 представляет собой Ar-L-A, где Ar, L и A имеют такие же значения, как и определенные ранее, или Ar-L, где Ar имеет такие же значения, как и определенные ранее, а L представляет собой NH2 или NO2;
X1 и X2 являются различными и независимо выбираются из CN, Cl, -NH-NH2, -N(Boc)-NH(Boc), -N(Boc)-N(Boc)2, в качестве промежуточных соединений для получения соединений общей формулы (I), таких как определено в п.1.
Соединения формулы (I) могут быть выделены и очищены известными традиционными способами, например, перекристаллизацией, хроматографией или экстракцией.
Энантиомеры, диастереоизомеры соединений формулы (I) составляют в равной мере часть данного изобретения.
Соединения формулы (I), содержащие основный остаток, могут быть, при необходимости, превращены в аддитивные соли неорганических или органических кислот действием таких кислот в среде растворителя, например органического растворителя, такого, как спирт, кетон, простой эфир или хлорсодержащий растворитель.
Соединения формулы (I), содержащие кислотный остаток, могут быть, при необходимости, превращены в соли металлов или в аддитивные соли с азотсодержащими основаниями согласно известным способам. Такие соли могут быть получены действием оснований металлов (например, щелочных или щелочноземельных), таких, как аммиак, амин или соль амина, на соединение формулы (I) в растворителе. Образовавшуюся соль отделяют традиционными способами.
Такие соли также составляют часть настоящего изобретения.
Если соединение по настоящему изобретению содержит по меньшей мере одну свободную основную группу, то фармацевтически приемлемые соли могут быть получены взаимодействием между упомянутым соединением и неорганической или органической кислотой. Фармацевтически приемлемыми солями являются хлориды, нитраты, сульфаты, гидросульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты, дигидрофосфаты, метафосфаты, пирофосфаты, ацетаты, пропионаты, акрилаты, 4-гидроксибутираты, каприлаты, капронаты, капринаты, оксалаты, малонаты, сукцинаты, глутараты, адипаты, пимелинаты, малеаты, фумараты, цитраты, тартраты, лактаты, фенилацетаты, манделаты, себацинаты, субераты, бензоаты, фталаты, метансульфонаты, п-толуолсульфонаты, пропансульфонаты, ксиленсульфонаты, салицилаты, циннаматы, глютаматы, аспартаты, глюкуронаты, галактуронаты.
Если соединение по настоящему изобретению содержит по меньшей мере одну свободную кислотную группу, то фармацевтически приемлемые соли могут быть получены взаимодействием между упомянутым соединением и неорганическим или органическим основанием. Фармацевтически приемлемыми основаниями являются гидроксиды катионов щелочных или щелочноземельных металлов, таких как Li, Na, K, Mg, Ca, щелочные аминосоединения, такие, как аммиак, аргинин, гистидин, пиперидин, морфолин, пиперазин, триэтиламин.
В настоящем изобретении описаны также следующие далее примеры, приведенные в качестве иллюстраций к настоящему изобретению.
Анализы ЖХ/МС производили на приборе Micromass модели LCT, связанном с прибором HP 1100. Содержание соединений измеряли с помощью диодно-матричного детектора HP G1315A в диапазоне волн 200-600 нм и детектора рассеяния света Sedex 65. Запись масс-спектров осуществляли в диапазоне от 180 до 800. Данные анализировали с использованием программы Micromass MassLynx. Разделение осуществляли на колонке Hypersil BDS C18, 3 мкм (50 Ч 4,6 мм), элюируя с линейным градиентом от 5 до 90% раствором ацетонитрила, содержащим 0,05% (об./об.) трифторуксусной кислоты (ТФУ), в воде, содержащей 0,05% (об./об.) ТФУ, в течение 3,5 мин при скорости подачи 1 мл/мин. Общее время анализа, включая время установления равновесия в колонке, составляет 7 мин.
Масс-спектры МС записывали в режиме электроспрея (ЭС+) на приборе Platform II (Micromass). Описывали главные наблюдаемые ионы.
Температуры плавления измеряли в капилляре на приборе Mettler FP62 в диапазоне от 30 до 300°C при скорости подъема температуры 2°C в минуту.
Очистка способом ЖХ/МС
Продукты могут быть очищены способом ЖХ/МС с использованием системы Waters FractionsLynx, состоящей из насоса градиента Waters модели 600, насоса регенерации Waters модели 515, насоса разбавления Waters Reagent Manager, автоинжектора Waters модели 2700, двух клапанов Rheodyne модели LabPro, диодно-матричного детектора Waters модели 996, масс-спектрометра Waters модели ZMD и коллектора фракций Gilson модели 204. Система функционирует под управлением программой Waters FractionLynx. Разделение осуществляли попеременно на двух колонках Waters Symmetry (C18, 5 мкм, 19 Ч 50 мм, номер по каталогу 186000210), причем пока одну колонку регенерировали смесью вода/ацетонитрил, 95/5 (об./об.), содержащей 0,07% (об./об.) трифторуксусной кислоты, другая колонка работала в режиме разделения. Элюирование колонок осуществляли с использованием линейного градиента от 5 до 95% раствора ацетонитрила, содержащего 0,07% (об./об.) трифторуксусной кислоты, в воде, содержащей 0,07% (об./об.) трифторуксусной кислоты, при скорости подачи 10 мл/мин. На выходе из разделяющей колонки одна тысячная часть выходящего потока отделяется посредством устройства LC Packing Accurate, разбавляется метиловым спиртом со скоростью подачи 0,5 мл/мин и направляется к детекторам из расчета 75% к диодно-матричному детектору, а оставшиеся 25% к масс-спектрометру. Остаток выходящего потока (999/1000) направляется к коллект