Способ получения ферментативного гидролизата сывороточных белков со средней степенью гидролиза
Иллюстрации
Показать всеСпособ включает получение белкового раствора, его пастеризацию, ферментативный гидролиз панкреатином, ультра- и диафильтрацию полученного гидролизата с разделением на фильтрат и концентрат, сушку. При этом перед внесением фермента начальное значение рН белкового раствора устанавливают 5%-ым водным раствором смеси щелочей гидроксида калия и гидроксида натрия, взятых в соотношении 2:1 соответственно. Белковый раствор получают из сухого концентрата сывороточного белка, а гидролиз ведут при фермент-субстратном соотношении 1,5-2,5%, при температуре 48-54°С в течение 3-3,5 часов, с начальным рН 7,9-8,3. Ультра- и диафильтрацию гидролизата осуществляют на мембранах с пропускной способностью по мол.м. 20 кДа до массовой доли сухих веществ в концентрате 18-20%. После чего полученный концентрат разбавляют до содержания сухих веществ 4-5% и повторно подают на ультра- и диафильтрацию. Полученный фильтрат первого и второго прогона концентрируют нанофильтрацией на мембранах с пропускной способностью по мол.м. 1,0 кДа до массовой доли сухих веществ 15-17%. Полученный наноконцентрат, содержащий очищенный гидролизат, сгущают, затем пастеризуют при 76-80°С в течение 45-75 с. Способ позволяет получить ферментативный гидролизат сывороточных белков с повышенной пищевой и биологической ценностью, повышенным качеством, улучшенными органолептическими свойствами, сниженной потенциальной аллергенностью, что дает возможность его использования в гипоаллергенных смесях с улучшенными органолептическими свойствами, сниженной потенциальной аллергенностью. 3 табл., 3 ил.
Реферат
Изобретение относится к молочной промышленности, в частности к получению очищенных гидролизатов сывороточных белков молока с высокой биологической ценностью, используемых при производстве широкого ассортимента гипоаллергенных продуктов питания для детей и взрослых, страдающих различными формами пищевой непереносимости.
Известен способ получения частичного гидролизата молочных белков (при соотношении сывороточные/казеин от 40/60 до 80/20), включающий гидролиз, концентрирование и сушку, см. US №5405637, НКИ 426/580, 11.04.1995 г. Гидролиз осуществляют в одну стадию под действием смеси трипсина и химотрипсина, при этом белок предварительно термически денатурируют при 70÷80°С. Гидролиз проводят в 4÷6% растворе субстрата при фермент-субстратном соотношении 0,6÷0,8% при температуре 30÷50°С 2÷6 часов. Устанавливают исходный рН 7,5÷8 и далее в ходе процесса не рН-статируют, позволяя рН опуститься до величины 6,6÷6,8. Далее проводят термическую инактивацию фермента при температуре 80÷90°С, концентрирование и сушку. Гидролизат используют в продуктах непосредственно, без дальнейшей очистки. По данным иммуноферментного анализа (проводимого в варианте метода торможения непрямого иммуноферментного теста) антигенность гидролизата снижается на 75÷95% в сравнении с исходным белком. Приведены исследования молекулярно-массового распределения методом эксклюзионной жидкостной хроматографии высокого давления на колонке TSK, которые, однако, были получены в водно-органических средах и поэтому недостаточно адекватно отражают состав гидролизата.
Аналогичный метод получения "частичных" гидролизатов молочного белка приводится в патенте США №5589357, НКИ 435/68.1, 31.12.1996 г. В отличие от указанной выше работы инактивацию смеси трипсин+химитрипсин в гидролизате проводят острым паром.
Недостатки представленных выше аналогов следующие:
- дополнительно необходима стадия термической инактивации фермента, которая может приводить к ухудшению качества продукта (снижению биологической ценности из-за потери части незаменимых аминокислот);
- непосредственно после проведения гидролиза и инактивации ферментов гидролизат сушат без дополнительной очистки. Это приводит к тому, что в состав продукта попадают остаточные количества нерасщепленного белкового субстрата и компоненты ферментных препаратов, которые могут сами по себе обладать аллергенным действием, что ухудшает качество продукта и снижает возможность его использования в гипоаллергенных смесях;
- степень снижения антигенности получаемого продукта составляет 75÷95%, что соответствует снижению в 4÷20 раз. Этого крайне недостаточно для использования данного гидролизата в гипоаллергенных продуктах питания. В составе гипоаллергенных смесей профилактического назначения степень снижения антигенных свойств должна составлять 104 (10.000) раз или более;
- в ходе проведения процесса производится мониторинг молекулярно-массового распределения пептидов методом эксклюзионной хроматографии на колонке TSK G-2000 SWXL. Однако при этом применяется растворитель, содержащий ацетонитрил, что может исказить результаты анализа, а именно привести к занижению содержания пептидов с молекулярными массами более 10 кДа (килодальтон), вследствие выпадения их в осадок при растворении в подвижной фазе, содержащей ацетонитрил. При этом следует отметить, что степень потери белково-пептидного материала зависит от концентрации ацетонитрила в подвижной фазе; это делает результаты анализа неопределенными.
Известен способ получения гидролизата, включающий гидролиз белка молочной сыворотки, сушку, см. US №5039532, НКИ 426/41, 13.08.1991 г. Предлагается двухстадийный гидролиз белка молочной сыворотки трипсином, смесью трипсин-химотрипсин или панкреатином. Первую стадию гидролиза проводят в 10÷15% растворе белка при рН 8,0 (рН-статирование осуществляют добавлением Ca(ОН)2 или КОН), фермент-субстратном соотношении 5% и температуре 50°С в течение 4 часов. Получаемый "гидролизат 1" нагревают до 80÷100°С 5 мин под действием острого пара, после чего охлаждают до 50°С и вносят вторую порцию фермента в количестве 1,3% от субстрата. Гидролиз проводят в течение 2 часов. Фермент инактивируют нагреванием до 80÷100°С. Получаемый "гидролизат 2" позиционируется как свободный от основных аллергенов молока и пригодный для использования в гипоаллергенных продуктах питания. В качестве метода оценки степени элиминации антигенных структур сыворотки в ходе заявляемого процесса предложен метод электрофореза в полиакриламидном геле (ЭФ в ПААГ) с окраской красителем Кумасси G-250. Данному аналогу присущи следующие недостатки:
- при подведении рН может использоваться гидроокись кальция. Это приводит к дополнительному поступлению ионов кальция в продукт, что в дальнейшем может затруднить составление питательной смеси, сбалансированной по минеральному составу (в особенности по соотношению кальций-фосфор);
- так же, как и в предыдущем аналоге, гидролизат после термической инактивации не подвергается дополнительной очистке, а поступает непосредственно на сушку. Это приводит к тому, что в состав продукта попадают остаточные количества нерасщепленного белкового субстрата и компоненты ферментных препаратов, которые могут сами по себе обладать аллергенным действием, что ухудшает качество продукта и снижает возможность его использования в гипоаллергенных смесях;
- применяемый метод оценки качества продукта с помощью ЭФ в ПААГ недостаточно чувствителен и не позволяет выявить остаточные количества нерасщепленного белкового субстрата долей менее 0,001 (0,1%) по массе общего белка образца, что не может гарантировать снижения антигенных свойств продукта до уровня, безопасного для больных с риском развития аллергии к белкам коровьего молока.
Наиболее близким по техническому решению к заявляемому способу является способ получения ферментативного гидролизата сывороточных белков, включающий получение белкового раствора, его пастеризацию, ферментативный гидролиз его панкреатином, ультрафильтрацию и диафильтрацию полученного гидролизата с разделением на фильтрат и концентрат, сгущение фильтрата и его сушку, см. US №4427658, НКИ 514/2, 24.01.1984 г.
В способе описано получение панкреатинового гидролизата молочной сыворотки, в котором более 70÷90% азота находится в форме пептидов с длиной цепи менее 10 аминокислот (размеры пептидов в работе подробно не оценивали, анализ содержания нерасщепленного белка проводили методом ЭФ в ПААГ). Процесс ведут до тех пор, пока образец не перестает осаждаться 12% ТХУ, рН процесса 7÷9, предпочтительно 7,0÷8,5 (поддерживают постоянным рН статированием - добавлением гидроксидов или карбонатов калия, натрия или кальция или аммиака), температура процесса 40÷45°С. Утверждается, что при этой температуре создаются достаточно неблагоприятные условия для развития микроорганизмов, и вместе с тем достаточно медленно происходит тепловая инактивация компонентов ферментного препарата. Фермент-субстратное соотношение 8÷15% (предпочтительно 12%) по массе, концентрация субстрата 8% по массе раствора. Для ультрафильрации / диафильтрации используют полкарбонатные мембраны Millipore с пропускной способностью по молекулярной массе (мол.м.) 5÷50 кДа (килодальтон). Особое внимание уделяется удалению из образца сыворотки нерастворимых фракций белка и липопротеидов, которые могут затруднить процесс фильтрации. Удаление осуществляется посредством предварительного центрифугирования раствора сывороточных белков.
Вместе с тем, метод-прототип не лишен определенных недостатков, которые могут быть преодолены в настоящем заявляемом способе. Эти недостатки следующие:
- температура проведения гидролиза 40÷45°С недостаточно велика для проявления панкреатином максимально возможного уровня своей активности. Это приводит к тому, что для проведения процесса с достаточно высокой скоростью необходимо добавлять значительные количества панкреатина (8÷15% по массе белкового субстрата), что, во-первых, удорожает получаемый продукт и, во-вторых, приводит к накоплению в нем избыточных количеств низкомолекулярных компонентов ферментного препарата животного происхождения (таких, как нуклеотиды), что может потенциально отрицательно сказаться на органолептических свойствах и пищевой ценности гидролизата, используемого в качестве белкового компонента специализированных продуктов питания;
- необходимо постоянное рН-статирование путем добавления растворов щелочи, что делает конечный продукт (гидролизат) несвободным от значительных количеств солей (калия, натрия, кальция или аммония), а также свободных аминокислот. Это ухудшает качество продукта, так как увеличивается его осмолярность, что способно отрицательно повлиять на усвоение продукта в организме; продукт становится несбалансированным по минеральному составу, что затрудняет его использование в составе детских гипоаллергеных смесей. В совокупности это приводит к ухудшению качества продукта;
- оценка степени расщепления антигенных структур белкового субстрата проводится с помощью метода ЭФ в ПААГ и осаждения ТХУ, которые недостаточно чувствительны и не могут гарантировать должного уровня элиминации (удаления) аллергенных белков из продукта. В совокупности это может отрицательно сказаться на качестве продукта.
Технический результат заявляемого изобретения заключается в получении ферментативного гидролизата сывороточных белков с повышенной пищевой и биологической ценностью, повышенным качеством, улучшенными органолептическими свойствами, сниженной потенциальной аллергенностью, что дает возможность его использования в гипоаллергенных смесях с улучшенными органолептическими свойствами, сниженной потенциальной аллергенностью.
Технический результат достигается тем, что в способе получения ферментативного гидролизата сывороточных белков, включающем получение белкового раствора, его пастеризацию, ферментативный гидролиз панкреатином, ультра- и диафильтрацию полученного гидролизата с разделением на фильтрат и концентрат, сушку, перед внесением фермента начальное значение рН белкового раствора устанавливают 5% водным раствором смеси щелочей гидроксида калия и гидроксида натрия, взятых в соотношении 2:1 соответственно, белковый раствор получают из сухого концентрата сывороточного белка, а гидролиз ведут при фермент-субстратном соотношении 1,5÷2,5%, температуре 48÷54°С в течение 3÷3,5 часов, с начальным рН 7,9÷8,3, ультра- и диафильтрацию гидролизата осуществляют на мембранах с пропускной способностью по мол.м. 20 кДа до массовой доли сухих веществ в концентрате 18÷20%, после чего полученный концентрат разбавляют до содержания сухих веществ 4÷5%) и повторно подают на ультра- и диафильтрацию, полученный фильтрат первого и второго прогона концентрируют нанофильтрацией на мембранах с пропускной способностью по мол.м. 1,0 кДа до массовой доли сухих веществ 15÷17%, полученный наноконцентрат, содержащий очищенный гидролизат, сгущают, затем пастеризуют при 76÷80°С в течение 45÷75 с.
Заявляемый результат достигается в результате сочетания следующих факторов: оптимальные параметры фермент-субстратного соотношения, температуры и времени проведения гидролиза, щадящие режимы тепловой обработки субстрата (отсутствие стадии термической инактивации ферментного препарата) - двухкратная ультрафильтрационная очистка с применением диафильтрации, нанофильтрационное фракционирование, пастеризация, сгущение, сушка.
Экспериментально было установлено, что фермент-субстратное соотношение 1,5÷2,5% является оптимальным. Отклонение в меньшую сторону приводит к сохранению в реакционной смеси значительных количеств высокомолекулярных белковых структур, удаляемых на стадии ультрафильтрации, что, во-первых, снижает выход гидролизата по белку, а во-вторых, повышает риск загрязнения конечного продукта (гидролизата) остаточными количествами антигенных структур и, следовательно, приводит к снижению пищевой ценности продукта, ухудшению его качества. Отклонение по содержанию фермента в большую сторону приводит, во-первых, к увеличению образования свободных аминокислот и дипептидов, удаляемых из продукта на стадии нанофильтрационного фракционирования, что снижает выход конечного продукта и поэтому нецелесообразно с экономической точки зрения. Во-вторых, при этом повышается содержание в составе продукта относительно коротких пептидов, содержащих ароматические аминокислоты, которые могут придать продукту выраженный горький вкус и, следовательно, ухудшить его органолептические свойства, пищевую и биологическую ценность, качество. В-третьих, при этом увеличивается расход ферментного препарата, что увеличивает себестоимость продукта и приводит к накоплению в нем низкомолекулярных продуктов автолиза ферментного препарата, обладающих потенциально аллергенными или токсическими свойствами.
Экспериментально было установлено, что температура гидролиза составляет 48÷54°С. Отклонение в меньшую сторону ниже 48°С нежелательно, т.к. приводит к увеличенному содержанию остающихся в реакционной смеси негидролизованных высокомолекулярных белковых структур, что снижает выход получаемого продукта, а также приводит к увеличению бактериального роста, а следовательно, к ухудшению пищевой и биологической ценности, снижению качества, повышению потенциальной аллергенности. Отклонение в большую сторону (свыше 54°С) также нежелательно, т.к. приводит к ускорению процесса термической инактивации ферментного препарата, что влечет за собой снижение степени гидролиза и уменьшение выхода готового продукта. Кроме того, это приводит к перерасходу энергии на поддержание температуры в ходе процесса и последующее охлаждение готового продукта, что вызывает увеличение себестоимости продукта.
В отличие от предлагаемого способа, в прототипе температура проведения гидролиза 40÷45°С недостаточно велика для проявления панкреатином максимально возможного уровня своей активности. Это замедляет и усложняет процесс, а также требует внесения дополнительных количеств фермента, что может потенциально отрицательно сказаться на себестоимости и качестве продукта. Кроме того, более низкая температура (40÷45°С) не является оптимальной с точки зрения микробиологии, так как повышает риск контаминации продукта санитарно-показательной и условно патогенной микрофлорой.
Проведение протеолиза панкреатином при установлении начального рН 7,9÷8,3 (оптимально 8,0÷8,1) (которое в течение гидролиза постепенно снижается) позволяет не проводить в дальнейшем рН-статирование (постоянное добавление щелочи для поддержания рН), что уменьшает количество солей, поступающих в продукт, и, следовательно, улучшает его качество и повышает выход готового продукта в ходе нанофильтрационного фракционирования.
Установление исходного значения рН выше 8,3 требует дополнительного количества щелочи, что вызывает увеличение содержания золы в продукте, но при этом не приводит к существенному увеличению степени гидролиза. Установление исходного значения рН ниже 7,9 приводит к снижению скорости гидролиза ввиду закисления реакционной смеси и ее быстрого выхода из диапазона рН, оптимального для действия панкреатина, следствием чего является сохранение в реакционной смеси значительных количеств негидролизованного белка, что отрицательно сказывается на выходе продукта.
Регулирование рН осуществляют 5%-ым раствором смеси щелочей КОН (гидроксида калия) и NaOH (гидроксида натрия), взятых в массовом соотношении 2:1 соответственно (данное соотношение калия и натрия является оптимальным с точки зрения физиологических потребностей организма человека). В результате проводимых в дальнейшем процессов мембранной очистки данное соотношение калия и натрия в продукте не изменяется, поскольку селекивность применяемых мембран (как ультра-, так и нанофильтрационных) в отошении гидратированных ионов К+ и Na+ практически одинакова. Вследствие этого соотношение калия и натрия в конечном продукте оказывается оптимальным с точки зрения содержания этих минералов в продуктах детского питания, и, тем самым, коррекция минерального состава путем внесения дополнительных количеств солей калия или натрия не требуется или требуется в значительно меньшей степени, чем при ином исходом вносимом соотношении обеих шелочей. Это упрощает технологию поизводства специализированных продуктов на основе патентуемого гидролизата, повышает их пищевую ценность и снижает себестоимость.
Ультрафильтрационная обработка гидролизата позволяет удалить высокомолекулярную фракцию (ВМФ) - остаточные количества негидролизованного сывороточного белка, белки ферментного препарата, жир.
Экспериментально было установлено, что ультра- и диафильтрация неочищенного гидролизата на мембранах с размерами пор (пропускная способность по молекулярной массе) 20 кДа позволяет получить гидролизат белков молочной сыворотки как с максимальным выходом, так и с требуемым снижением остаточной антигенности. Использование мембран с большими размерами пор приводит к недопустимому увеличению остаточной антигенности, а мембраны с меньшей пористостью снижают выход гидролизата, что нецелесообразно с экономической точки зрения.
Также экспериментально было установлено, что для увеличения выхода конечного продукта полученный концентрат после ультра- и диафильтрации необходимо вернуть на повторную ультра- и диафильтрацию в виде 4÷5%-ного водного раствора, что позволяет добиться максимального выхода готового продукта при минимальном времени процесса. Разбавление концентрата до содержания сухих веществ менее 4% нежелательно, так как в получаемом фильтрате содержание сухих веществ будет слишком низким, что осложняет процесс концентрирования нанофильтрацией. Разбавление концентрата до содержания сухих веществ выше 5% приводит к тому, что ультрафильтрационные мембраны забиваются и процесс останавливается.
Нанофильтрация является по современным представлениям единственным применимым в промышленных масштабах методом разделения гидролизата на фракцию средних пептидов и аминокислотно-олигопептидную смесь и также единственным методом эффективного обессоливания гидролизата. Использование нанофильтрации позволяет снизить осмолярность пептидного препарата; уменьшить содержание в нем солей калия и натрия, избыточное содержание которых в продуктах детского питания недопусимо, так как вызывает дополнительную нагрузку на функционально незрелую систему органов выделения у ребенка; уменьшить горечь продукта до приемлемого уровня; улучшить функциональные свойства продукта, а именно его эмульгирующую способность по отношению к жиру, что может сделать излишним использование искусственных пищевых добавок-эмульгаторов, что повышает качество продукта.
Экспериментально было установлено, что нанофильтрацию на мембранах с пропускной способностью по мол.м. 1 кДа желательно проводить до массовой доли сухих веществ в концентрате 15÷17%. Большая, чем 17%, доля сухих веществ в концентрате приводит к резкому возрастанию давления в нанофильтрационной установке и замедлению процесса. Менее 15% концентрация сухих веществ нецелесообразна с экономической точки зрения, так как при этом требуются дополнительные затраты на удаление воды в процессе концентрирования или распылительной сушки.
Пастеризация продукта необходима для улучшения его микробиологических показателей. Уменьшение температуры пастеризации ниже заявленного диапазона значений приводит к возрастанию риска микробной контаминации гидролизата и продукта на его основе при их последующем хранении. Повышение температуры пастеризации выше заявленных значений может привести к потерям ряда незаменимых аминокислот (в первую очередь лизина и триптофана), что снижает биологическую ценность продукта, а также к накоплению в нем потенциально токсичных продуктов термической деструкции аминокислот, что отрицательно влияет на пищевую и биологическую ценность продукта, снижает его качество и органолептические свойства.
Заявляемая совокупность признаков позволяет получить ферментативный гидролизат сывороточных белков с повышенной биологической и пищевой ценностью, улучшенным качеством и органолептическими свойствами, сниженной потенциальной аллергенностью. Это дает возможность его использования в гипоаллергенных смесях с улучшенными органолептическими свойствами, сниженной потенциальной аллергенностью.
Отклонение от заявляемых признаков в большую или меньшую сторону приводит к снижению пищевой и биологической ценности получаемого гидролизата, ухудшению его качества и органолептических свойств, повышению потенциальной аллергенности.
В отличие от прототипа в заявляемом изобретении степень удаления (элиминации) нерасщепленного белка и антигенных структур из продукта контролируется более чувствительными и специфичными методами эксклюзионной жидкостной хроматографии высокого давления и иммуноферментного анализа, которые адекватны поставленной задаче. Это позволяет получить продукт более высокого качества с меньшим содержанием нерасщепленных белков и аллергенов, по сравнению со способом-прототипом, где данные методы контроля не применяются.
Качественные преимущества получаемого гидролизата заключаются в следующем:
- в низкой осмолярности.
Известно, чем ниже осмоляльность, тем выше способность к ассимиляции белкового гиролизата и содержащего его продукта в целом в организме человека. Низкая осмолярность получаемого в соответствии с заявляемым способом гидролизата позволяет использовать его как в получении продуктов профилактического и лечебного питания для больных пищевой аллергией с сохранной функцией пищеварения, так и для больных с нарушениями функции пищеварения и всасывания (например, для терапевтического питания в палатах интенсивной терапии), для которых принципиально важна легкая усвояемость белкового компонента продукта при пероральном и энтеральном зондовом (как внутрижелудочном, так и при необходимости внутрикишечном) введении;
- в низкой остаточной антигенности.
Благодаря этому гидролизат в качестве белкового компонента может быть использован для получения продуктов для профилактического питания детей и взрослых, предрасположенных к пищевой аллергии и непереносимости белков коровьего молока;
- в высокой биологической ценности.
Сбалансированное содержание незаменимых аминокислот в составе гидролизата обеспечивает его высокую биологическую ценность, то есть максимально эффективное усвоение в организме и способность использоваться в пластических целях (то есть для построения собственных белков организма). Это преимущество особенно важно для использования гидролизата в питании истощенных больных с отрицательным азотистым балансом, находящихся в состоянии гиперкатаболизма/гиперметаболизма, при травме, ожоге, других стрессорных воздействиях, в пред- и послеоперационном периоде (в том числе при операциях на органах брюшной полости), у онкологических больных, переносящих лучевую и химиотерапию.
Способ получения ферментативного гидролизата сывороточных белков со средней степенью гидролиза осуществляется следующим образом.
Сухой концентрат сывороточных белков (КСБ) растворяют при постоянном перемешивании в питьевой воде с температурой 43÷47°С до образования раствора с массовой долей сухих веществ (белок, жир, лактроза, соли) 4÷5%, охлаждают до 4÷8°С и оставляют набухать в течение 3÷3,5 часов при перемешивании по 5 минут каждые 30 минут. Полученный раствор сывороточных белков пастеризуют при температуре 70÷74°С с выдержкой 15÷17 с и охлаждают до температуры 50÷54°С и подают на ферментативный гидролиз.
Ферментативный гидролиз раствора сывороточных белков ведут с использованием промышленного ферментного препарата «Pancreatin 6NF» или «Pancreatin 8NF» фирмы Unibios (Италия), при фермент-субстратном соотношении 1,5÷2,5% в течение 3÷3,5 часов.
Перед внесением фермента однократно доводят начальное значение рН раствора сывороточных белков до 7,9-8,3% 5%-ым раствором смеси щелочей KОН и NaOH, взятых в массовом соотношении 2:1 соответственно. В процессе гидролиза рН понижается до величины 6,1÷6,2.
Фермент панкреатин в количестве 2% от массы сухих веществ КСБ предварительно растворяют в питьевой воде с температурой 30÷40°С до образования раствора с массовой долей сухих веществ 9÷10% и при постоянном перемешивании вносят в раствор сывороточных белков. Ферментативный гидролиз ведут при температуре 48÷54°С в течение 3÷3,5 часов.
По окончании гидролиза полученный неочищенный гидролизат охлаждают до 35÷40°С и направляют на ультра- и диафильтрацию.
Неочищенный гидролизат сывороточных белков (ГСБ) разделяют на ультрафильтрационной установке с пропускной способностью мембран 20 кДа, давлении 4÷6 Бар на концентрат, содержащий высокомолекулярную фракцию (ВМФ), и фильтрат (первого прогона), содержащий низкомолекулярную фракцию (НМФ) - пептидный гидролизат. Для увеличения выхода НМФ в процессе ультрафильтрационной обработки в установку подают диафильтрационную воду, подогретую до температуры 38÷42°С, в количестве, необходимом для поддержания массовой доли сухих веществ в концентрате в пределах 18÷20%.
Полученный концентрат с массовой долей сухих веществ 18÷20% разбавляют технологической водой до содержания сухих веществ 4÷5% и повторно пропускают через ультрафильтрационную установку, что позволяет обеспечить более полный выход НМФ. Получают фильтрат (второго прогона) и концентрат с повторно сгущенной ВМФ. Последний охлаждают до 2÷6°С, собирают в емкость промежуточного хранения и отправляют, например, на корм скоту. Остатки НМФ из установки проталкивают технологической водой до содержания сухих веществ в фильтрате не более 0,01%.
Полученный фильтрат первого и второго прогона с массовой долей сухих веществ 2÷4%, температурой 30÷32°С направляют на нанофильтрацию.
Фильтрат концентрируют на установке нанофильтрации с пропускной способностью мембран по молекулярной массе 1 кДа до содержания сухих веществ в полученном наноконцентрате 15÷17%. Нанофильтрат (минеральные соли и часть свободных аминокислот) отправляют в дренаж. А наноконцентрат, содержащий очищенный гидролизат, охлаждают до 2÷6°С и отправляют в промежуточную емкость. Остатки гидролизата из установки проталкивают технологической водой до содержания сухих веществ в наноконцентрате не более 0,01%. Гидролизат сгущают на вакуум-выпарной установке до массовой доли сухих веществ 45÷50%. Затем сгущенную смесь пастеризуют при 76÷80°С с выдержкой 45÷75 с и направляют на распылительную сушку.
Сушку сгущенного гидролизата осуществляют при следующих режимах:
- температура воздуха на входе в сушильную башню -170÷180°С;
- температура воздуха на выходе из сушильной башни - 75÷85°С.
В процессе сушки продукт непрерывно поступает в инстантайзер, где он охлаждается, собирается в контейнеры (биг-беги) и направляется на промежуточное хранение.
Полученный сухой гидролизат охлаждают, фасуют и направляют на хранение.
Окончательный контроль качества полученного гидролизата осуществляется после проведения распылительной сушки хроматографическим и иммунохимическим методами. Кроме этого, хроматографический и иммунохимические методы оценки качества используются после вакуум-выпаривания перед распылительной сушкой в качестве предварительных контрольных тестов. Аналитические определения проводят согласно следующим методикам.
Молекулярно-массовое распределение белков и пептидов в исходных белковых субстратах и получаемых гидролизатах оценивают методом эксклюзионной хроматографии. Используют хроматографическую колонку с характеристиками пористости, наиболее подходящими для получаемых гидролизатов молочных белков, например колонку высокого давления TSK GEL G2000 SWLX (HP, США), 0,8×30 см. В качестве элюента используют нейтральный водно-солевой буферный раствор с ионной силой не менее 0,15 М, например 0,05 М калий фосфорнокислый однозамещенный с 0,15 М хлористым натрием рН 7,0 и 0,01% азидом натрия или 0,2 М хлористый натрий с добавлением 0,01% азида натрия. Скорость элюирования составляет 0,15-0,25 мл/мин, пептиды в элюате регистрируют с помощью проточного УФ-детектора в диапазоне длин волн от 220 до 280 нм. Колонку калибруют по набору водорастворимых глобулярных белков в диапазоне молекулярных масс (и, соответственно, времен удерживания) от свободного до полного объема.
После 3-4 месяцев использования (в зависимости от изменения хроматографических характеристик, таких как время удерживания, эффективность разделения, давление) хроматографические колонки подвергают регенерации (по методикам фирм-изготовителей) и повторной калибровке. Стандартные графики зависимости времен удержания от молекулярных масс стандартов строят по методу кубической регрессии (подбор коэффициентов полинома третьей степени с помощью метода наименьших квадратов). Содержание пептидов в диапазонах молекулярных масс, определенных с помощью калибровочной кривой, проводят после установления на хроматограмме нулевой линии методом весового интегрирования.
Определение остаточной антигенности ферментативных гидролизатов проводят методом торможения непрямого твердофазного иммуноферментного теста. При проведении анализа образцы сухих гидролизатов восстанавливают дистиллированной водой. В лунки стандартных плоскодонных полистирольных планшет вносят по 1 мкг антигена белка коровьего молока или белка молочной сыворотки в 100 мкл 0,1 М Na-бикарбонатного буфера рН 9,8. Проводят адсорбцию 16 ч при +2 - +8°С. Затем лунки отмывают трижды 0,01 М K-фосфатным буфером рН 7,3±0,1 с 0,15 М NaCl (PBS), содержащим 0,1% Твин-20. В лунки вносят на 30 мин по 200 мкл 1% раствора желатины («пищевая») в PBS. Отмывку PBS-Твин повторяют, и планшеты тщательно высушивают встряхиванием на марлевой подушечке. В лунки А-Н ряда 1 планшеты вносят (в двух репликах) по 100 мкл растворов тестируемых гидролизатов или их разведений в PBS с добавлением 0,5% нормальной лошадиной сыворотки (НЛС). В лунки А-Н ряда 12 вносят по 100 мкл PBS-НЛС. В ряды (столбцы) 2-11 планшеты вносят по 100 мкл антисыворотки больного человека, содержащей полиспецифические антитела к антигенам коровьего молока в разведении, отвечающем сигналу (оптической плотности) в тесте непрямого ИФА, равному 1,0-1,5 о.е. Разведения выполняют в PBS с 0,5% НЛС. Немедленно после этого в лунки А-Н столбца 1 планшеты вносят по 100 мкл вдвое более концентрированного раствора той же антисыворотки в том же разбавителе и титруют ряды 1-10 в серии двоичных разведений с помощью 8-канальной пипетки.
Планшеты инкубируют на встряхивателе 2 ч при комнатной температуре, после чего 5-кратно отмывают PBS-Твин. Во все лунки вносят по 100 мкл антител кролика против IgG человека, меченных пероксидазой, в разведении, указанном изготовителем на упаковке препарата. Инкубацию (2 ч) и отмывку PBS- Твин повторяют. Далее в лунки вносят по 100 мкл субстрата: 0,04% о-фенилендиамин с 0,04% перекиси водорода в 0,1 М Na-цитратно-фосфатном буфере рН 6,0±0,1. Планшеты инкубируют 20 мин при 37°С в воздушном термостате в темноте. Реакцию останавливают по секундомеру добавлением 100 мкл 1,0 н серной кислоты. Измеряют оптическую плотность при длине волны 492 нм на автоматическом иммуноферментном анализаторе против воздуха.
Для каждого разведения пробы и нулевого образца (столбец 11) рассчитывают связывание метки по формуле:
В=[(D1+D2)-(b1+b2)]/2, где D - оптическая плотность пробы (в двух повторах), а b - оптическая плотность бланка (ряд 12), также в двух повторах.
Далее для каждой пробы рассчитывают ингибирование ИФА по формуле:
I%=100×(Во-В)/Во, где Во - связывание метки для нулевого образца (ряд 11). Строят график в координатах: ось абсцисс - логарифм концентрации общего белка образца, мг/мл; ось ординат - I%. По этому графику определяют концентрацию образца IС50, отвечающую 50% ингибированию (возможно использование метода линейной интерполяции).
Параллельно с тестируемым образцом проводят определение IС50 для стандарта - нативного белка молочной сыворотки. Рассчитывают остаточную АГ (массовую долю антигенов молочной сыворотки) исследуемого гидролизата по формуле:
АГ=[IC50(st)/IC50(пр)], где IC50(st) - концентрация 50%-ного ингибирования стандарта (белка молока или молочной сыворотки), а IС50(пр) концентрация 50%-ного ингибирования изучаемого продукта.
Пример 1
1800 кг сухого концентрата сывороточных белков растворяют при постоянном перемешивании в питьевой воде с температурой 44°С до образования раствора с массовой долей сухих веществ (белок, жир, лактроза, соли) 5,0%, охлаждают до 6°С и оставляют набухать в течение 3,5 часов при перемешивании по 5 мин каждые 30 мин. Полученный раствор сывороточных белков пастеризуют при температуре 72°С с выдержкой 16 с затем охлаждают до температуры 53,8°С и подают на ферментативный гидролиз.
Ферментативный гидролиз раствора сывороточных белков ведут с использованием промышленного ферментного препарата «Pancreatin 6NF» фирмы Unibios (Италия) при фермент-субстратном соотношении 2% (2% от массы сухих веществ КСБ, то есть 36 кг) в течение 3 часов.
Перед внесением фермента доводят начальное значение рН раствора КСБ до 8,16 5%-ым раствором смеси щелочей KОН и NaOH, взятых в массовом соотношении 2:1 соответственно. Приготовление раствора щелочей: 12,6 кг КОН и 6,4 кг NaOH растворяют в 361 л воды с температурой 40°С и при постоянном перемешивании вносят в раствор КСБ до достижения нужного значения рН.
Фермент панкреатин в количестве 36 кг предварительно растворяют в 324 л питьевой воды с температурой 40°С (до образования раствора с массовой долей сухих веществ 10%) и при постоянном перемешивании вносят в вышеприготовленный раствор КСБ.
Ферментативный гидролиз ведут при температуре 53,4°С при постоянном контроле за температурой, в течение 3 часов; рН реакционной смеси снижалось в процессе гидролиза до значения 6,2.
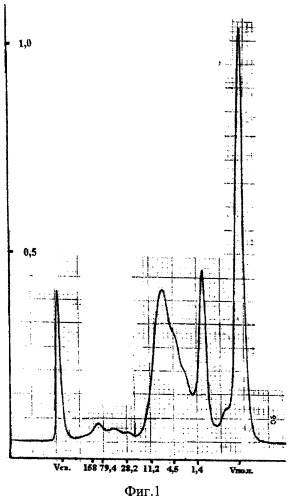
После 3 часов гидролиза отбирают пробу неочищенного гидролизата (проба 1) и исследуют методом эксклюзионной хроматографии высокого давления (определение молекулярно-массового распределения), см. таблицу 1. На фиг.1 представлена хроматограмма неочищеннного гидролизата (проба 1). По оси ординат отложены оптические плотности при длине волны 280 нм (в относительных единицах), по оси абсцисс - молекулярные массы (в кДа). Массовая доля антигенов молочной сыворотки пробы 1 составляет 2,2×10-4, осмоляльность 10% раствора 240 мОсм/кг.
По окончании гидролиза полученный неочищенный гидролизат охлаждают до 40°С и направляют на ультра- и диафильтрацию на мембранах с пропускной способностью по молекулярной массе 20 кДа. Используют полисульфоновые мембраны UF DHT 20-6338/30FF. Гидролизат разделяют на концентрат, содержащий ВМФ, и фильтрат, содержащий НМФ.
Для увеличения выхода НМФ в процессе ультрафильтрационной обработки в установку подают диафильтрационную воду в объеме около 8000 л, подогретую до температуры 40°С. Получают фильтрат первого прогона (около 41000 литров) с массовой долей сухих веществ 3,2%. Отобранную пробу исследуют методом эксклюзионной хроматографии высокого давления для оценки молекулярно-масового распределения (проба 2). Данные представлены в таблице 1. На фиг.2 приведена эксклюзионная хроматограмма этой пробы. Массовая доля антигенов молочной сыворотки пробы 2-3,0×10-5; осмоляльность 10% раствора 280 мОсм/кг.
Полученные около 1900 л концентрата с массовой долей сухих веществ 18,5% разбавляют технологической водой до содержания сухих веществ 5% и повторно пропускают через ультра- и диафильтрационную установку. Это позволяет обеспечить более полный выход НМФ, содержащейся в фильтрате. Конечный остаток ВМФ (около 1500 л) с массовой долей сухих веществ 11,6% охлаждают до 4°С, собирают в емкость промежуточного хранения и отправляют на корм скоту. Остатки НМФ из установки проталкивают технологической водой до содержания сухих веществ в фильтрате 0,01%. Получают около 6500 л фильтрата (второго прогона) с массовой долей сухих веществ 2,9%.
Фильтрат первого прогона и фильтрат второго прогона с температурой 32°С подают на нанофильтрацию с пропускной способностью мембран по молекулярной массе 1 кДа. Используют полисульфонов