Новые производные гидантоина в качестве ингибиторов металлопротеиназ
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным гидантоина общей формулы I, где R1 представляет собой циклобутил или циклопропил; где указанная группа циклопропил возможно дополнительно замещена СН3; R2 представляет собой C1-3алкил или циклопропил; и А, А1 и В независимо представляют собой СН или N. Также изобретение относится к способу получения соединений формулы I, фармацевтической композиции на его основе, его применение для изготовления лекарственного средства и способу ингибирования металлопротеиназ, основанному на использовании соединения формулы I. Технический результат: получены новые производные гидантоина, обладающий активностью ингибитора металлопротеиназ. 5 н. и 6 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к новым производным гидантоина, к способам их получения, к фармацевтическим композициям, содержащим их, и к их применению в терапии.
Металлопротеиназы представляют собой надсемейство протеиназ (ферментов), число которых в последние годы резко возросло. На основании структурных и функциональных соображений эти ферменты классифицированы на семейства и подсемейства, как описано в N.M.Hooper (1994) FEBS Letters 354: 1-6. Примеры металлопротеиназ включают матриксные металлопротеиназы (ММР), такие как коллагеназы (ММР1, ММР8, ММР13), желатиназы (ММР2, ММР9), стромелизины (ММРЗ, ММР10, ММР11), матрилизин (ММР7), металлоэластаза (ММР12), энамелизин (ММР19), МТ-ММР (ММР14, ММР15, ММР16, ММР17); репролизин или адамализин или семейство MDC, которое включает секретазы и шеддазы, такие как TNF-превращающие ферменты (ADAM 10 и ТАСЕ); семейство астацина, которое включает такие ферменты, как проколлаген-процессирующая протеиназа (РСР); и другие мателлопротеиназы, такие как аггреканаза, семейство эндотелинпревращающих ферментов и семейство ангиотензинпревращающих ферментов.
Считают, что металлопротеиназы важны при множестве физиологических болезненных процессов, в которые вовлечено ремоделирование ткани, таких как эмбриональное развитие, образование костей и ремоделирование матки во время менструации. Это основано на способности металлопротеиназ к расщеплению широкого ряда матриксных субстратов, таких как коллаген, протеогликан и фибронектин. Также считают, что металлопротеиназы важны при процессинге или секреции биологически значимых клеточных медиаторов, таких как фактор некроза опухоли (TNF); и при посттрансляционном протеолитическом процессинге или шеддинге биологически значимых мембранных белков, таких как рецептор IgE CD23 низкого аффинитета (более полный перечень см. в N.М.Hooper et at, (1997) Biochem. J. 321:265-279).
Металлопротеиназы связаны со многими заболеваниями или состояниями. Ингибирование активности одной или более чем одной металлопротеиназы может быть весьма полезным при этих заболеваниях или состояниях, например: при различных воспалительных и аллергических заболеваниях, таких как воспаление суставов (в частности ревматоидный артрит, остеоартрит и подагра), воспаление желудочно-кишечного тракта (в частности, воспалительное кишечное заболевание, неспецифический язвенный колит и гастрит), воспаление кожи (в частности, псориаз; экзема, дерматит); при метастазировании или инвазии опухоли; при заболевании, связанном с неконтролируемым разрушением внеклеточного матрикса, таком как остеоартрит; при заболевании, связанном с резорбцией костей (таком как остеопороз и болезнь Педжета); при заболеваниях, связанных с аберрантным ангиогенезом; при повышенном ремоделировании коллагена, связанном с диабетом, при заболевании периодонта (таком как гингивит), изъязвлении роговицы, изъязвлении кожи, при послеоперационных состояниях (таких как анастомоз ободочной кишки) и заживлении кожных ран; при демиелинизирующих заболеваниях центральной и периферической нервной системы (таких как рассеянный склероз); при болезни Альцгеймера; при ремоделировании внеклеточного матрикса, наблюдаемом при сердечнососудистых заболеваниях, таких как рестеноз и атеросклероз; при астме; рините и хронических обструктивных болезнях легких (ХОБЛ).
ММР12, также известная как макрофагальная эластаза или металлоэластаза, была впервые клонирована у мыши Shapiro et al [1992, Journal of Biological Chemistry 262: 4664] и у человека той же группой исследователей в 1995 г. ММР12 предпочтительно экспрессируется в активированных макрофагах, и показано, что она секретируется из альвеолярных макрофагов от курильщиков [Shapiro et al, 1993, Journal of Biological Chemistry, 268: 23824], а также в пенистых клетках в атеросклеротических повреждениях (Matsumoto et at, 1998, Am. J. Pathol. 153: 109]. Мышиная модель ХОБЛ основана на провокации мышей сигаретным дымом в течение шести месяцев, две сигареты в сутки шесть суток в неделю. У мышей дикого типа после этой обработки развивалась легочная эмфизема. Когда нокаут-мышей по ММР12 тестировали в данной модели, у них не развивалась значительная эмфизема, что является сильным доказательством того, что ММР12 является ключевым ферментом в патогенезе ХОБЛ. Роль ММР, таких как ММР12, при ХОБЛ (эмфиземе и бронхите) обсуждается в Anderson and Shinagawa, 1999, Current Opinion in Anti-inflammatory and Immunomodulatory Investigational Drugs 1.(1): 29-38. Недавно было сделано открытие, что курение повышает инфильтрацию макрофагов и экспрессию ММР-12 макрофагального происхождения в бляшках Кангавари сонной артерии человека [Matetzky S, Fishbein МС et al, Circulation 102: (18) 36-39 Suppl. S, Oct 31, 2000].
MMP9 (желатиназа В; 92 кДа коллагеназа типа IV; 92 кДа желатиназа) представляет собой секретируемый белок, который был впервые очищен, затем клонирован и секвенирован в 1989 году [S.M.Wilhelm et al (1989) J. Biol. Chem. 264 (29): 17213-17221; поправки опубликованы в J. Biol. Chem. (1990) 265 (36): 22570]. Недавний обзор по MMP9 дает великолепный источник подробной информации и ссылок на эту протеазу: Т.Н.Vu & Z.Werb (1998) (In: Matrix Metalloprofeinases, 1998, edited by W.C.Parks & R.P.Mecham, pp.115-148, Academic Press. ISBN 0-12-545090-7). Приведенные ниже положения взяты из этого обзора Т.Н.Vu & Z.Werb (1998).
Экспрессия MMP9 в норме ограничена немногими клеточными типами, включая трофобласты, остеокласты, нейтрофилы и макрофаги. Однако экспрессия может быть индуцирована в тех же самых клетках и в других типах клеток несколькими медиаторами, включая воздействие на клетки факторов роста или цитокинов. Они являются теми же медиаторами, которые часто вовлечены в инициацию воспалительного ответа. Как и другие секретируемые ММР, MMP9 высвобождается в виде неактивного профермента, который впоследствии расщепляется с образованием активного фермента с ферментативной активностью. Протеазы, необходимые для этой активации in vivo, неизвестны. Баланс активной MMP9 против неактивного фермента дополнительно регулируется in vivo взаимодействием с TIMP-1 (тканевым ингибитором металлопротеиназ-1), встречающимся в природе белком. TIMP-1 связывается с С-концевой областью ММР9, что приводит к ингибированию каталитического домена ММР9. Объединение баланса индуцированной экспрессии про-ММР9, расщепление про-ММР9 до активной ММР9 и присутствие Т1МР-1 определяет количество каталитически активной ММР9, которое присутствует в локальном сайте. ММР9 с протеолитической активностью атакует субстраты, которые включают желатин, эластин и нативные коллагены типа IV и типа V; она не обладает активностью против нативного коллагена типа I, протеогликанов или ламининов.
Существует все нарастающая масса данных, приписывающих роли ММР9 в различных физиологических и патологических процессах. Физиологические роли включают инвазию эмбриональных трофобластов через эпителий матки на ранних стадиях эмбриональной имплантации; некоторую роль в росте и развитии костей и миграции воспалительных клеток из сосудистой системы в ткани.
Высвобождение ММР9, измеренное с использованием ферментативного иммунологического анализа, значительно усиливалось в жидкостях и в надосадочных жидкостях AM от астматиков без лечения по сравнению с таковыми от других популяций [Am. J. Resp. Cell & Mol. Biol., Nov 1997, 17 (5):583-591]. Повышенную экспрессию ММР9 также наблюдали при некоторых других патологических состояниях, в результате чего была приписана роль ММР9 в болезненных процессах, таких как ХОБЛ, артрит, метастазы опухоли, болезнь Альцгеймера, рассеянный склероз и разрыв бляшек при атеросклерозе, приводящий к острым коронарным состояниям, таким как инфаркт миокарда.
Ряд ингибиторов металлопротеиназ известен (см., например, обзоры ингибиторов ММР Beckett R.P. and Whittaker M., 2998, Exp. Opin. Ther. Patents, 8(3); 259-282; и Whittaker M. Et al, 1999, Chemical Reviews 99 (9): 2735-2776).
В WO 02/074767 раскрыты производные гидантоина формулы
которые полезны в качестве ингибиторов ММР, в частности в качестве эффективных ингибиторов ММР12.
Теперь авторы изобретения открыли еще одну группу производных гидантоина, которые являются ингибиторами металлопротеиназ и представляют особый интерес при ингибировании таких ММР, как ММР12 и ММР9. Соединения по настоящему изобретению обладают благоприятной эффективностью, селективностью и/или фармакокинетическими свойствами.
В соответствии с настоящим изобретением предложены соединения формулы (I)
где
R1 представляет собой циклобутил или циклопропил; где указанная группа циклопропил возможно дополнительно замещена СН3, CN, либо одним или двумя атомами фтора;
R2 представляет собой C1-3алкил или циклопропил; и
А, А1 и В независимо представляют собой СН или N;
и их фармацевтически приемлемые соли.
Соединения формулы (I) могут существовать в энантиомерных формах. Должно быть понятно, что все энантиомеры, диастереомеры, рацематы, а также их смеси включены в объем изобретения.
Соединения формулы (I) могут существовать в различных таутомерных формах. Все возможные таутомеры и их смеси включены в объем изобретения.
В одном воплощении R1 представляет собой циклопропил; где указанная группа циклопропил возможно дополнительно замещена одним или двумя атомами фтора.
В одном воплощении R1 представляет собой циклопропил.
В одном воплощении R2 представляет собой метил или этил. В одном воплощении
R2 представляет собой метил.
В одном воплощении каждый из А и А1 независимо представляет собой N. В другом воплощении А представляет собой N, а А1 представляет собой CH.
В одном воплощении В представляет собой N. В другом воплощении В представляет собой CH.
В одном воплощении R1 представляет собой циклопропил; R2 представляет собой метил или этил; каждый из А и А1 представляет собой N; и В представляет собой СН.
В одном воплощении R1 представляет собой циклопропил; R2 представляет собой метил или этил; каждый из А и А1 представляет собой N; и В представляет собой N.
В одном воплощении R1 представляет собой циклопропил; R2 представляет собой метил или этил; А представляет собой N, и А1 представляет собой СН; и В представляет собой N.
В одном воплощении R1 представляет собой циклопропил; R2 представляет собой метил или этил; А представляет собой N, и А1 представляет собой СН; и В представляет собой СН.
В одном воплощении R1 представляет собой циклопропил; где указанная группа циклопропил возможно дополнительно замещена СН3, CN, либо одним или двумя атомами фтора; R2 представляет собой C1-3алкил, и А, А1 и В независимо представляют собой СН или N.
Если не указано иное, термин "C1-3алкил", относящийся к данному описанию, означает прямоцепочечную или разветвленную алкильную группу, имеющую от 1 до 3 атомов углерода. Примеры таких групп включают метил, этил, н-пропил и изопропил.
Примеры циклопропильного кольца, возможно дополнительно замещенного одним или двумя атомами фтора, включают 1-фтор-1-циклопропил, 2,2-дифтор-1-циклопропил и 2,3-дифтор-1-циклопропил:
Примеры соединений по изобретению включают:
(5S)-5-({[6-(2-циклопропилпиримидин-5-ил)-3,4-дигидроизохинолин-2(1H)-ил]сульфонил}метил)-5-метилимидазолидин-2,4-дион;
(5S)-5-({[6-(6-циклопропилпиридин-3-ил)-3,4-дигидро-2,7-нафтиридин-2(1H)-ил]сульфонил}метил)-5-метилимидазолидин-2,4-дион;
(5S)-5-({[6-(2-циклопропилпиримидин-5-ил)-3,4-дигидро-2,7-нафтиридин-2(1H)-ил]сульфонил}метил)-5-метилимидазолидин-2,4-дион;
(5S)-5-({[6-(2-циклопропилпиримидин-5-ил)-3,4-дигидро-2,7-нафтиридин-2(1H)-ил]сульфонил}метил)-5-этилимидазолидин-2,4-дион;
(5S)-5-({[6-(2-циклопропилпиримидин-5-ил)-3,4-дигидроизохинолин-2(1H)-ил]сульфонил}метил)-5-этилимидазолидин-2,4-дион;
(5S)-5-({[6-(2-циклобутилпиримидин-5-ил)-3,4-дигидроизохинолин-2(1H)-ил]сульфонил}метил)-5-метилимидазолидин-2,4-дион;
(5S)-5-метил-5-({[6-[2-(1-метилциклопропил)пиримидин-5-ил]-3,4-дигидроизохинолин-2(1Н)-ил]сульфонил}метил)имидазолидин-2,4-дион;
(5S)-5-циклопропил-5-({[6-(2-циклопропилпиримидин-5-ил)-3,4-дигидроизохинолин-2(1H)-ил]сульфонил}метил)имидазолидин-2,4-дион;
и их фармацевтически приемлемые соли.
Каждое представленное в качестве примера соединение представляет конкретный и независимый аспект изобретения.
Соединения формулы (I) могут существовать в энантиомерных формах. Следовательно, все энантиомеры, диастереомеры, рацематы, а также их смеси включены в объем изобретения. Различные оптические изомеры можно выделить путем разделения рацемической смеси соединений, используя общепринятые методики, например фракционную кристаллизацию или ВЭЖХ (высокоэффективная жидкостная хроматография). Альтернативно оптические изомеры могут быть получены путем асимметрического синтеза или путем синтеза из оптически активных исходных веществ.
Где оптические изомеры существует в соединениях по изобретению, авторы изобретения раскрыли все индивидуальные оптически активные формы и их комбинации как индивидуальные конкретные воплощения изобретения, а также их соответствующие рацематы.
Предпочтительно соединения формулы (I) имеют (5S)-стереохимию, как показано ниже:
Где таутомеры существует в соединениях по изобретению, авторы изобретения раскрыли все индивидуальные таутомерные формы и их комбинации как индивидуальные конкретные воплощения изобретения.
Настоящее изобретение включает соединения формулы (I) в форме солей. Приемлемые соли включают соли, образованные с органическими или неорганическими кислотами, либо с органическими или неорганическими основаниями. Такие соли обычно будут представлять собой фармацевтически приемлемые соли, хотя соли, не являющиеся фармацевтически приемлемыми, могут обладать пользой при получении и очистке конкретных соединений. Такие соли включают соли присоединения кислот, такие как соли гидрохлорид, гидробромид, цитрат, тозилат и малеат, и соли, образованные с фосфорной кислотой или серной кислотой. В другом аспекте приемлемые соли представляют собой соли оснований, такие как соль щелочного металла, например натрия или калия, соль щелочно-земельного металла, например кальция или магния, или соль органического амина, например триэтиламина.
Соли соединений формулы (I) можно образовать путем взаимодействия свободного основания или другой его соли с одним или более чем одним эквивалентом подходящей кислоты или основания.
Соединения формулы (I) являются полезными, поскольку они обладают фармакологической активностью у животных и, следовательно, потенциально полезны в качестве фармацевтических агентов. В частности, соединения по изобретению являются ингибиторами металлопротеиназ и, следовательно, могут применяться в лечении заболеваний или состояний, опосредованных ММР12 и/или ММР9, таких как астма, ринит, хронические обструктивные болезни легких (ХОБЛ), артрит (такой как ревматоидный артрит и остеоартрит), атеросклероз и рестеноз, рак, инвазия и метастазирование, заболевания, в которые вовлечено разрушение тканей, расшатывание эндопротезов тазобедренных суставов, заболевание периодонта, фиброзирующая болезнь, инфаркт и сердечное заболевание, фиброз печени и почек, эндометриоз, заболевания, связанные с ослаблением внеклеточного матрикса, сердечная недостаточность, аневризмы аорты, заболевания, связанные с ЦНС (центральная нервная система), такие как болезнь Альцгеймера и рассеянный склероз (PC) и гематологические расстройства.
В целом соединения по настоящему изобретению являются эффективными ингибиторами ММР9 и ММР12. Соединения по настоящему изобретению также проявляют хорошую селективность в плане относительного отсутствия ингибирования различных других ММР, таких как ММР8, ММР14 и ММР19.
Соответственно, в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль, как определено здесь выше, для применения в терапии.
В другом аспекте в изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь выше, в изготовлении лекарственного средства для применения в терапии.
В другом аспекте в изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь выше, в изготовлении лекарственного средства для применения в лечении заболеваний или состояний, при которых благоприятно ингибирование ММР12 и/или ММР9.
В другом аспекте в изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь выше, в изготовлении лекарственного средства для применения в лечении воспалительного заболевания.
В другом аспекте в изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь выше, в изготовлении лекарственного средства для применения в лечении обструктивного заболевания дыхательных путей, такого как астма или ХОБЛ.
В другом аспекте в изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь выше, в изготовлении лекарственного средства для применения в лечении ревматоидного артрита, остеоартрита, атеросклероза, рака или рассеянного склероза.
В контексте настоящего описания термин «терапия» также включает «профилактику», если нет конкретных противоречащих указаний. Термины «терапевтический» и «терапевтически» следует истолковывать соответственно.
Ожидают, что профилактика будет, в частности, релевантной для лечения людей, которые прежде страдали эпизодом или, иначе, считаются обладающими повышенным риском обсуждаемого заболевания или состояния. Люди, обладающие риском развития конкретного заболевания или состояния, как правило, включают людей, имеющих семейную историю этого заболевания или состояния, или тех, которые были идентифицированы с помощью генетического тестирования или скрининга как особенно склонные к развитию этого заболевания или состояния.
Далее в изобретении предложен способ лечения заболевания или состояния, при котором благоприятно ингибирование ММР12 и/или ММР9, включающий введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь выше.
В изобретении также предложен способ лечения обструктивного заболевания дыхательных путей, например астмы или ХОБЛ, включающий введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь выше.
Для вышеупомянутых терапевтических применений вводимая дозировка будет, разумеется, варьировать в зависимости от применяемого соединения, режима введения, желаемого лечения и расстройства, подлежащего лечению. Суточная дозировка соединения формулы (1)/соли (активного ингредиента) может находиться в интервале от 0,001 мг/кг до 75 мг/кг, в частности от 0,5 мг/кг до 30 мг/кг. Эту суточную дозу можно давать в разделенных дозах при необходимости. Типично стандартные лекарственные формы будут содержать примерно от 1 мг до 500 мг соединения по данному изобретению.
Соединения формулы (I) и их фармацевтически приемлемые соли можно применять как таковые, но, как правило, их будут вводить в форме фармацевтической композиции, в которой соединение формулы (1)/соль (активный ингредиент) находится в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем. В зависимости от режима введения, фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.% (процент по массе), более предпочтительно от 0,10 до 70 мас.% активного ингредиента и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,90 мас.% фармацевтически приемлемого адъюванта, разбавителя или носителя, где все проценты по массе основаны на суммарной композиции. Общепринятые методики выбора и изготовления подходящих фармацевтических препаратов описаны, например, в "Pharmaceuticals - The Science of Dosage Form Designs", M.E.Aulton, Churchill Livingstone, 1988.
Таким образом, в настоящем изобретении также предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как определено здесь выше, в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Далее в изобретении предложен способ изготовления фармацевтической композиции по изобретению, включающий смешивание соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь выше, с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Фармацевтические композиции по данному изобретению можно вводить стандартным способом для заболевания или состояния, которое желательно лечить, например, путем перорального, местного, парентерального, трансбуккального, назального, вагинального или ректального введения либо путем ингаляции. Для этих целей препараты соединений по данному изобретению можно готовить способами, известными в данной области техники, в форме, например, таблеток, капсул, водных или масляных растворов, суспензий, эмульсий, кремов, мазей, гелей, назальных спреев, суппозиториев, тонкоизмельченных порошков или аэрозолей для ингаляции и стерильных водных или масляных растворов или суспензий, либо стерильных эмульсий для парентерального применения (включая внутривенное, внутримышечное или инфузию).
В дополнение к соединениям по настоящему изобретению фармацевтическая композиция по данному изобретению может также содержать, либо ее можно совместно вводить (одновременно или последовательно) с одним или более чем одним фармацевтическим агентом, полезным при лечении одного или более чем одного заболевания или состояния, относящегося к вышеописанным, как, например, продукт "Symbicort" (торговая марка).
Далее в настоящем изобретении предложен способ получения соединения формулы (I) или его фармацевтически приемлемой соли, как определено здесь выше, включающий:
а) взаимодействие соединения формулы (II)
где R2 является таким, как определено в формуле (I), и L1 представляет собой уходящую группу, с соединением формулы (III) (или его солью)
где R1, А, А1 и В являются такими, как определено в формуле (I); либо
б) взаимодействие соединения формулы (V)
где R2 и В являются такими, как определено в формуле (I), и LG представляет собой уходящую группу, с производным бороновой кислоты формулы (XII)
где R1, А и А1 являются такими, как определено в формуле (I); либо
в) взаимодействие соединения формулы (IX)
где R1, R2, А, А1 и В являются такими, как определено в формуле (I), с карбонатом аммония и цианидом калия;
и, возможно, после этого образование его фармацевтически приемлемой соли.
В вышеописанном способе (а) подходящие уходящие группы L1 включают галогено, в частности хлоро, или трифторметилсульфонат. Реакцию предпочтительно проводят в подходящем растворителе, возможно в присутствии добавленного основания, в течение подходящего периода времени, типично от 0,5 до 16 ч, при температуре от температуры окружающей среды до температуры образования флегмы. Типично используют растворители, такие как N,N-диметилформамид, пиридин, тетрагидрофуран, ацетонитрил, N-метилпирролидин или дихлорметан. При использовании добавленного основания оно может представлять собой органическое основание, такое как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин или пиридин, или неорганическое основание, такое как карбонат щелочного металла. Реакцию типично проводят при температуре окружающей среды в течение от 0,5 до 16 ч или до достижения завершения реакции, что определяют хроматографическими или спектроскопическими методами. Реакции сульфонилгалогенидов с различными первичными и вторичными аминами хорошо известны в литературе, и вариации условий будут очевидны специалистам в данной области техники.
Сульфонилхлориды формулы (II), где L1 представляет собой хлоро, и R2 представляет собой Me, раскрыты в WO 02/074767 и ссылках, цитируемых там. Соответствующие соединения, где R2 представляет собой C1-3алкил, могут быть получены, используя аналогичные способы.
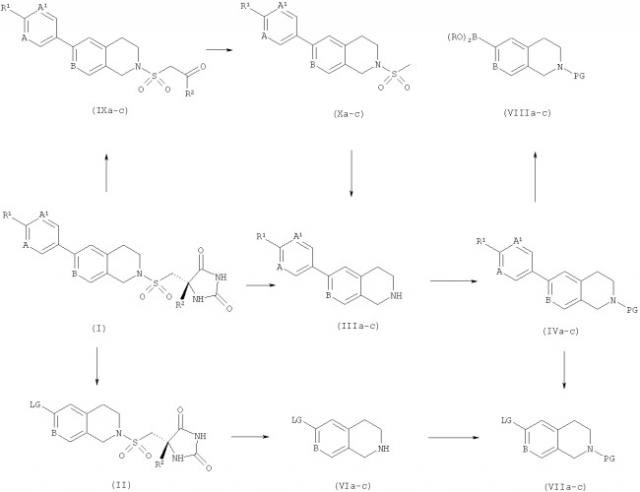
Пригодные способы получения соединений формулы (I) описаны ретросинтетическим образом на Схеме 1.
Схема 1
На Схеме 1 защитные группы (PG) могут представлять собой либо карбаматы (например трет-бутоксикарбамат), либо амиды (например, трифторацетил), либо алкил (например, третбутил или бензил). Уходящие группы (LG) могут представлять собой либо хлорид, бромид, йодид, либо трифторметилсульфонат. В катализируемых палладием сочетаниях Сузуки можно использовать либо бороновые кислоты, либо пинаколборонаты. Промежуточное соединение (IVa-c) может быть получено путем стандартного сочетания Сузуки (Chem. Rev. 1995, 95, 2457) между электрофилом (VIIa-с) и бороновым реагентом (XII), либо, иным путем, между электрофилом (XI) и бороновым реагентом (VIIIa-c). Последний может быть получен из (VIIa-c) с использованием стандартных условий Миаура (J. Org. Chem. 1995, 60, 7508-7510). В результате удаления защиты с (IVa-c) либо с помощью хлористого водорода в метаноле (PG = трет-бутоксикарбонил), либо с помощью смеси кипящий с обратным холодильником 1-хлорэтилхлорформиат/кипящий с обратным холодильником метанол (PG = третбутил или бензил) (Synlett. 1993, 195-196) получают амин (IIIa-c) в виде соли гидрохлорид. Свободное основание может быть получено путем обработки (IIIa-c) основанием и экстракции органическим растворителем, таким как этилацетат или толуол. В результате взаимодействия (IIIa-c) либо в виде соли, либо в виде основания в подходящем растворителе (например, в ацетонитриле, тетрагидрофуране, N-метилпирролидине или N,N-диметилформамиде) с сульфонилхлоридом (II) в присутствии третичного амина (например, триэтиламина, пиридина или N,N-диизопропилэтиламина) в течение 0,5-16 часов получают соединения формулы (I).
Альтернативный путь до соединений формулы (I) от промежуточного соединения (IIIa-c) через метансульфонамид (Ха-с) и кетон (IXa-c) описан ранее (WO 02/074767). Кратко, в результате обработки (IIIa-c) метансульфонилхлоридом и третичным амином (например, триэтиламином, пиридином или N,N-диизопропилэтиламином) в подходящем растворителе (например, дихлорметане или тетрагидрофуране) получают метансульфонамид (Ха-с), который, в свою очередь, можно превратить в кетон (IXa-c), используя стандартные методики. В результате нагревания кетона (IXa-c) с карбонатом аммония и цианидом калия в 50%-ном водном этаноле в герметичном флаконе при 80-90°С в течение 1-5 часов получают рацемический гидантоин, который можно разделить путем хиральной хроматографии (например, на OD-H со 100% этанола).
При третьем пути защиту с (VIIa-c) удаляют, как описано выше, с получением амина (VIa-c) в виде соли гидрохлорид. Свободное основание можно выделить путем обработки основанием и экстракции органическим растворителем, например этилацетатом или толуолом. В результате взаимодействия (VIa-c) либо в виде соли, либо в виде основания в подходящем растворителе (например ацетонитриле, тетрагидрофуране, N-метилпирролидине или N,N-диметилформамиде) с сульфонилхлоридом (II) в присутствии третичного амина (например, триэтиламина, пиридина или N,N-диизопропилэтиламина) в течение 0,5-16 часов получают хиральный сульфонамид (Va-c). Последний можно подвергнуть сочетанию с бороновым реагентом (XII), используя стандартные условия Сузуки, с получением соединений формулы (I).
Промежуточные соединения (VIIa-b) удобно получать, используя приведенные ниже способы.
Промежуточное соединение 1,2,3,4-тетрагидроизохинолин (VIIa)
Способы синтеза 1,2,3,4-тетрагидроизохинолинов хорошо известны в литературе. Классическим путем является реакция Померанца-Фрича бензальдегидов с защищенным ацеталем аминоацетальдегидом (Org. React. 1951, 6, 191) с получением изохинолинового ядра, которое после каталитического восстановления образует 1,2,3,4-тетрагидроизохинолины. Другим путем является реакция Бишлера-Напиральского (Org. React. 1951, 6, 74) карбамата 2-фенилэтанаминов с фосфорилхлоридом в кипящем с обратным холодильником толуоле или ксилолах. В результате восстановления полученного в результате циклического бензамида алюмогидридом лития в тетрагидрофуране (J. Med. Chem. 1987, 30 (12), 2208-2216) или дибораном в тетрагидрофуране (J. Med. Chem. 1980, 23 (5), 506-511) получают 1,2,3,4-тетрагидроизохинолин. Вариацией реакции Бишлера-Напиральского является синтез Пикте-Шпенглера (Org. React. 1951, 6, 151). При данной реакции амиды, карбаматы или сульфонамиды 2-фенилэтанаминов нагревают с параформальдегидом и сильными протонными кислотами (например, трифторуксусной кислотой, серной кислотой) или кислотами Льюиса в растворителе (например, дихлорметане, толуоле, муравьиной кислоте) с получением 1,2,3,4-тетрагидроизохинолина в одну стадию (Tetrahedron 2002, 58 (8), 1471-1478).
Схема 2
Реагенты:
а) (CF3CO)2О, Et3N; +4°С, b) (HCHO)n, H2SO4, НОАс; KT, с) NaBH4, EtOH; КТ или NH3 (конц.), EtOH, нагревание, d) (t-BuOCO)2O, Et3N, ДХМ, КТ.
Предпочтительно промежуточное соединение 1,2,3,4-тетрагидроизохинолин (VIIa) синтезируют с помощью пути А, показанного на схеме 2. Этот путь представляет собой реакцию типа Фриделя-Крафта N-[2-(3-бромфенил)этил]-2,2,2-трифторацетамида с формальдегидом и серной кислотой в уксусной кислоте (Tetrahedron Lett 1996, 37 (31), 5453-5456) с получением смеси 6-бром- и 8-бромизомера в отношении 3 к 1. В результате замены группы трифторацетамид ВОС-группой получают (VIIa). Региоизомеры неудобно разделять на этой стадии.
Промежуточное соединение 1,2,3.4-тетрагидро-2.7-нафтиридин (VIIb)
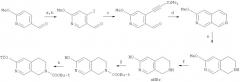
В противоположность 1,2,3,4-тетрагидроизохинолинам, в литературе существует достаточно мало примеров синтетических методов для 1,2,3,4-тетрагидро-2,7-нафтиридинов. Одним из важных способов получения 1,2,3,4-тетрагидро-2,7-нафтиридина является региоселективное каталитическое восстановление 2,7-нафтиридина (Eur. J. Med. Chem. Ther. 1996, 31 (11), 875-888). Синтез 2,7-нафтиридина и некоторых его производных описан в литературе. В один классический путь вовлечено несколько стадий, и он начинается с катализируемой кислотой конденсации малононитрила с диэтил-1,3-ацетондикарбоксилатом (J. Chem. Soc. 1960, 3513-3515; см. также J. Heterocycl. Chem. 1970, 7, 419-421). Несколько иной путь до 2,7-нафтиридина включает окисление 4-формил-2,7-нафтиридина с получением 2,7-нафтиридин-4-карбоновой кислоты с последующим декарбоксилированием (Synthesis 1973, 46-47). Полностью отличающийся способ основан на внутренней реакции Дильса-Альдера N-(этоксикарбонил)-N-(бут-3-инил)амино-метилпиразина и дает смесь 1,2,3,4-тетрагидро-2,7-нафтиридина и 5,6,7,8-тетрагидро-1,7-нафтиридина после гидролиза карбаматной группы (WO 02/064574).
Схема 3
Путь Б
Реагенты:
а) LiCH3NCH2CH2N(СН3)2, ТГФ, -70°C, b) н-BuLi в гексанах, -70°С, затем I2, с) ТМС-ацетилен, PdCl2(PPh3)2, CuI, Et3N, ТГФ, 60°С
d) 7 М NH3, EtOH, 80°C, e) H, PtO2, HOAc, f) 48% HBr (водн.), 120°С, д) (ВОС)2О, Et3N, H2O, ТГФ, h) Tf2O, PhMe, 30% K3PO4.
Предпочтительно промежуточное соединение 1,2,3,4-тетрагидро-2,7-нафтиридин (VIIb) можно синтезировать, как показано на схемах 3 и 4. При пути Б имеющийся в продаже 6-метоксиникотинальдегид последовательно обрабатывают литиевой солью N,N,N′-триметилэтилендиамина, затем н-BuLi в гексанах и, наконец, йодом с получением 4-йод-6-метоксиникотинальдегида (см. Tetrahedron Lett. 1993, 34 (39), 6173-6176). Это йодосоединение подвергают сочетанию с триметилсилилацетиленом в обычных условиях Сонагашира-Хагихара (Synthesis 1980, 627-630), и полученный в результате 6-метокси-4-[(триметилсилил)этинил]никотинальдегид конденсируют с гидроксидом аммония в этаноле с получением 3-метокси-2,7-нафтиридина (Synthesis 1999, 2, 306-311). В результате региоселективного каталитического восстановления (см. Eur. J. Med Chem. Ther. 1996, 31 (11), 875-888) получают 6-метокси-1,2,3,4-тетрагидро-2,7-нафтиридин. В результате деметилирования и N-защиты ВОС-ангидридом и, наконец, обработки полученного в результате третбутил-6-гидрокси-3,4-дигидро-2,7-нафтиридин-2(1H)-карбоксилата трифликовым ангидридом в двухфазной системе получают (VIIb).
Схема 4
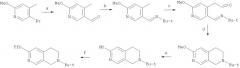
Путь В
Реагенты:
а) н-BuLi, ТГФ, -70°С, затем ДМФ, от -70°С до КТ, b) t-BuNH2, ДХМ, 3Е мол. сита, с) Li-TMP, -20°С, затем ДМФ, от -20 до -10°С, d) NaBH3CN, МеОН, HOAc; КТ, e) 48% HBr (водн.), кипячение с обратным холодильником; обработка K2CO3 (водн.), f) TF2O, пиридин, +4°С
При пути В имеющийся в продаже 5-бром-2-метокси-4-метилпиридин в безводном тетрагидрофуране подвергают металлированию с помощью н-BuLi, а затем обрабатывают N,N-диметилформамидом с получением 6-метокси-4-метилникотинальдегида. Это соединение превращают в третбутил и мин третбутиламином в дихлорметане. В результате металлирования с помощью литий-2,2,6,6-тетраметилпиперидина (Li-TMP) (см. J. Org. Chem. 1993, 58, 2463-2467) и добавления N,N-диметилформамида получают иминоацетальдегид, который восстанавливают цианоборгидридом натрия в метаноле с получением 2-третбутил-6-метокси-1,2,3,4-тетрагидро-2,7-нафтиридина. В результате отщепления метиловой группы кипящей с обратным холодильником 48%-ной бромисто-водородной кислотой и обработки трифликовым ангидридом в присутствии основания получают (VIIb), защищенный в виде третбутиламина.
Специалистам в данной области техники должно быть понятно, что в способах по настоящему изобретению некоторые потенциально реактивные функциональные группы, такие как гидроксил или аминогруппы, в исходных реагентах или промежуточных соединениях может быть необходимо защитить подходящими защитными группами. Таким образом, получение соединений по изобретению может включать на различных стадиях присоединение и удаление одной или более чем одной защитной группы.
Подходящие защитные группы и подробности способов присоединения и удаления таких групп описаны в 'Protective Groups in Organic Chemistry", edited by J.W.F. McOmie, Plenum Press (1973) и 'Protective Groups in Organic Synthesis', 3rd edition, T.W. Greene and P.G.M. Wuts, Wiley-lnterscience (1999).
Соединения по изобретению и промежуточные соединения к ним можно выделить из их реакционных смесей и, если необходимо, дополнительно очистить путем использования стандартных методик.
Теперь настоящее изобретение будет дополнительно объяснено со ссылкой на приведенные ниже иллюстративные примеры.
Общие способы
Спектры 1H ЯМР и 13С ЯМР записывали на приборе Varian Inova 400 МГц или Varian Mercury-VX 300 МГц. Центральные пики хлороформа-d (δH 7,27 м.д.), диметилсульфоксида-d6 (δH 2,50 м.д.), ацетонитрила-d3 (δH 1,95 м.д.) или метанола-d4
(δH 3,31 м.д.) использовали в качестве внутренних стандартов. Колоночную хроматографию проводили, используя силикагель (0,040-0,063 мм, Merck) с несколько повышенным давлением (0,2-0,4 бар (0,02-0,04 МПа)), прилагаемым к колонке. Для препаративной ВЭЖХ использовали колонку Kromasil KR-100-5-C18 (250×20 мм, Akzo Nobel) и смеси ацетонитрил/вода с 0,1% ТФУ при скорости тока 10 мл/мин. Если не указано иное, исходные вещества имелись в продаже. Все растворители и коммерческие реагенты имели лабораторную степень чистоты и использовались, как были получены. Органические фазы от экстракций высушивали над безводным сульфатом натрия, если не указано иное. Органические фазы или растворы концентрировали с помощью роторного выпаривания. Выходы не были оптимизированы.
Приведенный ниже способ использовали для анализа LC-MS (жидкостной хроматографии - масс-спектрометрии):
Прибор Agilent 1100; колонка Waters Symmetry 2,1×30 мм; масса APCI (химическая ионизация при атмосферном давлении; скорость тока 0,7 мл/мин; длина волны 254 или 220 нм; растворитель А: вода +0,1% ТФУ; растворитель Б: ацетонитрил +0,1% ТФУ; градиент 15-95% Б 2,7 мин, 95% Б 0,3 мин.
Приведенный ниже способ использовали для анализа GC-MS (газовой хроматографии - масс-спектрометрии):
Приб