Производные (индол-3-ил)гетероциклических соединений в качестве агонистов каннабиноидных рецепторов св1
Иллюстрации
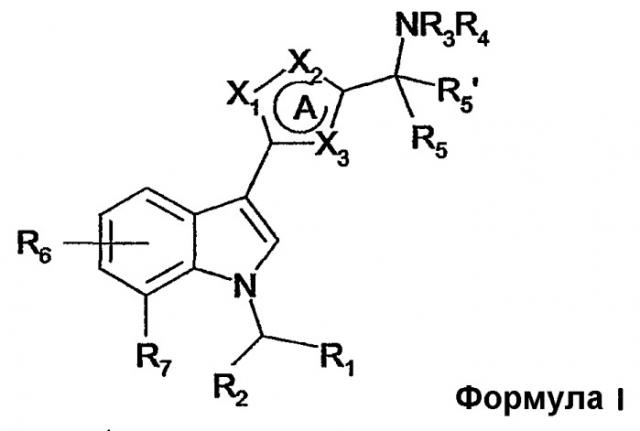
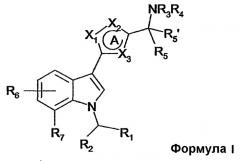
Показать всеИзобретение относится к новым производным (индол-3-ил)гетероциклическим соединениям формулы 1:
где А представляет собой 5-членное ароматическое гетероциклическое кольцо, где
Х1, Х2 и Х3 независимо выбирают из N, О, S, CR; R означает Н, (С1-4)алкил; или R, когда он присутствует в Х2 или Х3, может вместе с R3 образовывать 5-8-членное кольцо; R1 означает 5-8-членное насыщенное карбоциклическое кольцо, необязательно содержащее гетероатом О; R2 означает Н; или R2 соединен с R7 с образованием 6-членного кольца, необязательно содержащего гетероатом О, и где указанный гетероатом связан с положением 7 индольного кольца; R3 и R4 независимо означают Н, (С1-6)алкил, необязательно замещенный ОН, (С1-4)алкилокси; или R3 вместе с R4 и N, с которым они связаны, образует 4-8-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из О и S, и необязательно замещенное ОН, (С1-4)алкилом, (С1-4)алкилокси или (С1-4)алкилокси-(С1-4)алкилом; или R3 вместе с R5 образует 4-8-членное кольцо, необязательно замещенное ОН, (С1-4)алкилом, (С1-4)алкилокси; или R3 вместе с R, когда присутствуют в Х2 или Х3, образует 5-8-членное кольцо; R5 означает Н; или R5 вместе с R3 образует 4-8-членное кольцо, необязательно замещенное ОН, (С1-4)алкилом, (С1-4)алкилокси; R5′ означает Н; R6 означает один заместитель, выбранный из Н, (С1-4)алкила, (С1-4)алкилокси, галогена; R7 означает Н, (С1-4)алкил, (С1-4)алкилокси, галоген; или R7 соединен с R2 с образованием 6-членного кольца, необязательно содержащего дополнительный гетероатом О, и где гетероатом связан с положением 7 индольного кольца; или его фармацевтически приемлемая соль. Соединения формулы I проявляют активность агонистов к каннабиноидному рецептору СВ1, что позволяет использовать их для лечения боли, например, такой как хроническая боль, невропатическая боль, боль при раке. 4 н. и 6 з.п. ф-лы, 1 табл.
Реферат
Настоящее изобретение относится к производным (индол-3-ил)гетероциклических соединений, к содержащим их фармацевтическим композициям и к применению этих производных (индол-3-ил)гетероциклических соединений в терапии, особенно при лечении боли.
Лечение боли часто ограничено побочными эффектами доступных в настоящее время лекарственных средств. При боли, от умеренной до тяжелой, широко применяют опиоиды. Данные средства являются недорогими и эффективными, но обладают серьезными и потенциально опасными для жизни побочными эффектами, в особенности угнетением дыхания и ригидностью мышц. Кроме того, дозы опиоидов, которые можно вводить, ограничены тошнотой, рвотой, запором, зудом и задержкой мочи, что часто приводит к тому, что пациенты предпочтительнее выбирают недостаточно оптимальное устранение боли, чем терпеть эти причиняющие страдание побочные действия. Более того, эти побочные эффекты часто приводят к тому, что пациенты нуждаются в продолжительной госпитализации. Опиоиды представляют собой вызывающие сильное привыкание средства и внесены в список наркотиков во многих областях. Следовательно, существует необходимость в новых болеутоляющих средствах, обладающих улучшенным профилем побочных эффектов по сравнению с используемыми в настоящее время продуктами при равных болеутоляющих дозах.
Накапливаются доказательства, что каннабиноидные агонисты обладают потенциалом в качестве болеутоляющих и противовоспалительных средств. Каннабиноидные рецепторы включают два типа рецепторов: каннабиноидные рецепторы CB1, которые главным образом расположены в центральной нервной системе, но также экспрессируются периферическими нейронами и в меньшей степени в других периферических тканях; и каннабиноидные рецепторы CB2, которые главным образом расположены в клетках иммунной системы (Howlett, A.C. et al.: International Union of Pharmacology. XXVII. Classification of Cannabinoid Receptors. Pharmacol. Rev. 54, 161-202, 2002). Хотя рецепторы CB2 вовлечены в модуляцию иммунного и противовоспалительного ответа каннабиноидов, агонисты каннабиноидных рецепторов, главным образом те из них, которые взаимодействуют с рецепторами CB1, были предложены в качестве пригодных для лечения боли (см. Iversen, L. и Chapman, V. Current Opinion in Pharmacology, 2, 50-55, 2002 и приведенные там ссылки).
В патенте США 4939138 (Sterling Drug Inc.) в качестве болеутоляющего средства описан WIN 55,212-2, мезилатная соль (R)-(+)-[2,3-дигидро-5-метил[(морфолинил)метил]пирроло[1,2,3-de]-1,4-бензоксазинил]-(1-нафталенил)метанона. Данное соединение представляет собой прототип аминоалкилиндолов (Eissenstat, M.A. et al., J. Med. Chem. 38, 3094-3105, 1995), которые являются сильными агонистами рецепторов CB1, способными вызывать антиноцицепцию с равной морфину эффективностью на моделях животных острой боли, длительной боли при воспалении и невропатической боли.
Ключевыми структурными признаками аминоалкилиндолов, обладающих каннабимиметическими свойствами (Adam, J. и Cowley, P. Expert Opin. Ther. Patents, 12, 1475-1489, 2002), являются аминоалкильный заместитель в положении 1 индольной группы и, кроме того, объемный заместитель в положении 3 индольного кольца, примером которого является ароильная группа в аминоалкилиндолах, описанных в патенте США 4939138 (Sterling Drug Inc.) или в более поздней заявке WO02060447 (University of Connecticut), или замещенная амидогруппа в соединениях, описанных в WO0158869 (Bristol-Myers Squibb). Недавно в WO0236590 (Amrad Operations PTY Ltd.) в качестве модуляторов каннабиноидных рецепторов и пригодных в качестве болеутоляющих средств были описаны 1-(аминоалкил)индольные производные, имеющие замещенное оксадиазол-5-ильное кольцо в положении 3.
Сохраняется необходимость в каннабиноидных агонистах с улучшенными свойствами, такими как увеличенная растворимость в воде, для применения в качестве терапевтических средств.
В связи с этим, настоящее изобретение относится к производным (индол-3-ил)гетероциклических соединений, имеющим общую формулу I
где A представляет собой 5-членное ароматическое гетероциклическое кольцо, где X1, X2 и X3 независимо выбирают из N, O, S и CR;
R представляет собой H или (C1-4)алкил; или
R, когда он присутствует в X2 или X3, может вместе с R3 образовывать 5-8-членное кольцо;
R1 представляет собой 5-8-членное насыщенное карбоциклическое кольцо, необязательно содержащее гетероатом, выбранный из O и S;
R2 представляет собой H, CH3 или CH2-CH3; или
R2 соединен с R7 с образованием 6-членного кольца, необязательно содержащего гетероатом, выбранный из O и S, и где гетероатом связан с положением 7 индольного кольца;
R3 и R4 независимо представляют собой H, (C1-6)алкил или (C3-7)циклоалкил, где указанные алкильные группы необязательно замещены OH, (C1-4)алкилокси, (C1-4)алкилтио, (C1-4)алкилсульфонилом, CN или галогеном; или
R3 вместе с R4 и N, с которым они связаны, образует 4-8-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O и S, и необязательно замещенное OH, (C1-4)алкилом, (C1-4)алкилокси, (C1-4)алкилокси-(C1-4)алкилом или галогеном; или
R3 вместе с R5 образует 4-8-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O и S, и необязательно замещенное OH, (C1-4)алкилом, (C1-4)алкилокси, (C1-4)алкилокси-(C1-4)алкилом или галогеном; или
R3 вместе с R, когда он присутствует в X2 или X3, образует 5-8-членное кольцо;
R5 представляет собой H, (C1-4)алкил; или
R5 вместе с R3 образует 4-8-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O и S, и необязательно замещенное OH, (C1-4)алкилом, (C1-4)алкилокси, (C1-4)алкилокси-(C1-4)алкилом или галогеном;
R5' представляет собой H, (C1-4)алкил;
R6 представляет собой 1-3 замещающие группы, независимо выбранные из H, (C1-4)алкила, (C1-4)алкилокси, CN или галогена;
R7 представляет собой H, (C1-4)алкил (C1-4)алкилокси, CN или галоген; или
R7 соединен с R2 с образованием 6-членного кольца, необязательно содержащего дополнительный гетероатом, выбранный из O и S, и где гетероатом связан с положением 7 индольного кольца; или их фармацевтически приемлемым солям, в качестве агонистов каннабиноидных рецепторов CB1, которые можно применять для лечения боли, например, такой как периоперационная боль, хроническая боль, невропатическая боль, боль при раке и боль и мышечная спастичность при рассеянном склерозе.
Как использовано в определении формулы I, гетероцикл A представляет собой 5-членное ароматическое гетероциклическое кольцо, которое содержит 1-3 гетероатома, выбранных из N, O и S. Это означает, что по меньшей мере один из X1, X2 и X3, используемых для определения гетероцикла A, не может представлять собой CR. Репрезентативными гетероциклами A являются гетероциклы - производные тиофена, фурана, триазола, тиазола, тиадиазола, оксазола, оксадиазола и их изомеров, включающие изотиазол, изотиадиазол, изоксазол и изоксадиазол. Предпочтительные гетероциклы A представляют собой 1,2,4-оксадиазол (X1 представляет собой N, X2 представляет собой O, X3 представляет собой N), 1,2,4-тиадиазол (X1 представляет собой N, X2 представляет собой S, X3 представляет собой N) и тиазол (X1 представляет собой S, X2 представляет собой CR, X3 представляет собой N).
В определении формулы I R, когда он присутствует в X2 или X3, может образовывать с R3 5-8-членное кольцо, таким образом, образуя вместе с кольцом A бициклическую кольцевую систему, содержащую 5-8-членное N-содержащее кольцо, конденсированное с 5-членным ароматическим гетероциклическим кольцом A. Примерами таких конденсированных кольцевых систем являются конденсированные кольцевые системы, производные 5,6-дигидро-4H-пирроло[3,4-d]изоксазола, 4,5,6,7-тетрагидрооксазоло[5,4-c]пиридина, 4,5,6,7-тетрагидротиазоло[5,4-c]пиридина, 5,6,7,8-тетрагидро-4H-изоксазоло[5,4-c]азепина, 5,6-дигидро-4H-пирроло[3,4-d]тиазола и 5,6-дигидро-4H-пирроло[3,4-d]изотиазола.
Как использовано в определении формулы I, термин (C1-4)алкил означает разветвленную или неразветвленную алкильную группу с 1-4 атомами углерода, например бутил, изобутил, трет-бутил, пропил, изопропил, этил и метил.
В термине (C1-4)алкилокси, (C1-4)алкил имеет значение, указанное выше.
Термин галоген означает F, Cl, Br или I.
Как использовано в определении R1 формулы I, термин 5-8-членное насыщенное карбоциклическое кольцо представляет собой циклопентильное, циклогексильное, циклогептильное или циклооктильное кольцо. Такие кольца могут содержать гетероатом, выбранный из O и S, образующий насыщенное гетероциклическое кольцо, такое как тетрагидропиранил, тетрагидрофуранил, тетрагидротиопиранил или тетрагидротиенил. Предпочтительные карбоциклические кольца представляют собой циклогексил и тетрагидропиранил.
В определении формулы I R2 может быть соединен с R7 с образованием 6-членного кольца, необязательно содержащего гетероатом, выбранный из O и S, который связан с положением 7 индольного кольца. В таких (индол-3-ил)замещенных 5-членных гетероциклах по данному изобретению индол-3-ильная группа является частью трициклической конденсированной кольцевой системы, т.е. системы 2,3-дигидропирроло[3,2,1-ij]хинолина (R7 и R2 представляют собой -CH2-CH2-), системы 2,3-дигидропирроло[1,2,3-de]-1,4-бензоксазина (R7 и R2 представляют собой -O-CH2-) или системы 2,3-дигидропирроло[1,2,3-de]-1,4-бензотиазин (R7 и R2 представляют собой -S-CH2-).
В определении формулы I R3 вместе с R4 и N, с которым они связаны, образует 4-8-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O и S. Примерами таких колец являются пирролидин-1-ил, пиперидин-1-ил, азепин-1-ил, морфолин-4-ил и тиоморфолин-4-ил. Предпочтительными являются пирролидин-1-ил, пиперидин-1-ил и морфолин-4-ил.
В определении формулы I R3 вместе с R5 может образовывать 4-8-членное кольцо, необязательно содержащее дополнительный гетероатом, выбранный из O и S. Понятно, что N, с которым связан R3, и атом углерода, с которым связан R5, представляют собой часть 4-8-членного кольца. Примерами таких колец являются пирролидин-2-ил, пиперидин-2-ил, азепин-2-ил, морфолин-3-ил и тиоморфолин-3-ил.
В соответствии с формулой I существует предпочтение для производных (индол-3-ил)гетероциклических соединений, где R2 представляет собой H или где R2 соединен с R7 с образованием 6-членного кольца, необязательно содержащего гетероатом, выбранный из O и S, и где гетероатом соединен с положением 7 индольного кольца.
Кроме того, предпочтительными являются производные (индол-3-ил)гетероциклических соединений по настоящему изобретению, где R, R5, R5' и R6 представляют собой H.
Также предпочтительными являются производные (индол-3-ил)гетероциклических соединений в соответствии с формулой I, где R1 представляет собой циклогексил или тетрагидропиранил.
Особенно предпочтительными являются производные (индол-3-ил)гетероциклических соединений в соответствии с формулой I, где гетероцикл A представляет собой 1,2,4-оксадиазол (X1 представляет собой N, X2 представляет собой O, X3 представляет собой N), 1,2,4-тиадиазол (X1 представляет собой N, X2 представляет собой S, X3 представляет собой N) или тиазол (X1 представляет собой S, X2 представляет собой CR, X3 представляет собой N).
Особенно предпочтительными производными (индол-3-ил)гетероциклических соединений по настоящему изобретению являются:
7-хлор-3-(5-{[N-этил-N-(2-метоксиэтил)амино]метил}-[1,2,4]тиадиазол-3-ил)-1-(тетрагидропиран-4-ил)метил-1-H-индол;
7-хлор-3-{5-[(пирролидин-1-ил)метил]-[1,2,4]тиадиазол-3-ил}-1-(тетрагидропиран-4-ил)метил-1H-индол;
7-хлор-3-(5-{[N-этил-N-(2-гидроксиэтил)амино]метил}-[1,2,4]тиадиазол-3-ил)-1-(тетрагидропиран-4-ил)метил-1H-индол;
7-хлор-3-(4-{[N-(2-гидроксиэтил)-N-изопропиламино]метил}-[1,3]тиазол-2-ил)-1-(тетрагидропиран-4-ил)метил-1H-индол;
7-хлор-3-(4-{[N-этил-N-(2-гидроксиэтил)амино]метил}-[1,3]тиазол-2-ил)-1-(тетрагидропиран-4-ил)метил-1H-индол;
7-хлор-3-(4-{[N-(2-метоксиэтил)-N-метиламино]метил}-[1,3]тиазол-2-ил)-1-(тетрагидропиран-4-ил)метил-1H-индол;
7-хлор-3-{5-[(2,2-диметилпирролидин-1-ил)метил]-[1,2,4]оксадиазол-3-ил}-1-(тетрагидропиран-4-ил)метил-1H-индол,
или их фармацевтически приемлемые соли.
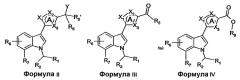
Как правило, производные (индол-3-ил)гетероциклических соединений по настоящему изобретению можно получать способами, известными в области органической химии. Например, производные (индол-3-ил)гетероциклических соединений формулы I можно получать из соединений формулы II, где Y представляет собой уходящую группу, такую как галоген или алкилсульфонатная группа, нуклеофильным замещением уходящей группы амином формулы NHR3R4. Соединения формулы II, где Y представляют собой алкилсульфонатную группу, можно получать из соединений формулы II, где Y представляет собой гидроксигруппу, реакцией с алкилсульфонилгалогенидом в присутствии основания, такого как триэтиламин. Производные (индол-3-ил)гетероциклических соединений формулы I, где R5' представляет собой водород, можно получать из соединений формулы III восстановительным аминированием, с использованием амина формулы NHR3R4 в присутствии восстановителя, такого как триацетоксиборгидрид натрия. В данной области хорошо известно, что соединения формулы II, где Y представляет собой гидроксигруппу и R5' представляет собой водород, можно взаимопревращать с соединениями формулы III окислением и восстановлением с использованием подходящих окислителей или восстановителей, как описано Burke D.S., Danheiser, R.L. в Handbook of Reagents for organic Synthesis: Oxidising and Reducing agents (Wiley: New York, 1999). Подобным образом, соединения формулы II, где Y представляет собой гидроксигруппу и R5 и R5' представляют собой водород, и соединения формулы III, где R5 представляет собой водород, можно получать из соединений формулы IV, где R8 представляет собой водород или (C1-4)алкил, восстановлением с использованием подходящих восстановителей. Соединения формулы II, где Y представляет собой гидроксигруппу и R5' представляет собой (C1-4)алкил, можно получать из соединений формулы III нуклеофильным присоединением с использованием (C1-4)алкилметаллического реагента, такого как алкильный реагент Гриньяра или алкиллитий.
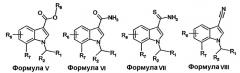
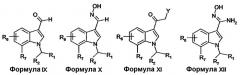
Соединения формулы I, формулы II, формулы III или формулы IV можно получать из соединений формулы V-XII, включительно, с применением хорошо известных в области конструирования гетероциклических колец способов. Такие способы описаны в основной ссылке Katritzky, A.R.: Comprehensive heterocyclic chemistry (First Edition, Pergamon Press, 1984, особенно см. Volume 4, Part 3, Five-membered rings with one oxygen, sulfur or nitrogen atom и Volume 6, Part 4B, Five-membered rings with two or more oxygen, sulfur or nitrogen atoms).
Соединения формулы V-XII, включительно, где R1, R2, R6 и R7 имеют определенные выше значения и R8 представляет собой H или (C1-4)алкил, можно получать описанными в литературе способами или известными специалисту в данной области модификациями описанных в литературе способов.
Например, соединения формулы VI можно получать из соединений формулы V или их активированных производных реакцией с аммиаком в приемлемом растворителе.
Соединения формулы VII можно получать из соединений формулы VI с использованием тионирующих реагентов, таких как пентасульфид фосфора или реагент Лавессона.
Альтернативно, соединения формулы VII можно получать из соединений формулы VIII реакцией с тиоацетамидом в растворителе, таком как диметилформамид.
Соединения формулы VIII можно получать из соединений формулы VI дегидратацией, например, с использованием трифторуксусного ангидрида в присутствии основания, такого как триэтиламин.
Соединения формулы X можно получать из соединений формулы IX реакцией с гидроксиламином в приемлемом растворителе.
Соединения формулы XI, где Y представляет собой NH2, можно получать из соединений формулы V или их активированных производных реакцией с цианид-анионом с образованием оксоацетонитрила с последующим восстановлением нитрила до первичного амина с использованием восстановителя, такого как газообразный водород, в присутствии катализатора, такого как палладий на активированном угле.
Соединения формулы XII можно получать из соединений формулы VIII реакцией с гидроксиламином в приемлемом растворителе.
Соединения формулы V и соединения формулы XI можно получать ацилированием соединений формулы XIII. Например, соединения формулы V, где R8 представляет собой водород, можно получать ацилированием соединений формулы XIII с использованием трифторуксусного ангидрида в растворителе, таком как диметилформамид, с последующим гидролизом с использованием водного гидроксида натрия при повышенной температуре. Соединения формулы XI, где Y представляет собой хлор, можно получать ацилированием соединений формулы XIII с использованием хлорацетилхлорида в присутствии основания, такого как пиридин.
Соединения формулы IX можно получать из соединений формулы XIII формилированием, например, с применением реакции Вильсмейера (для обзора см. Jutz, Adv. Org. Chem. 9, pt. 1, 225-342, 1976).
Альтернативно, соединения формулы V можно получать из соединений формулы XIV с применением способов, описанных Wijngaarden et al. (J. Med. Chem. 36, 3693-3699, 1993) или Hwu et al. (J. Org. Chem. 59, 1577-1582, 1994), или с применением модификаций этих способов.
Соединения формулы XIII можно получать описанными в литературе способами или известными специалисту в данной области модификациями описанных в литературе способов. Например, соединения формулы XIII можно получать алкилированием соединений формулы XV посредством обработки основанием, таким как гидрид натрия, с последующей реакцией с алкилирующим агентом R1R2CHY, где Y представляет собой уходящую группу, такую как галоген или алкилсульфонатная группа. Соединения формулы XV можно получить из коммерческих источников, можно получать описанными в литературе способами или известными специалисту в данной области модификациями описанных в литературе способов.
Альтернативно, соединения формулы XIII можно получать из соединений формулы XIV с применением синтеза индолов по Фишеру или его модификаций (Chem. Rev. 69, 227-250, 1969).
Соединения формулы XIV можно получать описанными в литературе способами или известными специалисту в данной области модификациями описанных в литературе способов. Например, соединения формулы XIV, где R2 соединен с R7 с образованием 6-членного карбоциклического кольца, можно получать из соединений формулы XVI восстановлением с использованием восстановителя, такого как боргидрид натрия, в присутствии катализатора, такого как хлорид никеля (II). Соединения формулы XVI можно получать, например, реакцией конденсации, такой как реакция 2-хлорхинолина с реактивом Гриньяра в присутствии катализатора никеля (II).
Соединения формулы XIV, где R2 соединен с R7 с образованием 6-членного кольца, содержащего кислород или серу, можно получить реакцией с соединением формулы XVII, где Z представляет собой OH или SH, с соединением формулы XVIII, где Y представляет собой уходящую группу, с образованием эфира или тиоэфира с последующим восстановлением нитрогруппы до амина и восстановительной циклизацией. Восстановление и циклизацию можно осуществлять, например, с использованием газообразного водорода в присутствии катализатора, такого как палладий на активированном угле.
Соединения формулы XVII и соединения формулы XVIII можно получить из коммерческих источников, можно получить описанными в литературе способами или известными специалисту в данной области модификациями описанных в литературе способов. Например, соединения формулы XVIII, где Y представляет собой бром, можно получать из соединений формулы XIX с использованием бромирующего вещества, такого как бром, в растворителе, таком как метанол.
Альтернативно, соединения формулы I, формулы II, формулы III или формулы IV можно получать из соединений формулы XX с использованием переходного металла, катализирующего реакции сочетания, как описано в основной ссылке Hegedus, L.S. Transition Metals in the Synthesis of Complex Organic Molecules (Second Edition, University Science: Sausalito 1999).
Например, соединения формулы III можно получить реакцией соединений формулы XX, где Y1 представляет собой галоген, с соединениями формулы XXI, где Y2 представляет собой бороновую кислоту или сложный эфир бороновой кислоты, с применением реакции Сузуки (Chem. Rev. 95, 2457-2483, 1995) или ее модификации.
Соединения формулы XX и соединения формулы XXI можно получать из коммерческих источников, можно получить описанными в литературе способами или известными специалисту в данной области модификациями описанных в литературе способов. Например, соединения формулы XX, где Y1 представляет собой бром, можно получить бромированием соединений формулы XIII с использованием брома в растворителе, таком как диметилформамид.
Специалисту в данной области понятно, что азот индола при описанных выше превращениях можно временно защитить с использованием защитной группы, такой как арилсульфонильная группа, с последующим снятием защиты и алкилированием на поздних стадиях синтеза. Кроме того, понятно, что такие защитные группы можно использовать для изменения стабильности промежуточных продуктов и реакционной способности индольного кольца в отношении электрофилов. Подходящие защитные группы описаны Kocienski, P.J.: в Protecting Groups, Thieme, Stuttgart; New York, 1994.
Также специалисту в данной области понятно, что различные производные (индол-3-ил)гетероциклических соединений формулы I можно получать посредством подходящих реакций конверсии функциональных групп, соответствующих определенным заместителям R3-R7. Например, соединения формулы I, где R3 или R4 представляют собой линейные, разветвленные или циклические C1-C6алкильные группы, необязательно замещенные гидроксилом, (C1-4)алкилокси, (C1-4)алкилтио,
(C1-4)алкилсульфонилом или циано, можно получить реакцией соединения формулы I, где R3 или R4 представляет собой водород, с C1-C6алкилгалогенидом или с функционализированным C1-C6алкилгалогенидом в присутствии основания, такого как карбонат калия.
Производные (индол-3-ил)гетероциклических соединений формулы I и их соли могут содержать по меньшей мере один хиральный центр и, следовательно, находиться в виде стереоизомеров, включая энантиомеры и диастереоизомеры. Настоящее изобретение в свой объем включает указанные выше стереоизомеры и каждый отдельный из R и S энантиомеров соединений формулы I и их соли, по существу чистые, т.е. ассоциированные менее чем с 5%, предпочтительно менее чем с 2%, конкретно, менее чем с 1% другого энантиомера, и смеси таких энантиомеров в любых пропорциях, включая рацемические смеси, содержащие по существу равные количества двух энантиомеров.
Способы асимметричного синтеза или хирального разделения, которыми получают стереоизомеры, хорошо известны в данной области, например синтез с хиральной индукцией или исходя из коммерчески доступных хиральных субстратов, или разделение стереоизомеров, например, с использованием хроматографии на хиральной среде, или кристаллизация с хиральным противоионом.
Фармацевтически приемлемые соли можно получать обработкой свободного основания соединения формулы I неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота и серная кислота, или органической кислотой, например, такой как аскорбиновая кислота, лимонная кислота, винная кислота, молочная кислота, малеиновая кислота, малоновая кислота, фумаровая кислота, гликолевая кислота, янтарная кислота, пропионовая кислота, уксусная кислота и метансульфоновая кислота.
Соединения по настоящему изобретению могут находиться как в несольватированной форме, так и в сольватированной форме с фармацевтически приемлемым растворителем, таким как вода, этанол и т.п. В основном, для целей настоящего изобретения сольватированные формы рассматриваются как эквивалентные несольватированным.
Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим производное (индол-3-ил)гетероциклического соединения общей формулы I или его фармацевтически приемлемую соль, в смеси с фармацевтически приемлемыми добавками и, необязательно, другими терапевтическими средствами. Термин "приемлемый” означает сочетаемый с другими ингредиентами композиции и безвредный для его потребителей. Например, композиции включают композиции, приемлемые для перорального, сублингвального, подкожного, внутривенного, эпидурального, интратекального, внутримышечного, трансдермального, легочного, местного или ректального введения и т.п., все в единичных дозированных формах для введения. Предпочтительным путем введения является внутривенный.
Для перорального введения активный ингредиент может находиться в виде отдельных единиц, таких как таблетки, капсулы, порошки, гранулированные формы, растворы, суспензии и т.п. Для парентерального введения фармацевтическая композиция по настоящему изобретению может находиться в контейнере для единичной дозы или многократных доз, например жидкость для инъекций в предопределенных количествах, например в герметичных пузырьках и ампулах, а также может храниться в высушенном вымораживанием состоянии (лиофилизированном), при котором необходимо только добавление стерильного жидкого носителя, например воды, перед применением.
Смешанное с такими фармацевтически приемлемыми добавками, например, как описано в стандартной ссылке Gennaro, A.R. et al., Remington: The Science and Practice of Pharmacy (20th Edition, Lippincott Williams & Wilkins, 2000, особенно см. Part 5: Pharmaceutical Manufacturing), активное средство можно спрессовать в твердые единичные дозы, такие как пилюли, таблетки, или обрабатывать с получением капсул, суппозиториев или пластырей. Посредством фармацевтически приемлемых жидкостей активное средство можно применять как жидкую композицию, например, в качестве инъекционного препарата в виде раствора, суспензии, эмульсии или спрея, например нозального спрея.
Для получения твердых дозированных единиц предусмотрено применение общепринятых добавок, таких как наполнители, красители, полимерные связующие вещества и т.п. В основном можно применять любые фармацевтически приемлемые добавки, которые не препятствуют действию активных соединений. Приемлемые носители, с которыми активное вещество по настоящему изобретению можно вводить в виде твердых композиций, включают производные лактозы, крахмала, целлюлозы и т.п., или их смеси, применяемые в подходящих количествах. Для парентерального введения можно применять водные суспензии, изотонические солевые растворы и стерильные инъецируемые растворы, содержащие фармацевтически приемлемые диспергирующие средства и/или увлажняющие средства, такие как пропиленгликоль или бутиленгликоль.
Кроме того, данное изобретение относится к описанной выше фармацевтической композиции в комбинации с пригодными для указанной композиции упаковочными материалами, где указанные упаковочные материалы включают инструкцию по применению композиции для указанного выше применения.
Обнаружено, что производные (индол-3-ил)гетероциклических соединений по настоящему изобретению являются агонистами рецептора CB1, как установлено в анализе репортера человеческих рецепторов CB1 с использованием клеток CHO. Способы определения связывания рецепторов, а также биологической активности модуляторов каннабиноидных рецепторов in vitro хорошо известны в данной области. В общем, экспрессированный рецептор приводят в контакт с соединением, которое должно быть испытано, и измеряют связывание или стимуляцию или ингибирование функционального ответа.
Для измерения функционального ответа выделенную ДНК, кодирующую ген рецептора CB1, предпочтительно рецептора человека, экспрессируют в подходящих клетках хозяина. Такие клетки могут представлять собой клетки яичника китайского хомяка, но также пригодны другие клетки. Предпочтительно, клетки происходят от млекопитающих.
Способы конструирования экспрессирующих рекомбинантный CB1 клеточных линий хорошо известны в данной области (Sambrook et al., Molecular Cloning: a Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, последнее издание). Экспрессии рецептора достигают посредством экспрессии кодирующей желаемый белок ДНК. Все способы лигирования дополнительных последовательностей и конструирования подходящих экспрессирующих систем к настоящему времени хорошо известны в данной области. Часть или всю ДНК, кодирующую желаемый белок, можно конструировать синтетически с применением стандартных твердофазных способов, предпочтительно с введением сайтов рестрикции для облегчения лигирования. Для кодирующих последовательностей ДНК можно обеспечить приемлемые контрольные элементы для транскрипции и трансляции введенных кодирующих последовательностей. Как хорошо известно, на сегодняшний день доступны системы экспрессии, которые совместимы с широким разнообразием хозяев, включая прокариотических хозяев, таких как бактерии, и эукариотических хозяев, таких как дрожжи, клетки растений, клетки насекомых, клетки млекопитающих, клетки птиц и т.п.
Затем экспрессирующие рецептор клетки приводят в контакт с тестируемым соединением для исследования связывания или стимуляции или ингибирования функционального ответа.
Альтернативно, для измерения связывания соединения можно применять изолированные клеточные мембраны, содержащие экспрессируемый рецептор CB1 (или CB2).
Для измерения связывания можно применять радиоактивно или флуоресцентно меченые соединения. Наиболее широко применяемым радиоактивным каннабиноидным зондом является [3H]CP55940, который обладает приблизительно равной аффинностью для сайтов связывания CB1 и CB2.
Другое исследование включает скрининг соединений-агонистов каннабиноидных CB1 посредством определения ответа вторичных мессенджеров, например, таких как измерение опосредованных рецептором изменений в путях цАМФ или MAP-киназы. Таким образом, такой способ включает экспрессию рецептора CB1 на клеточной поверхности клетки-хозяина и воздействие на клетку тестируемым соединением. Затем измеряют ответ вторичных мессенджеров. Уровень вторичных мессенджеров будет сниженным или повышенным в зависимости от действия тестируемого соединения при связывании с рецептором.
Кроме прямого измерения, например, уровней цАМФ в подвергаемой воздействию клетке, можно использовать клетки, которые, кроме трансфекции кодирующей рецептор ДНК, трансфицированы второй ДНК, кодирующей репортерный ген, экспрессия которого коррелирует с активацией рецептора. В основном экспрессию репортерного гена можно контролировать любым отвечающим элементом, реагирующим на измененные уровни вторичного мессенджера. Приемлемые репортерные гены представляет собой, например, LacZ, щелочную фосфатазу, люциферазу светляка и зеленый флуоресцентный белок. Принципы таких трансактивационных анализов хорошо известны в данной области, например, в Stratowa, Ch, Himmler, A. and Czernilofsky, A. P., Curr. Opin.Biotechnol. 6, 574 (1995). Для выбора активных соединений-агонистов для рецептора CB1 значение EC50 должно составлять <10-5М, предпочтительно <10-7М.
Соединения можно применять в качестве болеутоляющих средств для лечения боли, например, такой как периоперационная боль, хроническая боль, невропатическая боль, боль при раке и боль и спастичность, ассоциированные с рассеянным склерозом.
Также каннабиноидные агонисты по данному изобретению могут быть потенциально пригодными при лечении других нарушений, включая рассеянный склероз, спастичность, воспаление, глаукому, тошноту и рвоту, потерю аппетита, нарушения сна, нарушения дыхания, аллергию, эпилепсию, мигрень, сердечно-сосудистые нарушения, нейродегенеративные нарушения, тревога, травматическое повреждение мозга и удар.
Соединения также можно применять в комбинации с другими лекарственными средствами, например обезболивающими лекарственными средствами, такими как опиоды и нестероидные противовоспалительные лекарственные средства (NSAID), включающие селективные ингибиторы COX-2.
Соединения по данному изобретению можно вводить людям в достаточном количестве и в течение достаточного периода времени для облегчения симптомов. В качестве иллюстрации уровни дозирования для людей могут находиться в диапазоне 0,001-50 мг на 1 кг массы тела, предпочтительно в дозе 0,01-20 мг на кг массы тела.
Изобретение проиллюстрировано следующими примерами.
Общие способы
Если не указано иное, микроволновые реакции проводили с использованием Emrys™ Optimizer (Personal Chemistry). Колоночную флэш-хроматографию проводили на силикагеле. Полупрепаративную высокоэффективную жидкостную хроматографию (полупрепаративная ВЭЖХ) проводили с применением указанных ниже способов:
Способ (i): Agilent CombiHT (SB-C18, 5 мкм) 12 мм ID×100 мм; 5-95% ацетонитрил-вода при 9-минутном градиенте; 25 мл/мин; 0,1% трифторацетатного кислотного буфера; детекция посредством УФ при 254 нм.
Способ (ii): Waters Xterra (RP18, 5 мкм) 30 мм×100 мм; 10-100% ацетонитрил-вода при 25-минутном градиенте; 30 мл/мин; 0,1% трифторацетатного кислотного буфера; детекция посредством УФ при 254 нм.
Константы взаимодействия 1H ЯМР приведены в герцах.
Пример 1
1-(Циклогексил)метил-3-{5-[(диметиламино)метил]-[1,2,4]оксадиазол-3-ил-7-метокси-1H-индол, гидрохлоридная соль
Раствор 7-метоксииндола (45,0 г, 306 ммоль) в диметилформамиде (360 мл) охлаждали до 5°C в атмосфере азота в течение 20 минут и добавляли трифторуксусный ангидрид (60,5 мл, 433 ммоль), поддерживая температуру ниже 10°C. Смесь перемешивали при 5-10°C в течение 2 часов, затем выливали в воду (1600 мл). Полученную суспензию перемешивали в течение 15 минут и осадок 7-метокси-3-[(трифторметил)карбонил]-1H-индола отфильтровывали, промывая водой до нейтральности.
Влажное твердое вещество суспендировали в 4М водном гидроксиде натрия (1700 мл) и нагревали до температуры кипения с обратным холодильником при перемешивании в течение 2 часов. Смесь охлаждали и промывали диэтиловым эфиром (2×400 мл). Затем водную фазу подкисляли до pH 1, используя 5М хлористоводородную кислоту, и полученный чистый осадок отфильтровывали, промывали водой до нейтральности и сушили с получением 7-метокси-1H-индол-3-карбоновой кислоты в виде твердого розового вещества (42,7 г).
К раствору 7-метокси-1H-индол-3-карбоновой кислоты (42,7 г, 224 ммоль) в диметилформамиде (1250 мл) при 10°C в атмосфере азота порциями в течение 20 минут, поддерживая температуру ниже 15°C, добавляли гидрид натрия (60% дисперсия в минеральном масле, 23,0 г, 575 ммоль). Охлаждающую баню удаляли и суспензию перемешивали в течение 90 минут. Добавляли циклогексилметилбромид (64,7 мл, 464 ммоль). Смесь нагревали при 60°C при перемешивании в течение 3 часов. Смесь охлаждали до 10°C и выливали в воду (3600 мл). Эмульсию промывали диэтиловым эфиром (3×500 мл). Водную фазу подкисляли до pH 1, используя 5М хлористоводородную кислоту, и осадок отфильтровывали, промывали водой до нейтральности и сушили с получением 1-(циклогексил)метил-7-метокси-1H-индол-3-карбоновой кислоты (55 г) в виде белого твердого вещества.
К смеси 1-(циклогексил)метил-7-метокси-1H-индол-3-карбоновой кислоты (7,0 г, 24,4 ммоль) и дихлорметана (150 мл) при охлаждении ледяной водой по каплям добавляли оксалилхлорид (12,4 г, 97,4 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 18 часов. Дихлорметан и избыток оксалилхлорида удаляли выпариванием и полученный осадок смешива