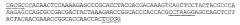Рекомбинантные молекулы лубрицина и их использование
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано в медико-биологической промышленности при получении препаратов, используемых в качестве смазывающих веществ, антиадгезивных средств и/или внутрисуставных добавок. В результате замены части кодируемой экзоном 6 аминокислотной последовательности человеческого белка PRG-4 искусственным полипептидом, включающим 4-15 последовательностей КЕРАРТТ или КЕРАРТТ-подобных последовательностей, получены рекомбинантные белки с существенно меньшим, чем у природного лубрицина, числом гликозилируемых повторов, которые сохраняют при этом его смазывающие свойства. Предлагается использование новых рекомбинантных белков в составе фармацевтических композиций и в способах лечения, где традиционно применяется природный лубрицин. Применение настоящего изобретения в медицинских целях имеет ряд преимуществ, связанных с упрощением, по сравнению с нативным белком, как синтеза рекомбинантных лубрицинов, так и манипуляций с ними. 15 н. и 13 з.п. ф-лы, 1 ил., 3 табл.
Реферат
Настоящее изобретение относится к новым рекомбинантным молекулам лубрицина и к их использованию в качестве смазывающих веществ, антиадгезивных агентов и/или внутрисуставных добавок, например, для введения в синовиальные соединения, мениск, сухожилия, брюшину, перикард и в плевру.
Предшествующий уровень техники
Для оптимального функционирования синовиальных соединений, коэффициенты трения между суставными тканями должны быть крайне низкими. Обычно, суставный хрящ имеет хорошо смазанную поверхность. Однако, при остеоартрите (ОА), снижение уровня суставной “смазки” может приводить к разрушению хрящевого матрикса и к фибрилляции, что, в свою очередь, может приводить к нарушению функции суставов и к болям. Уменьшение суставной смазки также приводит к нарушению функции суставов и к болям при других формах артрита, включая ревматоидный артрит (РА).
Что касается других тканей (например, сухожилий), то смазанная поверхность также может придавать этим тканям определенные оптимальные функциональные свойства. Сухожилию, для его нормального функционирования, помимо необходимой смазанной поверхности также требуется предотвращение прилипания клеток к поверхностям сухожилий. При поражении и восстановлении сгибательной мышцы сухожилия наиболее распространенным осложнением является, например, образование спаек между сухожилиями.
Природный белок лубрицин представляет собой белок, родственный белку-предшественнику фактора стимуляции мегакариоцитов (MSF). PRG4 (протеогликан 4) обозначается аббревиатурой MSF, которая имеется в базе данных по номенклатуре человеческих генов UCL/HGNC/HUGO. Белок PRG4 (т.е., белок-предшественник MSF) описан в патенте США № 6433142 и в заявке на патент США № 20020137894 (все патенты и патентные заявки, цитируемые в этом документе, во всей своей полноте вводятся в настоящее описание посредством ссылки). Полипептид, кодируемый экзоном 6 гена PRG4, является в высокой степени гликозилированным и, очевидно, его присутствие необходимо для того, чтобы PRG4-родственный белок служил в качестве смазки, например, между поверхностями суставного хряща.
Исследования показали, что гликопротеин PRG4 также синтезируется внутренними синовиоцитами, которые выстилают влагалище сухожилия, при этом наиболее вероятно, что этот гликопротеин также происходит от теноцитов (Rees et al., 2002). Указанный гликопротеин присутствует, в основном, в области волокнистой хрящевой ткани сухожилия. Данный гликопротеин, помимо того, что он обладает функцией синовиальной жидкости, может играть в сухожилии важную цитопротективную роль, заключающуюся в предупреждении прилипания клеток к поверхностям сухожилия, а также в обеспечении “смазки” в процессе нормального функционирования сухожилия.
Экзон 6 гена PRG4 (также называемый “лубрицином”) кодирует приблизительно 76-78 повторов КЕРАРТТ-подобных последовательностей и 6 повторов ХХТТТХ-подобных последовательностей. В соответствии с настоящим изобретением изменение числа сравнимых последовательностей-повторов в рекомбинантных белках лубрицина может быть положено в основу разработки улучшенных биотерапевтических средств в целях увеличения уровня смазывания суставов и для предотвращения нежелательных спаек между тканями.
Описание сущности изобретения
Настоящее изобретение относится к новым рекомбинантным молекулам лубрицина и к их использованию в качестве смазывающих веществ, антиадгезивных средств и/или внутрисуставных добавок.
Для оптимизации параметров экспрессии и исследования функциональной необходимости использования всех приблизительно 76-78 повторов КЕРАРТТ-подобных последовательностей были сконструированы конструкции для экспрессии лубрицина, которые обеспечивают синтез рекомбинантных белков лубрицина с различной степенью О-связанных олигосахаридных замещений. Это может быть достигнуто путем включения различного числа КЕРАРТТ-подобных последовательностей в “коровую” кДНК-конструкцию, состоящую из экзонов 1 - 5, 5'- и 3'-фланкирующих областей экзона 6 и экзонов 7-12. Введение повторяющихся вставок в “синтетические кДНК-кластеры”, кодирующие множество КЕРАРТТ-подобных последовательностей, облегчает генерирование рекомбинантных конструкций лубрицина различного размера. Исходным объектом этих исследований была конструкция PRG4-Lub:1 (содержащая ДНК “синтетического кДНК-кластера-1” (SEQ ID NO:1), кодирующего четыре последовательности КЕРАРТТ).
Рекомбинантные белки лубрицина настоящего изобретения имеют общую первичную структуру с несколькими изоформами нативного человеческого лубрицина (см. US6743774, US20040072741 и WO0064930). Каждая из охарактеризованных изоформ отличается по составу экзонов гена PRG4, которые кодируют первичную структуру изоформ. Так, например, экзоны 1-12 гена PRG4 кодируют изоформу V0, которая представляет собой полноразмерную изоформу, а экзоны 1-4 и 6-12 кодируют изоформу V1, в которой отсутствует только сегмент, кодируемый экзоном 5. Экзоны 1-3 и 6-12 кодируют изоформу V2, в которой отсутствуют сегменты, кодируемые экзонами 4 и 5. И наконец, экзоны 1, 3 и 6-12 кодируют изоформу V3, в которой отсутствуют сегменты, кодируемые экзонами 2, 4 и 5. При этом, вероятно, существуют и другие изоформы, и некоторые родственные мутантные белки были описаны ранее (см. US20020086824).
В частности, настоящее изобретение относится к рекомбинантному белку лубрицину, содержащему повторяющиеся КЕРАРТТ-подобные последовательности. В своих предпочтительных вариантах настоящее изобретение относится к выделенному белку, содержащему последовательности SEQ ID NO:9, 13, 17, 21 или 25. Настоящее изобретение также относится к родственным вариантам выделенного белка, содержащего последовательности SEQ ID NO:7, 11, 15, 19 или 23. В других родственных вариантах настоящее изобретение относится к выделенному полинуклеотиду, содержащему последовательность нуклеиновой кислоты, кодирующую рекомбинантный белок лубрицин. В предпочтительных вариантах настоящее изобретение относится к выделенному полинуклеотиду, содержащему последовательность нуклеиновой кислоты, кодирующую белок. В других родственных вариантах настоящее изобретение относится к выделенному полинуклеотиду, последовательность которого по всей его длине по крайней мере на 80%, 85%, 90%, 95%, 97%, 98% или на 99% идентична последовательности SEQ ID NO:6, 10, 14, 18 или 22.
В родственных аспектах настоящее изобретение также относится к выделенному белку, содержащему последовательность SEQ ID NO:26, присоединенную к последовательности (N-2) повтора(ов) SEQ ID NO:27, где N равно целому числу от 3 до 200. В других родственных вариантах настоящее изобретение относится к выделенному белку, содержащему последовательность SEQ ID NO:26 + SEQ ID NO:28 + [(N-2) повтора(ов) SEQ ID NO:27] + SEQ ID NO:29, где N равно целому числу от 3 до 200. В других вариантах родственных аспектов настоящего изобретения, описанных в этом параграфе, более предпочтительно, чтобы N было равно целому числу от 5 до 50, и еще более предпочтительно, чтобы N было равно целому числу от 10 до 30.
| Таблица 1Идентификация последовательностей, имеющих идентификационные номера | |
| SEQ ID NO: | Идентификация |
| 1 | Нуклеотидная последовательность синтетического кДНК-кластера-1: 155 оснований |
| 2 | Продукт трансляции SEQ ID NO:1: 51 аминокислота |
| 3 | Нуклеотидная последовательность синтетического кДНК-кластера-2: 125 оснований |
| 4 | Продукт трансляции SEQ ID NO:3: 41 аминокислота |
| 5 | Вектор pTmed2, содержащий рекомбинантную кДНК-конструкцию PRG4-Lub:1: 8049 оснований |
| 6 | кДНК-конструкция рекомбинантного белка PRG4-Lub:1: 2946 оснований |
| 7 | Аминокислотная последовательность полноразмерного рекомбинантного белка PRG4-LUB:1: 981 аминокислота |
| 8 | ДНК-вставка Lub:1 из синтетического кДНК-кластера-1: 157 оснований |
| 9 | 51 аминокислота, кодируемая ДНК-вставкой Lub:1 (4 последовательности КЕРАРТТ между S373-Е425 в SEQ ID NO:7) |
| 10 | кДНК-конструкция рекомбинантного белка PRG4-Lub:2: 3024 оснований |
| 11 | Аминокислотная последовательность полноразмерного белка PRG4-LUB:2: 1007 аминокислота |
| 12 | ДНК-вставка Lub:2 из синтетического кДНК-кластера-1 и одна последовательность синтетического кДНК-кластера-2: 235 оснований |
| 13 | 77 аминокислот, кодируемых ДНК-вставкой Lub:2 (6 последовательностей КЕРАРТТ между S373 и Е451 в SEQ ID NO:11) |
| 14 | кДНК-конструкция рекомбинантного белка PRG4-Lub:3: 3117 оснований |
| 15 | Аминокислотная последовательность полноразмерного белка PRG4-LUB:3: 1038 аминокислота |
| 16 | ДНК-вставка Lub:3 из синтетического кДНК-кластера-1 и две последовательности синтетического кДНК-кластера-2: 328 оснований |
| 17 | 108 аминокислот, кодируемых ДНК-вставкой Lub:3 (9 последовательностей КЕРАРТТ между S373 и Е482 в SEQ ID NO:15) |
| 18 | кДНК-конструкция рекомбинантного белка PRG4-Lub:4: 3210 оснований |
| 19 | Аминокислотная последовательность полноразмерного белка PRG4-LUB:4”: 1069 аминокислота |
| 20 | ДНК-вставка Lub:2 из синтетического кДНК-кластера-1 и три последовательности синтетического кДНК-кластера-2: 421 основание |
| 21 | 139 аминокислот, кодируемых ДНК-вставкой Lub:4 (12 последовательностей КЕРАРТТ между S373 и Е513 в SEQ ID NO:19) |
| 22 | кДНК-конструкция рекомбинантного белка PRG4-Lub:5: 3303 оснований |
| 23 | Аминокислотная последовательность полноразмерного белка PRG4-LUB:5: 1100 аминокислота |
| 24 | ДНК-вставка Lub:5 из синтетического кДНК-кластера-1 и четыре последовательности синтетического кДНК-кластера-2: 514 оснований |
| 25 | 170 аминокислот, кодируемых ДНК-вставкой Lub:5 (15 последовательностей КЕРАРТТ между S373 и Е544 в SEQ ID NO:23) |
| 26 | Аминокислотная последовательность “APTTPKEPAPTTTKSAPTTPKEPAPTTTKEPAPTTPKEPAPTTTK” (45 аминокислот) в предпочтительном белке PRG4-LUB:N |
| 27 | Аминокислотная последовательность “KEPAPTTTKEPAPTTTKSAPTTPKEPAPTTP” (31 аминокислота), повторяющаяся N-1 раз в предпочтительном белке PRG4-LUB:N |
| 28 | Аминокислотная последовательность “EPAPTTTKEPAPTTTKSAPTTPKEPAPTTP” (22 аминокислоты), соединяющая SEQ ID NO:26 с повторами (N-2) SEQ ID NO:27 в предпочтительном белке PRG4-LUB:N, где N ≥ 3 |
| 29 | Аминокислотная последовательность “KEPKPAPTTP” (10 аминокислот), в предпочтительном белке PRG4-LUB:N, где N ≥ 2 |
В родственных вариантах настоящее изобретение также относится к композиции, содержащей терапевтически эффективное количество рекомбинантного белка лубрицина в фармацевтически приемлемом носителе. В некоторых вариантах изобретения указанная композиция дополнительно содержит гиалуронан или гилан.
Настоящее изобретение также относится к способу лечения индивидуума, предусматривающему: получение композиции, содержащей рекомбинантный белок лубрицин, и введение указанной композиции в ткань данного индивидуума. В родственных вариантах применения указанного способа настоящего изобретения ткань выбирают из группы, состоящей из хряща, синовиальной жидкости, мениска, сухожилия, брюшины, перикарда и плевры. В других родственных вариантах способа настоящего изобретения указанный способ, кроме того, включает стадию, выбранную из группы, состоящей из: введения индивидууму анестетика; введения индивидууму противовоспалительного лекарственного средства; введения индивидууму антибиотика; отсасывания у индивидуума жидкости; промывки ткани индивидуума и визуализации ткани указанного индивидуума. В других родственных вариантах изобретения указанный индивидуум выбран из группы, состоящей из мышей, кошек, собак, лошадей и человека.
В других своих вариантах, настоящее изобретение также относится к экспрессионному вектору, содержащему полинуклеотид, кодирующий рекомбинантный белок лубрицин, где указанный полинуклеотид функционально присоединен к последовательности регуляции экспрессии. В своих родственных вариантах настоящее изобретение относится к способу получения рекомбинантного белка лубрицина, предусматривающему: культивирование клеток, трансформированных экспрессирующим вектором в жидкой культуральной среде, и сбор рекомбинантного белка лубрицина из данной среды. Стадия сбора белка может также включать: концентрирование белка путем фильтрации данной среды через мембрану; сбор оставшегося белка из указанной мембраны, и солюбилизацию собранного белка в забуференном солевом растворе, содержащем гидрохлорид L-аргинина в концентрации от 0,1 до 2,0 М.
В другом родственном варианте настоящее изобретение относится к выделенному антителу, специфичному к рекомбинантному белку лубрицину.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего описания предпочтительных вариантов изобретения и из формулы изобретения.
Подробное описание изобретения
Основная ДНК-конструкция, используемая для генерирования рекомбинантных белков лубрицина, может включать последовательности 5'- и 3'-экзона 6 гена PRG4 в различном порядке. Так, например, основная ДНК-конструкция может включать последовательности, кодирующие домены, подобные доменам соматомедина В, (экзоны 2-4) или гемопексин-подобные домены (экзоны 7-9) в различном порядке.
Вариантами основной ДНК-конструкции, имеющей последовательности 3'-экзона 6 в различном порядке, могут быть основные ДНК-конструкции, которые включают только отдельные экзоны 7, 8, 9, 10, 11 или 12, или пары экзонов (7 и 8), (7 и 9), (7 и 10), (7 и 11), (7 и 12), (8 и 9), (8 и 10), (8 и 11), (8 и 12), (9 и 10), (9 и 11), (9 и 12), (10 и 11), (10 и 12) или (11 и 12), или триплеты экзонов (7, 8 и 9), (7, 8 и 10), (7, 8 и 11), (7, 8 и 12), (7, 9 и 10), (7, 9 и 11), (7, 9 и 12), (7, 10 и 11), (7, 10 и 12), (7, 11 и 12), (8, 9 и 10), (8, 9 и 11), (8, 9 и 12), (8, 10 и 11), (8, 10 и 12), (8, 11 и 12), (9, 10 и 11), (9, 10 и 12), (9, 11 и 12) или (10, 11 и 12), или квадруплеты экзонов (7, 8, 9 и 10), (7, 8, 9 и 11), (7, 8, 9 и 12), (7, 8, 10 и 11), (7, 8, 10 и 12), (7, 8, 11 и 12), (7, 9, 10 и 11), (7, 9, 10 и 12), (7, 9, 11 и 12), (7, 10, 11 и 12), (8, 9, 10 и 11), (8, 9, 10 и 12), (8, 9, 11 и 12), (8, 10, 11 и 12) или (9, 10, 11 и 12), или квинтеты экзонов (7, 8, 9, 10 и 11), (7, 8, 9, 10 и 12), (7, 8, 9, 11 и 12), (7, 8, 10, 11 и 12), (7, 9, 10, 11 и 12) или (8, 9, 10, 11 и 12) или секстет экзонов (7, 8, 9, 10, 11 и 12).
Кроме того, вариантами основной ДНК-конструкции, имеющей последовательности 5'-экзона 6 в различном порядке, могут быть основные ДНК-конструкции, которые включают только отдельные экзоны 1, 2, 3, 4 или 5, или пары экзонов (1 и 2), (1 и 3), (1 и 4), (1 и 5), (2 и 3), (2 и 4), (2 и 5), (3 и 4), (3 и 5) или (4 и 5), или триплеты экзонов (1, 2 и 3), (1, 2 и 4), (1, 2 и 5), (1, 3 и 4), (1, 3 и 5), (1, 4 и 5), (2, 3 и 4), (2, 3 и 5), (2, 4 и 5) или (3, 4 и 5), или квадруплеты экзонов (1, 2, 3 и 4), (1, 2, 3 и 5), (1, 2, 4 и 5), (1, 3, 4 и 5) или (2, 3, 4 и 5), или квинтеты экзонов (1, 2, 3, 4 и 5).
Настоящее изобретение также охватывает белки, кодируемые основными ДНК-конструкциями, то есть белки, в которых часть полипептида или весь полипептид, кодируемые последовательностью экзона 6, делетированы, и в которых отсутствуют аминокислоты, кодируемые вставками, происходящими от синтетических кДНК-кластеров.
Настоящее изобретение также охватывает полинуклеотиды, гомологичные полинуклеотидам конкретных описанных здесь вариантов, например полинуклеотиды, имеющие последовательности, которые по крайней мере на 80%, 85%, 90%, 95%, 97%, 98% или 99% идентичны конкретным ДНК-последовательностям. Настоящее изобретение также включает полинуклеотиды, имеющие последовательность нуклеиновой кислоты, способную гибридизоваться с комплементом конкретных ДНК-последовательностей по всей длине функционального домена в условиях высокой жесткости. Настоящее изобретение также включает белки, кодируемые этими гомологичными или гибридизующимися полинуклеотидами.
Для лучшего понимания вариантов настоящего изобретения ниже приводятся определения встречающихся здесь терминов.
Определения
Выражение “повторяющаяся КЕРАРТТ-подобная последовательность” означает аминокислотную последовательность, которая по крайней мере на 90%, 93%, 95%, 96%, 97%, 98%, 99% или более: (а) идентична последовательности “APTTPКЕРАРТТTKSAPTTКЕРАРТТTKEPAPTTPКЕРАРТТТK” (SEQ ID NO:26; 45 аминокислот) и имеет по крайней мере одно замещение по О-связи; (b) идентичная последовательности “КЕРАРТТTКЕРАРТТTKSAPTTPКЕРАРТТP” (SEQ ID NO:27; 31 аминокислота) и имеет по крайней мере одно замещение по О-связи; или (с) идентична последовательности “ЕРАРТТTKSAPTTPКЕРАРТТP” (SEQ ID NO:28; 22 аминокислоты) и которая имеет по крайней мере одно замещение по О-связи. Повторяющаяся КЕРАРТТ-подобная последовательность может иметь, предпочтительно, две, три, четыре или более замещений по О-связи.
Существует ряд методов определения идентичности между двумя полинуклеотидными или полипептидными последовательностями, и термин “идентичность” хорошо известен специалистам и имеет определенное значение в зависимости от конкретно применяемого метода. Описанную здесь идентичность последовательностей определяют с использованием компьютерной программы BLAST 2 SEQUENCES, имеющейся в NCBI (http://www.ncbi.nlm.nih.gov/blast/, см. также Tatusova & Madden (1999)). Для аминокислотных последовательностей используются следующие параметры: ожидаемая величина = 1000; длина слова = 2; команда фильтр = отсутствует, а другие параметры используются по умолчанию. Для последовательностей нуклеиновых кислот используются те же самые параметры, за исключением, того, что длина слова = 8. Для сравнения аминокислотных последовательностей используются следующие параметры по умолчанию: матрица = BLOSUM62; штраф за пробел-пропуск = 11; штраф за пробел-удлинение = 1 и пробел х исключение = 50. Для сравнения последовательностей нуклеиновых кислот используются следующие параметры по умолчанию: “премия” за совпадение = 1; штраф за ошибочное спаривание = -2; выбор цепи = обе цепи; штраф за пробел-пропуск = 5; штраф за пробел-удлинение = 2 и пробел х исключение = 50.
Замещением по О-связи в рекомбинантном лубрицине может быть замещение смазывающим олигосахаридом β-(1-3)-Gal-GalNac, или другими молекулами, включая искусственные или природные углеводные молекулы (такие как сульфат кератина или сульфат хондротина). В некоторых вариантах изобретения, замещением по О-связи может быть замещение молекулами, которые способствуют функционированию рекомбинантного лубрицина как носителя поверхностно-активного фосфолипида (SALP) или других поверхностно-активных веществ (Hills, 2002). Процент гликозилирования или замещения определяют по массе (сухой массе).
Условия высокой жесткости, используемые для гибридизации ДНК:ДНК, означают условия, эквивалентные условиям связывания или гибридизации при 42єС в растворе, состоящем из 5х SSPE (43,8 г/л NaCl, 6,9 г/л NaH2PO4 · H2O и 1,85 г/л EDTA, рН, доведенный до 7,4 путем добавления NaOH), 0,5% ДСН, 5х реагент Денхардта и 100 мкг/мл денатурированной ДНК спермы лосося, с последующей промывкой в растворе, содержащем 0,1х SSPE, 1,0% ДСН, при 42°С, при использовании зонда длиной примерно 500 нуклеотидов.
Говорят, что полипептиды или другие описанные здесь соединения являются “выделенными”, если они присутствуют в препаратах, которые содержат по крайней мере 50 мас.% (по сухой массе) представляющего интерес соединения. Говорят, что полипептиды или другие описанные здесь соединения являются “по существу, чистыми”, если они присутствуют в препаратах, которые содержат по крайней мере 80 мас.% (по сухой массе) представляющего интерес соединения. Говорят, что полипептиды или другие описанные здесь соединения являются “гомогенными”, если они присутствуют в препаратах, которые содержат по крайней мере 95 мас.%, а предпочтительно, 99 мас.% (по сухой массе) представляющего интерес соединения. Чистоту измеряют путем электрофореза в восстанавливающем полиакриламидном геле и интенсивного окрашивания кумасси синим с последующим мониторингом оптической плотности полос (то есть, где чистота белка определяется путем оптической денситометрии).
Термин “апирогенный” означает “не содержащий примесей, вызывающих лихорадку, включая эндотоксин”. Определение наличия примесей осуществляют с помощью серии стандартных тестов, разрешенных Управлением по контролем за качеством пищевых продуктов, медикаментов и косметических средств (США).
Используемый здесь термин “терапевтически эффективное количество” означает общее количество каждого активного компонента, используемого в соответствующей фармацевтической композиции или в соответствующем способе, которое является достаточным для продуцирования у пациента положительного эффекта лечения и для излечения, предупреждения или улучшения соответствующего клинического состояния, а также для ускорения продуцирования у пациента положительного эффекта лечения и для ускорения излечения, предупреждения или улучшения такого состояния. При применении конкретного активного ингредиента, вводимого отдельно, этот термин относится лишь к одному ингредиенту. При применении комбинации ингредиентов этот термин означает комбинированное количество активных ингредиентов, которое дает терапевтический эффект независимо от того, вводятся ли эти ингредиенты в комбинации последовательно или одновременно.
В некоторых вариантах настоящего изобретения могут быть использованы внутрисуставные добавки. Такими добавками являются внутрисуставные добавки, которые содержат соединения, не происходящие от лубрицина, и которые используются в качестве терапевтических средств для лечения суставов. Так, например, для устранения ОА-ассоциированной боли в коленях использовали клинически приемлемые “добавки, повышающие вязкость” с полимерным гиауронаном (НА) и высокомолекулярными гиланами (такими как упруговязкая жидкость SYNVISC® “Hylan G-F 20”, распространяемая фирмой WYETH® Pharmaceuticals). Было показано, что эта повышающая вязкость добавка имеет высокую терапевтическую ценность, особенно для устранения боли в суставах у пациентов, вызываемые нагрузкой под действием массы тела (Wobig et al., 1998).
Гилан G-F 20 образуется при сшивании нескольких молекул НА, выделенных из петушиных или куриных гребешков. Добавка, повышающая вязкость и содержащая гилан G-F 20, может быть гораздо более эффективной для ослабления боли, чем добавка, содержащая НА с более низкой молекулярной массой (Wobig et al., 1999). Кроме того, использование повышающей вязкость и облегчающей боль добавки с гиланом G-F20, может оказаться более предпочтительной при введении НСПВС тем пациентам, которые страдают непереносимостью НСПВС (например, пациентам с высоким риском возникновения осложнений желудочно-кишечного заболевания; Espallargues & Pons, 2003). Хотя введение повышающей вязкость добавки с гиланом G-F 20 является безопасной и хорошо переносимой терапией, которая приводит к кратковременному (то есть, до 3-6 месяцев после лечения) ослаблению болевых симптомов и улучшению функции суставов, однако такая терапия пока не может дать надежную гарантию того, что в дальнейшем не потребуется протезирование колена у пациентов с ОА (Espallargues & Pons, 2003).
Пример 1: Клонирование рекомбинантного лубрицина
Конструкции. В некоторых вариантах изобретения, основная ДНК-конструкция для генерирования рекомбинантных молекул лубрицина состоит из последовательности, простирающейся от кодона Met (ATG) до (включительно) рестрикционного BssHII-сайта (G^CGCGC) SEQ ID NO:6 (т.е., нуклеотиды 1-1123), и из последовательности, простирающейся от рестрикционного BspE1-сайта (T^CCGGA) до (включительно) стоп-кодона (ТАА) SEQ ID NO:6 (т.е., нуклеотиды 1269-2946). Эти последовательности, т.е., нуклеотиды 1-1123 и 1269-2946 SEQ ID NO:6, кодируют аминокислоты М1-S373 (кодируемые экзонами 1-5 и приблизительно 174 фланкирующими 5'-кодонами экзона 6) и Е848-Р1404 (кодируемые приблизительно 293 фланкирующими 3'-кодонами экзона 6 и экзонами 7-14) природного полноразмерного лубрицина (т.е., PRG4). Часть экзона 6, удаленная из основной ДНК-конструкции, соответствует ДНК-последовательности, кодирующей аминокислоты А374-Р847 нативного PRG4 (т.е., приблизительно из 940 аминокислот, кодируемых экзоном 6, были удалены 474 аминокислоты). Такая отсутствующая аминокислотная последовательность обогащена КЕРАРТТ-подобными последовательностями.
ДНК-последовательность синтетического кДНК-кластера-1 (SEQ ID NO:1) была добавлена посредством BssHII/BspEI к основной конструкции с получением рекомбинантной кДНК-конструкции PRG4-Lub:1 (SEQ ID NO:6). Последовательность SEQ ID NO:6 состоит из ДНК-вставки Lub:1 (SEQ ID NO:8, которая кодирует 51 аминокислоту SEQ ID NO:9 с ее четырьмя последовательностями КЕРАРТТ), расположенной между ДНК, кодирующей аминокислоты М1-S373, и ДНК, кодирующей аминокислоты Е848-Р1404 нативного PRG4. Другими словами, вместо А374-Р847 (474 аминокислоты) нативного PRG4, рекомбинантный лубрицин PRG4-LUB:1 включает 51 аминокислоту, которые образуют четыре полноразмерные последовательности КЕРАРТТ и приблизительно три неполных последовательности КЕРАРТТ.
ДНК-последовательность синтетического кДНК-кластера-1 (SEQ ID NO:1) была добавлена посредством BsuHII/BspEI к конструкции PRG4-Lub:1 с получением кДНК-конструкции “PRG4-Lub:2” (SEQ ID NO:10). кДНК-конструкция PRG4-Lub:1 имеет один рестрикционный Bsu36I-сайт (CC^TNAGG, т.е., CC^TAAGG, нуклеотиды №№ 1225-1231 SEQ ID NO:6). При добавлении синтетического кДНК-кластера-2 к кДНК-конструкции PRG4-Lub:1, этот Bsu36I-сайт был разрушен, однако синтетический кластер-2 содержит другой внутренний рестрикционный Bsu36I-сайт (CC^TNAGG, т.е., CC^TAAGG; нуклеотиды 92-98 SEQ ID NO:3). Затем может быть получена конструкция PRG4-Lub:N+1 путем присоединения Bsu36I/BspEI-фрагмента синтетического кДНК-кластера-2 к описанной ранее конструкции PRG4-Lub:N в этом внутреннем рестрикционном Bsu36I-сайте, который обеспечивается синтетическим кДНК-кластером-2.
кДНК-кластеры синтезировали в виде одноцепочечных олигонуклеотидов и гибридизовали вместе для продуцирования фрагмента двухцепочечной ДНК с липкими концами. Поэтому концевые BssHII-, Bsu36I- и BspEI-сайты являются неполными. В синтетическом кДНК-кластере-1 (SEQ ID NO:1) последовательность, ограниченная остаточными фланкирующими рестрикционными сайтами BssHII-(G^CGCGC) и BspEI-(T^CCGGA), включает внутренний рестрикционный Bsu36I-сайт (CC^TNAGG, то есть, CC^TAAGG), и эти рестрикционные сайты в указанных ниже последовательностях подчеркнуты.
SEQ ID NO:2, которая образуется в результате трансляции последовательности SEQ ID NO:1, включает четыре последовательности КЕРАРТТ, имеющие абсолютные соответствия (подчеркнуты снизу):
Аналогичным образом, синтетический кДНК-кластер-2 (SEQ ID NO:3) имеет остаточный 5'-концевой рестрикционный Bsu36I-сайт (то есть, CC^TNAGG, представленный только последовательностью ТАА), 3'-концевой остаточный рестрикционный BspEI-сайт (T^CCGGA) и внутренний рестрикционный Bsu36I-сайт (CC^TNAGG); эти рестрикционные сайты в указанных ниже последовательностях подчеркнуты.
SEQ ID NO:4, которая образуется в результате трансляции последовательности SEQ ID NO:3, включает три последовательности КЕРАРТТ, имеющие абсолютные соответствия (подчеркнуты снизу):
Рекомбинантная кДНК-конструкция PRG4-Lub:1 (SEQ ID NO:6) в векторе рTmed2 (конструкция + вектор составляют последовательность SEQ ID NO:5) фланкирована рестрикционным Sall-сайтом (G^TCGAC; нуклеотиды 1027-1032 SEQ ID NO:5) и рестрикционным NotI-сайтом (GC^GGCCGC; нуклеотиды 3984-3991 SEQ ID NO:5). Sall-сайт вводит модифицированную последовательность инициации трансляции Козака (СССАСС; нуклеотиды 1032-1037 SEQ ID NO:5) перед кодоном инициации трансляции АТG (нуклеотиды 1038-1040 SEQ ID NO:5). Между рестрикционным BssHII-сайтом (G^CGCGC; нуклеотиды 2155-2160 SEQ ID NO:5) и BspEI-сайтом (T^CCGGA; нуклеотиды 2306-2311 SEQ ID NO:5) находится внутренний клонирующий Bsu36I-сайт (CC^TNAGG, то есть, CC^TАAGG; нуклеотиды 2262-2268 SEQ ID NO:5).
кДНК-конструкция PRG4-Lub:1 (SEQ ID NO:6) транслируется в белок PRG4-LUB:1 (SEQ ID NO:7). Вставка между S373 и Е425 (то есть, Е848 нативного PRG4) целого белка PRG4-LUB:1 (SEQ ID NO:7) представляет собой последовательность SEQ ID NO:9, состоящую из 51 аминокислоты. Эта последовательность транслируется из ДНК-вставки Lub:1 (SEQ ID NO:8) и включает четыре полноразмерных последовательностей КЕРАРТТ. Между рестрикционным BssHII-сайтом (G^CGCGC; нуклеотиды 1118-1123 SEQ ID NO:6) и рестрикционным BspEI-сайтом (T^CCGGA; нуклеотиды 1269-1274 SEQ ID NO:6) находится внутренний клонирующий Bsu36I-сайт (CC^TNAGG, то есть, CC^TАAGG; нуклеотиды 1225-1231 SEQ ID NO:6).
Как и в рекомбинантной конструкции PRG4-Lub:1 в векторе рTmed2, рекомбинантная кДНК-конструкция PRG4-Lub:2 (SEQ ID NO:10) в векторе рTmed2 фланкирована рестрикционным Sall-сайтом (G^TCGAC) и рестрикционным NotI-сайтом (GC^GGCCGC), где Sall-сайт вводит модифицированную последовательность инициации трансляции Козака (СССАСС) перед кодоном инициации трансляции АТG (нуклеотиды 1-3 SEQ ID NO:10). И аналогичным образом, каждая из рекомбинантных кДНК-конструкций PRG4-Lub:3 (SEQ ID NO:14), PRG4-Lub:4 (SEQ ID NO:18) и PRG4-Lub:5 (SEQ ID NO:22) в векторе рTmed2 фланкирована рестрикционным Sall-сайтом (G^TCGAC) и рестрикционным NotI-сайтом (GC^GGCCGC), где Sall-сайт вводит модифицированную последовательность инициации трансляции Козака (СССАСС) перед кодоном инициации трансляции АТG (нуклеотиды 1-3 SEQ ID NO:14, 18 и 22, соответственно).
В кДНК-конструкции “PRG4-Lub:2” внутренний клонирующий Bsu36I-сайт (CC^TNAGG, то есть, CC^TАAGG; нуклеотиды 1318-1324 SEQ ID NO:10) находится между рестрикционным BssHII-сайтом (G^CGCGC; нуклеотиды 1118-1123) и рестрикционным BspEI-сайтом (T^CCGGA; нуклеотиды 1347-1352). Конструкция PRG4-Lub:2 (SEQ ID NO:10) транслируется в белок PRG4-LUB:2 (SEQ ID NO:11). Вставка между S373 и Е451 (то есть, Е848 нативного PRG4) целого белка PRG4-LUB:2 (SEQ ID NO:11) представляет собой последовательность SEQ ID NO:13, состоящую из 77 аминокислот. Эта последовательность транслируется из ДНК-вставки Lub:2 (SEQ ID NO:12). Вместо А374-Р847 (474 аминокислоты) нативного PRG4, 77 аминокислот рекомбинантного лубрицина PRG4-LUB:2 образуют шесть полноразмерных последовательностей КЕРАРТТ и примерно четыре неполных последовательности КЕРАРТТ.
В кДНК-конструкции “PRG4-Lub:3” внутренний клонирующий Bsu36I-сайт (CC^TNAGG, то есть, CC^TАAGG; нуклеотиды 1411-1417 SEQ ID NO:14) находится между рестрикционным BssHII-сайтом (G^CGCGC; нуклеотиды 1118-1123) и рестрикционным BspEI-сайтом (T^CCGGA; нуклеотиды 1440-1445). Конструкция PRG4-Lub:3 (SEQ ID NO:14) транслируется в белок PRG4-LUB:3 (SEQ ID NO:15). Вставка между S373 и Е482 (то есть, Е848 нативного PRG4) целого белка PRG4-LUB:3 (SEQ ID NO:15) представляет собой последовательность SEQ ID NO:17, состоящую из 108 аминокислот. Эта последовательность транслируется из ДНК-вставки Lub:3 (SEQ ID NO:16). Вместо А374-Р847 (474 аминокислоты) нативного PRG4, 108 аминокислот рекомбинантного лубрицина PRG4-LUB:3 образуют девять полноразмерных последовательностей КЕРАРТТ и примерно пять неполных последовательностей КЕРАРТТ.
В кДНК-конструкции “PRG4-Lub:4” внутренний клонирующий Bsu36I-сайт (CC^TNAGG, то есть, CC^TАAGG; нуклеотиды 1504-1510 SEQ ID NO:18) находится между рестрикционным BssHII-сайтом (G^CGCGC; нуклеотиды 1118-1123) и рестрикционным BspEI-сайтом (T^CCGGA; нуклеотиды 1533-1538). Конструкция PRG4-Lub:4 (SEQ ID NO:18) транслируется в белок PRG4-LUB:4 (SEQ ID NO:19). Вставка между S373 и Е513 (то есть, Е848 нативного PRG4) целого белка PRG4-LUB:4 (SEQ ID NO:19) представляет собой последовательность SEQ ID NO:21, состоящую из 139 аминокислот. Эта последовательность транслируется из ДНК-вставки Lub:4 (SEQ ID NO:20). Вместо А374-Р847 (474 аминокислоты) нативного PRG4, 139 аминокислот рекомбинантного лубрицина PRG4-LUB:4 образуют двенадцать полноразмерных последовательностей КЕРАРТТ и примерно шесть неполных последовательностей КЕРАРТТ.
В кДНК-конструкции “PRG4-Lub:5” внутренний клонирующий Bsu36I-сайт (CC^TNAGG, то есть, CC^TАAGG; нуклеотиды 1597-1603 SEQ ID NO:22) находится между рестрикционным BssHII-сайтом (G^CGCGC; нуклеотиды 1118-1123) и рестрикционным BspEI-сайтом (T^CCGGA; нуклеотиды 1626-1631). Конструкция PRG4-Lub:5 (SEQ ID NO:22) транслируется в белок PRG4-LUB:5 (SEQ ID NO:23). Вставка между S373 и Е544 (то есть, Е848 нативного PRG4) целого белка PRG4-LUB:5 (SEQ ID NO:23) представляет собой последовательность SEQ ID NO:25, состоящую из 170 аминокислот. Эта последовательность транслируется из ДНК-вставки Lub:5 (SEQ ID NO:24). Вместо А374-Р847 (474 аминокислоты) нативного PRG4, 170 аминокислот рекомбинантного лубрицина PRG4-LUB:5 образуют пятнадцать полноразмерных последовательностей КЕРАРТТ и примерно семь неполных последовательностей КЕРАРТТ.
Важно отметить, что процесс встраивания синтетического кДНК-кластера-2 может повторяться бесконечно. Каждая итерация приводит к добавлению трех полноразмерных последовательностей КЕРАРТТ. Рекомбинантные лубрицины PRG4-LUB:6 - PRG4-LUB:N конструировали так же как и рекомбинантные лубрицины PRG4-LUB:2 - PRG4-LUB:5, которые были сконструированы вышеописанным способом с использованием последовательностей-вставок. В таблице 2 в систематизированном виде приводятся последовательности BssHII/BspEI-вставки.
Таблица 2. Последовательности BssHII/BspEI-вставки
Хотя авторами была проиллюстрирована основная ДНК-конструкция с полноразмерным PRG4, содержащим все 12 экзонов (без центральной части экзона 6), однако, могут быть также использованы варианты сплайсинга PRG44 в зависимости от желаемых активностей и нужной длины. Кроме того, могут быть использованы и другие рестриктирующие ферменты в аналогичной стратегии при условии, что они будут иметь подходящую локализацию в последовательности нуклеиновой кислоты, кодирующей белок PRG4. В других вариантах изобретения основная ДНК-конструкция не содержит нативной последовательности экзона 6, но включает одну или несколько последовательностей от экзона 1 до экзона 5, включительно, или последовательностей от экзона 7 до экзона 12, включительно, нативного гена PRG4. В других вариантах изобретения, основная ДНК-конструкция идентична рекомбинантным последовательностям МSF, описанным в US6433142 или US20020137894, за исключением того, что в ней отсутствует вся последовательность экзона 6 или ее часть.
В своем предпочтительном варианте настоящее изобретение относится к кДНК-конструкции, кодирующей рекомбинантные лубрицины, которые были клонированы в рестрикционный Sall-сайт (G^TCGAC; нуклеотиды 1027-1032 SEQ ID NO:5) и рестрикционный NotI-сайт (GC^GGCCGC; нуклеотиды 3984-3991 SEQ ID NO:5) в эукариотическом экспрессионном векторе рTmed2 (например, рекомбинантная кДНК-конструкция PRG4-Lub:1 (SEQ ID NO:10) в экспрессионном векторе рTmed2, локализована в SEQ ID NO:5 в положениях нуклеотидов 1038-3983). Sall-сайт вводит первый нуклеотид модифицированной последовательности инициации трансляции Козака (СССАСС; нуклеотид 1032 SEQ ID NO:5) перед инициирующим кодоном метионина (АТG; нуклеотиды 1038-1040 SEQ ID NO:5). Другие варианты настоящего изобретения включают другие комбинации рестрикционных сайтов и другие экспрессионные векторы.
В предпочтительном варианте изобретения, описанный итеративный процесс предусматривает использование синтетического кДНК-кластера-1 (SEQ ID NO:1) в экспрессионном векторе рTmed2, который фланкирован рестрикционными BssHII-сайтом (G^CGCGC) и рестрикционным BspEI-сайтом (T^CCGGA), и синтетического кДНК-кластера-1, который включает внутренний рестрикционный Bsu36I-сайт (CC^TNAGG, то есть, CC^TАAGG; нуклеотиды 107-113 SEQ ID NO:1). В этом предпочтительном варианте для итеративного генерирования рекомбинантных конструкций лубрицина, содержащих КЕРАРТТ-подобные последовательности, синтетический кДНК-кластер-2 (SEQ ID NO:3) был встроен между Bsu36I- и BspEI-сайтами указанной рекомбинантной конструкции. Синтетический кДНК-кластер-2 (SEQ ID NO:3) фланкирован модифицированным остаточным Bsu36I-сайтом (TAAAG) и остаточным BspEI-сайтом (ACTCCGG). Он также включает внутренний Bsu36I-сайт (CC^TNAGG, то есть, CC^TАAGG; нуклеотиды 92-98 SEQ ID NO:3). После клонирования синтетического кДНК-кластера-2 в Bsu36I- и BspEI-сайты рекомбинантной конструкции лубрицина, клонирующий Bsu36I-сайт исходной конструкции разрушался, в результате чего оставался один уникальный клонирующий Bsu36I-сайт в новой конструкции.
В этом предпочтительном варианте изобретения аминокислотная последовательность, “APTTPKEPAPTTTKSAPTTPKEPAPTTTKEPAPTTPKEPAPTTTK” (SEQ ID NO:26; 45 аминокислот) сохраняет часть каждого из белков PRG4-LUB:N (где N = целому числу 1 или более). Кроме того, аминокислотная последовательность “KEPAPTTTKEPAPTTTKSAPTTPKEPAPTTP” (SEQ ID NO:27; 31 аминокислота) кодируется ДНК-вставкой, которая становится частью каждой из кДНК-конструкций PRG4-LUB:N+1 в результате присоединения синтетического Bsu36I/BspEI-кДНК-кластера-2 к кДНК-конструкции PRG4-LUB:N. Что касается белка PRG4-LUB:N, где N равно целому числу ≥ 3, то в предпочтительных вариантах изобретения аминокислотная последовательность“EPAPTTTKEPAPTTTKSAPTTPKEPAPTTP” (SEQ ID NO:28; 22 аминокислоты), соединяет SEQ ID NO:26 с повторами (N-2) SEQ ID NO:27. Кроме того, в предпочтительных вариантах изобретения за аминокислотной последовательностью “KEPKPAPTTP” (SEQ ID NO:29, 10 аминокислот) непосредственно следует после