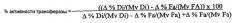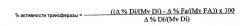Ферментативная обработка масел
Иллюстрации
Показать всеИзобретение относится к биотехнологии и касается способа уменьшения содержания и/или удаления диглицерида из пищевого масла, который включает смешивание пищевого масла с субстратом акцептора ацильных групп и диглицерид:глицерин-ацилтрансферазой, не зависящей от СоА жирной кислоты, причем диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты, является ферментом, способным переносить в пищевом масле ацильную группу из диглицерида в глицерин. Диглицерид:глицерин-ацилтрансфераза предпочтительно содержит фрагмент аминокислотной последовательности GDSX, где Х означает один или несколько нижеследующих аминокислотных остатков L, А, V, I, F, Y, H, Q, Т, N, М или S. Изобретение также касается применения диглицерид:глицерин-ацилтрансферазы, не зависящей от СоА жирной кислоты, которая является ферментом, способным переносить в пищевом масле ацильную группу из диглицерида в глицерин, при производстве пищевого масла для уменьшения содержания и/или удаления диглицерида из указанного пищевого масла, и к применению указанного фермента при производстве пищевого продукта, содержащего пищевое масло, для улучшения свойств кристаллизации указанного пищевого продукта. Изобретение позволяет повысить эффективность удаления или уменьшения диглицерида из масла. 3 н. и 26 з.п. ф-лы, 52 ил., 6 табл.
Реферат
Ссылка на родственные заявки
В описании настоящего изобретения сделаны ссылки на нижеследующие родственные заявки: заявка на патент США № 09/750990, поданная 20 июля 1999 г.; заявка на патент США № 10/409391; заявка на патент США № 60/489441, поданная 23 июля 2003 г.; заявка на патент Соединенного Королевства № GB 0301117.8, поданная 17 января 2003 г.; заявка на патент Соединенного Королевства № GB 0301118.6, поданная 17 января 2003 г.; заявка на патент Соединенного Королевства № GB 0301119.4, поданная 17 января 2003 г.; заявка на патент Соединенного Королевства № GB 0301120.2, поданная 17 января 2003 г.; заявка на патент Соединенного Королевства № GB 0301121.0, поданная 17 января 2003 г.; заявка на патент Соединенного Королевства № GB 0301122.8, поданная 17 января 2003 г.; заявка на патент Соединенного Королевства № GB 0330016.7, поданная 24 декабря 2003 г., и международная заявка на патент РСТ/IB 2004/000655, поданная 15 января 2004 г. Все вышеуказанные заявки, все документы, приведенные в указанных заявках (“документы, на которые имеется ссылка в материалах заявки”), и все документы, приведенные в документах, на которые имеется ссылка в материалах заявки, указанные в тексте или использованные при рассмотрении дела по заявке на патент, а также доводы, подтверждающие патентоспособность изобретения, приведенные в процессе рассмотрения дела, включены в настоящее описание изобретения в качестве ссылки. В настоящем описании изобретения также приведены ссылки на различные документы (“документы, на которые имеется ссылка в материалах данной заявки”). Все документы, приведенные в данной заявке, и документы, на которые имеется ссылка в указанных документах, включены в настоящее описание изобретения в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому способу ферментативного удаления и/или уменьшения содержания диглицерида (предпочтительно 1,2-диацилглицерида) в пищевом масле.
Уровень техники
Масла и жиры представляют собой сложные смеси триацилглицеринов (TAG), диацилглицеринов (DAG), свободных жирных кислот и других второстепенных компонентов. Кристаллизация указанных смесей зависит от характеристик TAG (структуры, длины цепи, насыщенности по сравнению с ненасыщенностью и тому подобных) и взаимодействия указанных TAG друг с другом. Что касается присутствия DAG, то ранее проведенные исследования показали, что диацилглицерины оказывают существенное влияние на физические свойства масел и жиров. Указанные свойства изменяются в зависимости от скорости кристаллизации, разной степени полиморфизма, температуры плавления, размеров и формы кристаллов (Siew, 2001).
В большинстве масел, экстрагированных из семян масличных, влияние DAG является менее выраженным, так как диацилглицерины присутствуют в таких маслах в небольших количествах. От присутствия DАG страдает главным образом качество пальмового и оливкового масел, которые характеризуются высоким природным содержанием DAG.
Пальмовое масло, получаемое из гвинейской масличной пальмы (Elaeis guineensis), является важным в коммерческом отношении пищевым маслом. Пальмовое масло является важным источником жира и масла для пищевой промышленности благодаря нескольким благоприятным свойствам, таким как высокая продуктивность, низкая стоимость, высокая тепловая стойкость, устойчивость к окислению и пластичность при комнатной температуре. Кроме того, по сравнению с другими растительными маслами пальмовое масло является богатым источником витамина Е, являющегося антиоксидантом.
Типичный химический состав рафинированного пальмового масла включает примерно 93% триглицеридов, 6% диглицеридов и 1% моноглицеридов (MAG) (Okiy, 1977).
В результате кристаллизации пальмового масла образуется сложная трехмерная сетка, состоящая из указанных компонентов. Из теории следует, что чем больше разнообразие строительных блоков (TAG, DAG и MAG) в указанной сетке, тем сложнее является данная сетка и тем медленнее происходит кристаллизация (Jacobsberg & Ho, 1976). Данная теория была подтверждена Дроздовским (1994). Кроме того, исследования, выполненные данным ученым, показывают, что чем разнообразнее является состав жирных кислот в молекуле триацилглицерина, тем труднее происходит переход между разными кристаллическими фазами.
Как было указано выше, высокое содержание диглицеридов в пальмовом масле влияет на его свойства кристаллизации (Okiy et al., 1978, Okiy, 1978).
Наличие диглицеридов в таких маслах является неблагоприятным фактором. Диглицериды в пищевых маслах (особенно в пальмовом масле), в частности, являются причиной низкого качества масла.
Проблемы, связанные с содержанием диглицеридов в пальмовом масле и других пищевых маслах и жирах, были предметом многих исследований и в научной литературе были описаны разные способы преодоления проблемы высокого содержания диглицеридов.
Японский производитель ферментов, компания Амано на своей информационной home-странице (Amano Enzyme Inc., 2004) рекомендует применение ферментативного процесса для удаления диглицерида из жиров и масел. Данный процесс основан на использовании фермента ЛИПАЗА G “AMANO” 50, который способен расщеплять диглицериды с образованием свободных жирных кислот и глицерина. Указанный фермент гидролизует диглицерид (DAG) и/или моноглицерид (MAG). Образовавшиеся свободные жирные кислоты удаляют путем вакуумной перегонки или фракционированной кристаллизации.
В европейском патенте № 0558112 описан способ ферментативного гидролиза остаточных диглицеридов в триглицеридных препаратах в эмульсиях. Данный способ основан на гидролизе диглицерида при помощи липазы G компании Amano, Япония (см. выше). Указанный способ был усовершенствован в результате выполнения ферментативной реакции в эмульсии для расщепления диглицерида с образованием жирных кислот и глицерина. Водную фазу отделяют после выполнения реакции и указанный фермент частично используют вторично.
В патенте Японии № 62061590 описано масло твердой консистенции с низким содержанием диглицерида, которое получают путем обработки масел или жиров частично глицеридспецифическим ферментом (например, липазой) в присутствии каталитического количества воды или липазой, которая является ферментом, специфичным к 1,3-диглицериду, в присутствии жирных кислот, сложных эфиров жирных кислот или других глицеридов масел или жиров. Полученный продукт представляет собой масло твердой консистенции, которое особенно пригодно для использования в качестве заменителя масла какао. Таким образом, липазу G и липазу Rhizopus deremer (фермент, специфичный к 1,3-диглицериду) смешивали с диатомитом и гранулировали. Гранулы смешивали с фракцией, имеющей температуру плавления пальмового масла (5,7% диглицерида, кислотное число 0,25), и водой (10% в расчете на частично глицеридспецифический фермент). Смесь перемешивали при комнатной температуре в течение 1 часа, после чего ферменты и воду удаляли с образованием масла твердой консистенции, содержащего 1,2% диглицерида (кислотное число 10,5).
Таким образом, ранее были описаны способы удаления или уменьшения содержания диглицерида в пальмовом масле и других пищевых маслах при помощи ферментативных реакций. В основе указанных способов лежит гидролиз диглицерида специфической диглицеридгидролизующей липазой с образованием свободных жирных кислот и глицерина. Затем свободные жирные кислоты могут быть удалены разными методами, такими как вакуумная перегонка или фракционирование.
Недостатком применения специфического диглицеридгидролизующего фермента является вредное образование свободных жирных кислот. Указанные свободные жирные кислоты должны быть удалены из пальмового масла. Таким образом, образование свободных жирных кислот часто рассматривается как потеря продукта.
Для преодоления проблем, связанных с удалением свободных жирных кислот и потерей продукта, вызываемого образованием свободных жирных кислот, авторы настоящего изобретения разработали новый способ, позволяющий снизить содержание диглицеридов в пальмовом масле и других растительных маслах.
В научной литературе было описано ферментативное удаление диглицеридов из пальмового масла при помощи липаз, которые обычно являются триацилглицерингидролизующими ферментами, специфичными к 1,3-диглицериду (Е.С. 3.1.1.3) (см., например, патент Японии № 62061590 или европейский патент № 0652289). В публикации WO 00/05396 наряду с прочим описана обработка липазой пищевого продукта, который может содержать глицерин, для осуществления глицеролиза в среде с низким содержанием воды.
Однако как триацилглицерингидролизующие ферменты, специфичные к 1,3-диглицериду (липазы), так и ферменты, гидролизующие DAG/MAG, вызывают значительное увеличение содержания свободных жирных кислот в масле, а также гидролиз моноглицеридов.
Однако в некоторых растительных маслах, предназначенных для определенных применений, может быть желательно увеличить содержание моноглицеридов, так как благодаря этому такое масло приобретает свойства эмульгатора. Таким образом, с одной стороны, желательно уменьшить содержание диглицеридов, не уменьшая содержания моноглицеридов. С другой стороны, может быть желательно уменьшить содержание как диглицеридов, так и моноглицеридов.
Кроме того, такие ферменты как липазы могут в значительной степени увеличивать содержание DAG вследствие гидролиза триацилглицерина (TAG), основного липида, присутствующего в пищевых маслах.
В публикациях WO 2000/36114, США 2003/0028923 и США 2003/0074695 описана трансформация растения нуклеиновой кислотой, которая имеет последовательность, кодирующую фермент диацилглицерин-ацилтрансферазу (DGAT), или его антисмысловую последовательность. В приведенных выше документах указано, что фермент DGAT катализирует конечную стадию “пути Кеннеди”, на которой диацилглицерин (DAG) объединяется с ацильными группами ацил-СоА с образованием триглицерида (TAG). Таким образом, в указанных документах описано получение трансгенных растений с модифицированным составом и/или содержанием TAG. Ферменты DGAT, как описано в вышеуказанных документах, не являются липид-ацилтрансферазами и/или диглицерид:глицерин-ацилтрансферазами по настоящему изобретению.
В частности, ферменты DGAT осуществляют воздействие только в присутствии ацил-СоА или СоА жирной кислоты. Ацил-СоА не пригоден для промышленного применения с целью обработки пищевых масел из-за слишком высокой стоимости. Однако указанные ферменты не действуют при отсутствии ацил-СоА. Кроме того, ферментативные реакции, осуществляемые в присутствии СоА жирной кислоты, трудно контролировать в промышленном масштабе.
Во всех приведенных выше документах указано, что часто желательно уменьшить экспрессию ферментов DGAT в растении и таким образом уменьшить содержание TAG. Такой подход резко отличается от настоящего изобретения, которое в конечном счете требует сохранения и/или продуцирования TAG при одновременном уменьшении содержания диглицеридов (DAG) в пищевом масле.
В публикации WO 03/100044 описана фосфолипид:диацилглицерин-ацилтрансфераза (PDAT), которая катализирует образование триглицеридов (TAG) в результате переноса ацильных групп из фосфолипидов (лецитин) в диацилглицерины (DAG). Ферменты PDAT требуют присутствия фосфолипида в качестве донора ацильных групп. Такой подход резко отличается от настоящего изобретения, в котором донором ацильных групп является DAG. В вышеуказанном документе не описано удаление DAG из пищевых масел с использованием липид-ацилтрансферазы по настоящему изобретению.
Сущность изобретения
Установлено, что использование липид-ацилтрансфераз, не зависящих от СоА жирной кислоты, в соответствии с определением, приведенным в настоящем описании изобретения, в частности диглицерид:глицерин-ацилтрансфераз, не зависящих от СоА жирной кислоты, вызывает избирательное уменьшение содержания и/или удаление диглицеридов (предпочтительно 1,2-диглицеридов) из пищевых масел.
Термин “избирательный” в используемом здесь значении означает, что в среде пищевого масла данный фермент использует диглицериды (DAG), предпочтительно 1,2-диглицериды, в качестве субстрата главным образом для триацилглицеридов (ТAG) или моноглицеридов (MAG). Таким образом, можно уменьшить содержание и/или удалить диглицериды из пищевого масла без изменения (или, по существу, без изменения) содержания триглицерида в масле. Количество моноглицеридов в масле остается неизмененным (или, по существу, неизмененным) или увеличивается. В некоторых применениях количество моноглицерида в масле может быть уменьшено.
Одним объектом настоящего изобретения является способ уменьшения содержания и/или удаления диглицерида из пищевого продукта, который включает смешивание пищевого продукта или его части с субстратом акцептора ацильных групп и диглицерид:глицерин-ацилтрансферазой, не зависящей от СоА жирной кислоты, причем диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты, является ферментом, способным переносить ацильную группу из диглицерида в глицерин в пищевом масле.
Другим объектом настоящего изобретения является способ уменьшения содержания и/или удаления диглицерида из пищевого масла, который включает смешивание пищевого масла с субстратом акцептора ацильных групп и диглицерид:глицерин-ацилтрансферазой, не зависящей от СоА жирной кислоты, причем диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты, является ферментом, способным переносить ацильную группу из диглицерида в глицерин в пищевом масле.
Способ по настоящему изобретению может далее включать добавление подвергнутого обработке пищевого масла или его части к одному или нескольким пищевым компонентам для получения пищевого продукта, такого как, например, маргарин или паста.
Настоящее изобретение далее относится к применению диглицерид:глицерин-ацилтрансферазы, не зависящей от СоА жирной кислоты, которая является ферментом, способным переносить ацильную группу из диглицерида в глицерин в пищевом масле, для производства пищевого продукта с пониженным содержанием и/или полностью удаленным (предпочтительно с избирательно пониженным содержанием и/или удаленным) диглицеридом.
Другим объектом настоящего изобретения является применение диглицерид:глицерин-ацилтрансферазы, не зависящей от СоА жирной кислоты, которая является ферментом, способным переносить ацильную группу из диглицерида в глицерин в пищевом масле, при производстве пищевого продукта для улучшения свойств кристаллизации указанного пищевого продукта.
Другим объектом настоящего изобретения является применение диглицерид:глицерин-ацилтрансферазы, не зависящей от СоА жирной кислоты, которая является ферментом, способным переносить ацильную группу из диглицерида в глицерин в пищевом масле, при производстве пищевого масла для уменьшения содержания и/или полного удаления (предпочтительно для избирательного уменьшения содержания и/или удаления) диглицерида из указанного пищевого масла.
Другим объектом настоящего изобретения является применение диглицерид:глицерин-ацилтрансферазы, не зависящей от СоА жирной кислоты, которая является ферментом, способным переносить ацильную группу из диглицерида в глицерин в пищевом масле, при производстве пищевого масла для улучшения свойств кристаллизации указанного пищевого масла.
Подробное описание изобретения
Термины “липид-ацилтрансфераза, не зависящая от СоА жирной кислоты” и “диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты” в используемом здесь значении означает фермент, обладающий активностью ацилтрансферазы (обычно классифицируемый как Е.С. 2.3.1.х в соответствии с публикацией “Рекомендации по номенклатуре ферментов” (1992) Комитета по номенклатуре Международного союза биохимии и молекулярной биологии), причем указанный фермент способен переносить ацильную группу из диглицерида в один или несколько акцепторных субстратов).
Таким образом, “липид-ацилтрансфераза, не зависящая от СоА жирной кислоты” или “диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты”, по настоящему изобретению означает фермент, который обладает активностью ацилтрансферазы (обычно классифицируемый как Е.С. 2.3.1.х), но не является диацилглицерин-ацилтрансферазой (DGAT) или фосфолипид:диацилглицерин-ацилтрансферазой (PDAT). Ферменты DGAT обычно классифицируются как Е.С. 2.3.1.20. Ферменты PDAT обычно классифицируются как Е.С. 2.3.1.158. Таким образом, липид-ацилтрансфераза, не зависящая от СоА жирной кислоты или диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению представляет собой фермент, который обладает активностью ацилтрансферазы, но не является ни одним из ферментов, классифицируемых как Е.С. 2.3.1.20 или Е.С. 2.3.1.158.
Фермент липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, или фермент диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению является ферментом, способным переносить ацильную группу из DAG в глицерин в пищевом масле. Таким образом, реакцию, катализируемую ферментом по настоящему изобретению, можно представить следующим образом: диглицерид (DAG) + глицерин → 2 моноглицерида (MAG).
Указанный фермент резко отличается от ферментов, известных как диацилглицерин-ацилтрансферазы (или диацилглицерин-О-ацилтрансфераза) (DGAT) (такие ферменты классифицируются как Е.С. 2.3.1.20), которые катализируют конечную стадию процесса Кеннеди, а именно: 1,2-DAG + ацил-СоА → СоА + триацилглицерин (TAG).
Во избежание сомнений следует отметить, что ферменты DGAT не являются липид-ацилтрансферазами, не зависящими от СоА жирной кислоты, или диглицерид:глицерин-ацилтрансферазами, не зависящими от СоА жирной кислоты, по настоящему изобретению.
Реакция, катализируемая ферментом по настоящему изобретению, также отличается от реакции, катализируемой ферментами, известными как фосфолипиды:диацилглицерин-ацилтрансфераза (PDAT), а именно:
фосфолипиды (такие как лецитин) + 1,2-DAG → триацилглицерин (TAG) + лизофосфолипид
Во избежание сомнений следует отметить, что ферменты PDAT не являются липид-ацилтрансферазами, не зависящими от СоА жирной кислоты, или диглицерид:глицерин-ацилтрансферазами, не зависящими от СоА жирной кислоты, по настоящему изобретению.
Липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, или диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению является ферментом, классифицируемым как Е.С. 2.3.1.73.
Диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты, может быть не связана от мембраны, то есть может быть белком, который в естественном окружении не связан с мембраной при помощи мембраносвязывающего фрагмента или трансмембранного домена.
Во избежание сомнений следует отметить, что липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению не является ферментом, описанным в любой из вышеуказанных публикаций WO 03/100044, WO 2000/36114, США 2003/0028923 или США 2003/0074695.
Помимо активности ацилтрансферазы указанный фермент может также обладать активностью липазы, например активностью фосфолипазы (обычно классифицируемый как Е.С. 3.1.1.х).
Липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению является диглицерид:глицерин-ацилтрансферазой, не зависящей от СоА жирной кислоты. Указанные термины могут иметь взаимозаменяемые значения в настоящем описании изобретения.
Диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению является ацилтрансферазой, которая содержит фрагмент аминокислотной последовательности GDSX, в котором Х означает один или несколько нижеследующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S.
Термин “диглицерид:глицерин-ацилтрансфераза” в значении, используемом в настоящем описании изобретения, синонимичен термину “диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты”.
Во избежание сомнений следует отметить, что термин “СоА жирной кислоты” аналогичен терминам “ацил-СоА”, “кофермент А жирной кислоты” и “ацил-кофермент А”. Указанные термины могут иметь взаимозаменяемые значения в настоящем описании изобретения.
Пищевое масло, используемое в способе или применении по настоящему изобретению, может представлять собой нерафинированное или рафинированное масло.
В одном варианте осуществления изобретения количество диглицерида предпочтительно уменьшают, а не удаляют полностью.
Термин “уменьшить” в используемом здесь значении означает, что количество диглицерида в пищевом масле, подвергнутом обработке ферментом по настоящему изобретению, меньше количества диглицерида в пищевом масле до обработки ферментом.
Диглицериды предпочтительно не удаляют полностью из пищевого масла.
В некоторых применениях, например, связанных с использованием подвергнутого обработке масла в маргаринах и/или шортенинге, количество диглицеридов, в частности 1,2-диглицеридов, должно быть уменьшено до такого количества, при котором скорость кристаллизации жировой смеси соответствует образованию мелких бета-кристаллов. Количество 1,2-диглицерида по отношению к количеству всего диглицерида в пальмовом масле зависит от возраста и условий хранения масла. Для коммерчески доступных масел соотношение 1,3-диглицерида и 1,2-диглицерида равно 1,8:3,3. Удаление 1,2-диглицеридов оказывает наибольшее влияние на свойства кристаллизации.
Как должно быть очевидно квалифицированному специалисту, уменьшение количества диглицерида можно контролировать по времени и температуре реакции. В проточном реакторе с использованием иммобилизованного фермента ход реакции можно контролировать по скорости потока.
Липид-ацилтрансфераза, предназначенная для использования в способах и/или применениях по настоящему изобретению, предпочтительно способна переносить ацильную группу из диглицерида в акцептор ацильных групп, причем акцептором ацильных групп является любое соединение, содержащее гидроксильную группу (-ОН).
Термин “диглицерид” в используемом здесь значении означает один или несколько 1,2-диглицеридов или 1,3-диглицеридов. Диглицеридом предпочтительно является 1,2-диглицерид.
Термины “диглицерид” и “диацилглицерин” имеют в данном описании изобретения взаимозаменяемые значения.
В определение термина “диглицерид” не входит дигалактозилдиглицерид (DGDG) и/или лецитин, например фосфатидилхолин.
Акцептором ацильных групп предпочтительно является вещество, растворимое в пищевом масле.
Акцептором ацильных групп может быть спирт, такой как, например, этанол или многоатомные спирты, в том числе глицерин, их смеси и производные. Акцептором ацильных групп может быть одно или несколько веществ, выбираемых из стерола, станола, оксикислоты, сорбита, сорбитана или других углеводов.
В одном предпочтительном варианте осуществления изобретения акцептором ацильных групп является глицерин.
Таким образом, один вариант осуществления настоящего изобретения относится к способу уменьшения содержания и/или удаления диглицерида из пищевого масла, который включает смешивание пищевого масла с глицерином и диглицерид:глицерин-ацилтрансферазой, не зависящей от СоА жирной кислоты, причем диглицерид:глицерин-ацилтрансфераза, не зависящая от СоА жирной кислоты, является ферментом, обладающим активностью ацилтрансферазы и содержащим фрагмент аминокислотной последовательности GDSX, где Х означает один или несколько нижеследующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S.
Акцептор ацильных групп по настоящему изобретению предпочтительно не является водой.
Акцептор ацильных групп предпочтительно не является моноглицеридом и/или диглицеридом.
Липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению способна расщеплять ацильную связь между одним или несколькими остатками жирной кислоты и глицериновым остовом липидного субстрата, причем липидный субстрат предпочтительно является диглицеридом, в частности 1,2-диглицеридом.
Липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению предпочтительно не воздействует на триглицериды и/или моноглицериды. Другими словами, липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, избирательно воздействует на диглицериды, предпочтительно на 1,2-диглицериды. Липидный субстрат может быть определен в настоящем изобретении как “липидный донор ацильных групп”.
Таким образом, настоящее изобретение обеспечивает достижение одного или нескольких благоприятных качеств: уменьшение содержания диглицеридов в пищевом масле; уменьшение содержания диглицеридов в пищевом масле без уменьшения содержания триглицеридов; уменьшение содержания диглицеридов в пищевом масле без увеличения содержания моноглицеридов; уменьшение содержания диглицеридов в пищевом масле с увеличением содержания моноглицеридов; уменьшение содержания диглицеридов и уменьшение содержания моноглицеридов в пищевом масле; уменьшение содержания диглицеридов в пищевом масле без значительного увеличения содержания жирных кислот.
Липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению выполняет реакцию алкоголиза (предпочтительно глицеролиза), осуществляя перенос ацильной группы жирной кислоты из диглицерида (предпочтительно 1,2-DAG) в спирт (предпочтительно глицерин), в результате чего образуются две молекулы моноглицерида, то есть одна молекула образуется из диглицерида и другая молекула образуется из глицерина вместе с захваченной ацильной группой.
Х во фрагменте DGSX предпочтительно означает L. Таким образом, фермент по настоящему изобретению предпочтительно содержит фрагмент аминокислотной последовательности GSDL.
Фрагмент GDSX состоит из четырех консервативных аминокислот. Серин в указанном фрагменте предпочтительно является каталитическим серином фермента липид-ацилтрансферазы. Серин во фрагменте GDSX может находиться в положении, соответствующем Ser-16 в липолитическом ферменте Aeromonas hydrophila, описанном в публикации Brumlik & Buckley (Journal of Bacteriology Apr. 1996, Vol.178, № 7, pр.2060-2064).
Чтобы определить наличие в белке фрагмента GDSX по настоящему изобретению, данную последовательность предпочтительно сравнивают с профилями скрытых моделей Маркова (профили НММ) в базе данных Рfam.
Pfam представляет собой базу данных семейств доменов белков. Pfam содержит множество проверенных последовательностей для каждого семейства, подвергнутых сравнительному анализу, а также профили скрытых моделей Маркова (профили НММ), которые предназначены для идентификации указанных доменов в новых последовательностях. С введением к базе данных Pfam можно ознакомиться в публикации Bateman A. et al. (2002) Nucleic Acids Res. 30; 276-280. Скрытые модели Маркова использованы в ряде баз данных, предназначенных для классифицикации белков; для ознакомления с указанными базами данных см. публикацию Bateman A. and Haft D.H. (2002) Brief Bioinform. 3; 236-245:
http://www.ncbi.nlm.nih.gov/entrez/guery.fcgi?cmd=Retrieve&db=PubMed&list- uids=12230032&dopt=Abstract
http://www.ncbi.nlm.nih.gov/entrez/guery.fcgi?cmd=Retrieve&db=PubMed&list- uids=11752314&dopt=Abstract
Для подробного ознакомления со скрытыми моделями Маркова и их применением в базе данных Pfam см. публикацию Durbin R., Eddy S., and Krogh A. (1998) Biological sequence analysis; probabilistic models of proteins and nucleic acids. Cambridge University Press, ISBN 0-521-62041-4. Пакет программ Хаммера можно приобрести в Вашингтонском университете, Сент-Луис, США.
Альтернативно фрагмент GDSX можно идентифицировать при помощи пакета программ Хаммера, инструкции по использованию которого представлены в публикации Durbin R., Eddy S., and Krogh A. (1998) Biological sequence analysis; probabilistic models of proteins and nucleic acids. Cambridge University Press, ISBN 0-521-62041-4, и в приведенных в ней ссылках, и с помощью профиля НММЕR2, рассмотренного в настоящем описании изобретения.
Доступ к базе данных PFAM можно получить, например, с нескольких серверов, которые в настоящее время расположены на нижеследующих web-сайтах.
http://www.sanger.ac.uk/Software/Pfam/index.shtml
http://pfam.wustl.edu/
http://pfam.jouy.inra.fr/
http://pfam.cgb.ki.se/
Указанная база данных предоставляет средства поиска, с помощью которых можно войти в белковую последовательность. Используя параметры по умолчанию указанной базы данных, можно произвести анализ белковой последовательности на наличие доменов Pfam. Домен GDSX является установленным доментом в базе данных, поэтому его присутствие может быть обнаружено в любой запрашиваемой последовательности. Указанная база данных производит сравнительный анализ консенсусной последовательности Pfam00657 с запрашиваемой последовательностью.
Множественный сравнительный анализ, в том числе Aeromonas salmonicida или Aeromonas hydrophila, можно произвести
а) вручную
вышеописанным способом выполняют сравнительный анализ представляющего интерес белка с консенсусной последовательностью Pfam00657 и затем выполняют сравнительный анализ Р10480 с консенсусной последовательностью Pfam00657;
или
b) при помощи базы данных
после идентификации консенсусной последовательности Pfam00657 база данных предлагает вариант, показывающий сравнительный анализ запрашиваемой последовательности с отборочным сравнительным анализом консенсусной последовательности Pfam00657. Р10480 является частью указанного отборочного сравнительного анализа и обозначена GCAT_AERHY. Запрашиваемая последовательность и Р10480 будут отображены в одном окне.
Эталонная последовательность Aeromonas hydrophila:
Остатки липазы GDSX Aeromonas hydrophila пронумерованы в файле NCBI P10480, причем номера в настоящем описании изобретения соответствуют номерам, приведенным в указанном файле, который в настоящем изобретении использован для определения специфических аминокислотных остатков, присутствующих в предпочтительном варианте осуществления изобретения в ферментах липид-ацилтрансферазы по настоящему изобретению.
Выполнение сравнительного анализа при помощи базы данных Рfam (фиг.33 и 34):
Могут быть обнаружены нижеследующие консервативные остатки, которые могут присутствовать в предпочтительном варианте осуществления изобретения в ферментах, предназначенных для использования в композициях и способах по настоящему изобретению.
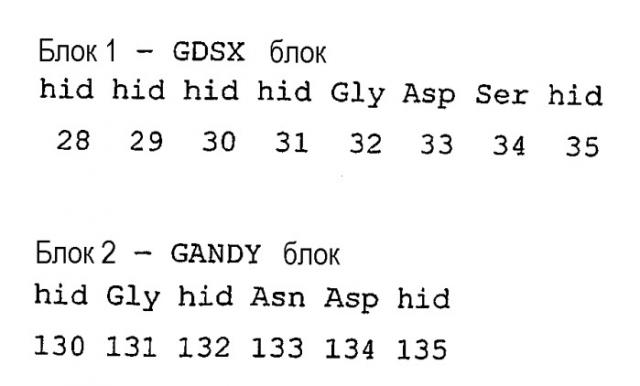
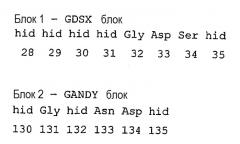
где “hid” означает гидрофобный остаток, выбираемый из Met, Ile, Leu, Val, Ala, Gly, Cys, His, Lys, Trp, Tyr, Phe.
Сравнительный анализ фермента липид-ацилтрансферазы, предназначенного для использования в композициях/способах по настоящему изобретению, предпочтительно можно произвести, используя консенсусную последовательность Pfam00657.
Положительное совпадение с профилем скрытой модели Маркова (профиль НММ) семейства доменов pfam00657 указывает на присутствие домента GDSL или GDSX по настоящему изобретению.
При сравнении с консенсусной последовательностью Pfam00657 липид-ацилтрансфераза, предназначенная для использования в композициях/способах по настоящему изобретению, предпочтительно содержит по крайней мере один, предпочтительно более одного, предпочтительно более двух нижеследующих блоков: блок GDSx, блок GANDY, блок НРТ. Липид-ацилтрансфераза может иметь блок GDSx и блок GANDY. Альтернативно указанный фермент может иметь блок GDSx и блок НРТ. Указанный фермент предпочтительно содержит по крайней мере блок GDSx.
При сравнении с консенсусной последовательностью Pfam00657 фермент, предназначенный для использования в композициях/способах по настоящему изобретению, содержит по крайней мере один, предпочтительно более одного, предпочтительно более двух, предпочтительно более трех, предпочтительно более четырех, предпочтительно более пяти, предпочтительно более шести, предпочтительно более семи, предпочтительно более восьми, предпочтительно более девяти, предпочтительно более десяти, предпочтительно более одиннадцати, предпочтительно более двенадцати, предпочтительно более тринадцати, предпочтительно более четырнадцати нижеследующих аминокислотных остатков при сравнении с эталонной полипептидной последовательностью A. hydrophilia, а именно с SEQ ID NO:32: 28hid, 29hid, 30hid, 31hid, 32gly, 33Asp, 34Ser, 35hid, 130hid, 131Gly, 132Hid, 133Asn, 134Asp, 135hid, 309His.
Домен GDSX pfam00657 является однозначным идентификатором, который позволяет отличить белки, имеющие данный домен, от других ферментов.
Консенсусная последовательность pfam00657 представлена на фиг.1 как SEQ ID NO:1. Указанная последовательность получена в результате идентификации семейства 00657 при помощи базы данных pfam версии 6, которая в данном описании изобретения может быть также определена как pfam00657.6.
Консенсусная последовательность может быть модифицирована в результате использования последующих версий базы данных pfam.
Например, на фиг.33 и 34 показан сравнительный анализ семейства 00657 с использованием базы данных pfam версии 11, которая в данном описании изобретения может быть также определена как pfam00657.11.
Присутствие блоков GDSx, GANDY и НРТ обнаружено в семействе 00657 с использованием обеих версий базы данных pfam. Для идентификации семейства 00657 могут быть использованы последующие версии базы данных pfam.
Фермент липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению можно предпочтительно охарактеризовать на основании нижеследующих критериев:
(i) данный фермент обладает активностью ацилтрансферазы, которая может быть определена как активность переноса сложного эфира, в результате которого ацильная часть исходной сложноэфирной связи липидного донора ацильных групп переносится в акцептор ацильных групп с образованием нового сложного эфира;
(ii) данный фермент содержит фрагмент аминокислотной последовательности GDSX, в котором Х означает один или несколько нижеследующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S;
(iii) данный фермент содержит остаток His-309 или остаток гистидина в положении, соответствующем остатку His-309 в липолитическом ферменте Aeromonas hydrophila, показанном на фиг.2 (SEQ ID NO:2 или SEQ ID NO:32).
Аминокислотным остатком фрагмента GDSХ предпочтительно является L.
В SEQ ID NO:2 или SEQ ID NO:32 первые 18 аминокислотных остатков образуют сигнальную последовательность. His-309 непроцессированной последовательности, которая представляет собой белок, включающий сигнальную последовательность, соответствует His-291 зрелой части белка, т.е. данной последовательности без сигнальной последовательности.
Фермент липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению включает три каталитических остатка: Ser-34, Asp-134 и His-309 или соответственно остаток серина, остаток аспарагиновой кислоты и остаток гистидина в положениях, соответствующих Sеr-34, Asp-134 и His-309 в липолитическом ферменте Aeromonas hydrophila, показанном на фиг.2 (SEQ ID NO:2) или на фиг.28 (SEQ ID NO:32). Как было указано выше, в последовательности, показанной в SEQ ID NO:2 или SEQ ID NO:32, первые 18 аминокислотных остатков образуют сигнальную последовательность. Ser-34, Asp-134 и His-309 непроцессированной последовательности, которая представляет собой белок, включающий сигнальную последовательность, соответствуют Ser-16, Asp-116 и Нis-291 зрелой части белка, то есть данной последовательности без сигнальной последовательности. В консенсусной последовательности pfam00657, как показано на фиг.1 (SEQ ID NO:1), остатки активного сайта соответствуют Ser-7, Asp-157 и His-348.
Фермент липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению можно предпочтительно охарактеризовать на основании нижеследующих критериев:
(i) данный фермент обладает активностью ацилтрансферазы, которая может быть определена как активность переноса сложного эфира, в результате которого ацильная часть исходной сложноэфирной связи первого липидного донора ацильных групп переносится в акцептор ацильных групп с образованием нового сложного эфира; и
(ii) данный фермент содержит по крайней мере Gly-32, Asp-33, Ser-34, Asp-134 и His-309 или остатки глицина, аспарагиновой кислоты, серина, аспарагиновой кислоты и гистидина в положениях, соответствующих Gly-32, Asp-33, Ser-34, Asp-134 и His-309 в липолитическом ферменте Aeromonas hydrophila, показанном на фиг.2 (SEQ ID NO:2) или на фиг.28 (SEQ ID NO:32).
Фермент липид-ацилтрансфераза, не зависящая от СоА жирной кислоты, по настоящему изобретению может быть предпочтительно получен из организмов, относящихся к одному или