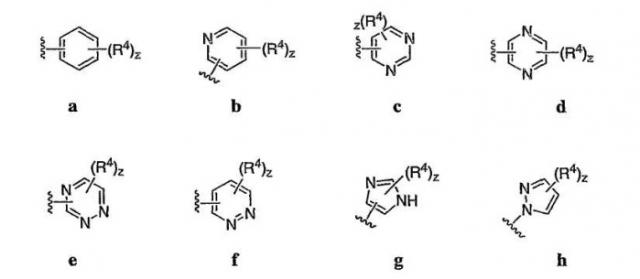
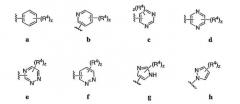
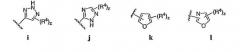
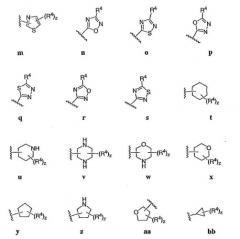
4-аминохиназолиновые антагонисты селективных натриевых и кальциевых ионных каналов
Иллюстрации
Показать всеНастоящее изобретение относится к хиназолиновым соединениям формулы (IA-ii) или его фармацевтически приемлемым солям, полезным в качестве ингибиторов потенциалозависимых натриевых каналов и кальциевых каналов, где R1, R2, R3, R5a, R5, у и х определены в формуле изобретения. Изобретение также относится к фармацевтической композиции, включающей соединения изобретения, и к способам ингибирования одной или более из NaV1.2, NaV1.3, NaV1.8 или CaV2.2. Технический результат - 4-аминохиназолиновые антагонисты селективных натриевых и кальциевых ионных каналов. 3 н. и 14 з.п. ф-лы, 3 табл.
Реферат
Информация о приоритете
В настоящей заявке заявляется приоритет по 35 U.S.С. § 119 на основании предварительных заявок США №№60/451458, поданной 3 марта 2003 г., озаглавленной "Compositions Useful as Inhibitors of Voltage-Gated Sodium Channels", и 60/463797, поданной 18 апреля 2003 г., озаглавленной "Compositions Useful as Inhibitors of Voltage-Gated Sodium Channels", и все содержание каждой из данных заявок включается в настоящее описание для сведения.
Техническая область изобретения
Настоящее изобретение относится к соединениям, полезным в качестве ингибиторов ионных каналов. Изобретение также предоставляет фармацевтически приемлемые композиции, включающие соединения изобретения, и способы применения композиций в лечении разнообразных расстройств.
Предпосылки изобретения
Натриевые каналы являются центральными в отношении генерации потенциалов действия во всех возбудимых клетках, таких как нейроны и миоциты. Они играют ключевую роль в возбудимых тканях, включая головной мозг, гладкие мышцы желудочно-кишечного тракта, скелетные мышцы, периферическую нервную систему, спинной мозг и воздушные пути. Как таковые они играют ключевую роль в широком разнообразии болезненных состояний, таких как эпилепсия (см. Moulard, В. and D. Bertrand (2002), "Epilepsy and sodium channel blockers" Expert Opin. Ther. Patents 12(1): 85-91)), боль (см. Waxman, S. G., S. Dib-Hajj et al. (1999) “Sodium channels and pain” Proc Natl Acad Sci U S A 96(14): 7635-9 и Waxman, S. G., T. R. Cummins, et al. (2000) “Voltage-gated sodium channels and the molecular pathogenesis of pain: a rewiew” J Rehabil Res Dev 37(5): 517-28), миотония (см. Meola, G. аnd V. Sansone (2000) “Therapy in myotonic disordеrs and in muscle channelopathies” Neurol Sci 21(5): S953-61 и Mankodi, A. and C. A. Thornton (2002) “Myotonic syndromes” Curr Opin Neurol 15(5): 545-52), атаксия (см. Мeisler, M. H., J. A. Kearney et al. (2002) “Mutations of volage-gated sodium channels in movement disorders and epilepsy” Novartis Found Symp 241: 72-81), рассеянный склероз (см. Black, J. A., S. Dib-Hajj et al. (2000) “Sensory neuron-sрecific sodium channel SNS is abnormally expressed in the brains of mice with experimental allergic encephalomyelitis and humans with multiple sclerosis” Proc Natl Acad Sci U S A 97(21): 11598-602, и Renganathan, M., M. Gelderblom et al. (2003) “Expression of Na(v)1.8 sodium channels perturbs the firing patterns of cerebellar purkinje cells” Brain Res 959(2): 235-42), раздражимый или болезненно чувствительный кишечник (см. Su, X., R. E. Waсhtel et al. (1999) “Capsaicin sensitivity and voltage-gated sodium currents in colon sensory neurons from rat dorsal root ganglia” Am J Physiol 277(6 Pt 1): G1180-8, и Laird, J. M., V. Souslova et al. (2002) “Deficits in visceral pain and referred hyperаlgesia in Navl.8 (SNS/PN3)- null mice” J Neurosci 22(19): 8352-6), недержание мочи и висцеральная боль (см. Yoshimura, N.,S. Seki, et al. (2001) “The involvement of the tetrodotoxin-resistant sodium channel Na(v)l.8 (PN3/SNS) in a rat model of visceral pain” J Neurosci 21(21): 8690-6), а также множество психических дисфункций, таких как беспокойство и депрессия (см. Hurley, S. C. (2002) “Lamotrigine update and its ise in mood disorders” Ann Pharmacother 36(5): 860-73).
Потенциалозависимые натриевые каналы включают семейство генов, состоящее из 9 различных подтипов (NaV1.1-NaV1.9). Как показано в таблице 1, эти подтипы показывают специфическую к ткани локализацию и функциональные различия (см. Goldin, A. L. (2001) “Resurgence of sodium channel research” Annu Rev Physiol 63: 871-94). Три члена из данного семейства генов (NaV1.8, 1.9, 1.5) являются устойчивыми к блокированию хорошо известным блокатором Na канала TTX, демонстрируя специфичность подтипа внутри данного семейства генов. Мутационный анализ идентифицировал глютамат 387 как критический остаток для ТТХ связывания (см. Noda, M., H. Suzuki et al. (1989) “A single point mutation confers tetrodotoxin and saxitoxin insensitivity on the sodium channеl II” FEBS Lett 259(1): 213-6).
Таблица 1 (cокращения CNS=центральная нервная система, PNS=периферическая нервная система, DRG=дорзальный коренной ганглий, TG=тригеминальный ганглий):
| Naизоформа | Ткань | TTX IC50 | Признаки |
| NаV1.1 | CNS, PNS сома нейронов | 10 нМ | Боль, эпилепсия, нейродегенерация |
| NаV1.2 | CNS, аксоны(в высокой концентрации) | 10 нМ | Нейродегенерация, эпилепсия |
| NаV1.3 | CNS, эмбриональная, поврежденные нервы | 15 нМ | Боль |
| NаV1.4 | Скелетная мускулатура | 25 нМ | Миотония |
| NаV1.5 | Сердце | 2 мкМ | Аритмия, долгое QT |
| NаV1.6 | CNS, широко распространенный, наиболее обильный | 6 нМ | Боль, расстройства движения |
| NаV1.7 | PNS, DRG, нейроэндокринные терминалы | 25 нМ | Боль, нейроэндокринные расстройства |
| NаV1.8 | PNS, малые нейроны в DRG и TG | >50 мкМ | Боль |
| NаV1.9 | PNS, малые нейроны в DRG и TG | 1 мкМ | Боль |
В общем, потенциалозависимые натриевые каналы (NaVs) являются ответственными за инициирование быстрого скачка возрастающих потенциалов действия в раздражимой ткани в нервной системе, что передает электрические сигналы, которые успокаивают и кодируют нормальные и аберрантные или отличающиеся от нормы болевые ощущения. Антагонисты NaV каналов могут ослаблять данные болевые сигналы и являются полезными для лечения широкого разнообразия болевых состояний, включая, но не ограничиваясь ими, острую, хроническую, воспалительную и нейропатическую боль. Было показано, что известные NaV антагонисты, такие как TTX, лидокаин (см. Mao, J. аnd L. L. Chen (2000) “Systemic lidocaine for neuropathic pain relief” Pain 87(1): 7-17), бупивакаин, фенитоин (см. Jensen, T. S. (2002) “Аnticonvulsants in neuropathic pain: rationale and clinical evidence” Eur J Pain 6 (Suppl A): 61-8), ламотригин (см. Rozen, T. D. (2001) “Antiepileptic drugs in the management of cluster headache and trigeminal neuralgia” Headache 41 Suppl 1: S25-32 и Jensen, T. S. (2002) “Anticonvulsants in neurоpathic pain: rationale and clinical evidence” Eur J Pain 6 (Suppl A): 61-8), и карбамазепин (см. Backonja, M. M. (2002) “Use of anticonvulsants for treatment of neuropathic pain” Neurology 59(5 Suppl 2): S14-7), являются полезными для ослабления боли у людей и животных моделей.
Гиперальгезия (крайняя чувствительность к чему-либо, причиняющему боль) развивается в присутствии повреждений ткани или воспалительных рефлексов, по крайней мере, частично, увеличение возбудимости высокопороговых первичных афферентных нейронов, иннервирующих участок повреждения. Активация чувствительных к напряжению натриевых каналов является критической для генерирования и распространения потенциалов нейронного действия. Имеется растущая масса свидетельств, указывающих на то, что модуляция NaV потоков является эндогенным механизмом, используемым для регулирования нейронной возбудимости (см. Goldin, A. L. (2001) “Resurgence of sodium channel research” Annu Rev Physiol 63: 871-94). Несколько кинетически и фармакологически отличных потенциалозависимых натриевых каналов найдено в нейронах дорзального корневого ганглия (DRG). Устойчивый к TTX поток является нечувствительным к микромолярным концентрациям тетродотоксина и демонстрирует медленную активационную и инактивационную кинетику и более деполяризованный активационный порог по сравнению с другими потенциалозависимыми натриевыми каналами. ТТХ-устойчивые натриевые потоки прежде всего ограничены субпопуляцией сенсорных нейронов, вероятно, вовлекаемых в ноцицепцию (болевую рецепцию). В частности, ТТХ-устойчивые натриевые потоки экспрессируются почти исключительно в нейронах, которые имеют малый диаметр клетки, и вызывают медленно проводящие аксоны с малым диаметром, и они отвечают на капсаицин. Огромная масса экспериментальных свидетельств показывает, что ТТХ-устойчивые натриевые каналы экспрессируются в С-волокнах и являются важными в передаче ноцицептичной информации к спинному мозгу.
Интратекальное введение антисенсорных олиго-дезоксинуклеотидов, нацеленное на уникальную область ТТХ-устойчивого натриевого канала NaV1.8, приводило в результате к значительному снижению PGE2-индуцированной гиперальгезии (см. Khasar, S. G., M. S. Gold еt al. (1998) “A tetrodotoxin-resistant sodium current mediates inflammatory pain in the rat” Neurо-Sci Lett 256(1): 17-20). Совсем недавно Wood с коллегами генерировали нокаутированную мышиную линию, у которой не хватает функционального NaV1.8. Мутация дает анальгетический эффект в опытах по оценке ответной реакции животных на воспалительный агент каррагенан (см. Akopian, A.N., V. Souslova et al. (1999) “The tetrоdоtoxin-resistant sodium channel SNS has a specialized function in pain pathways” Nat Neurosci 2(6): 541-8). В дополнение к изложенному, у данных животных наблюдался дефицит как механо-, так и терморецепции. Анальгезия, показанная NaV1.8 нокаутными мутантами, согласуется с наблюдениями относительно роли ТТХ-устойчивых потоков в ноцицепции.
Иммуногистохимические эксперименты, эксперименты по in sity гибридизации и in vitro электрофизиологии - все показали, что натриевый канал NaV1.8 селективно локализован с мелкими сенсорными нейронами дорзального корневого ганглия и тригеминального ганглия (см. Akopian, A. N., L. Sivilotti et al. (1996) «A tetrodotoxin-resistant voltage-gated sodium channel expressed by sensory neurons» Nature 379(6562): 257-62). Первостепенная роль данных нейронов состоит в детекции и трансмиссии ноцицептивных стимулов. Антисенсорное и иммуногистохимическое свидетельство также говорит о роли NaV1.8 в нейропатической боли (см. Lai, J., M. S. Gold et al. (2002) «Inhibition of neuropаthic рain by decreased expression of the tetrodotoxin-resistant sodium channel, NaV1.8» Pain 95(1-2): 143-52, и Lai, J., J. C. Hunter et al. (2000) «Blockade of neuropathic pain by antisense targeting оf tetrodotoxin-resistant sodium channels in sensory neurons» Mеthods Enzymol 314: 201-13.). NaV1.8 белок положительно регулируется среди неповрежденных С-волокон, прилегающих к повреждению нерва. Антисенсорная обработка предотвращает перераспределение NaV1.8 по нервам и обращает нейропатическую боль. Взятые вместе ген-нокаутные и антисенсорные данные подтверждают роль NaV1.8 в детекции и трансмиссии воспалительной и нейропатической боли.
При состояниях нейропатической боли имеет место ремоделирование распределения и подтипа натриевых каналов. В поврежденном нерве экспрессия NaV1.8 и NaV1.9 значительно снижается, тогда как экспрессия ТТХ чувствительной подъединицы NaV1.3 5-10-кратно увеличивается (см. Dib-Hajj, S. D., J. Fjell et al. (1999) “Plasticity of sodium channel expression in DRG neurons in the chronic constriсtion injury model of neuropathic pain.” Pain 83(3): 591-600). Временной курс увеличения в NaV1.3 соответствует внешнему виду аллодинии у животных моделей вследствие нервного повреждения. Биофизика NaV1.3 канала характеризуется тем, что она показывает очень быстрое восстановление готовности после инактивации, следующей за потенциалом действия. Это дает неослабевающие темпы высокого возбуждения, как это часто видно в поврежденном нерве (см. Cummins. T. R., F. Aglieco et al. (2001) “NaV1.3 sodium channels: rapid repriming and slow closed-state inactivation display quantitative differences after expression in a mammalian cell line and in spinal sensory neurons” J. Neurosci 21(16): 5952-61). NaV1.3 экспрессируется в центральной и периферической системах человека. NaV1.9 является сходным с NaV1.8, так как он селективно локализуется с мелкими сенсорными нейронами дорзального корневого ганглия и тригеминального ганглия (см. Fang, X., L. Djouhri et al. (2002). “The presence and role of the tetrodotoxin-resistant sodium channel Na(v)1,9 (NaN) in nociceptive primary afferent neurons.” J Neurosci 22(17): 7425-33). Он имеет медленную скорость инактивации и сдвинутую влево зависимость активации от напряжения (см. Dib-Hajj, S., J. A. Black et al. (2002) “NaN/NaV1.9: a sodium channel with unique properties” Trends Neurosci 25(5): 253-9). Эти два биофизические свойства позволяют NaV1.9 играть роль в установлении остающегося без изменений мембранного потенциала ноцицептивных нейронов. Остающийся без изменений мембранный потенциал NaV1.9 экспрессирующих клеток составляет в интервале -55 до -50 мВ по сравнению с -65мВ для большинства других периферических и центральных нейронов. Данная стойкая деполяризация является в большой части следствием ослабленной низкоуровневой активации NaV1.9 каналов. Данная деполяризация позволяет нейронам более легко достигать порога потенциалов возбуждающего действия в ответ на ноцицептивные стимулы. Соединения, которые блокируют NaV1.9 канал, могут играть важную роль в установлении начальной точки детекции болезненных стимулов. При хронических болевых состояниях нервы и нервные окончания могут становиться разбухшими и гиперчувствительными, проявляя возбуждение потенциала действия высокой частоты под влиянием слабой стимуляции или без всякой стимуляции. Данные патологические набухания нервов называются нейромами, и первичными Na каналами, экспрессированными в них, являются NaV1.8 и NaV1.7 (см. Kretschmer, T., L. T. Happel et al. (2002) “Accumulation of PN1 and PN3 sodium channels in painfull human neuroma- evidence from immunocytochemistry” Acta Neurochir (Wien) 144(8): 803-10; discussion 810). NaV1.6 и NaV1.7 также экспрессируются в нейронах дорзального корневого ганглия и способствуют малому ТТХ чувствительному компоненту, видному в данных клетках. NaV1.7, в частности, может поэтому быть потенциальной болевой мишенью в дополнение к его роли в нейроэндокринной возбудимости (см. Klugbauer, N., L. Lacinova еt al. (1995) “Structure and functional expression of a new member of the tetrodotoxin- sensitive voltage-activated sodium channel family from human neuroendocrine cells" Embo J 14(6): 1084-90).
NaV1.1 (см. Sugawara, T., E. Mazaki-Miyazaki et al. (2001) “Nav1.1 mutations cause febrile seizures associated with afebrile partial seizures.” Neurology 57 (4): 703-5) и NaV1.2 (см. Sugawara, T., Y. Tsurubuchi, et al. (2001) “A missense mutation of the Na+ channel alpha II subunit gene Na(v)1.2 in a patient with febrile and afebrile seizures causes channel dysfunction” Proc Natl Acad Sci U S A 98 (11): 6384-9) связаны с состояниями эпилепсии, включая приступы лихорадки. Имеется свыше 9 генетических мутаций NaV1.1, связанных с приступами лихорадки (см. Meisler, M. H., J. A. Kearney, et al. (2002) “Mutations of voltage-gated sodium channels in movement disorders and epilepsy” Novartis Found Symp 241: 72-81).
Для лечения сердечной аритмии были разработаны и используются антагонисты NaV1.5. Генный дефект в NaV1.5, который продуцирует более крупный неинактивирующий компонент к току, связан с длинным QT у человека, и для лечения данного состояния используется орально доступный местный анестетик мексилитин (см. Wang, D. W., K. Yazawa et al. (1997) “Pharmacological targeting of long QT mutant sodium channels.” J Clin Invest 99(7): 1714-20).
В настоящее время несколько блокаторов Na каналов используются или испытываются в клинике для лечения эпилепсии (см. Moulard, B. аnd D. Bertrand (2002) “Epilepsy and sodium channel blockers” Expert Opin. Ther. Patents 12(1): 85-91); острой (см. Wiffen, P., S. Collins, et al. (2000) “Anticonvulsant drugs for acute and chronic pain” Cochrane Database Syst Rev 3), хронической (см. Wiffen, P., S. Collins, et al. (2000) “Anticonvulsant drugs for acute and chronic pain” Cochrane Database Syst Rev 3, и Guay, D. R. (2001) “Ajuncive agents in the management оf chronic pain” Pharmacotherapy 21(9): 1070-81), воспалительной (см. Gold, M. S. (1999) “Tetrodotoxin-resistant Na+ currents and inflammatory hyperalgesia.” Proc Natl Acad Sci U S A 96(14): 7645-9) и нейропатической боли (см. Strichartz, G. R., Z. Zhou, et al. (2002) “Therapeutic concentrations of local anaethetics unveil the potential role of sodium channels in neuropathic pain” Novartis Found Symp 241: 189-201, и Sandner-Kiesling, A., G. Rumpold Seitlinger, et al. (2002) “Lamotrigine monotherapy for control of neuralgia after nerve section” Acta Anaesthesiol Scand 46(10): 1261-4); сердечной аритмии (см. An, R. H., R. Bangalore, et al (1996) “Lidocaine block of LQT-3 mutant human Na+ channels” Circ Res 79(1): 103-8, и Wang, D. W., K. Yazawa, et al. (1997) “Pharmacological targeting of long QT mutant sodium channels" J Clin Invest 99(7): 1714-20); нейрозащиты (см. Taylor, C. P. аnd L. S. Narasimhan (1997) ”Sodium channels and therapy of central nervous system diseases” Adv Pharmacol 39: 47-98) и в качестве анестетиков (см. Strichartz, G. R., Z. Zhou, et al. (2002) “Therapeutic concentrations of local anaesthetics unveil the potential role of sodium channels in neuropathic pain.” Novartis Found Symp 241: 189-201).
Кальциевые каналы являются мембранно-охватывающими, мульти-субъединичными белками, которые обеспечивают возможность выхода Са из наружной среды и одновременной деполяризации потенциала клеточной мембраны. Традиционно кальциевые каналы классифицируются на основе их функциональных характеристик, таких как низковольтажная или высоковольтажная активация, и их кинетики (L,T,N,P,Q). Способность клонировать и экспрессировать субъединицы кальциевых каналов ведет к улучшенному пониманию состава каналов, который дает данные функциональные ответные реакции. Имеется три важнейших типа субъединиц, которые образуют кальциевые каналы - α1, α2δ и β. α1 представляет субъединицу, содержащую канальные поры и сенсор напряжения, α2 является в основном внеклеточным и представляет дисульфид, связанный с трансмембранной δ субъединицей, β является негликозилированной субъединицей, найденной связанной с цитоплазматической областью α1 субъединицы Са канала. В настоящее время считают, что различные подтипы кальциевых каналов составляются из следующих характерных субъединиц:
• L-тип, включающий субъединицы α1Сα1Dα1F или α1S, α2δ и β3а
• N-тип, включающий субъединицы α1В, α2δ, β1b
• Р-тип, включающий субъединицы α1А, α2δ, β4а
• Q-тип, включающий субъединицы α1А (сплайс вариант) α2δ, β4а
• R-тип, включающий субъединицы α1Е, α2δ, β1b
• Т-тип, включающий субъединицы α1G, α1H или α1I
Кальциевые каналы играют центральную роль в высвобождении нейротрансмиттера. Приток Са в пресинаптический терминал нервного процесса связывается с каскадом и продуцирует каскад белок-белковых взаимодействий (синтаксин 1А, SNAP-25 и синаптотагмин), который в конце концов заканчивается слиянием синаптического пузыря и высвобождением нейротрансмиттерного пакета. Блокада пресинаптических кальциевых каналов снижает приток Са и дает кубическое Х3 уменьшение высвобождения нейротрансмиттера.
Кальциевый канал N типа (CaV2.2) в высокой степени экспрессируется в пресинаптических нервных окончаниях дорзального корневого ганглия, так как он образует синапс с нейронами дорзального рога в слое I и II. Данные нейроны в свою очередь имеют большие числа Са каналов N типа в их пресинаптических терминалах, так как они функционально контактируют с нейронами второго и третьего порядка. Данный путь является очень важным в передаче болевой информации в головной мозг.
Боль может быть грубо разделена на три различных типа: острую, воспалительную и нейропатическую. Острая боль служит важной защитной функцией в поддержании организма в безопасности от стимулов, которые могут вызывать повреждение ткани. Сильные термические, механические или химические воздействия обладают потенциалом вызывать тяжелые повреждения организма, если их оставить без внимания. Острая боль служит для быстрого удаления индивидуума из причиняющей вред окружающей среды. Острая боль по своей природе обычно является длящейся недолго и интенсивной. Воспалительная боль, с другой стороны, может длиться в течение более длительных периодов времени, и ее интенсивность меняется более постепенно. Воспаление может происходить по многим причинам, включающим повреждение ткани, аутоиммунную ответную реакцию и патогенную инвазию. Воспалительная боль опосредуется “воспалительным супом”, который состоит из вещества Р, гистаминов, кислоты, простагландина, брадикинина, CGRP, цитокинов, АТР, и высвобождением нейротрансмиттера. Третий класс боли является нейропатической болью и включает нервное повреждение, которое приводит в результате к реорганизации нейронных белков и совершает цикл, который дает патологическое “с повышенной чувствительностью” состояние, которое может давать хроническую боль, длящуюся в течение многих лет. Данный тип боли не обеспечивает никакой адаптивной выгоды, и ее особенно трудно лечить существующими методами терапии.
Боль, особенно нейропатическая и боль, с трудом поддающаяся лечению, в огромной мере является нерешенной медицинской проблемой. Миллионы индивидуумов страдают от сильной боли, которая недостаточно регулируется существующими терапевтическими средствами. Современные лекарства, используемые для лечения боли, включают NSAID, ингибиторы COX2, опиоиды, трициклические антидепрессанты и антиконвульсивные средства. Нейропатическую боль особенно трудно лечить, так как она не отвечает достаточно на опиоиды до тех пор, пока не будут достигнуты высокие дозы. Габапентин является в настоящее время терапевтическим средством, которому оказывается предпочтение, для лечения нейропатической боли, хотя он срабатывает только у 60% пациентов, в случае которых он обнаруживает умеренную эффективность. Данное лекарство является однако очень безопасным, а побочные действия обычно переносимы, хотя облегчение достигается при более высоких дозах.
Са канал N типа у человека был задействован путем интратекального вливания токсина зиконотида для лечения не поддающейся лечению боли, раковой боли, стойкой к опиоидам боли, и нейропатической и сильной боли. Данный токсин имеет 85% степень успеха для лечения боли у людей с большей силой действия, чем морфин. Орально доступный антагонист Са канала N типа составил бы гораздо большую долю на рынке средств от боли. Зиконотид вызывает дегрануляцию тучных клеток и дает дозозависимые центральные побочные эффекты. Они включают головокружение, нистагм, волнение и дисметрию. У некоторых пациентов при высоких дозах имеет место также ортостатическая гипотензия. Основной риск для данной мишени включает в себя побочные эффекты в ЦНС, наблюдаемые с зиконотидом при высокой дозировке. Они включают головокружение, нистагм, волнение и дисметрию. У некоторых пациентов при высоких дозах имеет место также ортостатическая гипотензия. Считается, что это может быть следствием вызываемой зиконотидом дегрануляции тучных клеток и/или его действия на симпатический ганглий, который как и спинномозговой ганглий также экспрессирует Са канал N типа. В зависимости от использования соединения, которые блокируют предпочтительно в более высокочастотном интервале >10 Гц, должны быть полезными в минимизации данных возможных побочных эффектов. Степень возбуждения у людей симпатических эфферентов находится в 0,3 Гц интервале. Нейроны CNS могут возбуждаться при более высоких частотах, но обычно это происходит только при коротких вспышках потенциалов действия. Даже с селективностью, придаваемой в зависимости от использования с внутренней присущей селективностью против кальциевого канала L типа, кальциевый канал все еще необходим, так как он вовлечен в сокращение сердечных и сосудистых гладких мышц.
К сожалению, как описывалось выше, эффективность используемых в настоящее время блокаторов натриевых каналов и блокаторов кальциевых каналов против болезненных состояний, описанных выше, в огромной степени ограничивается рядом побочных эффектов. Данные побочные эффекты включают различные нарушения CNS, такие как расплывчатое зрение, головокружение, тошнота и седативный эффект, также как и более возможно угрожающие жизни сердечные аритмии и сердечную недостаточность. Соответственно, остается потребность в разработке дополнительных антагонистов Na каналов и Са каналов, предпочтительно антагонистов более высокой силы действия и с меньшими побочными эффектами.
Краткое содержание изобретения
Было найдено, что соединения данного изобретения и их фармацевтически приемлемые композиции полезны в качестве ингибиторов потенциалозависимых натриевых каналов и кальциевых каналов. Эти соединения имеют общую формулу I:
или представляют их фармацевтически приемлемые производные, где R1, X, R3, x и кольцо A имеют значения, определенные ниже.
Данные соединения и фармацевтически приемлемые композиции полезны для лечения или снижения тяжести широкого ряда болезней, расстройств или состояний, включающих, но не ограниченных ими, острую, хроническую, нейропатическую или воспалительную боль, артрит, мигрени, тригеминальную невралгию, герпетическую невралгию, общую невралгию, эпилепсию или эпилептические состояния, нейродегенеративные расстройства, психиатрические расстройства, такие как беспокойство и депрессия, миотонию, аритмию, расстройства движения, нейроэндокринные расстройства, атаксию, рассеянный склероз, синдром раздраженного кишечника, недержание, висцеральную боль, остеоартритную боль, постгерпетическую невралгию, диабетическую нейропатию, корешковую боль, ишиалгию, спинную боль, головную и шейную боль, сильную или непреходящую боль, ноцицептивную боль, боль при разрывах тканей, постхирургическую боль или раковую боль.
Подробное описание изобретения
I. Общее описание соединений изобретения:
Настоящее изобретение относится к соединениям формулы I, полезным в качестве ингибиторов потенциалозависимых натриевых каналов и кальциевых каналов:
или к их фармацевтически приемлемым солям,
где Х представляет О или NR2; R1 и R2 представляют каждый независимо необязательно замещенную группу, выбранную из водорода, С1-6 алифатической группы или Су1, где Су1 представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное насыщенное или частично ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, в котором Су1 связана непосредственно с атомом азота или связана через необязательно замещенную С1-4 алифатическую группу, где одно или более метиленовых звеньев в С1-4 алифатической группе необязательно заменены группой -NR-, -O-, -COO, -OCO-, -NRCO-, -CONR-, -SO2NR- или -NRSO2-; или R1 и R2 взятые вместе с атомом азота, к которому они присоединены, образуют необязательно замещенное 3-12-членное моноциклическое или бициклическое насыщенное, частично ненасыщенное или полностью ненасыщенное кольцо, имеющее 0-3 дополнительных гетероатома, независимо выбранных из азота, серы или кислорода; где R1 и R2 или кольцо, образованное R1 и
R2, взятыми вместе, каждый необязательно и независимо замещены при одном или более замещаемых атомах углерода, азота или серы z числом независимых заместителей R4, где z представляет 0-5;
кольцо А представляет 5-7-членное моноциклическое арильное кольцо или 8-10-членное бициклическое арильное кольцо, имеющее 0-3 гетероатома, выбранных независимо из азота, кислорода или серы, или представляет 3-12-членное моноциклическое или бициклическое насыщенное или частично ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, в котором кольцо А необязательно замещено числом у независимых заместителей -R5, где у представляет 0-5, и дополнительно необязательно замещено числом q независимых случаев R5а, где q представляет 0-2;
х представляет 0-4;
каждый из R3, R4 и R5 представляет независимо Q-RX, где Q представляет связь или представляет С1-С6 алкилиденовую цепь, где вплоть до двух несмежных метиленовых звеньев Q необязательно и независимо замещены группой -NR-, -S-, -O-, -CS- -CO2-, -OCO-, -CO-, -COCO-, -CONR-, -NRCO-, -NRCO2, -SO2NR-, -NRSO2-, -CONRNR-, -NRCONR-, -OCONR-, -NRNR-, -NRSO2NR-, -SO-, -SO2-, -PO-, -PO2-, -OP(O)(OR)- или -POR-;
каждый из RX независимо выбран из -R', =O, =NR', галогена, -NO2, -CN, -OR', -SR', -N(R')2, -NR'COR', -NR'CON(R')2, -NR'CO2R', -COR', -CO2R', -OCOR', -CON(R')2, -OCON(R')2, -SOR', -SO2R', -SO2N(R')2, -NR'SO2R', -NR'SO2N(R')2, -COCOR', -COCH2COR', -OP(O)(OR')2, -P(O)(OR')2 -OP(O)2OR', -P(O)2OR', -PO(R')2, или -OPO(R')2
каждый из R5a представляет независимо необязательно замещенную С1-С6 алифатическую группу галоген, -OR', -SR', -N(R')2, -NR'COR', -NR'CON(R')2, -NR'CO2R', -COR', -CO2R', -OCOR', -CON(R')2, -OCON(R')2, -SOR', -SO2R', -SO2N(R')2, -NR'SO2R', -NR'SO2N(R')2, -COCOR', -COCH2COR', -OP(O)(OR')2, -P(O)(OR')2, -OP(O)2OR', -P(O)2OR', -PO(R')2 или -OPO(R')2 и
каждый из R представляет независимо водород или необязательно замещенную С1-6 алифатическую группу и каждый из R' представляет независимо водород или необязательно замещенную С1-6 алифатическую группу, 3-8-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое кольцо, имеющее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, или 8-12-членную насыщенную, частично ненасыщенную или полностью ненасыщенную бициклическую кольцевую систему, имеющую 0-5 гетероатомов, независимо выбранных из азота, кислорода или серы; или R и R', два из R, или два из R' взяты вместе с атомом(ами), к которому они присоединены, образуя необязательно насыщенное 3-12-членное насыщенное, частично ненасыщенное или полностью ненасыщенное моноциклическое или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В некоторых воплощениях соединений, непосредственно описанных выше:
i) когда х представляет 1 и R3 представляет необязательно замещенный 6-фенил или 6-пиридил, и R1 представляет водород, тогда R2 не является Cy1, и
ii) моногидрохлорид 1-(4-амино-6,7-диметокси-2-хиназолинил)-4-(2-фуранилкарбонил)пиперазина и 1-(4-амино-6,7-диметокси-2-хиназолинил)-4-[(2,3-дигидро-1,4-бензодиоксин-2-ил)карбонил]пиперазин исключаются.
2. Соединения и определения:
Соединения данного изобретения включают соединения, описанные в общем выше, и далее иллюстрируются классами, подклассами и видами, раскрытыми в данном описании. В используемом здесь смысле следует применять следующие определения, если не указывается иное. Для целей данного изобретения химические элементы идентифицируются в соответствии с Периодической таблицей элементов в версии CAS, Handbook of Chemistry and Physics, 75th Ed. Дополнительно общие принципы органической химии описаны в «Organic Chemistry», Thomas Sorrell, University Science Books, Sausalito: 1999, и «March's Advanced Organic Chemistry», 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley & Sons, New York: 2001, содержание которых целиком включается в данное описание в виде ссылки.
Как описано здесь, соединения изобретения могут быть необязательно замещены одним или более заместителями, такими, как в общем иллюстрируются выше, или показаны примерами классов, подклассов и видов изобретения. Следует понимать, что фраза «необязательно замещенный» используется взаимозаменяемо с фразой «замещенный или незамещенный». В общем термин «замещенный», предшествует ли ему термин “необязательно” или нет, относится к замещению водородных радикалов в данной структуре радикалом указанного заместителя. Если не указано иное, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы, и, когда более чем одно положение в любой заданной структуре может быть замещено более чем одним заместителем, выбранным из указанной группы, заместитель может быть или одинаковым, или различным в каждом положении. Комбинациями заместителей, предусматриваемыми данным изобретением, предпочтительно являются те, которые получаются в результате образования стабильных или химически возможных соединений. Термин “стабильный”, используемый здесь, относится к соединениям, которые по существу не изменяются, когда подвергаются действию условий, обеспечивающих возможность их получения, идентификации и предпочтительно их выделения, очистки и использования для одной или более целей, описанных здесь. Согласно некоторым воплощениям стабильным соединением или химически возможным соединением является соединение, которое по существу не меняется, когда хранится при температуре порядка 40оС или ниже, в отсутствие влаги или других химически активных условий в течение, по крайней мере, недели.
Термин “алифатическая” или “алифатическая группа”, используемый здесь, обозначает неразветвленную (т.е. с нормальной цепью) или разветвленную, насыщенную или ненасыщенную углеводородную цепь, которая является полностью насыщенной или которая содержит одно или более ненасыщенных звеньев, или моноциклический углеводород или бициклический углеводород, который является полностью насыщенным или который содержит одно или более ненасыщенных звеньев, но который не является ароматическим (называемый здесь также как “карбоцикл”, “циклоалифатический” или “циклоалкил”), который имеет одно положение для присоединения к остальной части молекулы. Если не указано иное, алифатические группы содержат 1-20 алифатических атомов углерода. Согласно некоторым воплощениям алифатические группы содержат 1-10 алифатических атомов углерода. В других воплощениях алифатические группы содержат 1-8 алифатических атомов углерода. В следующих воплощениях алифатические группы содержат 1-6 алифатических атомов углерода и в следующих далее воплощениях алифатические группы содержат 1-4 алифатических атома углерода. В некоторых воплощениях “циклоалифатический(ая)” (или “карбоцикл” или “циклоалкил”) относится к моноциклическому С3-С8 углеводороду или бициклическому С8-С12 углеводороду, который является полностью насыщенным или который содержит одно или более звеньев с ненасыщением, но который не является ароматическим, который имеет одну точку присоединения к остальной части молекулы, где любое индивидуальное кольцо в указанной бициклической системе имеет 3-7 членов. Подходящие алифатические группы включают, но не ограничиваются указанными, линейные или разветвленные, насыщенные или ненасыщенные алкильные, алкенильные, алкинильные группы и гибриды их, такие как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил.
Термин “гетероалифатическая(ий)”, используемый здесь, обозначает алифатические группы, в которых один или два атома углерода независимо замещены одним или более атомами из кислорода, серы, азота, фосфора или кремния. Гетероалифатические группы могут быть замещенными или незамещенными, разветвленными или неразветвленными, циклическими или ациклическими и включают “гетероцикл(ическую)”, “гетероциклил(ьную)”, “гетероциклоалифатическую” или “гетероциклическую” группы.
Термин “гетероцикл”, “гетероциклил”, “гетероциклоалифатический(ая)” или “гетероциклический(ая)” используемый здесь, обозначает неароматическую, моноциклическую, бициклическую или трициклическую кольцевые системы, в которых один или более кольцевых членов являются независимо выбранным гетероатомом. В некоторых воплощениях “гетероцикл(ическая)”, “гетероциклил(ьная)”, “гетероциклоалифатическая” или “гетероциклическая” группа имеет три-четырнадцать кольцевых членов, в которой один или более кольцевых членов является гетероатомом, независимо выбранным из кислорода, серы, азота или фосфора, и каждое кольцо в системе содержит 3-7 кольцевых членов.
Термин “гетероатом” обозначает один или более атомов из кислорода, серы, азота, фосфора или кремния (включая любую окисленную форму азота, серы, фосфора или кремния; кватернизованную форму любого основного азота или замещаемого азота гетероциклического кольца, например N (в виде 3,4-дигидро-2Н-пирролила), NH (в виде пирролидинила) или NR+ (в виде N-замещенного пирролидинила)).
Термин «ненасыщенный», используемый здесь, обозначает, что фрагмент имеет одно или более звеньев с ненасыщением.
Термин «алкокси» или «тиоалкил», используемый здесь, относится к алкильной группе, как определено ранее, присоединенной к главной углеродной цепи через атом кислорода («алкокси») или серы («тиоалкил»).
Термин «галогеналкил», «галогеналкенил» и «галогеналкокси» обозначает алкил, алкенил или алкокси, и данный радикал может быть замещен одним или более атомами галогена. Термин «галоген» обозначает F, Cl, Br или I.
Термин «арил», используемый сам по себе или как часть более крупного фрагмента, как в случае «аралкила», «аралкокси» или «арилоксиалкила», относится к моноциклической, бициклической и трициклической кольцевым системам, имеющим всего от пяти до четырнадцати кольцевых членов, где, по крайней мере, одно кольцо в системе является ароматическим и где каждое кольцо в системе содержит 3-7 кольцевых членов. Термин «арил» может использоваться взаимозаменяемо с термином «арильное кольцо». Термин «арил» относится также к гетероарильным кольцевым системам, как они определены здесь ниже.
Термин «гетероарил», используемый сам по себе или как часть более крупного фрагмента, как в случае «гетероаралкила» или «гетероарилалкокси»», относится к моноциклической, бициклической и трициклической кольцевым системам, имеющим всего от пяти до четырнадцати кольцевых членов, где, по крайней мере, одно кольцо в системе является ароматическим, по крайней мере, одно кольцо в системе содержит один или более гетероатомов и где каждое кольцо в системе содержит 3-7 кольцевых членов. Термин «гетероарил» может использоваться взаимозаменяемо с термином «гетероарильное кольцо» или термином «гетероароматическое».
Арильная (включая аралкил, аралкокси, арилоксиалкил и аналогичные) или гетероарильная (включая гетероаралкил и гетероарилалкокси и аналогичные) группа может содержать один или более заместителей и, таким образом, может быть «необязательно замещенной». Если иное не определено выше и в данном описании подходящие заместители у ненасыщенного атома углерода арильной или гетероарильной группы обычно выбираются из галогена; -Ro ; -ORo; -SRo; фенила (Ph), необязательно замещенного радикалом Ro; -O(Ph), необязательно замещенного Ro; -(CH2)1-2(Ph), необязательно замещенного Ro; -CH=CH(Ph), необязательно замещенного Ro; -NO2; -CN; -N(R